乳腺肿瘤WHO分类学习笔记(连载18)
往期回顾
第9章 乳腺遗传性肿瘤综合征
介绍
本章讨论乳腺癌家族易感性的遗传学,以及一些已经确定的和正在出现的基因,这些基因是遗传学临床诊断的讨论目标。BRCA1和BRCA2已被充分证实,PALB2也越来被重视;怀疑家族易感性的患者都要接受这三种基因检测。许多其他基因(TM、CHEK2等)在常规检测中的应用证据有限,主要是由于外显率和频率数据有限,以及缺乏种族变异数据。由于这些局限性,这些基因中通常遇到意义不明的变异,使得患者管理变得困难。现在人们对多基因乳腺癌易感性和多基因风险评分的使用越来越感兴趣;本章最后的多基因部分介绍了这些主题(见乳腺癌易感性的多基因成分,原书第292页)。
表9.01列出了本章所涵盖的家族综合征的详细信息。虽然其他综合征与乳腺癌相关,但由于乳腺癌不是其主要特征,本书未涵盖其细节;其中大多数在本丛书的其他分册中都有详细介绍。
表9.01与乳腺癌易感性增加相关的遗传综合征
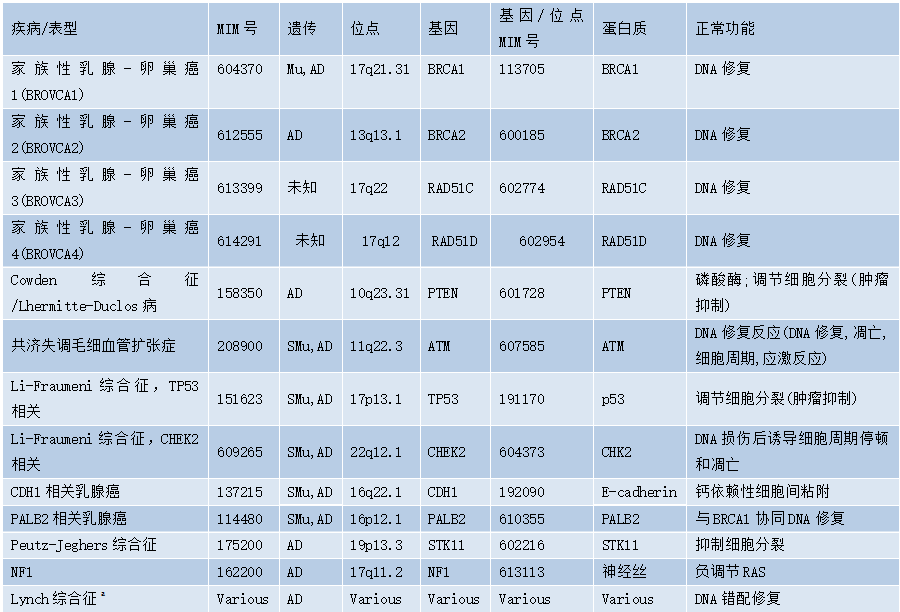 AD,常染色体显性;Mu,多灶;SMu,体细胞突变。
AD,常染色体显性;Mu,多灶;SMu,体细胞突变。
a没有确凿证据表明Lynch综合征患者乳腺癌易感性增加。
病理医师应了解家族易感性筛查。肿瘤的临床、形态学和免疫组化特征可能与某些遗传综合征有关,病理医师可以识别。例如,伴BRCA1和BRCA2突变的遗传综合征往往与双侧肿瘤有关,主要在年轻时发生;并且,BRCA1相关综合征的病例与实性巢和淋巴浆细胞浸润、显著核异型性、高级别和高核分裂活性、边界清楚的肿瘤有关。一组免疫组化标记物可用于区分BRCA1/2相关性和散发性乳腺癌。Cowden综合征优先导致PTEN阴性大汗腺癌。高通量和大规模测序的技术进步,越来越多地应用于肿瘤和正常测序,能够识别种系变异,从而识别潜在的遗传综合征。在大型机构患者群体中,对晚期肾癌患者和各种异质性肿瘤患者进行广泛的肿瘤-正常测序,证实了测序的价值。技术进步可能促进不断发展的基于人群的筛查观念,在筛查中使用包括相关乳腺癌易感性基因的乳腺癌测序组合。此外,已证明福尔马林固定、石蜡包埋标本的全外显子组或全基因组测序是可行的,并可能适用于常规临床环境,这表明在日常临床实践测序中,有一条超越靶向测序的路径。人们越来越意识到肿瘤测序的伦理考虑。
特定的乳腺癌亚型,如三阴性乳腺癌,也能提示同源重组缺乏相关的潜在种系突变,例如,已发现14.8%的三阴性乳腺癌患者携带BRCA1有害突变,而ATM、RAD51D、CHEK2或PALB2突变的携带者均无家族史。因此,无论家族史或患者年龄如何,对三阴性乳腺癌患者进行基因检测的观念强调病理医师充分可靠地识别具有特定乳腺癌亚型(例如三阴性乳腺癌)患者的重要性。病理医师的重要性在于,根据详细的形态学和免疫组化分析识别潜在患者。仅仅通过关注家族史来识别乳腺癌易感基因高风险突变的患者不仅繁琐,而且可能导致大量患者被遗漏。
具有同源重组缺陷的患者,最常见的是与BRCA1和/或BRCA2中的种系和/或体细胞突变有关,对聚ADP核糖聚合酶(PARP)抑制剂表现出敏感性。因此,新出现的使用免疫组化标记物(如RAD51)来预测乳腺癌PARP抑制剂的疗效,与病理学和遗传学学科的进一步融合有着内在的联系。病理医师可以通过了解这些生物标记物的最佳应用情况及其解释背景来帮助识别这些患者。
BRCA1/2相关遗传性乳腺癌和卵巢癌综合征
定义
BRCA1/2相关遗传性乳腺癌和卵巢癌综合征(BRCA1/2syn)是一种常染色体显性遗传性癌症易感性综合征,由BRCA1和BRCA2种系突变引起,发生乳腺癌(尤其是50岁之前)和卵巢癌的风险高于正常水平。其他癌症的风险也增加。
MIM编号
604370家族性乳腺-卵巢癌1(BROVCA1)
612555家族性乳腺-卵巢癌2(BROVCA2)
ICD-O编码
2C65遗传性乳腺癌和卵巢癌综合征
相关术语
可接受:遗传性乳腺-卵巢癌综合征
亚型
没有
部位
BRCA1/2syn与乳腺癌、卵巢癌、胰腺癌、前列腺癌和其他潜在部位癌有关。
临床特征
临床特征取决于肿瘤的表现;没有特定的表型。
流行病学
一项荟萃分析包括60项研究,涉及105220名乳腺癌患者,其中3588名患者(3.4%)是BRCA 1/2突变携带者。已知BRCA1和BRCA2的种系突变会导致乳腺癌、卵巢癌,以及对侧乳腺癌的终生高风险。在美国,可操作的BRCA1和BRCA2突变的携带者女性人数估计每300-500人中有1人。最近的大型国际研究对风险估计进行了改进。BRCA1/2变异体研究者联合会(CIMBA)收集了六大洲29000个BRCA1或BRCA2突变家庭的数据,发现乳腺癌和卵巢癌的风险因BRCA1/2突变的类型和位置而异。乳腺癌的发病率为46%(BRCA1)和52%(BRCA2),卵巢癌的发病率分别为12%和6%(BRCA1和BRCA2)。乳腺癌和卵巢癌的合并发病率分别为5%(BRCA1)和2%(BRCA2);37%的BRCA1和40%的BRCA2突变携带者没有癌。该联盟还观察到,不同地理区域和种族/民族的突变类型和频率存在显著差异。除了已知的创始人突变外,在特定的种族/民族或地理群体中也发现了其他相对较高频率的突变。最近对印度乳腺癌和卵巢癌进行的一项荟萃分析显示,有18种新的BRCA1和16种BRCA2变体,这些变体以前未报道或未包含在乳腺癌信息核心(BIC)或ClinVar数据库中。大约2.5%的德系犹太人中发现了BRCA1和BRCA2的三种创始人突变。了解特定人群的BRCA1和BRCA2突变谱可以为基因检测的有效策略提供信息,并可能证明在某些人群中进行更广泛的致癌检测是合理的。
表9.02 BRCA1和BRCA2突变携带者发生乳腺癌和卵巢癌以外癌症的风险
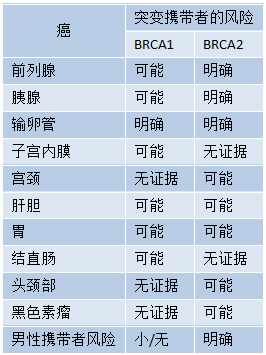
BRCA1和BRCA2突变也会增加男性乳腺癌的风险,这些病例中BRCA2突变的频率更高。在高危家庭中,BRCA2突变占男性乳腺癌的60-76%,BRCA1突变占10-16%。
BRCA1/2突变携带者的其他癌症
BRCA1或BRCA2突变除了增加乳腺癌和卵巢癌的终生风险外,据报道还增加了前列腺癌、胰腺癌、胃癌和结肠癌的易感性(见表9.02)。已观察到BRCA1突变携带者黑色素瘤和BRCA2突变携带者宫颈癌发病率增加的趋势。最近的一项亚组荟萃分析报道了根据性别和年龄调整的评估结果,显示结直肠癌风险增加与BRCA1突变相关但与BRCA2突变无关。
BRCA1/2突变携带者的风险调节因素
BRCA1和BRCA2突变的外显率可能受到遗传、生活方式和生殖因素以及遗传变异的影响。这些信息有助于预测和预防BRCA1和BRCA2突变携带者乳腺癌及其他癌症的风险。
生活方式因素
据报道,生殖和生活方式因素是BRCA1和BRCA2突变个体发生乳腺癌的风险调节因素。在BRCA1和BRCA2突变携带者中,足月妊娠次数越多,乳腺癌的风险越低。据报道,母乳喂养是BRCA1突变携带者的保护因素。然而,在BRCA2突变携带者中,母乳喂养与乳腺癌风险之间没有发现显著关联。在BRCA2突变携带者中,月经初潮早与乳腺癌风险增加有关,但与BRCA1突变携带者无关。相反,在BRCA突变携带者中,更年期晚显示对乳腺癌的保护作用。在BRCA突变携带者中,口服避孕药与乳腺癌之间没有显著关联。
有趣的是,最近一项使用BRCA1和BRCA2突变携带者的联合数据的研究表明,身高和身高遗传评分与乳腺癌风险呈正相关,尽管与身高遗传评分的相关性在统计学上并不显著。观察到的体重指数和体重指数遗传评分与乳腺癌风险呈负相关。体重指数与绝经前乳腺癌相关。这些环境和生活方式因素对有家族史的女性尤为重要。
病因
BRCA基因是肿瘤抑制基因,编码参与高度保守的同源重组修复途径的蛋白质,以姐妹染色单体为模板准确修复DNA断裂。如果不修复,这种断裂会促进基因组的不稳定性,并导致乳腺癌发生。最近一项使用种系BRCA1/2突变和非携带者患者肿瘤全基因组测序的研究表明,一些患者在乳腺癌风险基因中存在未报道的双重致病种系变异(BRCA1/BRCA2;BRCA1/MUTYH)。它还提示,100%的BRCA1携带者肿瘤和91%的BRCA2携带者肿瘤表现出各自基因的双等位基因失活,以及提示同源重组功能缺陷的体细胞突变特征。尽管BRCA突变在这些大基因上广泛传播,但BRCA2中心部分(卵巢聚集区域)的突变与卵巢癌的可能性增加之间存在关联。BRCA1定位于染色体17q21,包含23个编码外显子。它编码1863个氨基酸的核蛋白。N末端的RING指结构域介导与其他蛋白质的相互作用。BRCA1通常在三个结构域中发生突变:RING结构域、外显子11-13和BRCA1 C末端结构域。BRCA2定位于染色体13q13.1,由27个编码外显子组成。BRCA2蛋白包含3418个氨基酸。BRCA1和BRCA2蛋白与任何其他蛋白没有结构同源性。图9.01显示了BRCA1和BRCA2蛋白中的功能结构域。
发病机制
DNA修复对细胞存活至关重要,细胞有多种机制来确保基因组的完整性。在复制过程中,复制叉处的双链断裂会导致基因组片段的丢失和重排。BRCA1和BRCA2肿瘤抑制功能的丧失可能是癌症发生的核心因素,但目前仍不清楚为什么BRCA相关癌主要局限于乳腺和/或卵巢。有人认为,至少对于BRCA1来说,转录中的同源重组非依赖性功能可能是乳腺癌发生的原因。
BRCA基因突变和启动子甲基化与乳腺癌风险有关,并且据报道是互斥的。据报道,BRCA甲基化在散发性乳腺癌中更常见,并与乳腺癌风险增加有关。最近的一项系统综述得出结论,在BRCA突变携带者中,BRCA甲基化分别出现在1.3%和1.1%的乳腺癌和卵巢癌中。BRCA突变的频率在BRCA1和BRCA2启动子中的CpG位点之间差异很大。
据报道,基于人群的全基因组关联和多联盟研究发现,许多遗传事件会影响BRCA1和BRCA2突变携带者患乳腺癌的实际风险。BRCA1和BRCA2的突变谱,包括插入缺失、错义、无义和剪接位点突变,已被发现是相似的,分别占BRCA1突变的67%和BRA2突变的56%,以及意义不明变异的33%和45%。相比之下,在早期关于BRCA1突变的研究中,这些突变仅占未知不明变异的8%左右。这一观察结果反映了突变检测的进步远远超过了突变解释的进步。事实上,已经采用了各种技术方法来评估意义不明变异的致病性,这需要进一步澄清。
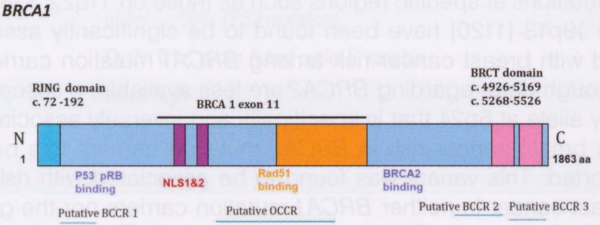
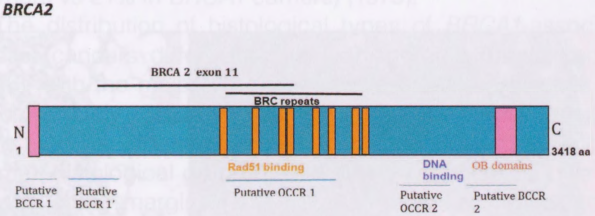
图9.01 BRCA蛋白中的功能结构域。A BRCA1蛋白。RING结构域包含一个与其他蛋白质相互作用的C3HC4基序。B BRCA2蛋白。在蛋白质的中心结构域中,有八个BRC重复序列与RAD51相互作用。寡核苷酸/寡糖结合(OB)结构域对单链DNA具有很强的亲和力。aa,氨基酸;BCCR,乳腺癌聚集区;BRCT,BRCA1C-末端;C,C-末端;N,N-末端;NLS,核定位信号;OCCR,卵巢癌聚集区。
乳腺癌和卵巢癌的风险因BRCA1/2突变的类型和位置的不同而异。在BRCA1中发现了三个乳腺癌聚集区和一个卵巢癌聚集区,位于外显子11。与其他BRCA1突变相比,BRCA1 C末端结构域区域的突变与更高的乳腺癌易感性有关。这可能是因为BRCA1 C-末端磷蛋白识别对BRCA1肿瘤抑制作用至关重要。在BRCA2中,发现了多个乳腺癌聚集区,以及三个卵巢癌聚集区。在BRCA1和BRCA2突变携带者中,导致非酶介导衰退的突变与乳腺癌或卵巢癌风险的差异以及乳腺癌诊断年龄的提前有关。
在BRCA1突变携带者中,发现特定区域的突变(如11q22.3和19p13等)与乳腺癌风险显著相关。尽管关于BRCA2的数据较少,但据报道,在BRCA2突变携带者中,位于6p24的易感性等位基因与乳腺癌风险存在特定的负相关。无论是BRCA1突变携带者还是普通人群,都发现该变体与乳腺癌风险相关。BRCA变体的信号相互作用网络,特别是参与DNA损伤修复和细胞周期调控的基因(如ATM、ATR、TP53、RB1和RAD51),是另一个可能影响外显率的因素。使用全基因组测序的大规模研究已经确定了不同肿瘤类型中不同的基因组改变模式(称为突变特征,mutation signature)。一种整合了其中六个突变特征的算法,包括那些反映同源重组缺陷的突变特征,可以以识别BRCA1/2散发性和种系突变相关的肿瘤,灵敏度高达98.7%,表明这种方法可用于识别可能受益于聚ADP核糖聚合酶(PARP)抑制剂的患者。
基因表达分析表明,BRCA1肿瘤的特征是参与增殖、粘附、血管生成、运动、转录和DNA修复的基因发生改变,而BRCA2肿瘤的特征则是参与增殖、粘附、信号转导和细胞外间质产生的基因发生变化。
BRCA阳性乳腺癌的肿瘤浸润淋巴细胞数量明显较高,最近在小鼠模型中的研究表明,联合免疫检查点阻断可能起作用;但这只是初步研究数据。
大体检查
这些肿瘤的特征类似于非BRCA相关的乳腺癌,大部分病例表现为边界清楚和分叶状切面,伴出血和坏死区域。
组织病理学
携带BRCA1和BRCA2突变的肿瘤比散发性乳腺癌更有可能具有某些组织学和分子特征(见表9.03)。此外,与BRCA2突变携带者相比,BRCA1突变携带者的乳腺癌与侵袭性更强的肿瘤特征有关。BRCA1(与BRCA2相比)突变携带者的肿瘤表现出明显更高的核级别和组织学级别,并伴有明显的淋巴细胞浸润。它们更常见于三阴性癌,而BRCA2肿瘤更常见于ER阳性癌。据报道,BRCA1突变携带者中存在IBC-NST、IBC伴髓样模式(以前称为髓样癌)和化生性癌。BRCA2肿瘤更常见纯DCIS,更常见钙化,因而乳房X线更容易发现。据报道,在BRCA2携带者中,LCIS主要是预防性乳房切除术标本中的偶然发现。有限的数据表明,炎性乳腺癌的年轻患者可能更容易携带BRCA突变。
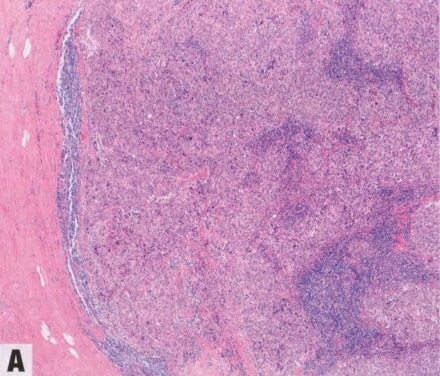
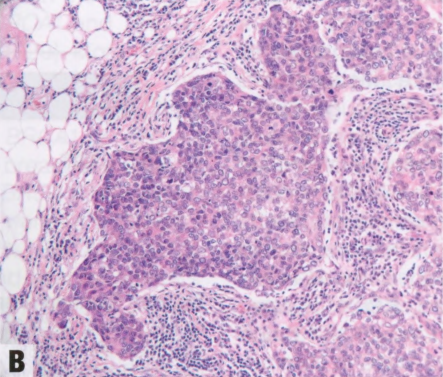

图9.02 BRCA1/2相关肿瘤的组织学特征。A、B BRCA1突变相关乳腺癌的典型形态学表现:边界清楚的肿瘤,推挤性边缘,合胞体生长,伴明显的淋巴细胞浸润(A)。注意大量核分裂象和邻近的淋巴细胞浸润(B)。C 来自BRCA2突变携带者的预防性乳房切除术标本中的LCIS。非典型非粘附性细胞增殖,累及TDLU。
表9.03 BRCA1和BRCA2突变携带者乳腺癌与散发性乳腺癌的组织学特征和分子表型比较
由于BRCA突变携带者乳腺癌的组织病理学特征不同于非突变乳腺癌,因此认为这些特征可用于突变预测、风险预测算法和统计建模,以评估临床意义不确定的BRCA变异的致病性,并为筛查和预防的临床策略提供信息。在BRCA1突变携带者中,ER阴性癌和三阴性癌的比例随着患者诊断年龄的增长而减少,但在BRCA2携带者中,它们随着诊断年龄的增长而增多。在BRCA1和BRCA2携带者中,ER阴性癌的组织学分级高于ER阳性癌。有趣的是,除了许多具有基底样表型的病例(见下文)外,最近发现很大一部分BRCA携带者具有管腔A亚型。这些病例主要是BRCA2携带者(35%),而不是BRCA1携带者(9%)。管腔B亚型比管腔A亚型更常见,在BRCA2携带者中的比例也更高(BRCA2携带者为40%,BRCA1携带者为21%)。
BRCA1相关乳腺癌的组织学类型分布与散发性乳腺癌不同,其中大多数是IBC-NST;约15%被归类为髓样IBC(以前称为髓样癌)3级,伴大量淋巴细胞浸润和推挤性边界。三阴性乳腺癌表达CK5/6(称为基础样型),在BRCA1肿瘤中的比例很高。尽管基底样CK和/或EGFR(HER1)可用于鉴定具有基底样表型的三阴性乳腺癌,但仅凭这些标记物的表达不足以确定哪些患有三阴性乳腺癌的女性可能携带BRCA1种系突变。BRCA2相关乳腺癌似乎没有表现出特定的病理表型,但已经发现LN更有可能与BRCA2相关。
对CIMBA和乳腺癌协会联盟(BCAC)收集的大型病理学数据集的分析表明,ER-阳性表型对BRCA1突变状态的预测呈阴性,而与级别无关。诊断时患者年龄是重要变量,ER阴性3级组织病理学更能预测阳性BRCA1突变状态:≥50岁女性似然比4.13,范围3.70-4.62,而<50岁似然比3.16,范围2.96-3.37。年龄同样能预测三阴性肿瘤状态:≤50岁女性似然比4.41,范围3.86-5.04,而<50岁女性似然比3.73,范围3.43-4.05。这些特征仅能适度预测BRCA2突变病例,级别比ER状态更有用。
BRCA2男性乳腺癌的分期和分级明显高于BRCA2女性乳腺癌。在SEER项目数据中,其级别也高于散发性男性乳腺癌。
细胞学
BRCA相关乳腺癌的细胞学与非BRCA相关的乳腺癌相同,除外与BRCA1相关髓质型病例的相对频率。
诊断分子病理学
BRCA1/2syn是一种常染色体显性遗传性疾病,BRCA1和BRCA2有种系突变。
诊断标准
必要标准:鉴定BRCA1和BRCA2种系致病突变;使用包括BRCAPRO模型、乳腺和卵巢疾病发病率分析和携带者估计算法(BOADICEA)和曼彻斯特评分系统在内的工具确定哪些患者需要进行种系BRCA1/2检测。
分期
BRCA1/2syn背景下的乳腺癌分期与非BRCA乳腺癌相似。
预后和预测
在一项研究中,与BRCA1/2野生型病例相比,BRCA1/2种系突变病例的总体生存率和疾病特异性生存率更低。一些荟萃分析支持这些发现,而其他荟萃分析发现没有定论。一项对2733名≤40岁乳腺癌的女性(其中12%为BRCA1/2突变携带者)的临床结局进行的前瞻性队列研究显示,在约10年的随访中,BRCA1/2携带者和非携带者的存活率没有显着差异(中位数:8.2年)。在三阴性乳腺癌患者中,BRCA突变携带者在随访2年后的总生存率高于非携带者,但在5年或10年后没有差异。
BRCA1和BRCA2乳腺癌患者总体生存率的差异可归因于肿瘤生物学。尽管BRCA1突变的乳腺癌患者的10年无病生存率可能低于BRCA2乳腺癌乳腺癌患者,但化疗和降低风险的对侧乳房切除术可以降低BRCA1和BRCA2突变携带者的死亡率。对于患有乳腺癌和BRCA1突变的女性,已证明顺铂和卵巢切除术是有效的治疗方法。
“合成致死性”一词是指两个基因中的任一基因突变对细胞存活率没有影响,但两个基因都突变就会导致细胞死亡的情况。合成致死性最著名的例子之一与BRCA1/2和PARP抑制剂有关。BRCA 1/2基因负责修复双链DNA断裂,PARP负责通过碱基切除修复单链DNA断裂。已发现PARP抑制剂对种系或体细胞BRCA1/2突变相关的卵巢癌患者有效,对铂敏感疾病患者的临床益处更大。对于BRCA1/2缺陷型乳腺癌也发现了类似的有希望的结果,晚期BRCA1/2突变乳腺癌患者的反应率为41%。如上所述,突变特征的应用可能有助于识别这些患者。
除了监测策略和化学预防的可能性外,在美国,国家乳腺癌综合网络(NCCN)和妇科肿瘤学会(SGO)指南建议对35-40岁或生育完成后的种系BRCA1/2突变携带者进行降低风险的输卵管-卵巢切除术,以及预防性乳房切除术。研究发现,这可以将患乳腺癌的风险降低90%。
Cowden综合征
定义
Cowden(考登)综合征(Cowden syndrome,CS),也称为PTEN错构瘤肿瘤综合征(PHTS),是一组由PTEN基因种系突变引起的常染色体显性遗传疾病,其特征是多发性错构瘤和易患乳腺癌。
MIM编号
158350CS
ICD-11编码
LD2D.Y其他特定的瘢痣病(phakomatoses)或错构瘤综合征-CS
相关术语
可接受:多发性错构瘤综合征;PTEN错构瘤肿瘤综合征。
亚型
Bannayan-Riley-Ruvalcaba综合征;变形综合征
部位
CS累及来自三个胚层之一的器官。
临床特征
CS的特征是黏膜皮肤病变(多发性面部毛根鞘瘤、肢端角化症、乳头状丘诊和黏膜病变视为特异性病征)、乳腺癌风险增加、良性错构瘤过生长(包括错构瘤/幼年性胃肠道息肉病)和巨头畸形。弥漫性食管糖原棘皮病加上结肠息肉病可能是CS诊断性特征。癌症风险较广泛,包括乳腺癌、甲状腺癌、子宫内膜癌、肾细胞癌、结肠癌以及黑色素瘤。
PHTS还包括Bannayan-Riley Ruvalcaba综合征和Proteus综合征。然而,大多数PHTS病例对应于CS,这些术语通常可以互换使用。
流行病学
在欧洲人群中,估计患病率约为每20万至25万人中有1例。考虑到诊断这种综合征的困难,这可能是低估了。女性CS患者一生中累积的乳腺癌风险(至70岁)高达85%,相对风险为25。据报道,在发生乳腺癌的CS患者中,34%罹患多发性和双侧乳腺癌。男性CS患者乳腺癌的风险也增加,但确切风险程度未知。大多数女性CS患者都有良性乳腺病变。
病因
CS是一种常染色体显性遗传疾病,具有与年龄相关的外显率和可变表达。PTEN(10q23.3)中的种系突变在约85%的CS病例以及其他PHTS疾病的亚群中发现(Bannayan-Riley-Ruvalcaba综合征为65%,变形综合征为20%,变形样综合征为50%)。个体化风险计算可能有助于根据临床特征评估患者携带种系PTEN突变的风险。
简表16.01国际Cowden联盟(ICC)操作性诊断标准

a这里只是ICC标准的规定。
b这里只是2010年国家综合癌症网络(NCCN)标准的定义。
表9.04 PTEN错构瘤肿瘤综合征的终生乳腺癌风险和一般筛查建议
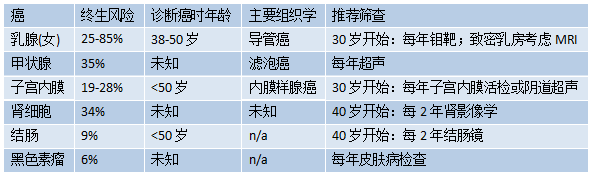
在约5%的PTEN突变阴性CS/CS样表型患者中发现了种系SDH突变,这些突变与乳腺癌、甲状腺癌和肾癌的发病率增加有关,超出了种系PTEN突变的范围。
发病机制
PTEN是一种几乎普遍表达的肿瘤抑制因子,是一种双特异性脂质和蛋白质磷酸酶,通过PI3K/AKT途径抑制AKT,调节细胞增殖、细胞迁移和凋亡。基因第二拷贝的失活使得AKT途径失调。
大体检查
与临床无关
组织病理学
约75%的女性CS患者发生良性乳腺病变,包括导管增生、导管内乳头状瘤病、腺病、小叶萎缩、FA和纤维囊性变。许多患者的特征提示乳腺错构瘤。恶性乳腺病变大多为IBC-NST,常伴有DCIS。最近的一份报道表明,在患有种系PTEN突变的乳腺癌患者中,大汗腺分化常见,表达谱归入分子大汗腺类别。
细胞学
与临床无关
诊断分子病理学
CS是由种系PTEN突变引起的。
诊断标准
简表9.01(原书第275页)列出了国际考登联盟(ICC)的操作性诊断标准。
分期
与临床无关
预后和预测
PHTS患者发生几种类型癌症的风险增加,建议进行间隔筛查(见表9.04)。
共济失调毛细血管扩张症
定义
共济失调毛细血管扩张症(AT)是一种常染色体隐性综合征,其特征是进行性小脑共济失调、动眼神经失用症、舞蹈手足徐动症、鼻窦感染、眼皮肤毛细血管扩张症、不同程度的免疫缺陷、不育、恶性肿瘤的高风险以及对电离辐射敏感,由ATM基因的种系突变引起。
MIM编号
208900 AT
ICD-11编码
4A01.31除T细胞或B细胞联合免疫缺陷外的DNA修复缺陷-AT
相关术语
可接受:免疫缺陷伴共济失调毛细血管扩张;Louis Bar综合征;小脑眼皮肤毛细血管扩张症。
亚型
没有
部位
AT患者的恶性肿瘤发病率很高,尤其是白血病和淋巴瘤。杂合子携带者发生乳腺癌的风险较高。也有一些证据表明卵巢癌和消化道癌的风险增加。
临床特征
ATM中的杂合子种系突变与早发乳腺癌有关。ATM变异的杂合子携带者没有表现出AT患者可能发生的放疗严重毒性作用,但在接受放疗的有害ATM变异杂合子携带者中,对侧乳腺癌的风险升高。
AT的主要特征通常是一致的,但在发病年龄、进展和症状严重程度以及癌症的发生方面存在差异。特别是,已经观察到ATM错义突变导致一些蛋白质表达和残留激酶活性,可能导致表型减弱。在这方面,c.7271T>G错义突变引起了人们的兴趣,因为这种突变的罕见纯合子表现出较轻的AT形式和正常水平的ATM蛋白。此外,在纯合和杂合携带者中观察到乳腺癌发病率升高。
流行病学
AT罕见,估计患病率为每4万-10万活产1例。
病因
经典AT是一种由ATM基因种系突变引起的单基因疾病。大多数AT患者是ATM突变的复合杂合子。
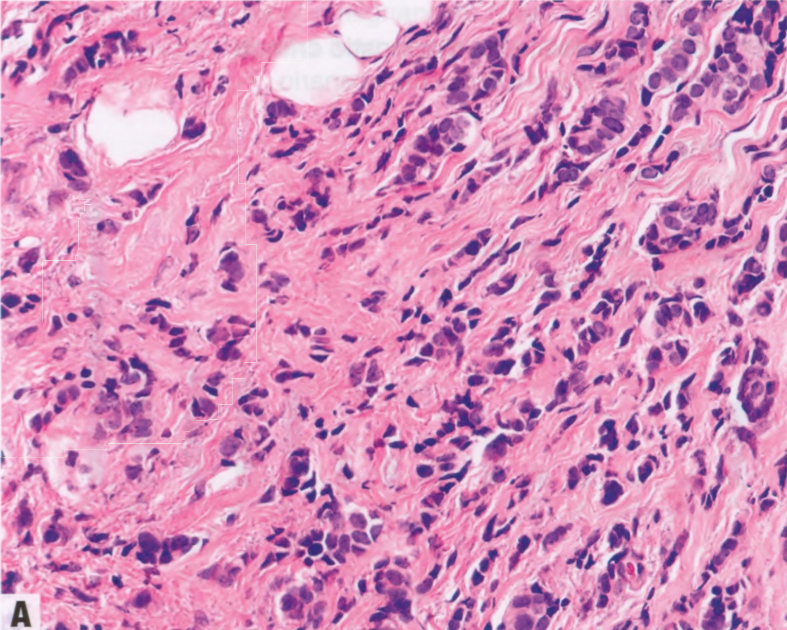
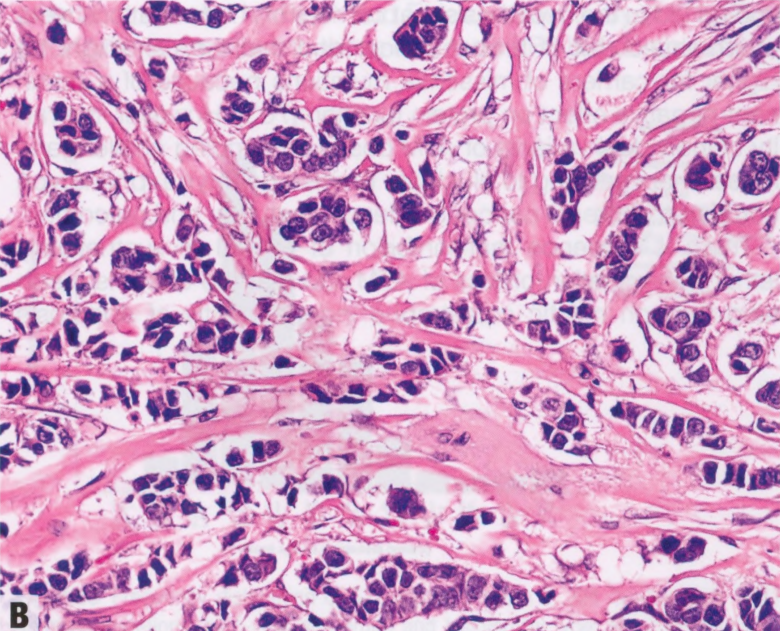
图9.03 A TM相关的乳腺癌。A、B 两例种系ATM突变患者的乳腺癌。均表现为导管形态伴小叶特征,包括单个和成条浸润的细胞。均为ER/PR阳性;A肿瘤呈HER2阴性,B 肿瘤HER2扩增。都没有BRCA突变肿瘤常见的高核级别或显著免疫反应。
发病机制
ATM基因延伸超过150KB的DNA,有66个外显子。ATM转录本为13KB,编码350kDa的3056个氨基酸的蛋白质。起始密码子位于外显子4。ATM在所有正常组织中都有表达,是一种丝氨酸/苏氨酸激酶,属于PI3K相关激酶家族,在C末端区域具有保守的激酶和调控结构域。ATM具有大量磷酸化靶标,包括主要的人类肿瘤抑制因子,如p53和BRCA1。为了应对DNA损伤,特别是双链DNA断裂,ATM被自磷酸化激活。它的许多已知功能与细胞周期检查点的激活有关,这些检查点阻碍DNA受损细胞中细胞周期的进展。ATM通过MRN复合物成分的磷酸化和BRCA1、FANCD2和SMC1的直接磷酸化来减缓S期进展。CHK2、BRCA1和RAD17的磷酸化有助于G2/M检查点。ATM也可能通过CHK2介导的BRCA1磷酸化和染色质动力学调节,促进DNA修复,并与端粒长度的维持有关。
据报道,ATM中有500多种独特的种系突变,分布在整个基因中,没有突变热点。ATM突变可大致分为:(1)蛋白质截断、非表达突变;(2)编码无激酶活性突变蛋白的框内缺失;或(3)编码激酶活性降低的突变蛋白的错义突变。大多数AT患者携带蛋白质截断、非表达突变。大约90%的AT患者没有检测到ATM蛋白,10%有微量ATM蛋白,1%表达正常量的蛋白但没有激酶活性。ATM蛋白的检测和放射敏感性和ATM激酶活性的体外检测可能是AT诊断测试的一部分。
目前估计ATM突变携带者(截断突变)发生乳腺癌的相对风险为2.8(95% CI: 22-3.7),c.7271T>G(p.Val2424Gly)错义突变的风险更高(11.0;95% Cl: 1.42-85.7)。这一发现导致了一种假说,即ATM突变的携带者发生乳腺癌的风险增加,而错义突变的携带者的风险可能更高,因为对蛋白质功能的显性负效应。然而,由于ATM个体变异,很难阐明乳腺癌发病率、特征和结果的精确基因型表型相关性。
有证据表明,PARP1抑制与ATM的突变或丢失构成合成致死性,并且这种作用是由核分裂灾变介导的,与凋亡无关。因此,有人认为,罹患乳腺癌的ATM突变携带者可能适用聚(ADP-核糖)聚合酶(PARP)抑制剂治疗,类似于BRCA1和BRCA2突变携带者。然而,最近的分析表明,ATM突变携带者的乳腺肿瘤常有ATM的双等位基因失活,但缺乏同源重组缺陷和大规模基因组不稳定的突变特征,表明它们可能对PARP抑制剂不敏感。
大体检查
与临床无关
组织病理学
关于ATM变体携带者发生的乳腺癌,组织病理学信息有限,也没有重现性鉴定出独特的肿瘤表型。一个系列研究显示,ATM突变的乳腺癌和对照组之间没有显著的形态学差异。其他人报道称,ATM突变的乳腺癌通常是管腔型伴激素受体阳性,ER和PR双重阳性。值得注意的是,尽管ATM在DNA损伤修复中的作用与BRCA1/2相似,但没有一个系列发现ATM异常的乳腺肿瘤中BRCA 1/2突变相关乳腺癌典型的高级别、富含淋巴细胞的形态占主导地位。相反,大多数报道的病例是IBC-NST(>80%),或具有混合导管和小叶样形态,间质缺乏肿瘤浸润淋巴细胞。ATM杂合子中的乳腺肿瘤通常是激素受体阳性,很少免疫浸润,以及TP53野生型。
细胞学
与临床无关
诊断分子病理学
AT是由ATM中的致病性种系突变引起的。
诊断标准
必要标准:特征性临床情景。
分期
与临床无关
预后和预测
与临床无关
Li-Fraumeni综合征,TP53相关
定义
TP53相关Li-Fraumeni综合征(LFS)是一种由TP53基因种系突变引起的常染色体显性遗传癌症易感性综合征。
MIM编号
151623 LFS
ICD-11编码
没有
相关术语
不推荐:Li和Fraumeni肉瘤家族综合征。
亚型
没有
部位
TP53相关LFS与乳腺、软组织、骨、脑、肾上腺和女性生殖道的癌症有关。
临床特征
LFS的特点是早期发生广泛的乳腺癌,终生乳腺癌风险高。乳腺癌和肾上腺皮质癌、脑肿瘤(特别是脉络丛癌)、白血病、软组织和骨肉瘤这主要癌症类型或组成部分或轴心肿瘤,约占LFS相关肿瘤的70%。此外,LFS家族中还描述了一系列其他肿瘤,包括淋巴瘤、胃肠道恶性肿瘤(胃癌和结直肠癌)、黑色素瘤和肺癌,其发生年龄更年轻。最近的研究还报道了女性生殖器官(卵巢癌和子宫内膜癌)、泌尿生殖道(肾癌和前列腺癌)和眼睛的癌症。
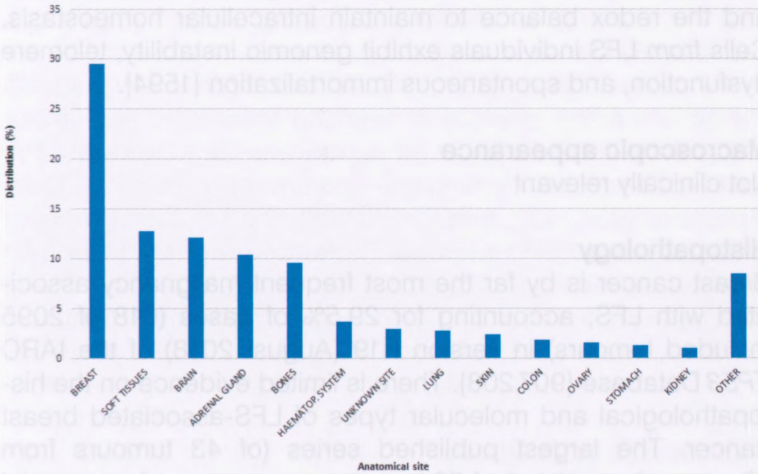
图9.04 2095例TP53种系突变相关肿瘤的百分比分布,按解剖部位分类。
简表9.02根据2019年WHO肿瘤分类术语修订的TP53种系检测的Chompret标准

LFS的经典定义要求<45岁的患者患有肉瘤,45岁之前患有任何癌症的一级亲属,以及45岁之前患任何癌症的一级或二级亲属或任何年龄的肉瘤。此后,这一临床定义得到了扩展,以更广泛地认识患有LFS的个人和家庭(见简表9.02)。
没有完整经典标准的患者和家庭称为患有Li-Fraumeni样综合征(LFL),该综合征在临床上分别由Birch和Eeles提出的两套标准进一步定义。Birch标准与经典LFS标准接近,但不需要肉瘤,而Eeles对LFL的定义包括两个在任何年龄患有LFS成分肿瘤的一级或二级亲属,而不是经典标准所要求的三个。对其他家族基因和TP53基因非编码区的调查可以解释LFL的发生。
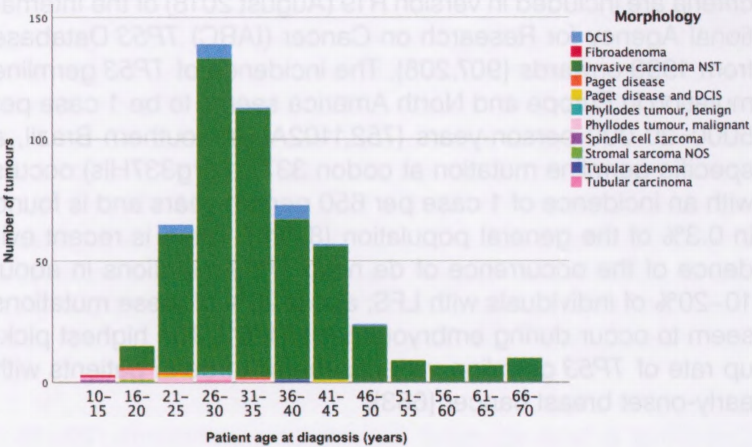
图9.05 324个TP53种系突变家庭中522例乳腺肿瘤的频率分布,按5年年龄组和组织学类型分类:491例非特殊类型浸润性癌(NST);DCIS10例;恶性PT10例;良性PT、FA、管状腺瘤和小管癌各1例。
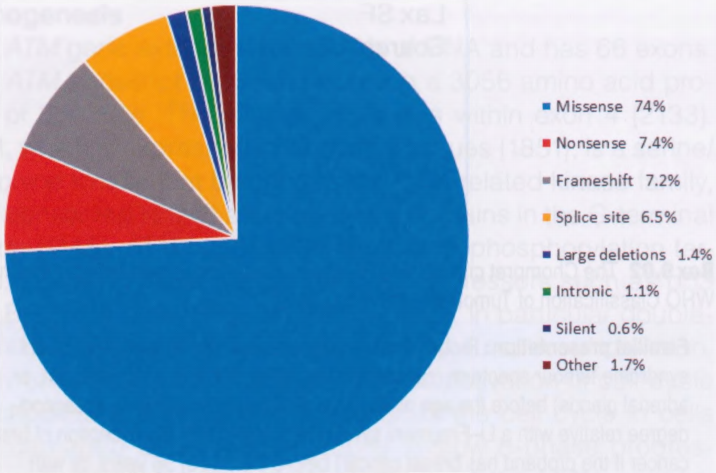
图9.06 1219种TP53种系突变按突变类型的百分比分布。
LFS或LFL相关乳腺癌大约1/3似乎发生在30岁之前,而50岁之后少见。估计<30岁的乳腺癌患者中约有3-8%携带TP53种系突变,无论家族史如何。在70名携带TP53 p.Arg337His突变的乳腺癌患者的队列中,49名患者年龄<45岁,21名患者年龄>55岁。因此,在没有其他恶性肿瘤的病例中,乳腺癌的早期发病指向LFS,而LFL中出现了乳腺癌的晚期发病。软组织肉瘤是第二常见的癌症类型,肿瘤发病年龄广泛(6个月至70岁),而骨肉瘤主要发生在儿童。
流行病学
从1990年起,国际癌症研究机构(IARC)TP53数据库的R19版(2018年8月)中包含了1200多个与LFS、LFL和有家族史或符合Chompret标准的先证者相关的种系突变。欧洲和北美TP53种系突变的发病率似乎为每5000-20000人每年1例。在巴西南部,密码子337(p.Arg337His)发生特定的种系突变,发病率为每650人每年1例,占总人口的0.3%。最近有证据表明,约10-20%的LFS患者发生了新发TP53突变;大约20%的突变似乎发生在胚胎发育过程中。TP53种系变异的最高检出率似乎是在早发性乳腺癌患者中。
病因
LFS的遗传基础是TP53基因的种系突变。在LFS家族中发现了涉及基因编码区的广泛TP53种系突变,但20-40%的LFS个体和大多数LFL家族可能缺乏可检测的突变。TP53突变与经典LFS表型之间缺乏100%一致性可以用几种方式来解释,包括翻译后改变、完全缺失、修饰基因的影响,以及影响特定种系改变产生的表型的其他基因的改变。突变可能发生在特定的热点密码子上,这些密码子要么干扰DNA结合,要么破坏结合表面的结构,从而干扰其调节靶基因转录的能力。错义突变导致密码子改变,对新变体的功能解释提出了挑战。进一步的突变可能发生在DNA结合结构域之外,包括重排和缺失。在IARC TP53数据库中,列出了1500多种不同的种系突变,只有四种模式约占突变的80%:CpG岛上的G:C>A:T占近50%,其次是A:T>G:C、G:C>A:T和缺失(各占约10%),主要涉及外显子5-8编码区内的11个密码子,最常见的密码子是175、245、248、273和282。已经鉴定了基因内含子或调控区内的病变,但它们的功能意义尚不清楚,并且关于癌症中发生的一些TP53变体的意义存在悬而未决的问题。有一些证据表明,在乳腺癌中发现的Fanconi通路基因、RECQ家族基因和其他基因与LFL癌有关。未来利用二代测序等新型测序技术的研究可能能够发现TP53以及LFS和LFL中其他基因的更多突变。
发病机制
TP53是最显著的肿瘤抑制因子之一,其作为转录因子激活,刺激下游途径,导致保护性细胞过程,包括细胞周期阻滞、凋亡和衰老,以防止转基因细胞的繁殖。这些细胞反应的重要性最近受到了小鼠模型研究结果的挑战。在正常病例中,p53蛋白由于其主要负调控因子MDM2介导的快速转换而保持在低水平。最近的证据表明,TP53功能与代谢调节和氧化还原平衡有关,以维持细胞内稳态。LFS个体的细胞表现出基因组不稳定、端粒功能障碍和自发永生化。
大体检查
与临床无关
组织病理学
迄今为止,乳腺癌是最常见的与LFS相关的恶性肿瘤,在IARC TP53数据库的R19版本(2018年8月)中,占29.5%的病例(2095个肿瘤中的618个)。关于LFS相关的乳腺癌的组织病理学和分子类型的证据有限。已发表的最大系列(39名女性的43个肿瘤)包括32例IBC-NST和11例DCIS;未见其他组织学类型。诊断时患者的中位年龄为32岁(范围:22-46岁)。有趣的是,HER2扩增的分子亚型(经典和变体)占主导地位。在浸润性癌中,84%为ER和/或PR阳性,81%为高级别,63%为HER2阳性(免疫组化3+或FISH扩增),53%为ER和HER2均阳性。在DCIS病例中,73%的HER2阳性,27%的ER和HER2阳性。HER2阳性的高频率已被其他人证实。乳腺恶性PT也可能与LFS有关,而男性乳腺癌似乎少见。
其他癌症可能累及除乳腺外的许多其他器官,最常见的是软组织和骨肉瘤、脑瘤和肾上腺皮质癌。最常见的软组织肉瘤类型是平滑肌肉瘤、横纹肌肉瘤、脂肪肉瘤和难以分类的未分化肉瘤。骨肉瘤是最常见的骨肿瘤。在脑肿瘤中,发现了胶质母细胞瘤和其他类型的胶质瘤、脉络丛癌、髓母细胞瘤和室管膜瘤。
细胞学
与临床无关
诊断分子病理学
TP53种系检测的候选人是根据2015年Chompret标准(见简表9.02,原书第279页)和国家综合乳腺癌网络(NCCN;见简表9.03)的建议确定的。在二代测序时代,可能有必要进一步扩大标准,以发现更多的TP53种系突变。除了BRCA1、BRCA2和其他基因外,年轻乳腺癌患者的种系测试应包括TP53测试。
诊断标准
必要标准:TP53中的致病性种系突变;适当的家族史。
简表9.03 NCCN推荐的LFS检测标准

a经典的LFS标准。b与LFS相关肿瘤:软组织肉瘤、骨肉瘤、CNS肿瘤、乳腺癌和肾上腺皮质癌。c Chompret标准。
分期
与临床无关
预后和预测
在男性中,≤15岁、16-45岁和>45岁的特定癌症风险分别为19%、27%和54%。在女性中,上述年龄组的风险分别为12%、82%和100%,乳腺癌发病率是观察到性别差异的原因。LFS中观察到的TP53突变会增加放射诱导的继发性恶性肿瘤的风险,并可能增加对低剂量放射暴露诊断方法(如乳房X线)的敏感性。
Li-Fraumeni综合征,CHEK2相关
定义
CHEK2相关Li-Fraumeni综合征(也称为LiFraumeni综合群2,LFS2)是一种遗传性癌症易感性综合征,由CHEK2基因的种系突变引起。
MIM编号
609265 LFS2
ICD-11编码
没有
相关术语
可接受:CHK2
亚型
没有
部位
除了乳腺癌,种系CHEK2 c.1100delC杂合性还与胃、结肠、甲状腺、肾和前列腺的癌症以及肉瘤和非霍奇金淋巴瘤的风险增加有关。
临床特征
CHEK2是一种中度渗透性乳腺癌易感性基因,女性估计的终生风险为20-30%。女性CHEK2c.1100delC携带者在80岁时发生ER阳性和ER阴性肿瘤的估计累积风险分别为20%和3%。女性CHEK2c.1100delC相关乳腺癌似乎伴有对侧乳腺癌发病率增高。
流行病学
由潜在CHEK2种系突变引起的乳腺癌占女性所有乳腺癌病例的1-3%,占男性的4-9%。c.1100delC变异最普遍,总体比值比为2.89,女性乳腺癌为2.88,男性乳腺癌为3.13。c.1100delC的发病率因地区性乳腺癌人群而异,从0%(马来西亚)到2.7%(俄罗斯联邦)。在基于人群的无症状携带者研究中,频率范围为0%(西班牙)至0.7%(瑞典)。
病因
CHEK2是一个54.6KB的基因,位于染色体22q12.1。CHEK2突变产生功能失调的蛋白质,导致DNA修复中断,从而积累导致癌症发生的遗传事件。CHEK2种系突变患者发生癌症的外部因素目前未知。
发病机制
CHEK2是一种肿瘤抑制基因,编码丝氨酸/苏氨酸细胞周期检查点激酶CHK2。CHK2蛋白被双链DNA断裂激活,进而激活下游修复蛋白,包括BRCA1和p53,通过调节细胞周期检查点和通过同源重组触发DNA修复,在DNA损伤反应中发挥重要作用。最常见的遗传改变是c.1100delC截短功能丧失突变,该突变产生了一种不稳定的CHK2蛋白,失去激酶活性。对于女性c.1100delC突变携带者,目前没有证据表明在调整ER状态后,风险会因PR或HER2状态而变化,也没有证据表明相对风险会因级别或形态而变化。
c.1100delC病例的阵列比较基因组杂交显示1p13.3-p31.3、8p21.1-p21.2、8p23.1-p23.2和17p12-p13.1的重现性缺失,以及12q13.11-q13.13、16p13.3和19p13.3的获得。在基因表达分析中,26例CHEK2 c.1100delC突变肿瘤与激素受体阳性乳腺癌聚集在一起,为管腔A(n=8)或管腔B(n=18)亚型乳腺癌。另一项研究指出,1p22上的CLCA1和12q13上的CALOC01、MUCH(SBEM)和LRP1是CHEK2 c.1100delC相关肿瘤进展驱动因素的候选者。
CHEK2的大部分数据都与c.1100delC变异有关,这种变异在北欧人群中常见。纯合型c.1100delC携带者乳腺癌的风险可能高于杂合型女性。CHEK2错义变异体,如c.470T>c(p.lle157Thr)可能比CHEK2 c.1100delC截断变异体降低女性乳腺癌的风险。p.lle157Thr变体破坏了CHK2蛋白的正确二聚化,导致功能失调的蛋白质影响叉头相关和激酶结构域界面的相互作用。发现p.lle157Thr变体与管腔A型和低E-cadherin(CDH1)表达有关,截断突变似乎与管腔B型有关。根据截至2018年11月的ClinVar数据库,已报道200多种致病性或可能致病性CHEK2种系变异,其中c.1100delC和c.470T>c(p.lle157Thr)错义变异似乎最为普遍。
大体检查
大体表现与散发性乳腺癌的差异未知。
组织病理学
关于CHEK2相关乳腺癌的形态学和生物标记物免疫表型特征的集体报道相互矛盾。一些研究已经确定了高级别肿瘤的倾向,而另一些研究则描述了低级别乳腺癌的频率增加。ER、PR和HER2表达的所有组合也已被鉴定,但c.1100delC携带者往往是激素受体阳性肿瘤。据报道,p.lle157Thr变异携带者与小叶表型有很强的联系。当按突变分析时,c.1100delC变体与管腔B型相关,而p.lle157Thr变体与管腔A型相关。肿瘤病理学的差异可能与CHEK2突变的类型有关。
细胞学
与散发性乳腺癌的细胞学差异未知。
诊断分子病理学
与临床无关
诊断标准
必要标准:CHEK2中的致病性种系突变。
分期
分期与散发性乳腺癌没有差异。
预后和预测
患有c.1100delC相关乳腺癌的患者的生存率降低。此外,这些患者对辅助化疗的反应没有显著差异。CHEK2 p.lle157Thr携带者的存活率与非携带者相当。
CDH1相关乳腺癌
定义
CDH1相关乳腺癌是一种癌症易感性综合征,其特征是乳腺小叶癌,由CDH1(编码E-cadherin)的种系突变失活引起。ILC也可发生在遗传性弥漫性胃癌(HDGC)中,这也是由CDH1的种系突变引起的。
MIM编号
192090 Cadherin 1;CDH1
ICD-11编码
没有
相关术语
可接受:遗传性乳腺小叶性癌;遗传性弥漫性胃癌(HDGC)。
亚型
没有
部位
CDH1相关的乳腺癌没有明确的部位。HDGC可以影响胃的所有分区。
临床特征
女性CDH1突变携带者罹患乳腺小叶癌的终生风险为40%。ILC的临床表现见第2章(原书第114页)。对于与胃癌无关的小叶癌易感性,没有广泛使用的CDH1基因筛查的临床标准。然而,一个关于遗传性乳腺小叶癌的国际专家小组提出了CDH1检测的标准(见下文的诊断标准)。
流行病学
在没有胃癌家族史的早发性或家族性乳腺小叶癌女性中,CDH1种系突变的频率非常低(约1%)。在50例双侧LCIS或ILC患者中,有4例发现了致病性CDH1种系突变。
病因
CDH1位于16q22.1,由16个外显子组成,编码E-cadherin。E-cadherin是一种跨膜蛋白,主要在上皮细胞的基底外侧膜上表达,参与嗜同细胞粘附和机械力的转导。它的细胞质结构域与许多结构和调节蛋白相互作用,包括catenin家族。这些相互作用影响细胞存活信号、微管网络和皮质actin细胞骨架的组织,对细胞形状、极性和运动性产生深远影响。
发病机制
据报道,几种CDH1种系改变与乳腺小叶癌风险增加有关。传统上,CDH1种系突变患者的乳腺小叶癌也与HDGC的易感性有关。然而,最近的研究发现,在没有胃癌家族史的病例中,CDH1变异在遗传性乳腺小叶癌中具有潜在的致病作用。乳腺肿瘤中E-cadherin表达的缺失是通过各种体细胞机制发生的:体细胞CDH1突变、杂合性缺失、CDH1启动子高甲基化和等位基因失衡。
大体检查
CDH1突变携带者的大体表现没有具体信息;然而,ILC通常表现为难以肉眼观察的模糊肿块。可能存在硬度增加的模糊区域,而不是离散的肿块,最终的肿瘤直径通常超过肉眼估计。
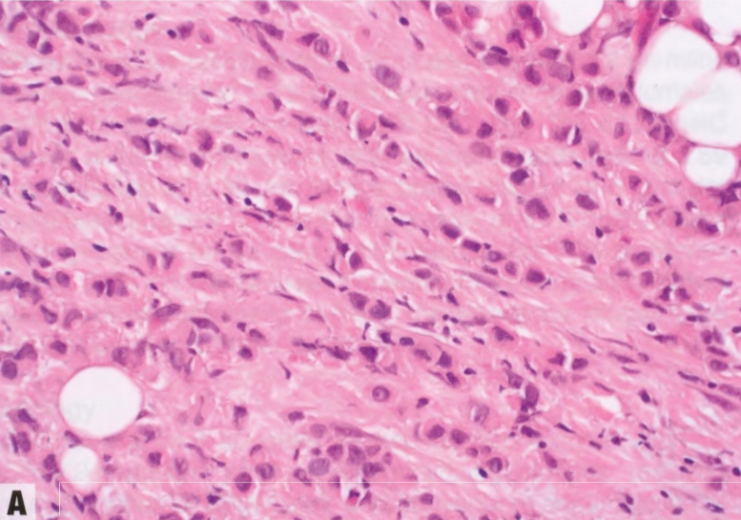
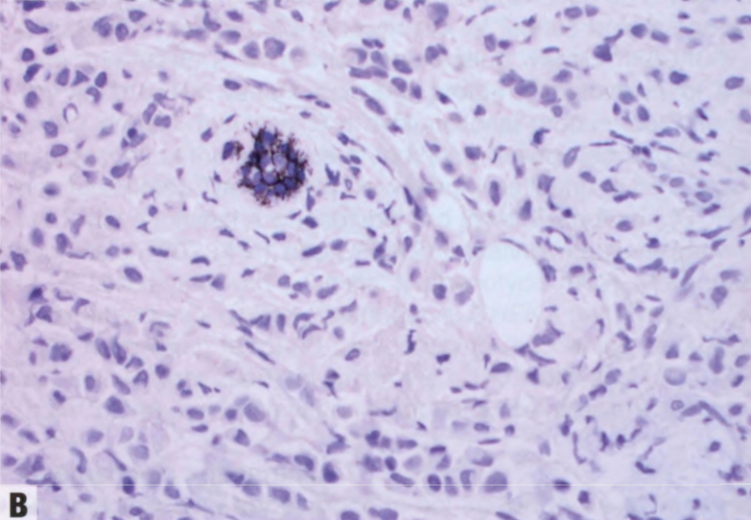
图9.07乳腺ILC。A 这些细胞不形成腺体,单独存在或单行排列。轻微核多形性,偶见核仁和细胞质内包涵体(更多图像参见原书第114页)。B E-cadherin表达的典型缺失。注意正常上皮细胞阳性。
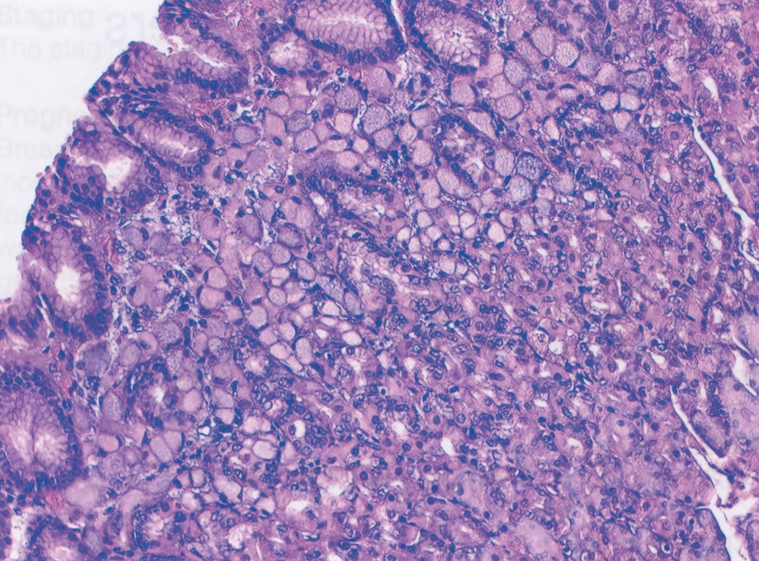
图9.08胃印戒细胞/弥漫性癌。一例遗传性弥漫性胃癌(HDGC),它也可能形成ILC。
组织病理学
CDH1种系突变与ILC特异性相关。大多数已发表的系列文章没有提供更详细的组织学信息,如CDH1突变携带者的级别或大小。
ILC在第2章(原书第114页)详细描述,总体上,其特征是弥漫性浸润,由具有单形核的小圆细胞单独或以单行和条索的形式浸润。背景乳腺结构轻微破坏,肿瘤细胞通常围绕现有结构,形成靶向排列。有时,细胞可能有显著的细胞质内黏液空泡或淡染的泡沫状细胞质,呈现组织细胞样外观。有具有实性、腺泡状或管状小叶状生长模式的亚型,也有具有明显核多形性的多形性亚型,后者常有大汗腺形态和丰富的嗜酸性细胞质。经典型ILC几乎总是ER阳性和HER2阴性,但多形性亚型可能ER阴性,在大约15-40%的病例中HER2阳性。无论种系突变如何,ILC都会发生E-cadherin膜染色缺失。
细胞学
ILC的穿刺物含有小的单形细胞,具有轻度异型性,常有细胞质内黏液空泡。细胞表现单个、松散的簇状或形成条索。一些系列研究表明,FNA的假阴性率增加,ILC在很大程度上与低肿瘤细胞量有关,但这些细胞有时很温和,可能误认为淋巴细胞。详见第2章(原书第114页)。
诊断分子病理学
CDH1种系突变的基因检测应在两种情况下考虑。在没有乳腺癌家族史的病例中,基因检测的两个标准是:(1)双侧ILC,伴或不伴ILC家族史,患者发病年龄<50岁;(2)单侧ILC,ILC家族史,患者发病时间<45岁。在HDGC的情况下,基因检测的标准是个人或家族(一级或二级亲属)有弥漫性胃癌和ILC病史,其中一例诊断年龄小于50岁。
诊断标准
必要标准:CDH1中的致病性种系突变。
分期
分期与其他乳腺癌相同。
预后和预测
估计男性和女性CDH1突变携带者发生乳腺癌的累积风险分别为70%和56%。女性携带者患ILC的终生风险为40%。在HDGC的情况下,弥漫性胃癌是男女死亡率的主要原因。
PALB2相关乳腺癌
定义
PALB2相关乳腺癌的发生是由于PALB2基因(BRCA2伴侣)的种系突变。
MIM编号
610355 BRCA2的伴侣和定位点;PALB2
ICD-11编码
没有
相关术语
可接受:DNA双链断裂修复;同源重组修复;胰腺癌3;范可尼贫血,互补组N。
亚型
种系单等位基因突变与癌症风险增加相关。种系双等位基因突变与遗传综合征范可尼贫血,互补组2相关。
部位
PALB2突变与乳腺癌和胰腺癌有关。
临床特征
具有单等位基因种系PALB2突变的患者对乳腺癌和胰腺癌的易感性增加。PALB2最初视为乳腺癌的中危基因;然而,随后的工作导致其被重新分类为高风险:PALB2突变与乳腺癌风险相关,比平均水平高出9倍,平均终生风险约为14%。功能丧失的基因突变带来的风险似乎与尚未阐明的其他遗传因素协同作用,因为携带者的平均风险因家族史而异。例如,一名没有乳腺癌直系家族史的70岁携带者的风险仅为33%,但当两名一级亲属有乳腺癌病史时,风险几乎翻了一番,达到58%。
PALB2中的双等位基因突变导致常染色体隐性遗传综合征范可尼贫血,互补组2。范可尼贫血患者表现出对DNA交联剂的超敏反应、身材矮小、小头畸形、高血压、骨髓衰竭和主要器官系统发育异常。此外,范可尼贫血与多种儿童恶性肿瘤的早期发作有关,包括急性白血病、神经母细胞瘤、肾母细胞瘤和髓母细胞瘤。在乳腺癌组织中很少观察到PALB2的体细胞突变。在乳腺癌组织的全基因组分析中,在560个样本中的8个样本中发现了PALB2的体细胞突变(1.4%)。根据乳腺癌体细胞突变目录(COSMIC),在4060份乳腺癌样本中发现52份(约1.3%)PALBE体细胞突变。
流行病学
尽管在一般人群中很罕见(<1%),但在1-5%的家族性乳腺癌患者中发现了单等位基因种系PALB2突变。与BRCA突变不同,PALB2突变似乎与德系犹太人血统或种族多样化的犹太血统没有强烈关联。在美国,范可尼贫血的患病率约为每13万活产1例,其中只有一小部分病例可归因于双等位基因PALB2突变。
病因
与PALB2相关的家族性乳腺癌患者遗传了该基因中的单等位基因种系突变。第二次命中,无论是通过体细胞点突变还是杂合性丧失,都会导致大多数乳腺癌的双等位基因失活,导致PALB2功能丧失。
发病机制
PALB2是一个38KB的基因,位于染色体16p12.2上,跨越13个外显子,编码肿瘤抑制蛋白PALB2,通过同源重组参与DNA双链断裂修复。其关键作用之一是结合和稳定BRCA2,允许核BRCA2积累。PALB2还促进肿瘤抑制蛋白RAD51掺入加工的单链DNA末端,用于同源重组修复中的链交换。因此,PALB2功能受损会导致双链断裂修复缺陷,这有助于DNA断裂的非同源末端连接和突变的积累。
大体检查
与散发性乳腺癌的大体表现差异未知。
组织病理学
与PALB2突变相关的乳腺癌的形态学研究有限。一项针对28例病例的系列研究将PALB2突变患者的乳腺癌与BRCA相关和非家族性乳腺癌进行了比较,发现PALB2组的唯一形态特征是轻微的间质硬化。尽管PALB2和BRCA2蛋白之间存在功能关系,但与BRCA相关乳腺癌更常见的特征,如高级别组织学和强烈的淋巴浸润,并不能预测这个小系列中的PALB2突变。
细胞学
与散发性乳腺癌的细胞学差异未知。
诊断分子病理学
PALB2突变最常通过对患者血液样本进行二代测序来鉴定。这些测试越来越多地使用多基因组合来评估大量与家族性乳腺癌风险相关的基因。
诊断标准
必要标准:PALB2中的致病性种系突变。
分期
分期与散发性乳腺癌相同。
预后和预测
PALB2突变的乳腺癌患者不仅患继发性乳腺癌的风险增加,患胰腺癌的风险也增加。因此,在这一人群中增加筛查可能是有必要的。最近的研究表明,PALB2致病性种系变异与功能性BRCA缺乏有关,提示使用聚ADP核糖聚合酶(PARP)抑制剂进行治疗干预的可能性。
Peutz-Jeghers综合征
定义
Peutz-Jeghers综合征(PJS)是一种常染色体显性遗传性息肉和癌症易感性综合征,其特征是与STK11突变相关的黏膜皮肤黑色素沉着和胃肠道息肉病。
MIM编号
175200 PJS
ICD-11编码
LD2D.0 PJS
相关术语
没有
亚型
没有
部位
PJS中的息肉通常发生在小肠(95%的PJS患者)。大约25%的患者结肠和胃有息肉。女性恶性肿瘤第二常见的器官部位是乳腺。
临床特征
出现的症状包括腹痛、肠出血、贫血和肠套叠,通常在生命的前二十年出现。如果存在特征性的黏膜皮肤色素沉着,可以诊断出家族性病例中的无症状患者,但特征性的PJ息肉是主要的临床标志。
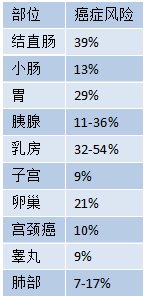
PJS与一系列恶性肿瘤的中高风险相关,70岁时患任何癌症的总风险为81%(见表9.05)。有充分记录的肠外肿瘤包括乳腺癌和胰腺癌,以及其他罕见的性腺病变,包括卵巢环状小管性索肿瘤和睾丸支持细胞肿瘤。
流行病学
PJS的发病率大约是家族性腺瘤性息肉病的十分之一,估计发病率为每5万-20万新生儿中1例。
病因
90%以上的PJS患者存在编码丝氨酸/苏氨酸激酶的肿瘤抑制基因STK11(以前称为LKB1)的种系突变。大多数种系缺陷是点突变和小的基因内缺失,但也有人描述了一个或多个外显子的较大缺失。
表9.05 65-70岁时特定解剖定位的PJS乳腺癌风险
发病机制
PJS患者胃肠道癌症的直接前驱病变尚不清楚。Peutz-Jegers息肉可能是癌症的副带现象,而不是必然的恶性前驱病变。目前尚无关于乳腺癌发病机制的资料。
大体检查
与散发性乳腺癌的大体表现差异未知。
组织病理学
关于PJS中乳腺癌表型的数据很少,但非常有限的数据表明,与BRCA2携带者的乳腺癌类似,PJS中的乳腺癌可能为中高级别、ER-阳性和PR-阳性以及HER2-阴性。胃肠道PJ息肉在本丛书的消化系统肿瘤分册中有详细描述。
细胞学
与散发性乳腺癌的细胞学检查差异未知。
诊断分子病理学
与临床无关
诊断标准
PJS的诊断标准见简表9.04。
分期
分期与散发性乳腺癌相同。
预后和预测
PJS患者的预后现在主要由恶性肿瘤的风险决定,并且PJS显示癌症死亡率增加。PJS患者应接受调查,以预防胃肠道并发症和癌症。乳腺癌的具体数据未知。
简表9.04 PJS的诊断标准

a一些黑色素沉着也经常出现在未受累个体,因此强调色素沉着的显著性;此外,PJS患者的色素沉着可能随着时间的推移而消失,在极少数病例中可能完全消失。
1型神经纤维瘤病
定义
1型神经纤维瘤病(NF1)是一种遗传性、多系统、神经皮肤疾病,使个体易患良性和恶性肿瘤。
MIM编号
162200 NF1
ICD-11编码
LD2D.10 NF1
相关术语
可接受:von Recklinghausen病。
亚型
没有
部位
与NF1相关的肿瘤位于大脑、中枢和外周神经以及乳腺。
临床特征
NF1相关的乳腺癌(NF1-BC)没有特定的临床特征,尽管整个NF1基因缺失(所谓的微缺失)的患者倾向于经历更严重的NF1相关疾病,包括恶性肿瘤(如恶性周围神经鞘瘤)的发病率更高,但矛盾的是,他们患NF1-BC的风险似乎很低。然而,尽管NF1-BC可以发生在任何年龄,但它往往较年轻,并且更加恶性。
流行病学
NF1的患病率为每2000-3500人1例,在所有受试人群中都是一致的。NF1-BC发生在男性和女性,有时是双侧,符合易感性。50岁以下女性NF1-BC的绝对和相对风险都有所增加:7.8-8.4%,而普通人群为2%,标准化发病率为4.0-8.8(见表9.06)。
病因
NF1是一种常染色体显性肿瘤易感性综合征,由NF1基因中的遗传致病性变异引起(17q11.2)。很大一部分病例是由新发突变引起的。表现力和与年龄相关的外显率是可变的。有证据表明,NF1-BC在NF1致病性变体患者中更有可能获得功能。这与在散发性乳腺癌中观察到的体细胞NF1突变的研究一致,其中乳腺癌是唯一一种常见NF1扩增的恶性肿瘤(重要的是,它独立于ERBB2扩增)。
发病机制
神经纤维蛋白(NF1)是一种大型(2485个氨基酸)细胞质蛋白,主要在神经元、雪旺细胞和少突胶质细胞中表达。它有许多结构域,是几种细胞内途径(如RAS/cAMP)、MAPK/ERK级联、腺苷酸环化酶和细胞骨架组装的主要调节因子。最近在大鼠模型中证明了与ER信号传导的潜在直接功能联系。
大体检查
NF1-BC没有特定的大体特征。
组织病理学
NF1中发生的乳腺癌大多是IBC-NST ,但LN也会发生。最近的数据还显示,它与散发性化生性癌有关,其中体细胞NF1突变的表达过高。
细胞学
与临床无关
表9.06 NF1-BC风险估计
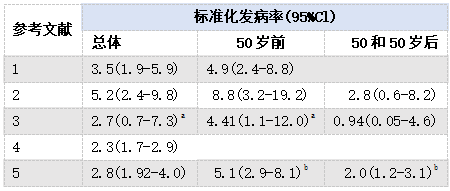
a根据种族、1型神经纤维瘤病发病率和诊断日期进行调整。b根据已发布的观测值和预期值,使用Poisson回归进行计算。
诊断分子病理学
NF1-BC没有一致的特征,如ER、PR或HER2的阳性,但缺乏明确的证据来排除这种关系。
诊断标准
需要以下标准中的两个才能诊断NF1:>6个牛奶咖啡斑、神经纤维瘤(即表现为皮肤、皮下或丛状病变的周围神经鞘瘤)、皮肤褶皱雀斑、>2个虹膜结节、视神经通路胶质瘤、特定骨发育不良(长骨皮质变薄、蝶骨翼发育不良)、一名受影响的一级亲属。
分期
NF1中乳腺癌的分期与散发性乳腺癌的分期相同。
预后和预测
考虑到NF1中患乳腺癌的风险增加,建议对患有NF1的女性进行乳腺癌筛查。然而,最近的研究表明,与特定的NF1变体相关,乳腺癌的风险可能更高,并且全基因缺失的患者的风险可能降低,这表明在个体中推广风险的作用可能有限;未来,可能有更个性化的突变特异性建议。
NF1-BC的预后往往较差,这可能与就诊时较高分期有关,部分可能是由于NF1患者经常有学习困难,这是晚期诊断中公认的危险因素。三项人体研究报道了NF1-BC的死亡率增加和不利的预后因素。
乳腺癌易感性的多基因成分
已知乳腺癌易感性基因的致病性变异仅占乳腺癌家族风险的一小部分。已经鉴定了几种乳腺癌易感基因,当它们在生殖系中突变时,会显著增加患乳腺癌的风险(即2倍至20倍)。这些是BRCA1、BRCA2、TP53、PTEN、STK11、CDH1、PALB2、CHEK2、ATM和NBN(NBS1);它们加在一起能解释20-25%的家族性乳腺癌风险。
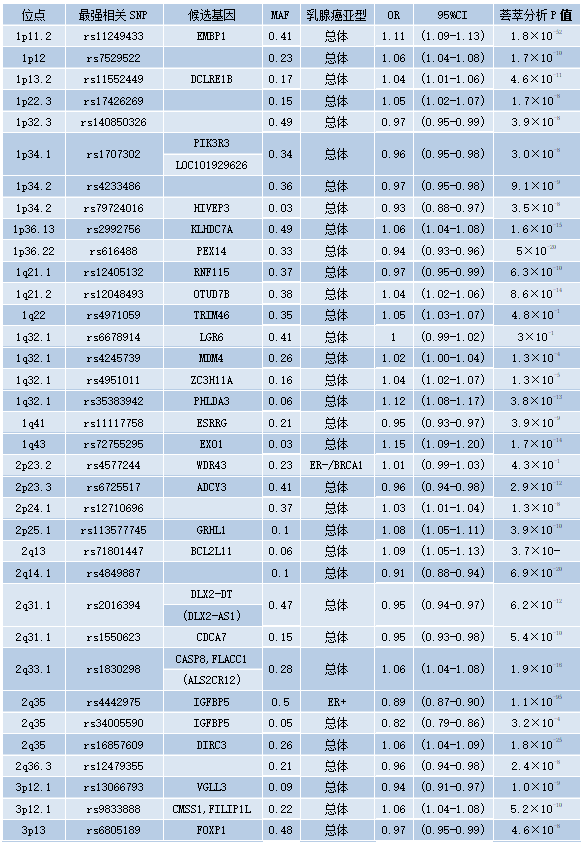
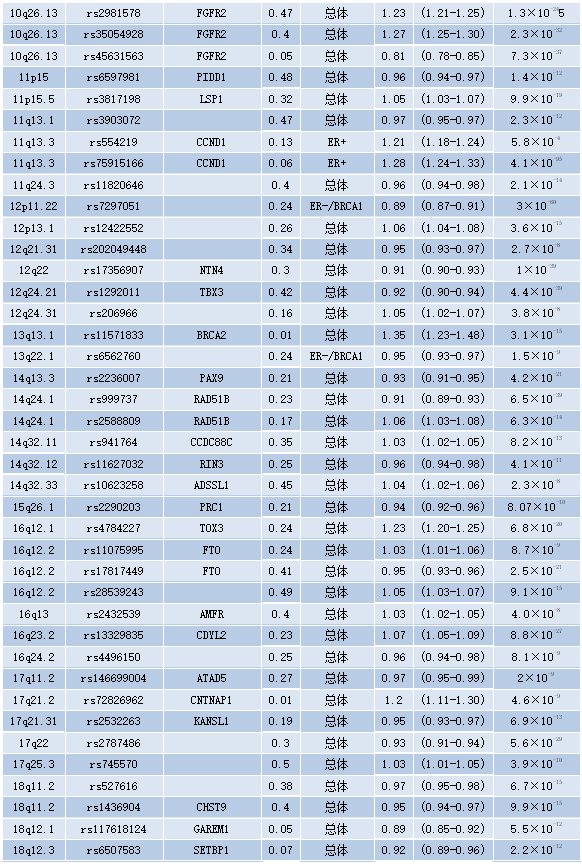
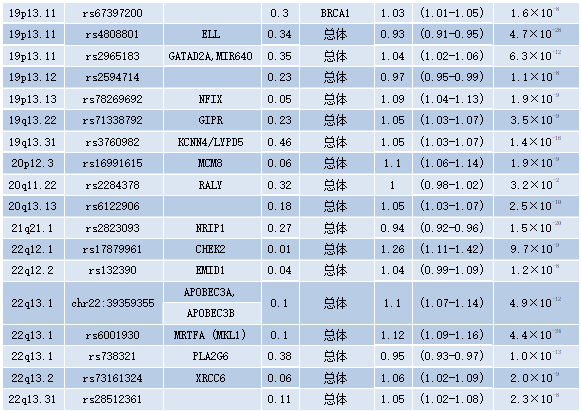
在过去的十年里,家族性乳腺癌风险的另外18%是通过识别170多种常见的遗传变异来解释的,这些变异通常位于编码区之外,每种变异都与乳腺癌风险的增加高达1.3倍有关。与高外显率相关的致病性变异不同,这些变异在人群中常见,通常被称为低外显率等位基因。这些所谓的低外显率乳腺癌易感性等位基因通常通过全基因组关联研究来识别,在该研究中,标记基因组等位基因的SNP在受乳腺癌影响的女性(病例)和未受乳腺癌影响的女性之间进行比较,从而利用人类基因组中的连锁不平衡结构。由于与这些变异相关的乳腺癌风险非常小,因此需要大量受试者进行全基因组关联研究;因此,建立大型研究联盟对于继续识别这些变体至关重要。来自乳腺癌协会联合会(BCAC)的最新也是最大的乳腺癌全基因组关联研究,测量了137045例病例和119078例对照的1180万个SNP。该研究确定了65个新的乳腺癌风险等位基因,并从49个先前确定的等位基因中复制了低渗透等位基因。到目前为止,共鉴定出172个低渗透性乳腺癌易感性等位基因(见表9.07,原书第294页)。然而,据估计,这些仅占家族性乳腺癌风险的44%,这可以通过乳腺癌易感性的多基因成分来解释。
乳腺癌亚型
大多数低渗透性乳腺癌易感性等位基因与ER-阳性而非ER-阴性乳腺癌乳腺癌的高风险相关。事实上,与总体乳腺癌风险相关的大多数常见基因变异也显示与ER-阳性乳腺癌相关。只有20个低渗透性乳腺癌易感性等位基因与ER-阴性乳腺癌单独相关。这表明ER阳性和ER阴性乳腺癌具有共同的遗传病因,伴有亚型特异性遗传特征。
与ER-阴性乳腺癌相关的低遗传性乳腺癌易感性等位基因也与BRCA1致病性变异携带者的乳腺癌风险相关——这一发现与大多数BRCA1致病性变异携带者携带者ER-阴性疾病的观察结果一致。此外,24个与总体乳腺癌风险相关的低渗透性乳腺癌易感性等位基因也与BRCA1致病性变异携带者的乳腺癌风险相关。类似地,BRCA2致病性变异携带者通常发展为ER-阳性疾病,与总体乳腺癌(主要是ER-阳性病)风险相关的低外显率乳腺癌易感性等位基因也与BRCA2致病型变异携带者的乳腺癌风险相关。
尽管大多数乳腺癌是导管癌,但也有人致力于识别低渗透性乳腺癌易感性等位基因,这些基因特别使个体易患其他组织学亚型。7q34的一个低渗透性乳腺癌易感性等位基因与乳腺小叶癌特异性相关。七个等位基因在ER阳性乳腺癌浸润性导管癌组织学和浸润性小叶癌组织学之间显示显著差异。其中三个等位基因与浸润性小叶癌的关联比与浸润性导管癌的关联更强,另外四个与浸润性管道癌有特异性关联。没有发现与DCIS特异性相关的低渗透性乳腺癌易感性等位基因,这表明DCIS和浸润性导管癌具有共同的遗传病因。
很少有低渗透性乳腺癌易感性等位基因与其他乳腺癌类型明确相关。一个罕见的例外是19p13的低渗透性乳腺癌易感性等位基因,它也与乳腺癌相关。有趣的是,9p21.3区域的常见遗传变异与多种疾病表型相关,包括中风、冠状动脉疾病、糖尿病和几种类型的癌症(包括乳腺癌、食管鳞状细胞癌、口腔癌症和多发性骨髓瘤)。该区域的常见遗传变异也与胶质瘤中的全球DNA甲基化模式有关。此外,在一个家族性黑色素瘤、星形细胞瘤和乳腺癌家族中,报道了该区域的大量种系缺失(累及9个基因)。
大多数低渗透性乳腺癌易感性等位基因已在欧洲血统人群中鉴定。由于欧洲和非欧洲血统人群之间的连锁不平衡结构存在差异,这可能影响某些人群中某些等位基因的乳腺癌风险。非洲妇女ER-阴性乳腺癌的发病率增加,这也可能部分由遗传风险因素解释。这突显了在非欧洲人群,特别是非洲人群中进行更大规模的全基因组关联研究的必要性。
乳腺癌特异性存活率
在许多病例中,已经研究了种系遗传信息添加到常规收集的肿瘤衍生预后因素中的潜力。在候选基因研究和汇总分析中,研究了常见基因变异与乳腺癌特异性生存率之间的可能联系。这些研究已经确定并进一步评估了许多名义上与结果相关的常见遗传变异,但很少有被复制和/或达到全基因组意义。作为欧洲全基因组关联研究大型荟萃分析的一部分,进行了乳腺癌亚型特异性生存分析,确定了一种与具有全基因组意义的ER-阴性疾病相关的(估算)常见遗传变异。然而,需要具有必要设计和数据的更大规模研究来提供足够的统计能力,以明确识别与生存相关的常见遗传变异,并支持乳腺癌亚型分析。
归因于遗传变异
全基因组关联研究利用了人类基因组的连锁不平衡结构,并确定了可能标记与疾病相关的基因组区域的常见变异。这些区域标记的常见遗传变异与乳腺癌风险相关,但它们很少是遗传易感性的原因。因此,已经投入了大量的工作来进一步精细地绘制这些感兴趣的区域,并结合计算机分析和分子实验,以确定所谓的因果变异及其作用机制。对172个风险等位基因中的22个进行了此类全基因组后关联研究分析,并对低渗透性乳腺癌易感性等位基因如何增加乳腺癌风险提供了一些新的见解。例如,一个单一的乳腺癌风险等位基因可能包含多种因果变异。1p11.2、2q33、4q24、5p12、5p15.33、5q11.2、6q25.1、8q24、9q31.2、10q21、10q26、11q13和12p11处的乳腺癌风险等位基因可能各自包含两到五种不同的因果变异。此外,每个因果变异都被预测会调节两到三个不同的靶基因。在这些低渗透性乳腺癌易感性等位基因中,在转录水平上下调靶基因或非编码RNA是一个共同的主题。因此,这些等位基因通常位于与开放染色质位点、转录因子结合位点以及染色质相互作用和组蛋白修饰位点相关的调控区域。与高渗透性和中等渗透性乳腺癌易感性基因相反,这些低渗透性等位基因解除调节的基因不一定参与DNA损伤反应途径,而是影响已知的体细胞乳腺癌驱动基因。对来自128个乳腺癌风险等位基因的689个预测靶基因的通路分析揭示了参与的FGF、PDGF和WNT信号通路,以及ERK1/2级联、免疫反应和细胞周期通路。然而,乳腺癌驱动基因的表达不一定会因种系变异和体细胞突变而在同一方向上失调。例如,MAP3K1的表达在生殖系中通过5q11.2位点的低外显率变体上调。相比之下,MAP3K1中的体细胞驱动突变是失活的,因此与表达下调有关。
多基因风险评分
与每个个体低外显率乳腺癌易感性等位基因相关的风险程度非常低,但这些风险似乎是成倍结合的,因此与携带大量这些等位基因有关的乳腺癌风险可能是巨大的。多基因风险评分(PRS)是每种常见风险相关变异的对数比值比之和,现在可以用来确定是否应该为每个女性探索降低风险的干预措施,即使没有高风险致病性变异。根据77个风险相关等位基因的最新估计,与处于PRS中间五分之一的女性相比,处于PRS分布最高1%的女性患乳腺癌的风险增加了3.4倍。预计在PRS中添加更多风险相关的等位基因,可能进一步对普通人群中的乳腺癌风险进行分层,为PRS在预防环境中的应用提供额外支持。
PRS还被证明可用于进一步对BRCA1、BRCA2和CHEK2种系致病性变体携带者中的乳腺癌风险进行分层。特别是对于BRCA1和BRCA2致病性变异携带者,他们(平均而言)一生中患乳腺癌的风险很高,有关PRS的信息可以充分改变他们的风险,以支持他们临床风险管理的改变。可以对PALB2和ATM致病性变异携带者的乳腺癌风险进行分层的PRS可能在未来开发。
利用各种临床变量(如家族史、生殖史和乳腺密度)的几种乳腺癌风险预测模型目前应用于临床环境,如乳腺和卵巢疾病发病率分析和携带者估计算法(BOADICEA)、BRCAPRO模型、乳腺癌风险评估工具(BCRAT)和国际乳腺癌干预研究(IBIS)风险评估工具。值得注意的是,将77风险等位PRS与这些临床模型相结合,可将50岁以下女性的乳腺癌风险预测提高20%以上。然而,纳入这些风险模型的一些临床变量也是遗传特征;因此,与这些特征和乳腺癌相关的风险相关基因变异可能存在一些重叠。例如,18%的已知低渗透性乳腺癌易感性等位基因也与乳腺摄影乳腺密度有关,这是乳腺癌的一个重要风险因素。因此,了解乳腺癌PRS已经包含了多少这些可遗传风险因素是未来研究的一个重要领域。
表9.07 172个与癌症相关的低风险等位基因


全书完结。
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论