往期回顾:
2.2腺病和良性硬化性病变
简介:腺病定义为TDLU腺泡单位数量的相对增加。属于非肿瘤性增殖,保持正常的两个细胞群和基底膜。
腺病和良性硬化性病变(特别是RS和CSL)的特征是具有双层上皮(上皮和肌上皮细胞层)的小管和腺泡的小叶中心性增殖。良性硬化性病变还具有中心硬化和/或弹性病灶,此处腺体结构呈放射状。良性硬化性病变通常被上皮增生性病变累及,而腺病常有单层上皮细胞衬覆于腺泡。
Sclerosing adenosis
硬化性腺病(SA)
定义
因纤维化而扭曲的良性腺体结构,形成小叶中心性增殖。
ICD-11编码
没有
ICD-11编码
GB20.Y其他特定良性乳腺疾病
相关命名
没有
亚型
没有
部位
SA没有特征性的位置或侧性。
临床特征
SA通常是因其他适应症而切除的乳腺标本中的显微镜下偶然发现。许多病变伴有乳房X线检查发现的微钙化和/或结构变形,这会导致粗针活检。有时,大面积腺病可能表现为无法触及的影像学检出的肿块病变。
流行病学
SA发生在广泛的年龄组,最常见于20-40岁女性。
病因
尚未发现与SA病因相关的具体因素。
发病机制
腺病是一种非肿瘤性增殖,目前没有已知的分子或遗传学异常。
大体表现
大体表现取决于病变的大小和组织病理学特征。大多数腺病小,所以肉眼检查不明显。偶尔形成质硬、橡胶样灰色肿块,称为结节性腺病或腺病瘤。可能伴有微钙化,微钙化可能非常丰富,切面呈沙砾感。
组织病理学
SA的特征是小腺泡或小管结构的增殖,导致小叶单位增大,小腺泡或小管被间质胶原挤压或扭曲。小管呈圆形,稍微成角,通常大小均匀。常见微钙化,可见于纤维化间质或腺腔中。上皮细胞小,通常呈立方形到柱状,核居中。小管周围的肌上皮细胞有深染的梭形核,通常容易识别。上皮细胞与肌上皮细胞的比例在不同病例之间差异很大。部分病例中,上皮细胞相对萎缩,肌上皮细胞相对增殖。其他病例中,两种细胞都增生。两种细胞都可有化生改变。间质胶原多少不等。间质胶原的积累导致小管受挤压,可能产生假浸润生长模式。腺体挤压和扭曲在病变中心更明显,可能完全堵塞腺腔,导致实性或条索状生长模式。SA腺体可能延伸到脂肪组织,但仍然维持小叶中性性生长模式。低倍辨认小叶中心性生长模式有助于确诊诊断。
导管型和小叶型的非典型上皮增殖和CIS都可能累及SA,可能导致诊断问题。特别是CIS累及SA,可能貌似浸润性癌,活检小标本(如粗针活检)更难。识别潜在的SA小叶中心性生长模式和导管周围肌上皮细胞,有助于确定诊断。可能需要免疫染色显示肌上皮细胞,以证实病变的原位性质。
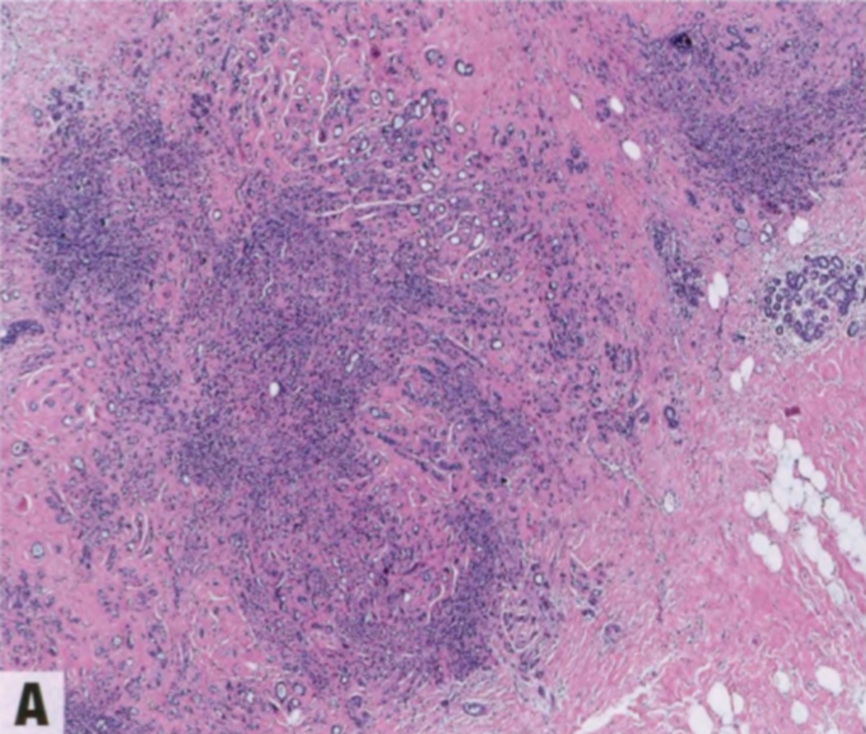
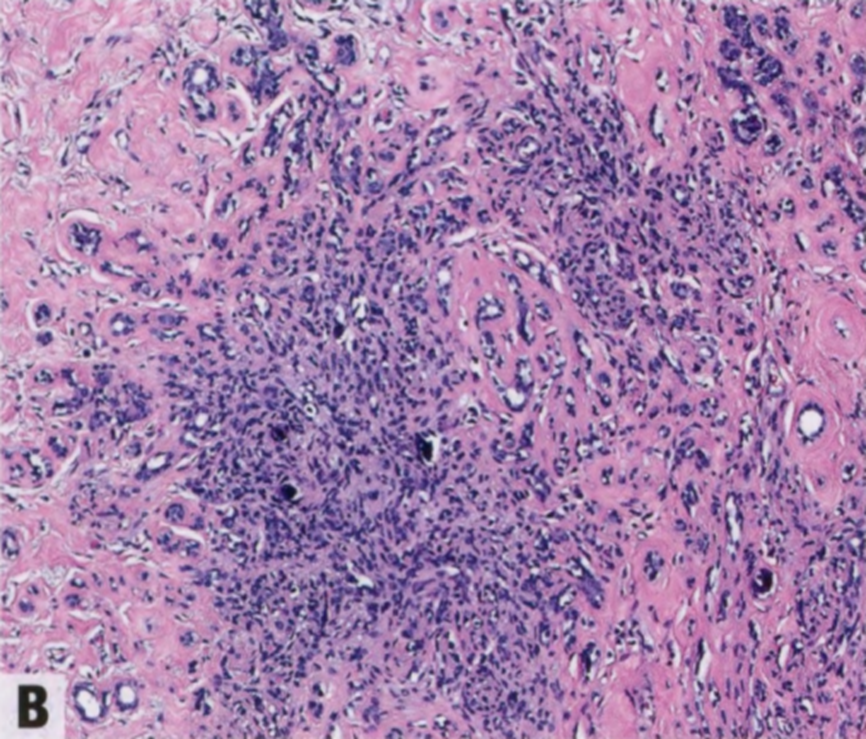
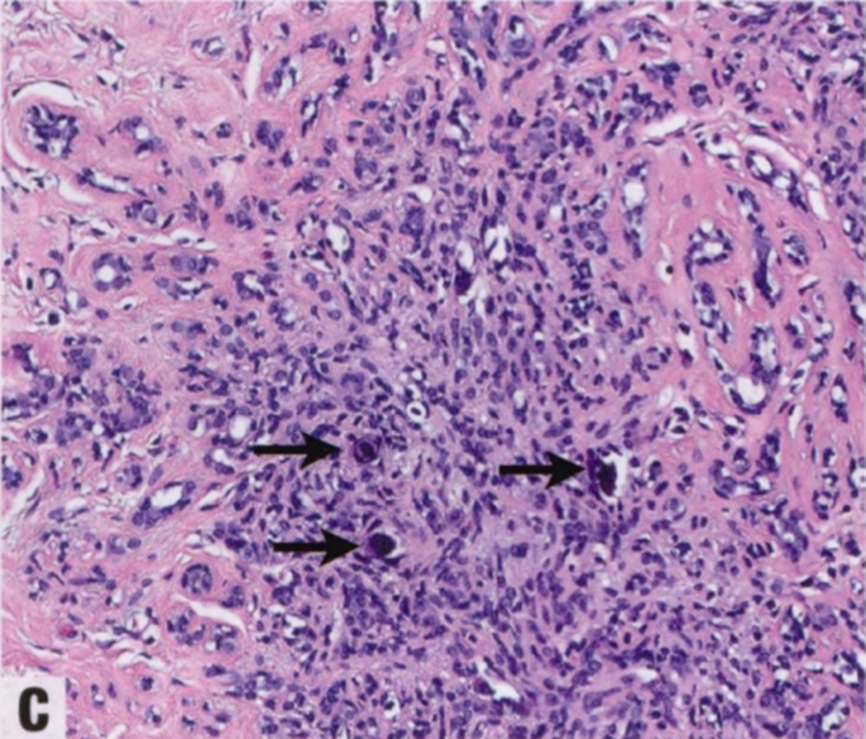 图2.12 SA。A 低倍特点是腺体成分增多,间质增殖并扭曲和挤压腺体。低倍辨认具有圆形边界的小叶结构很重要。B 腺腔经常被小叶内间质纤维化挤压或堵塞。C 常见微钙化(箭头)。
图2.12 SA。A 低倍特点是腺体成分增多,间质增殖并扭曲和挤压腺体。低倍辨认具有圆形边界的小叶结构很重要。B 腺腔经常被小叶内间质纤维化挤压或堵塞。C 常见微钙化(箭头)。
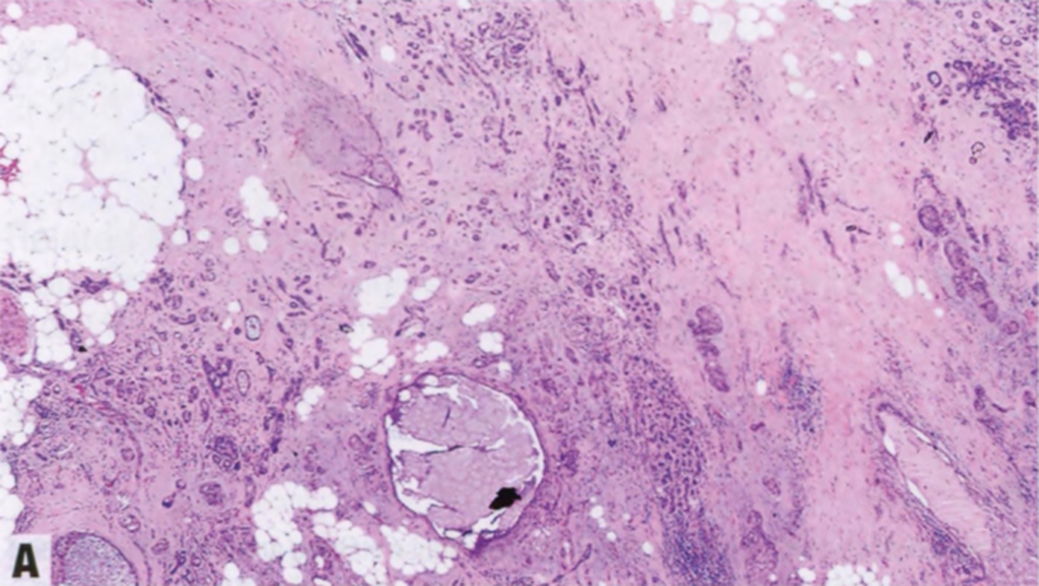
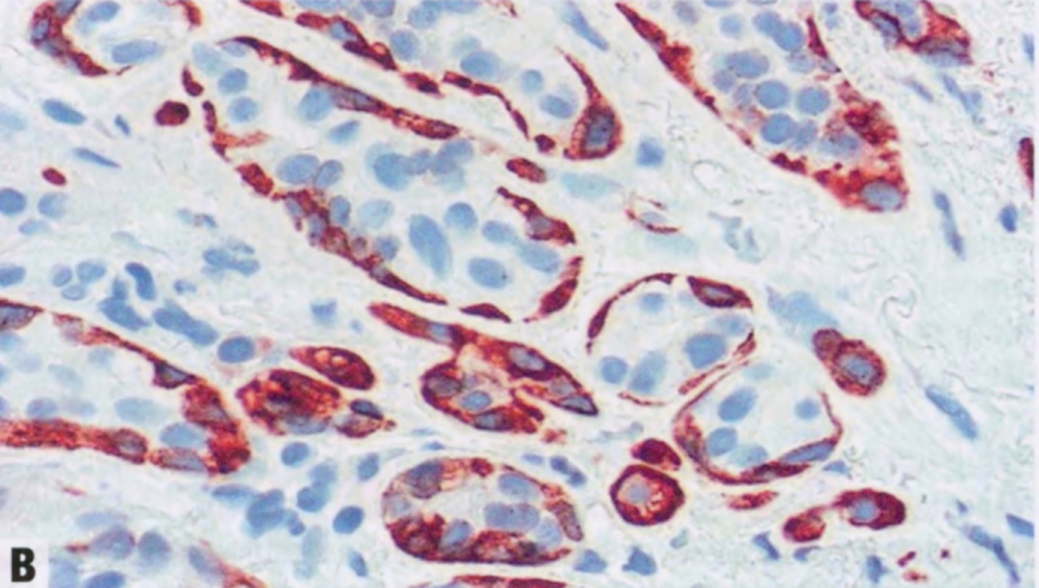 图2.13 SA中的DCIS。A 在SA的背景中,上皮增殖导致腺泡扩张。B SMMHC免疫染色显示腺泡周围完整的肌上皮细胞。
图2.13 SA中的DCIS。A 在SA的背景中,上皮增殖导致腺泡扩张。B SMMHC免疫染色显示腺泡周围完整的肌上皮细胞。
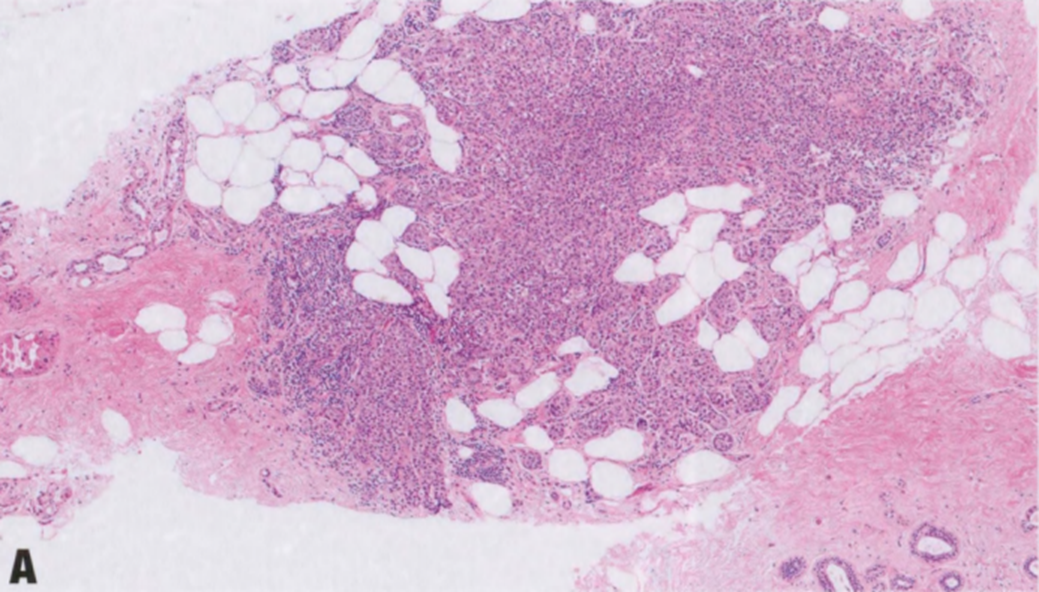
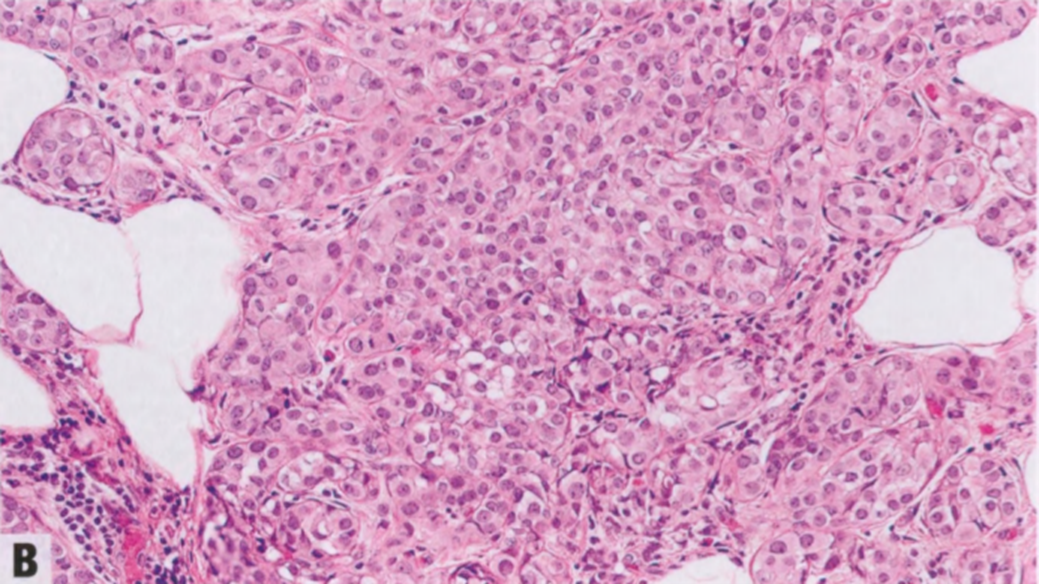 图2.14 LCIS累及SA。A 低倍显示小叶结构的扩张和改变。B 较高倍显示扩张和扭曲的腺泡,有密集的上皮细胞和均匀一致的小叶性肿瘤细胞。
图2.14 LCIS累及SA。A 低倍显示小叶结构的扩张和改变。B 较高倍显示扩张和扭曲的腺泡,有密集的上皮细胞和均匀一致的小叶性肿瘤细胞。
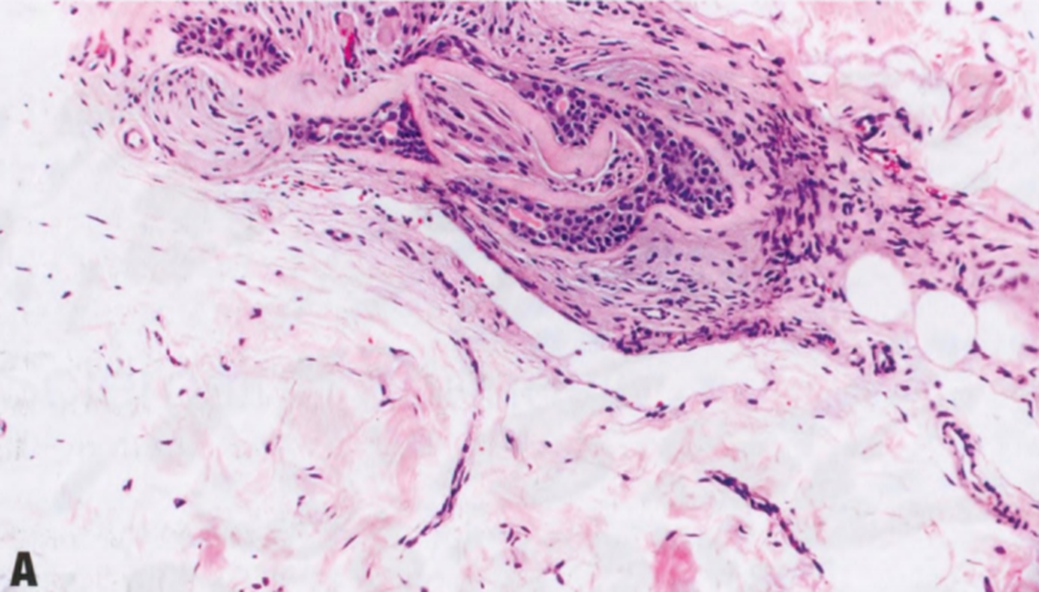
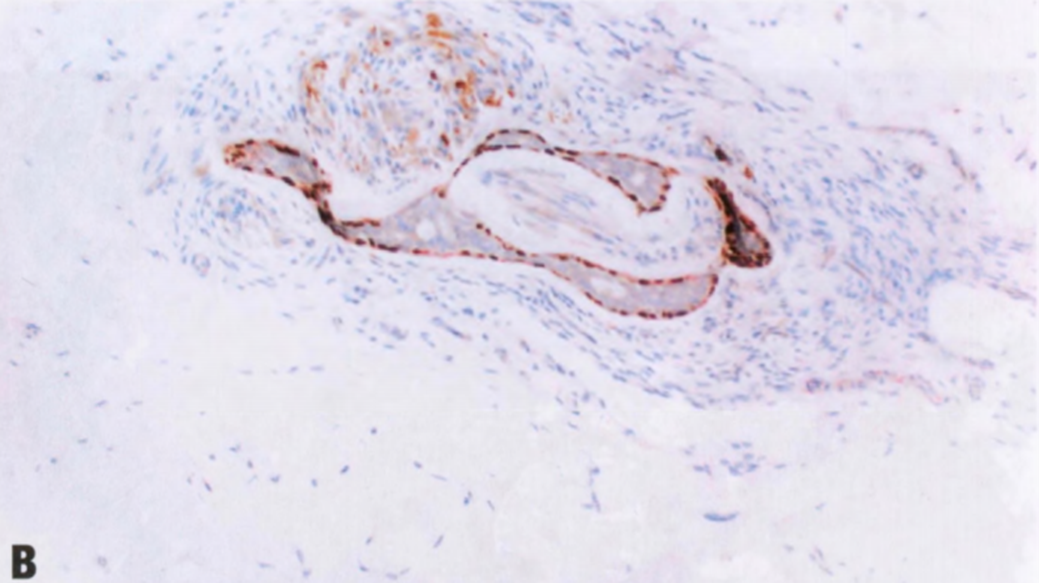 图2.15 SA。A 神经周围的SA腺体。B SMA免疫染色显示腺体周围肌上皮细胞,支持这些神经周围腺体为良性。
图2.15 SA。A 神经周围的SA腺体。B SMA免疫染色显示腺体周围肌上皮细胞,支持这些神经周围腺体为良性。
罕见SA腺体位于神经周围,貌似浸润性癌的神经周围浸润。具有良性细胞学特征和腺体周围肌上皮细胞,有助于区分浸润性癌。
细胞学
上皮细胞不明显,通常有点萎缩。肌上皮细胞可能不同程度地明显。不存在细胞异型性。
诊断分子病理学
与临床无关
诊断标准
必要标准:小叶中心性结构;间质胶原挤压扭曲的小腺泡或小管结构的增殖;周围存在基底膜和保留肌上皮层。
理想标准:免疫组化(如p63、calponin、SMMHC)鉴定肌上皮细胞。
分期
与临床无关
预后和预测
SA随后发生癌症的风险增加1.5-2倍,类似于其他无异型性增生性病变。SA的诊断不是手术切除的指征。如果存在非典型上皮增殖,则需要结合临床和影像学以及多学科评估来为后续管理提供信息。
Apocrine adenosis and adenoma
大汗腺腺病(AAs)和大汗腺腺瘤(AAa)
定义
AAs是一种良性腺体结构的小叶中心性增殖,由具有丰富颗粒状粉红色胞质的细胞组成,并因纤维化而扭曲。AAa是一种边界清楚的良性肿瘤,其特征是由具有丰富嗜酸性胞质的大上皮细胞组成的圆形和卵圆形管状结构的密集、弥漫性增殖。
ICD-11编码
8401/0 AAa
ICD-11编码
2F30&XH6YZ9乳腺良性肿瘤&AAa
相关命名
不推荐:SA伴大汗腺化生;结节性腺病伴大汗腺化生。
亚型
没有
部位
AAs和AAa发生在TDLU。
临床特征
AAs通常是显微镜下偶然发现,但可能因微钙化而X线检出,或MRI检出非肿块样增强。AAa可能表现为孤立、无痛、可自由移动、界限分明的可触及结节。在某个病例中,其大小随月经周期轻微波动,并有白色乳头溢液。影像学检查,AAa通常表现为边界清晰的肿块,超声检查呈低回声。一例表现为边界不清的钙化密度。AAa和FA具有相似的临床和放射学表现,难以区分,但组织学可以明确区分。
流行病学
AAs最常见于20-40岁。粗针活检的预期频率尚未确定,似乎<1-2%。
与纤维囊性病变常见的大汗腺化生相反,AAa似乎极罕见,文献中仅有几例。然而,由于没有大小标准来区分聚集性大汗腺化生导管和完好AAa,文献中的大汗腺腺瘤可能代表性不足。主要发生于女性,男性病例罕见。患者年龄从14岁(1男1女)到72岁不等。
病因
尚未发现与AAs病因相关的具体因素。目前尚不清楚AAa是新发肿瘤还是增生性病变,如结节性SA叠加大汗腺化生。
发病机制
大汗腺改变是乳腺最常见的化生改变。与SA并存时,称为AAs。大汗腺生殖增殖中,发现了几个位点(1p、3、11q、16和17q)杂合性缺失。比较基因组杂交显示AAs的缺失和获得,随着大汗腺DCIS和大汗腺癌的进展而积累。
由于文献中AAa很少,发病机制尚未深入研究。有几种大汗腺细胞起源的理论。一般认为,乳腺导管细胞在青春期前后化生,变成大汗腺细胞,类似于腋窝、乳晕和会阴。正常立方形导管上皮向中间形式过渡,最终形成完好的大汗腺细胞,并受雄激素和激活素的累及(可以解释男性发生的少数AAa病例),因此支持化生学说。另一种理论认为,发育过程中皮肤大汗腺的胚胎性截留。有人反对这两种理论,认为大汗腺细胞是乳腺上皮的正常成分。
少数病例做了分子学检查,为二倍体,但有些可能是四倍体。对更常见的大汗腺化生和大汗腺腺病进行的研究发现,后续乳腺癌风险升高,并可能存在癌前病变。部分病例中,已经描述了与较高增殖相关的异常癌蛋白表达和凋亡相关蛋白表达,以及杂合性缺失和等位基因失衡,提示一些可能具有遗传学不稳定性的大汗腺化生病变可能具有致癌潜能。
大体表现
AAs通常肉眼观察不明显。在某些结节性腺病或腺病肿瘤病例中,肉眼检查可能发现橡胶样灰色肿块。由于微钙化的存在,切面可能呈砂砾感。大体检查,AAa为边界清楚的结节,可有局部囊性变,大小范围为0.3-1.7cm。
组织病理学
AAs的特征是腺泡呈小叶中心性增殖,腺泡由上皮和肌上皮细胞层组成,周围有基底膜。大汗腺细胞有时呈非典型细胞学特征,核增大,明显的多形性核仁。大汗腺细胞通常呈ER阴性和AR阳性。CK8/18、CD10和GCDFP-15也呈阳性。还表达囊液中发现的三种蛋白质:GCDFP-15(等同于催乳素诱导蛋白)、GCDFP-24(载脂蛋白D)和GCDFP-44(锌-a2-糖蛋白)。
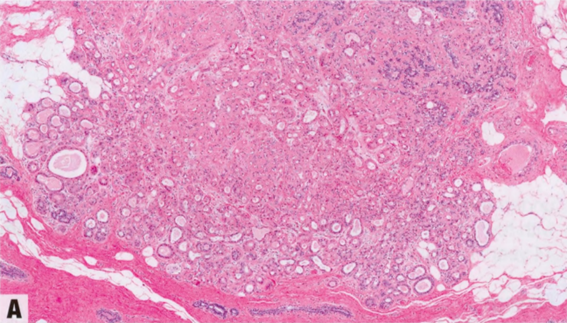
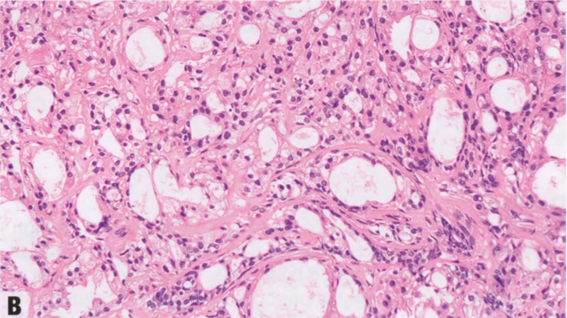
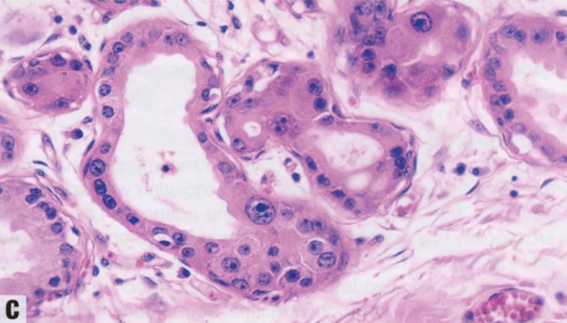
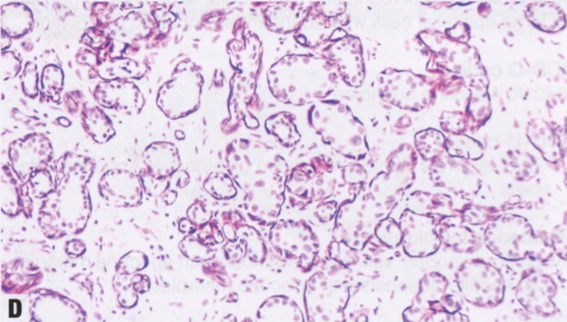
图2.16 AAa和AAs。A AAa。低倍显示边界清晰的致密增殖,由圆形和规则的腺体组成,全部衬覆管腔面大汗腺细胞和变薄的基底部肌上皮细胞层。B AAs。上皮细胞具有大汗腺化生的嗜酸性胞质,和轻微的核扩大和核深染。C AAs。大汗腺细胞群可能显示非典型细胞学特征,核增大,明显的多形性核仁。D AAs。actin染色显示保留的肌上皮细胞层。
低倍观,AAa呈边界清晰的致密的增殖,由圆形和规则的腺体组成,腺体全部衬覆管腔面大汗腺细胞和外层变薄的基底部肌上皮细胞层。除了腺管状,腺体还可能囊性扩张或形成细小的乳头。大汗腺细胞分布均匀,呈柱状或立方形,含有丰富的细颗粒性或明亮的嗜酸性胞质,腺腔面有顶端胞质空泡(顶泌突起),腔内有断头分泌产生嗜酸性碎屑。电镜检查,胞质颗粒是由于丰富的内质网、线粒体、中间丝和分泌囊泡。胞质也可能含有核上金黄色颗粒,PAS和普鲁士蓝(铁)染色呈阳性。核位于基底,形态温和,圆形到卵圆形,染色质均匀致密,含有一个点状核仁。罕见钙化和核分裂象。部分出现细胞学非典型性(非典型AAs),定义为核大小的差异≥3倍伴核仁增大。
复杂FA可能含有大汗腺化生,但FA保留的纤维上皮结构、明显的间质,只有局灶性大汗腺细胞而非密集增殖,可区分AAa。TA有密集的小管,结构与AAa相似,但缺乏大汗腺化生。与DA相比,AAa缺乏厚的导管壁,具有弥漫性而非局灶性大汗腺化生,可区分DA。纤维囊性病变也可能有明显的大汗腺化生,但不形成界限清楚的肿块。最后,它与非典型和恶性大汗腺上皮增生的区别在于缺乏细胞和结构异型性和坏死。
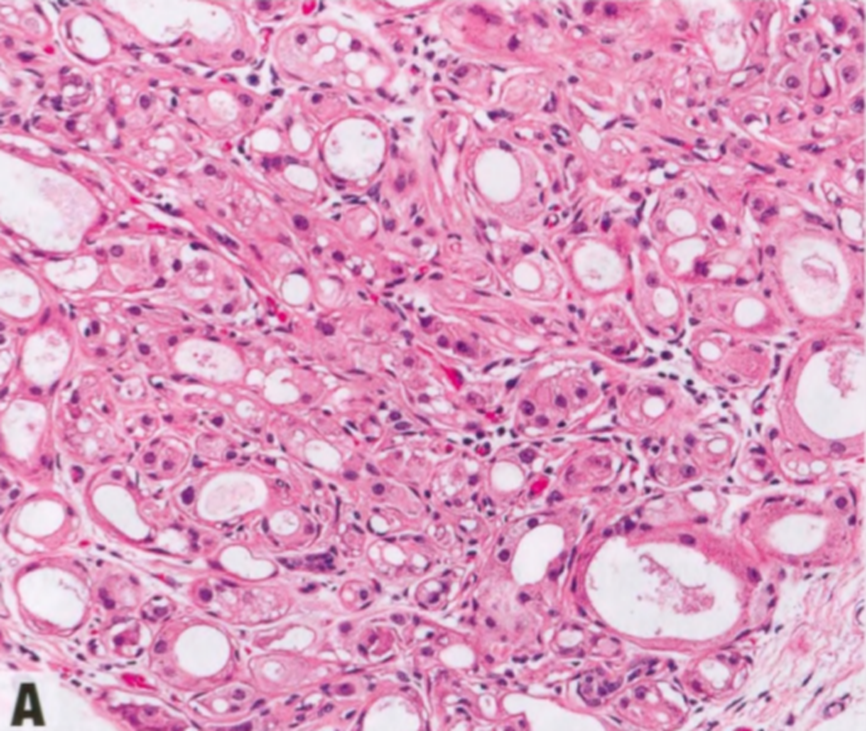
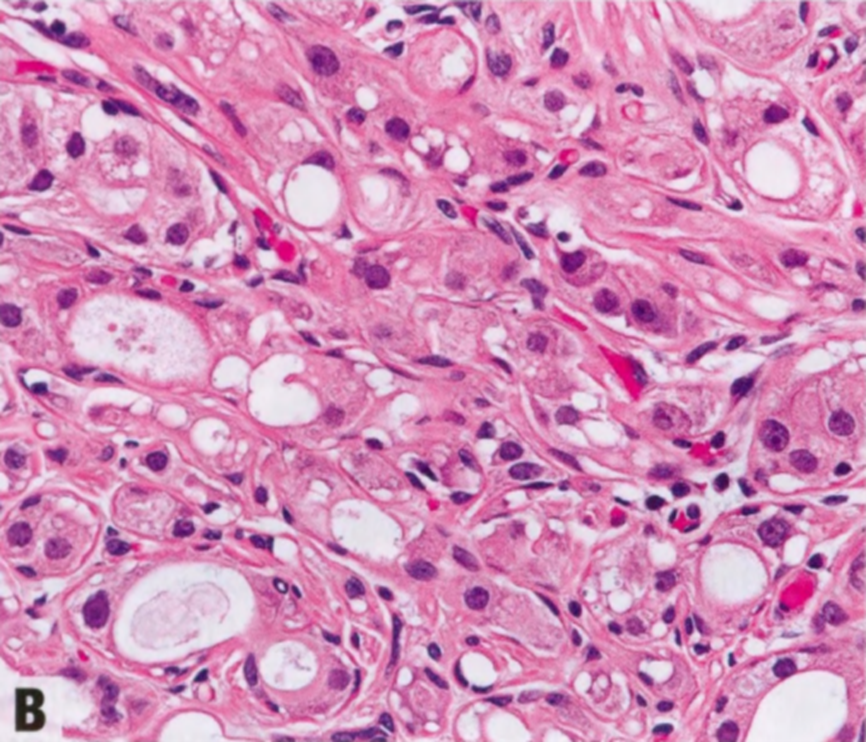
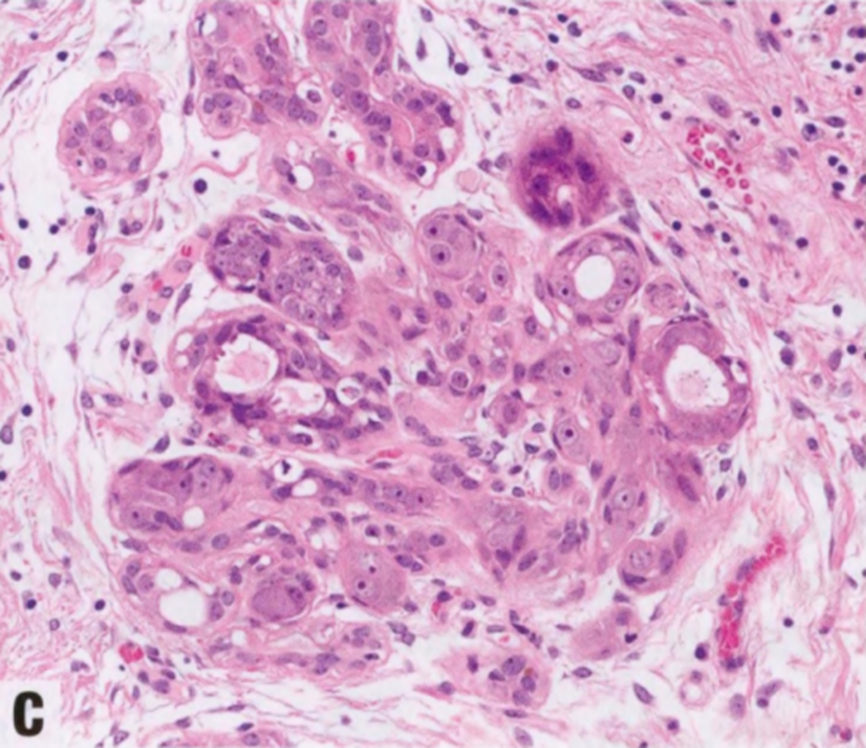 图2.17 AAs伴非典型性。A 小腺体致密增殖,衬覆大汗腺型上皮细胞,核大小不等。B 有些核是传统型大汗腺化生核的2-3倍。C 有些核增大>3倍,有明显核仁。
图2.17 AAs伴非典型性。A 小腺体致密增殖,衬覆大汗腺型上皮细胞,核大小不等。B 有些核是传统型大汗腺化生核的2-3倍。C 有些核增大>3倍,有明显核仁。
细胞学
AAs的细胞学发现包括涂片中细胞丰富,形成致密的粘附性小簇,偶尔形成筛状结构。背景几乎没有或罕见双极裸核。上皮细胞具有大汗腺化生细胞的特征(即丰富的颗粒状、粉红色或泡沫状胞质;圆形核;明显核仁)。核上空泡可能含有任命符合铁、脂褐素或含铁血黄素的黄棕色色素。在非典型AAs中,核大小和轮廓有2到3倍的差异,常有非常明显的核仁。核特征可能导致将增殖误解为非典型性或恶性。
诊断分子病理学
与临床无关
诊断标准
必要标准:
AAs:良性腺体结构的小叶中心性增殖,因纤维化而变形,衬覆大汗腺细胞(嗜酸性颗粒状或空泡状胞质,有明显核仁)。
AAa:边界清楚的良性肿瘤,特征是圆形和卵圆形管状结构的密集、弥漫性增殖,管腔面为大汗腺细胞,外层为变薄的基底部肌上皮细胞层,背景间质很少。
理想标准:
如果需要支持形态学解读,大汗腺细胞呈特殊染色PASD阳性和免疫组化EMA、CK8/18和AR阳性,ER和PR阴性。
分期
与临床无关
预后和预测
AAs相关的后续癌症风险约为1-2倍。尽管数据有限,但非典型AAs似乎不像高危前驱病变。根据文献中描述的少数病例,AAa视为良性和稳定的,Ki-67增殖指数低(范围:0.7-13%)进一步支持了这一结论。在粗针活检诊断确认后,AAa可以像FA一样进行治疗,可以观察、年度临床乳腺检查和影像学检查。未发现复发或恶性转化。然而,已经描述了一例浸润性导管癌伴AAa,很可能是由于共存。
Microglandular adenosis
微腺腺病(MA)
定义
MA是由单层上皮细胞组成的小圆腺体的杂乱增殖,没有伴随的肌上皮细胞层。
ICD-11编码
没有
ICD-11编码
GB20.Y其他特定良性乳腺疾病
相关命名
没有
亚型
没有
部位
乳腺
临床特征
其他原因进行的乳腺活检中偶然发现MA。也可能形成肿块,或表现为乳房X线检出的致密斑块或钙化。MA中发生的癌表现为可触及的肿块。
流行病学
据报道,微腺腺病发生在不同年龄段的女性。
病因
尚未发现与MA病因相关的特定因素。
发病机制
阵列比较基因组杂交提示,MA和并发的浸润性癌存在进行性分子改变。从MA进展到同时发生的浸润性癌,获得了遗传学改变,提示存在克隆性演进。然而,这些只是初步发现,需要进一步研究。
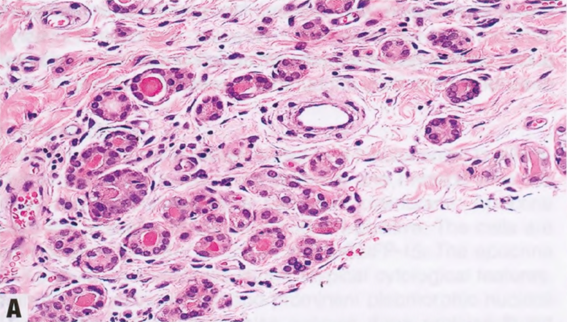
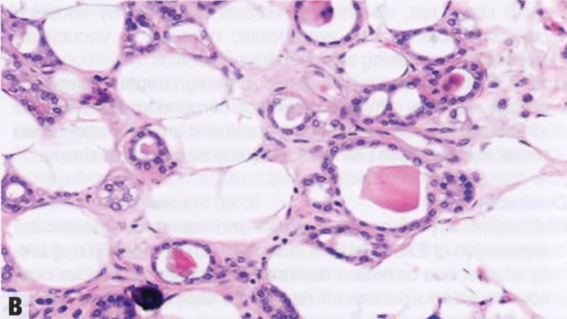
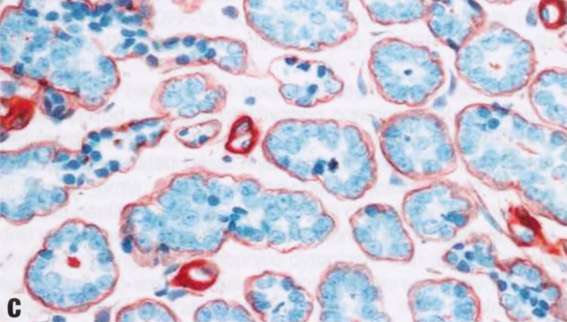
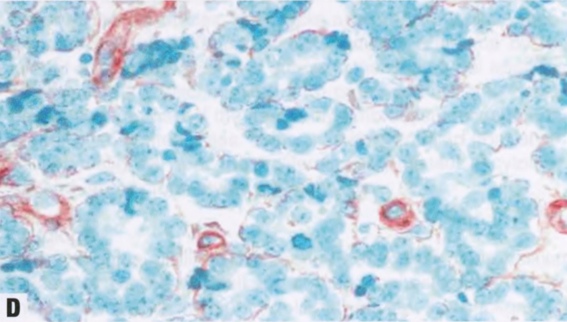
图2.18 MA。A 小圆腺体杂乱浸润到纤维间质中。B 这些腺体衬覆单层立方形细胞,核均匀一致。腔内含有嗜酸性分泌物。C IV型胶原免疫染色显示单个腺体周围有完整的基底膜。D SMA的免疫染色。在MA腺体周围未见肌上皮细胞。
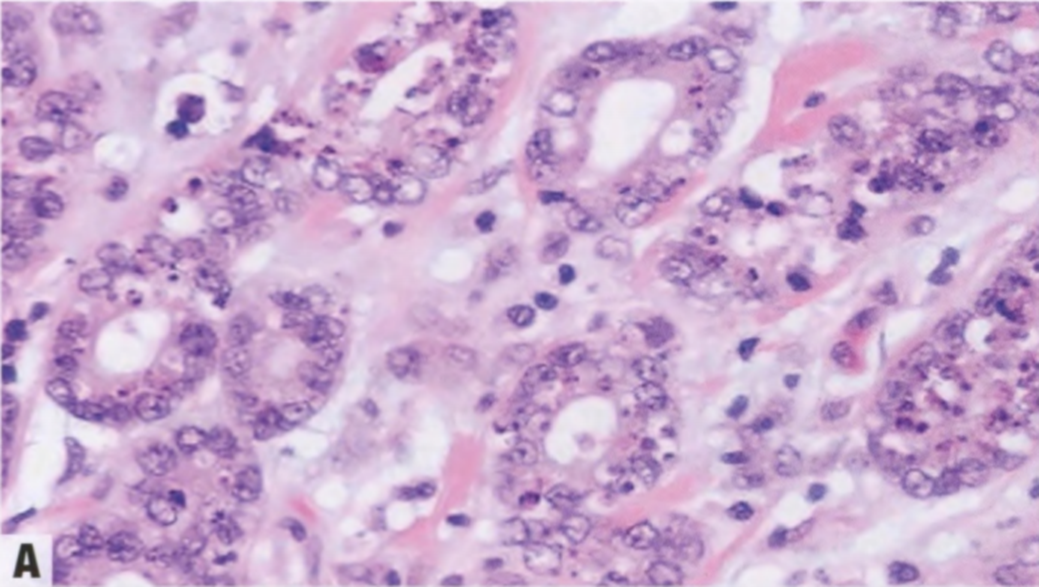
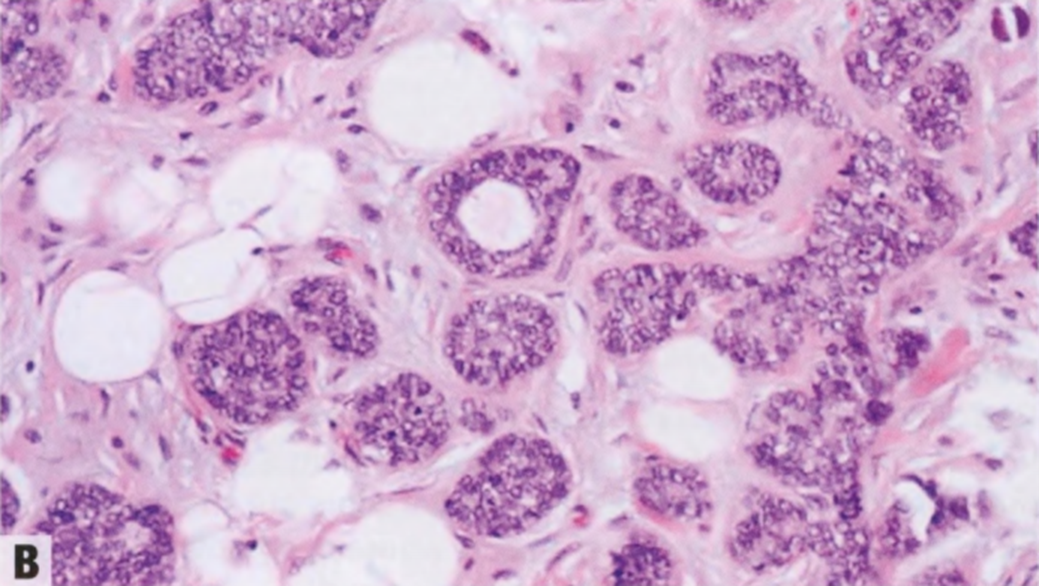 图2.19非典型微腺腺病。A 类似于微腺腺病的小圆腺体,有一层以上的上皮细胞,有些核增大。B 细胞增殖,使腺腔消失。
图2.19非典型微腺腺病。A 类似于微腺腺病的小圆腺体,有一层以上的上皮细胞,有些核增大。B 细胞增殖,使腺腔消失。
大体表现
MA大体表现并无特殊。可能看似正常的乳腺实质,也可能形成界限模糊的结节或肿块。在MA背景下发生的癌症病例中,通常会出现明显的肿块病变。
组织病理学
MA由小圆形管状结构组成,以无序的非小叶中心性模式生长。腺体不受周围间质的挤压;腺腔开放,腺腔内通常含有胶样嗜酸性分泌物(PASD阳性)。MA腺体大小均匀,与正常小叶腺泡相似或略大。腺体由单层立方形上皮细胞组成,核小,双染性胞质。肌上皮细胞不存在,但免疫组化或电镜可以证实腺体周围的基底膜。MA表达CK、S100、组织蛋白酶D和EGFR(HER1),不表达EMA、ER和PR,HER2不扩增。细胞学
细胞量稀少,中等大小的细胞形成单一的细胞群,核均匀圆形,核仁小,胞质透明、空泡化。
诊断分子病理学
与临床无关
诊断标准
必要标准:均匀的小圆形腺体的杂乱增殖,浸润到乳腺实质和脂肪组织中,不破坏原有的正常腺体;腺体衬覆单层立方形细胞,无异型性。
分期
与临床无关
预后和预测
MA是一种良性增殖,但非典型MA和MA中发生的癌已有报道。基于这些病变在分子和细胞遗传学上的相似性,有人提出,MA是基底型乳腺癌的非必然前驱病变。需要更多的研究来建立这种联系。
Radial scar/ complex sclerosing lesion
放射状瘢痕(RS)/复杂性硬化性病变(CSL)
定义
RS/CSL是一种良性病变,伴纤维弹性组织增生和陷入的腺体结构,伴或不伴增殖性上皮病变。RS是小病变,通常呈星状结构,而CSL更大、更混乱。
ICD-11编码
没有
ICD-11编码
GB20.Y其他特定良性乳腺疾病
相关命名
可接受:RS;放射状硬化性病变;良性硬化性导管增殖。
不推荐:硬化性乳头状病变;硬化弹性瘢痕;星状瘢痕;非包裹性硬化性病变;浸润性上皮病。
亚型
没有
部位
不适用
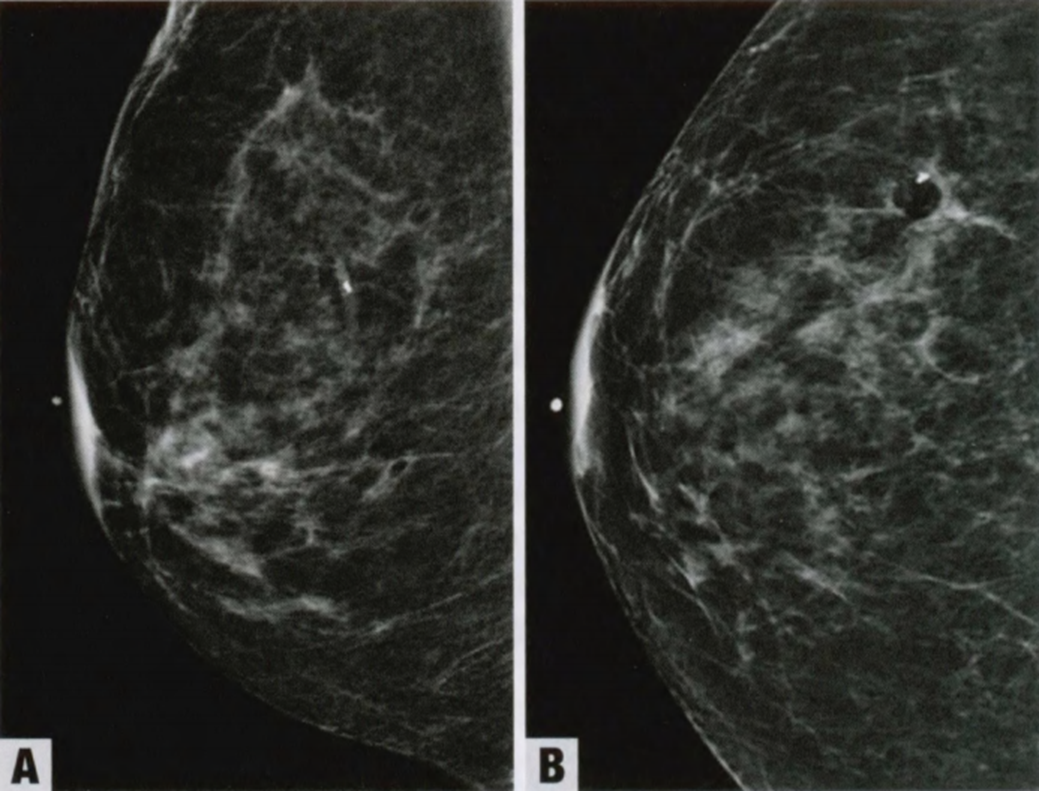 图2.21 RS/CSL。A 右乳房结构扭曲。B 毛刺状外观貌似癌,但中心是透射的低密度区域,而不是肿块。
图2.21 RS/CSL。A 右乳房结构扭曲。B 毛刺状外观貌似癌,但中心是透射的低密度区域,而不是肿块。
临床特征
乳腺影像学检查,不规则星状结构可能貌似浸润性癌;据报道,存在透射中心提示RS,而不是癌。偶尔,病变大到足以产生可触及的肿块。RS/CSL可能是多发性,通常是双侧性。
流行病学
报道的发病率因检测方式而异。目前最常见乳房X线的识别。
病因
尚未发现与RS/CSL病因相关的具体因素。
发病机制
RS/CSL的分子遗传学尚未被描述。其中发现的各种上皮增生过程的分子特征以及与之相关的恶性肿瘤形式,如本书相关章节的其他部分所述。
大体表现
大体检查可能无法辨认,也可能大到足以产生不规则的质硬区域,该区域可见弹性间质的黄色条纹。大体表现可能与浸润性癌难以区分。
组织病理学
RS是一种小叶中心性增殖,留有多种良性改变,包括囊肿、UDH和SA。RS较小,呈星状结构,而CSL更大更乱。可见中央致密透明变性胶原和弹性纤维增生(有时明显)。中央纤维组织含有陷入的不规则良性小管,保持双层细胞,但HE染色并不是总能辨认双层结构,因为肌上皮细胞层偶尔变薄。病变周围有不同程度的导管扩张、UDH和大汗腺化生。
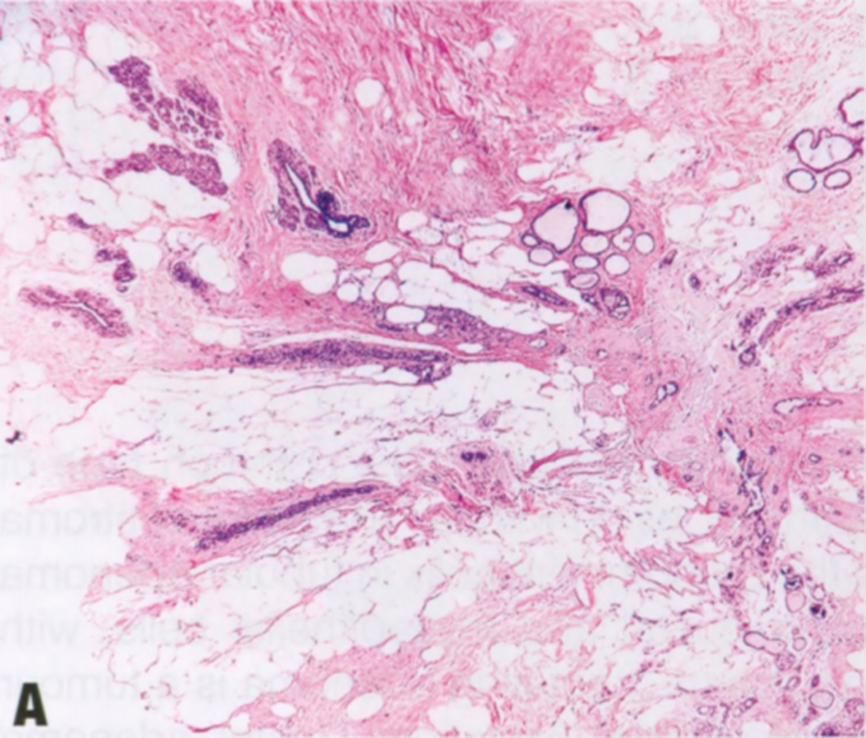
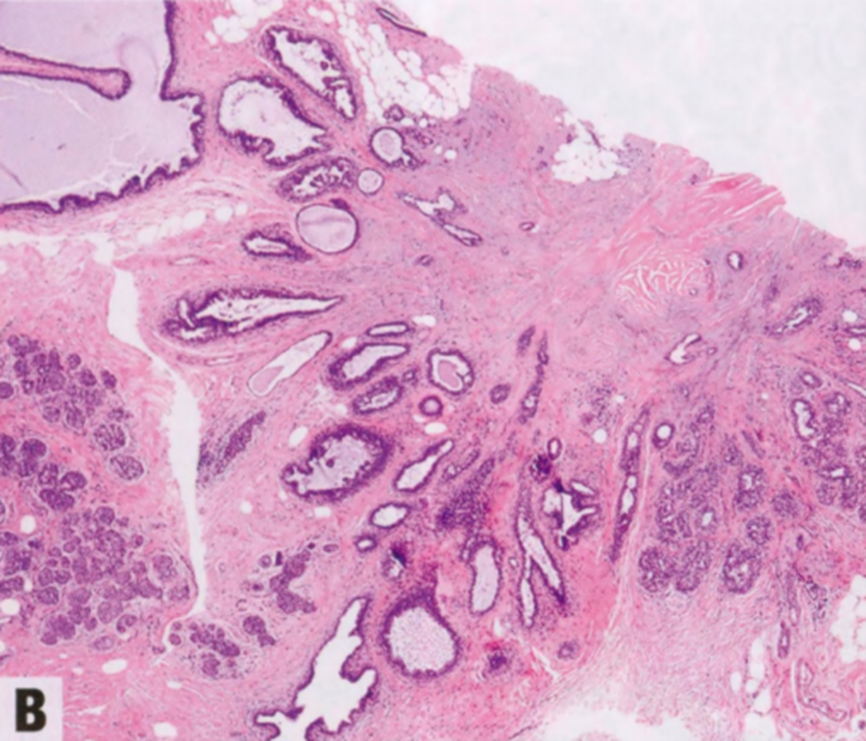
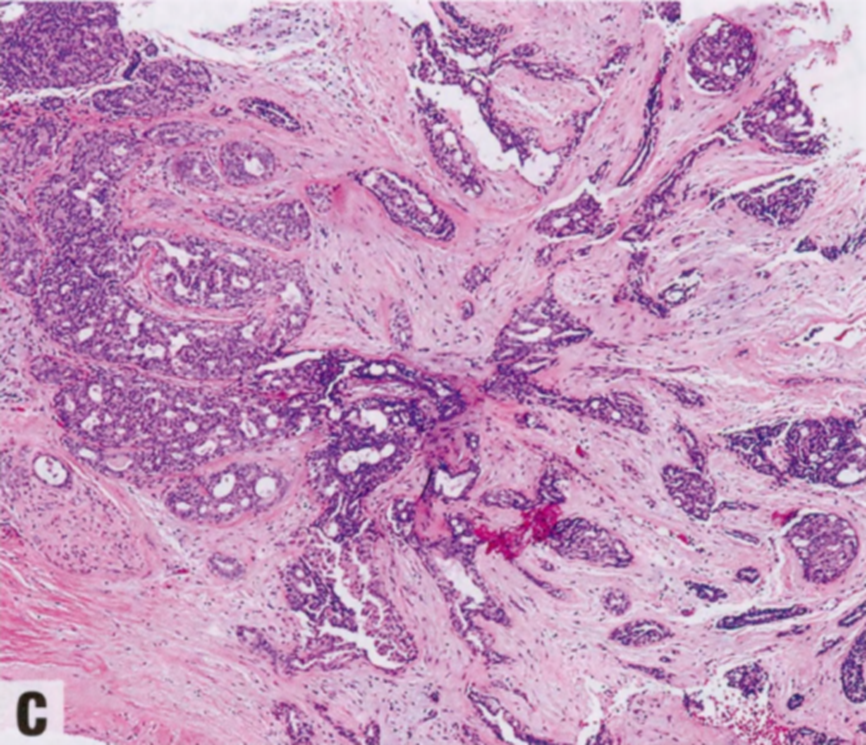
图2.22 RS/CSL。A 小RS,特征是有纤维弹性轴心,导管从中心向周围呈放射状分布,形成星状结构。B 较大RS,中央有纤维弹性间质。C CSL,由增殖的腺体和纤维化间质组成。周围的导管显示不同程度的上皮增殖。
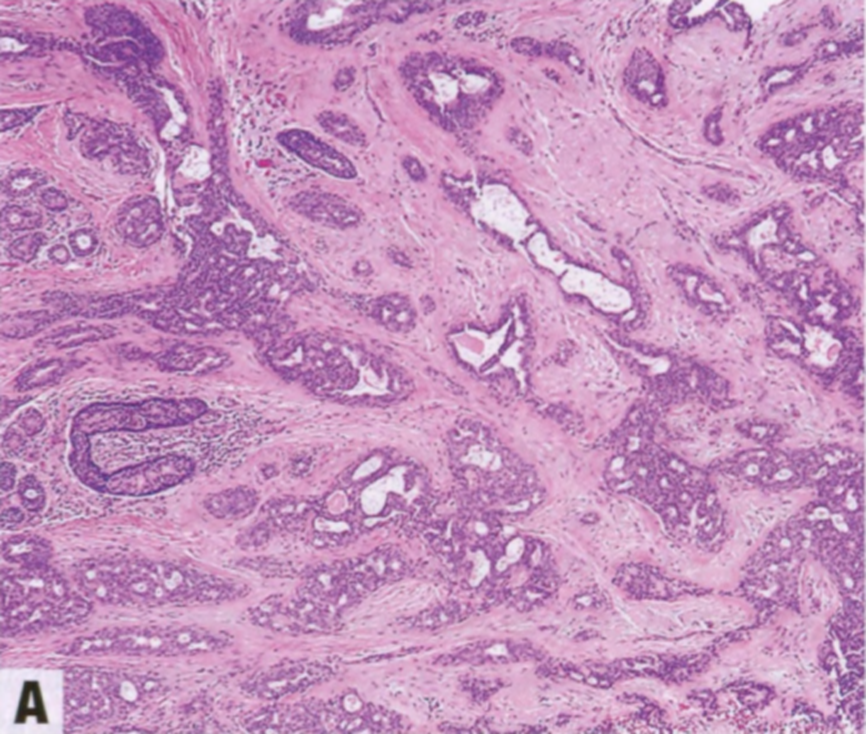
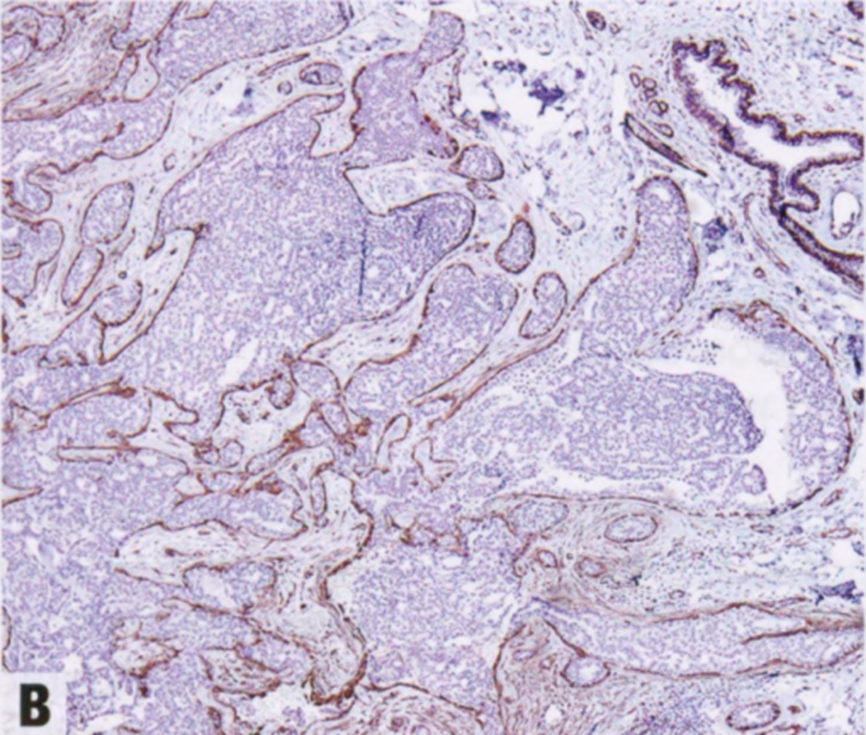
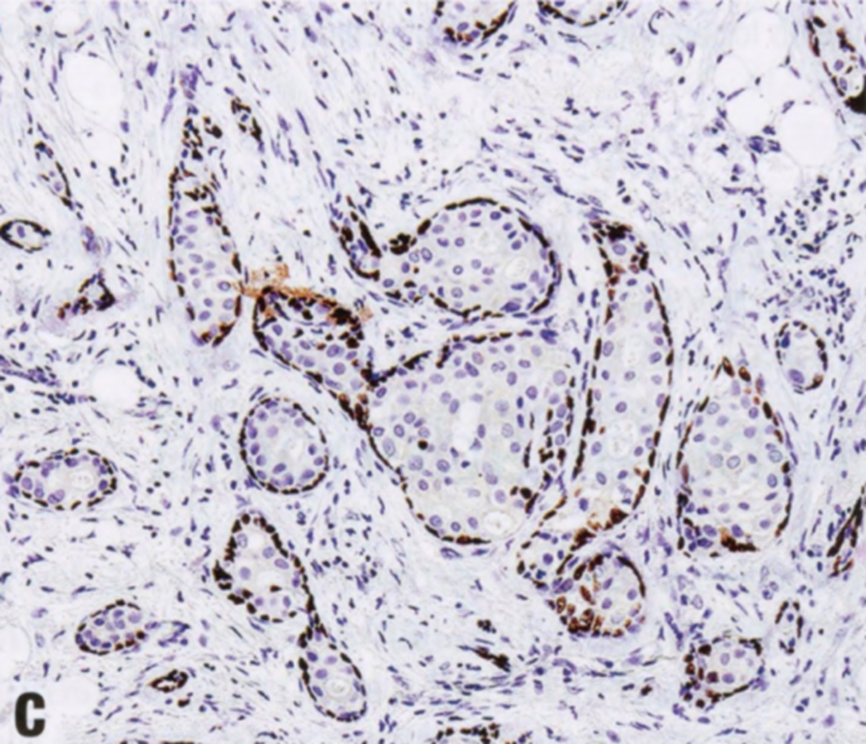 图2.23 DCIS累及CSL。因DCIS细胞而扩张的不规则增殖腺体(A)。SMMHC(B)和p63(C)显示肌上皮细胞。
图2.23 DCIS累及CSL。因DCIS细胞而扩张的不规则增殖腺体(A)。SMMHC(B)和p63(C)显示肌上皮细胞。
在更大的CSL中,上述几种成分组合,然后汇入由微小乳头状瘤(常硬化)和各种模式的上皮增殖组成的混合区域。
细胞学
上皮细胞可显示UDH和/或大汗腺化生的特征。肌上皮细胞可能不同程度地明显。不存在细胞异型性。
诊断分子病理学
与临床无关
诊断标准
必要标准:特征性小叶中心结构;管状结构周围存在肌上皮细胞层和基底膜;致密透明变性间质伴弹性纤维增生,缺乏反应性纤维母细胞间质。
理想标准:如果需要,免疫染色显示肌上皮细胞(如p63、calponin、SMMHC)。
分期
与临床无关
预后和预测
尽管有建议(特别是在放射学文献中)认为这些病变可能是癌前病变,但没有证据支持这一论点。两项长期随访研究的结果提示,任何明显的风险都与相关导管内增生的各种模式有关。对其中一项研究的最新分析提示,即使在调整了良性乳腺疾病的组织学分类(相对风险:1.74)后,RS也与癌症风险增加有关,而一项荟萃分析提示,风险的程度更适中(相对风险为1.45)。非典型增生和癌(原位和浸润性)可能累及或与RS/CSL并存,特别是在大于0.6cm的病变,这些病变更常见于乳房X线检查,并在50岁以上的女性中发现。通过乳房X线检测到的RS和CSL的管理仍然存在争议。在粗针活检中检测到的伴有上皮异型性的病变有并存恶性肿瘤的风险,应予以切除。较新的数据提示,没有异型性的放射学病理一致性病变可能不需要切除。CSL与化生性癌(特别是低级别腺鳞癌)之间存在罕见的关联。
未完待续......










































共0条评论