往期回顾:
乳腺肿瘤WHO分类学习笔记(连载1)
乳腺肿瘤WHO分类学习笔记(连载2)
乳腺肿瘤WHO分类学习笔记(连载3)
乳腺肿瘤WHO分类学习笔记(连载4)
乳腺肿瘤WHO分类学习笔记(连载5)
2.5乳头状肿瘤
简介:乳头状肿瘤主要由含有纤维血管轴心的乳头,轴心被上皮伴或不伴肌上皮层,取决于乳头状肿瘤的类型。上皮的性质决定了乳头状肿瘤是良性、非典型还是恶性。将相邻轴心之间的空间视为导管腔,使用IDL的解读标准,有助于评估上皮异型性。3mm阈值用于区分乳头状瘤中的ADH和低级别DCIS。大汗腺化生常有乳头状结构,UDH也可能有细乳头,然而,这两种病变的报告不应使用形容词“乳头状”,因为它可能引发临床管理的问题。此外,在没有独立的乳头聚集/结节的情况下,局灶性乳头状UDH不应被过度诊断为乳头状瘤。
大多数乳头状肿瘤局限于导管内,导管常扩张并呈囊性,并有厚的纤维壁。乳腺导管内乳头状肿瘤包括乳头状瘤、伴有ADH/DCIS的乳头状瘤,pDCIS,以及原位SPC和EPC(见下文相应章节的讨论)。所有良性导管内乳头状肿瘤都被一层连续的肌上皮包围,但肌上皮细胞沿乳头和恶性病变周围的存在和分布因病变类型而异。完全没有肌上皮的乳头状病变包括IPC和大多数EPC和SPC乳头状癌。后者可能有少量散在和局灶性残留肌上皮细胞(见下文相应章节的讨论)。
TCCRP,在本书中与其他罕见的涎腺型肿瘤归为一类(见极性反转高细胞癌,第153页),常有乳头区,没有肌上皮。
在常规HE染色切片中,肌上皮细胞有时可能难以识别,可以借助免疫染色(如calponin、SMA、SMMHC和p63)。其敏感性和特异性各不相同。乳头状癌结节附近的反应性肌纤维母细胞通常表达肌上皮抗原,如calponin和SMA。纤维血管轴心和乳头状病变周围与毛细血管相关的周细胞可能表达actin、calponin和SMMHC,不应将其误解为肌上皮细胞。散在的肿瘤上皮细胞,特别是乳头状癌,可能表达p63,不要误认为肌上皮细胞。使用一组肌上皮标记物(如calponin和p63)评估有问题乳头状病变中的肌上皮。已有商用的肌上皮/基底抗原(p63、CK5、CK14)和管腔CK(CK8和CK18)的鸡尾酒抗体,可用于评估乳头病变内肌上皮细胞的存在和分布,以及上皮增殖的性质。
在粗针活检中,乳头状病变的正确分类可能困难。在这种情况下,有两个重要方面需要评估:(1)上皮-间质界面是否有肌上皮细胞,(2)上皮细胞群是否非典型。纤维血管轴心存在肌上皮细胞层表明潜在乳头状病变可能是良性或被肿瘤性上皮(ADH/低中高级别DCIS,取决于大小和非典型程度)累及。
表2.02肌上皮抗体
完全缺失潜在的良性乳头状病变,定义为完全缺乏肌上皮细胞层或任何残留的良性增生上皮,提示乳头状癌(pDCIS或EPC)。上皮成分的肿瘤性质是根据其形态学和免疫组化特征来定义的。根据定义,乳头状癌中95%以上的细胞群是肿瘤性,但粗针活检无法估计比例。
乳头状病变的细针穿刺细胞学诊断困难,良恶性病变表现出重叠的特征。怀疑乳头状病变时,应促使组织学评估以进行准确诊断。
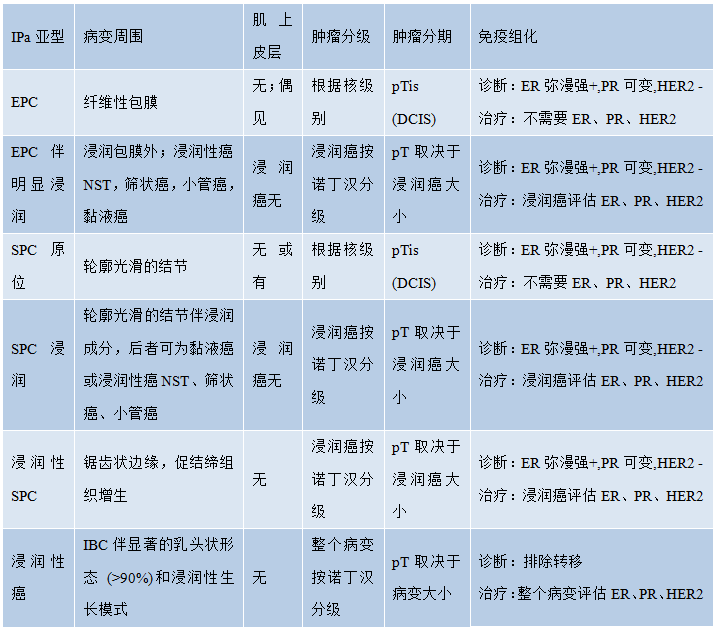
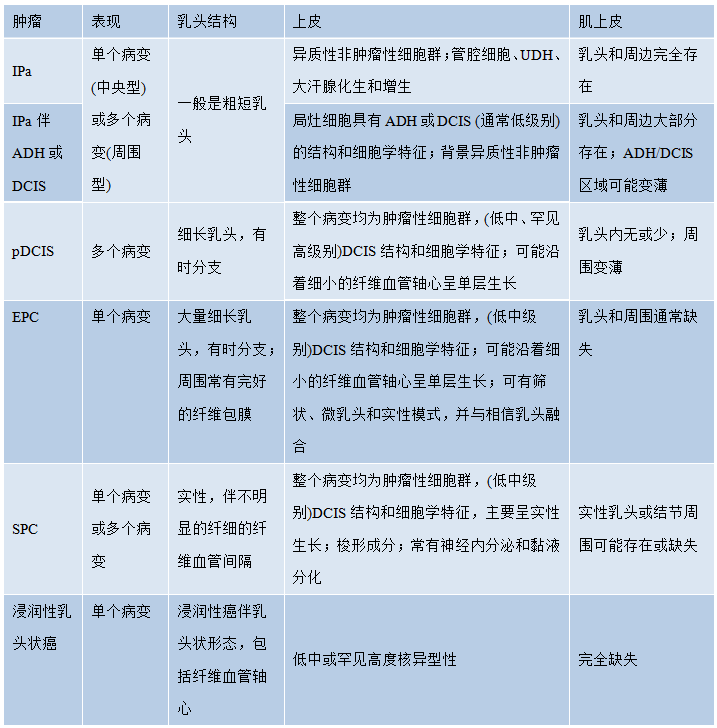
表2.03乳腺乳头状肿瘤的组织病理学特征
注:罕见病例,SPC和EPC之间或EPC和pDCIS之间存在重叠特征;并非每个病例都能区分乳头状癌亚型。
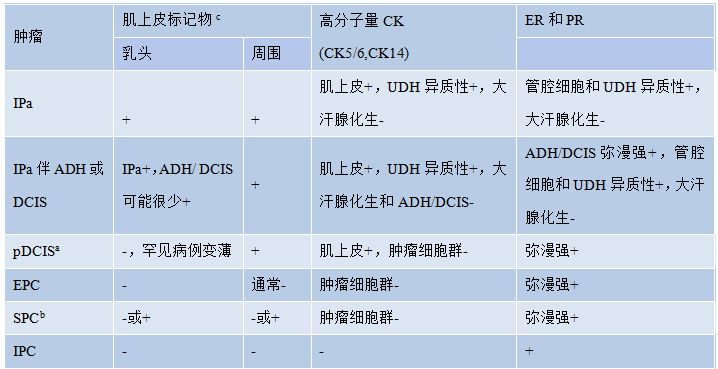
表2.04乳腺乳头状肿瘤的免疫组化特征
a 高级别病变可显示不同的染色模式。b 常表达CgA和Syn。c 如p63,CK14,SMM,calponin
之前接受过粗针活检的乳腺切除标本通常会在粗针活检部位内发现移位上皮,这一发现与粗针活检和手术切除之间的时间间隔呈负相关。这种现象在乳头状肿瘤的粗针活检后尤为明显。粗针活检部位的移位上皮不要过度诊断为浸润性癌。腋窝淋巴结的淋巴窦中也可能发现移位的上皮细胞簇或单个细胞,通常伴有异物型巨细胞和含铁血黄素的巨噬细胞。对于上皮移位,肌上皮抗原的免疫染色(缺失)通常都是无效的,因为肌上皮细胞可能没有发生上皮移位;只有阳性结果才能被可靠地解读。
在细针穿刺或粗针活检后,乳头状病变可能发生梗死,梗死也可能继发于茎扭转。梗死与乳头状肿瘤的类型无关,但在较大的肿瘤中可能更常见。在这种情况下,使用肌上皮和/或上皮标记物有时可能有助于显示潜在的结构和细胞成分,并可能确定乳头状肿瘤的性质,但需要理解,任何染色缺失都是无效的,不应被解释为阴性结果,组织退变往往妨碍明确的解读。
表2.05乳头状癌:诊断和分期,包括ER、PR和HER2状态

Intraductal papilloma
导管内乳头状瘤(IPa)
定义
IPa是一种良性乳腺病变,发生在中央(孤立)或外周(多发)位置的导管内,由被覆上皮和肌上皮层的纤维血管轴心的乳头组成。
ICD-11编码
8503/0 IPa
ICD-11编码
2F30.2&XH4LZ4乳腺IPa&IPa
相关命名
可接受:
中央乳头状瘤:大导管乳头状瘤。
外周乳头状瘤:显微镜下乳头状瘤。
不推荐:乳头状瘤病。
亚型
没有
部位
IPa可能发生在乳头附近的大导管中心,也可能发生在任何象限的较小导管周围。
临床特征
中央乳头状瘤最常见表现为单侧透明或血性乳头溢液。少见可触及肿块。乳房X线异常包括良性外观的局限性乳晕后肿块、孤立的乳晕后扩张导管和(罕见)微钙化。乳房X线可能无法检出小的中央乳头状瘤。超声检查可能显示边界清晰、壁光滑、实性低回声结节或分叶状、壁光滑的囊性病变,伴实性成分;彩色多普勒超声可显示血管蒂。乳导管造影显示管腔内充盈缺损或导管扩张。MRI检查,小的乳头状瘤可能表现为边缘光滑的增强肿块,而较大的病变可能具有不规则的边缘。导管镜检查可以直接组织取样和导管切除。临床上外周乳头状瘤通常是隐匿的,罕见乳头溢液,更少见由小簇乳头状瘤引起的肿块。它们在乳腺成像上也相对隐蔽,但可能表现为位于外周的微钙化;明显的结节状导管;或多个边界清晰的小肿块。

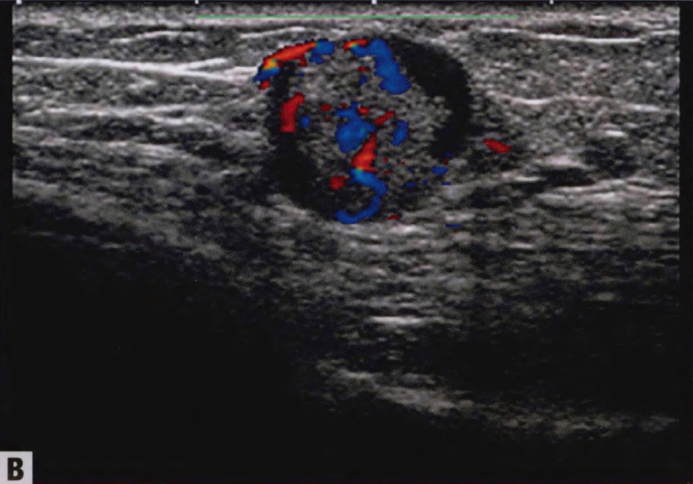
图2.35 IPa。A 超声检查显示,明显囊性扩张的导管,内有一个大的IPa。B彩色多普勒显示血管血流。
流行病学
在超过9000名女性的队列中,5.3%的良性乳腺活检发现了IPa(伴或不伴异型性)。大多数乳头状瘤位于中央。患者的年龄范围很广,但大多数是30-50岁。
病因
未知
发病机制
良性乳头状瘤是单克隆增生。在伴或不伴UDH的良性乳头状瘤中,经常发现PIK3CA/AKT1通路中的激活点突变。在良性乳头状病变和乳头状癌中都发现了16p13杂合性缺失,而只有在恶性乳头状病变中发现了16q23与D16S476标记的杂合性丧失。
大体表现
中央乳头状瘤可形成边界清晰的有乳头结构的圆形肿瘤,通过一个或多个根部附着在扩张的导管壁上。中央乳头状瘤的大小从几mm到>5cm不等。可能存在局灶性坏死或出血,特别是较大的病变。相比之下,外周乳头状瘤通常非常隐匿,除非伴有其他发现。

图2.36 IPa。一个大的多结节乳头状结构伸入大囊肿的腔内(定位染料呈蓝色)。
组织病理学
IPa-NOS
中央和外周乳头状瘤的特征都是由衬覆双层细胞的纤维血管轴心组成的粘附性树枝状结构,内层为上皮细胞,外层为肌上皮细胞。肌上皮层始终存在,可能不明显,结合肌上皮免疫染色,如SMMHC、calponin、CK5、CK14和p63,有助于证实其存在(见第49页表2.02)。在某些病变中,肌上皮细胞可能非常明显或增生。受累导管腔的周围也围绕肌上皮细胞。上皮成分可能由一层立方至柱状细胞组成,也可能表现出UDH并且CK5/14阳性,ER染色不均匀。乳头状瘤的上皮有时发生大汗腺改变,可能伴肌上皮减少。也可能再现鳞状化生,最常见于梗死区域,而黏液化生、透明细胞化生和皮脂腺化生以及胶原小球样改变则罕见。上皮细胞无核分裂象或极为罕见。乳头状瘤区域的导管经常出现扩张。
穿刺手术后或由于纤维血管轴心扭转,可能出现出血或梗死区域。常见硬化/纤维化,可能范围很广并掩盖了病变的潜在乳头结构。这种病变被称为硬化性乳头状瘤,其亚型是DA。上皮巢可能陷入纤维化区域,并可能貌似浸润性癌。上皮保留了相伴的肌上皮层,证实其良性性质。同样,上皮移位可能出现在愈合的活检针道中;并可能造成解读陷阱,不要误认为浸润性癌。
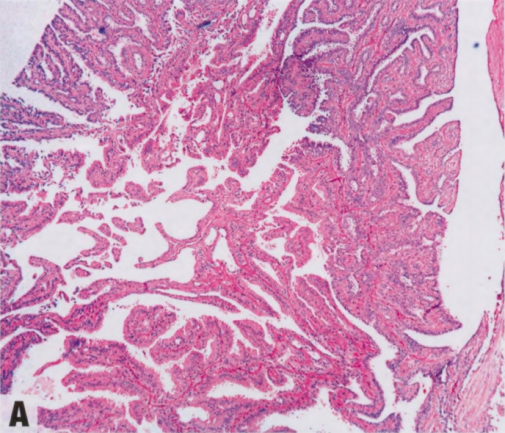
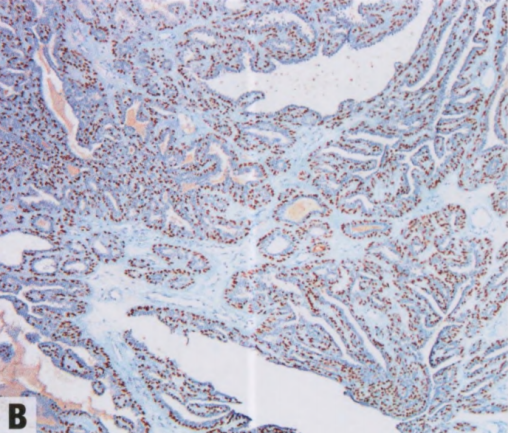
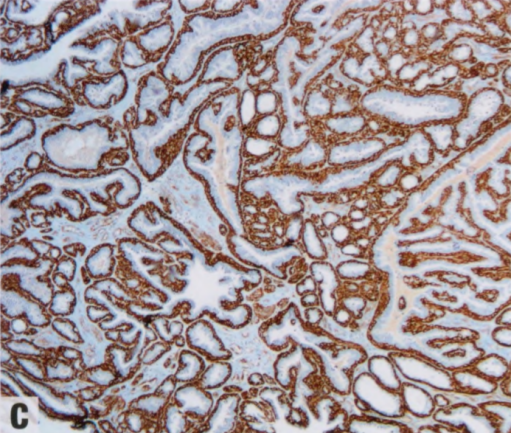
图2.37 IPa。A 组织学显示,乳头具有纤维血管轴心,被覆柱状上皮和大汗腺上皮并有肌上皮。B p63染色显示纤维血管轴心上方被覆的肌上皮核。C 胞质SMMHC染色显示连续的肌上皮层。
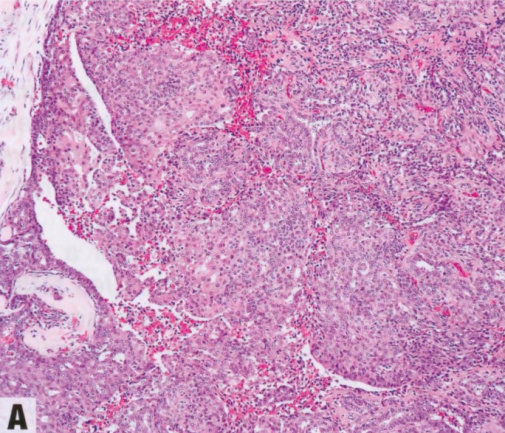
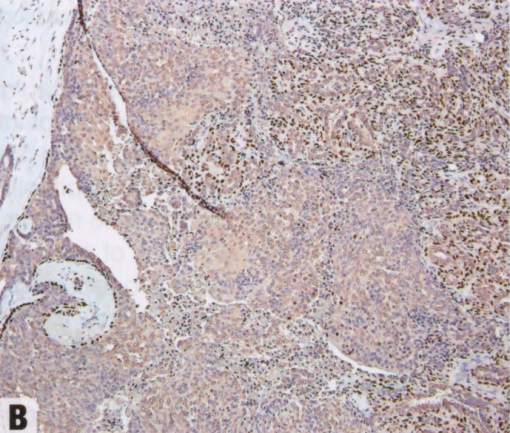
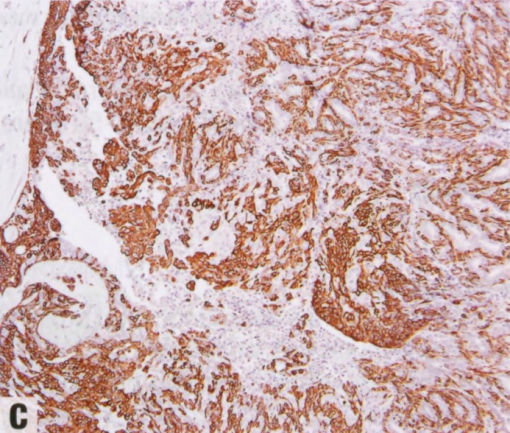
图2.38 IPa,伴UDH和肌上皮增生。A 上皮细胞核拥挤重叠,在中心的裂隙状腔隙周围杂乱排列。右上角的梭形细胞是肌上皮。B p63染色显示右上角的肌上皮细胞,以及纤维血管轴心上方的肌上皮核。左侧受累导管边缘排列着肌上皮细胞。C 中心的UDH呈CK14阳性,并有ER染色的马赛克模式(未显示)。CK14还显示右上角的肌上皮细胞。
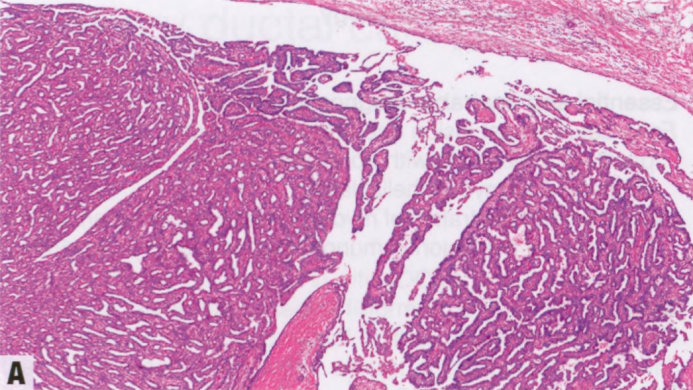
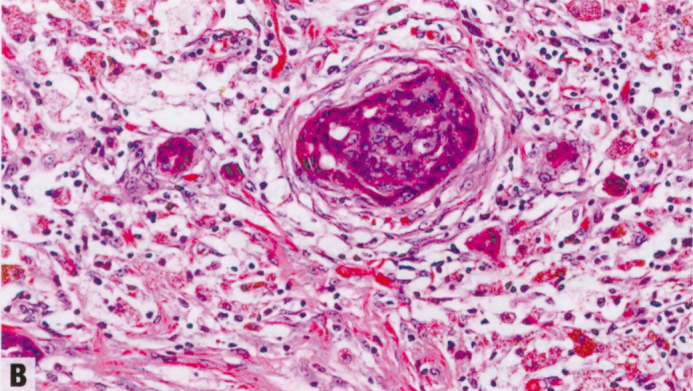
图2.39 IPa伴上皮移位。A 低倍显示IPa。B 较高倍。上皮巢可能陷入活检部位的肉芽组织中,超出病变周围,可能貌似浸润。
在粗针活检中,即使是碎片组织,良性乳头状瘤的特征(如上所述)也很容易识别。然而,取样不完整的乳头状瘤可能导致诊断困难,特别是硬化性乳头状瘤或伴有上皮增生或非典型性的乳头状瘤。肌上皮免疫染色可能有助于显示潜在的乳头结构,并确定肌上皮细胞是否存在。应报告粗针活检乳头状病变的大小,以便结合放射学和临床管理。粗针活检后,无非典型性的乳头状瘤的处理仍然存在争议。尽管异质性仍然是一个问题,但最近的研究提示,升级率差异很大,但总体上较低。如果在粗针活检中发现非典型特征(缺乏肌上皮细胞、低度细胞学或结构异型性或高度细胞学),则应切除乳头状病变。
根据组织病理学背景,乳头状瘤的鉴别诊断可能包括乳头状病变的谱系——IPa伴ADH/DCIS、pDCIS/导管内乳头状癌(特别是二态型亚型,因为球状细胞可能貌似肌上皮)、EPC、SPC和极性反转的高细胞癌——以及具有息肉样间质结构的AME或纤维上皮性肿瘤、乳头腺瘤和乳头状汗腺瘤。罕见报道,腋窝淋巴结中良性上皮包涵体表现为乳头状瘤。
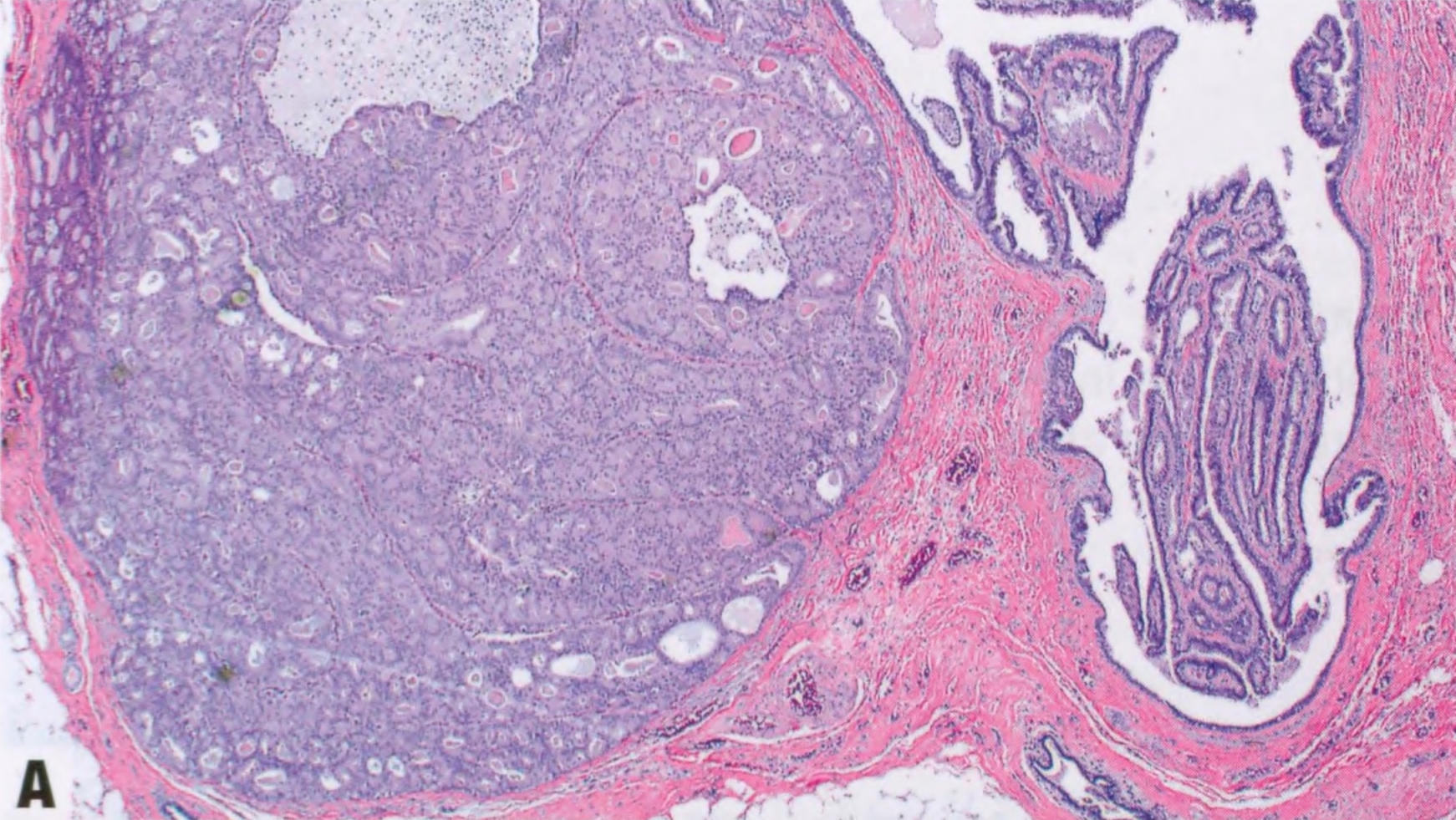
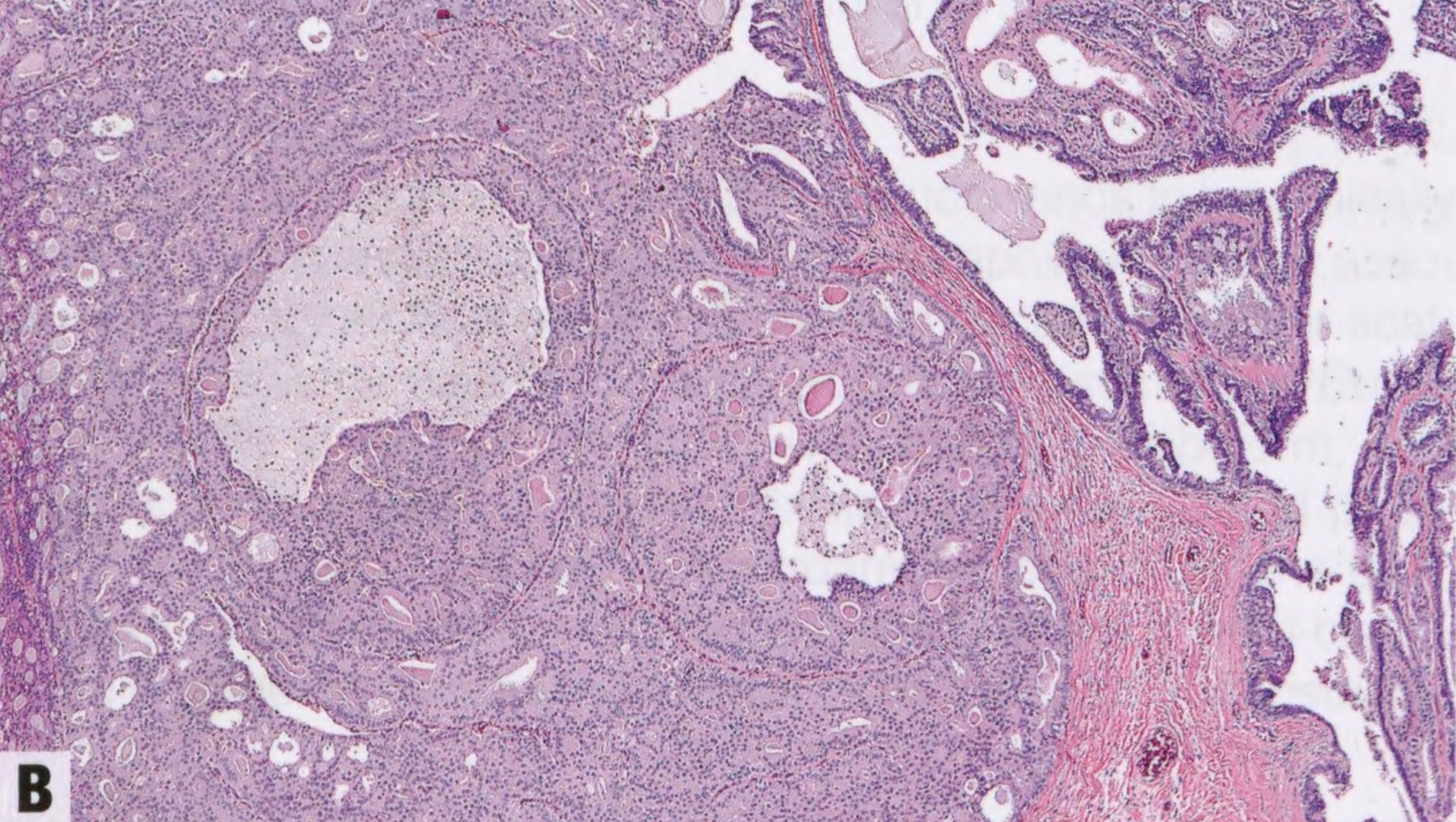
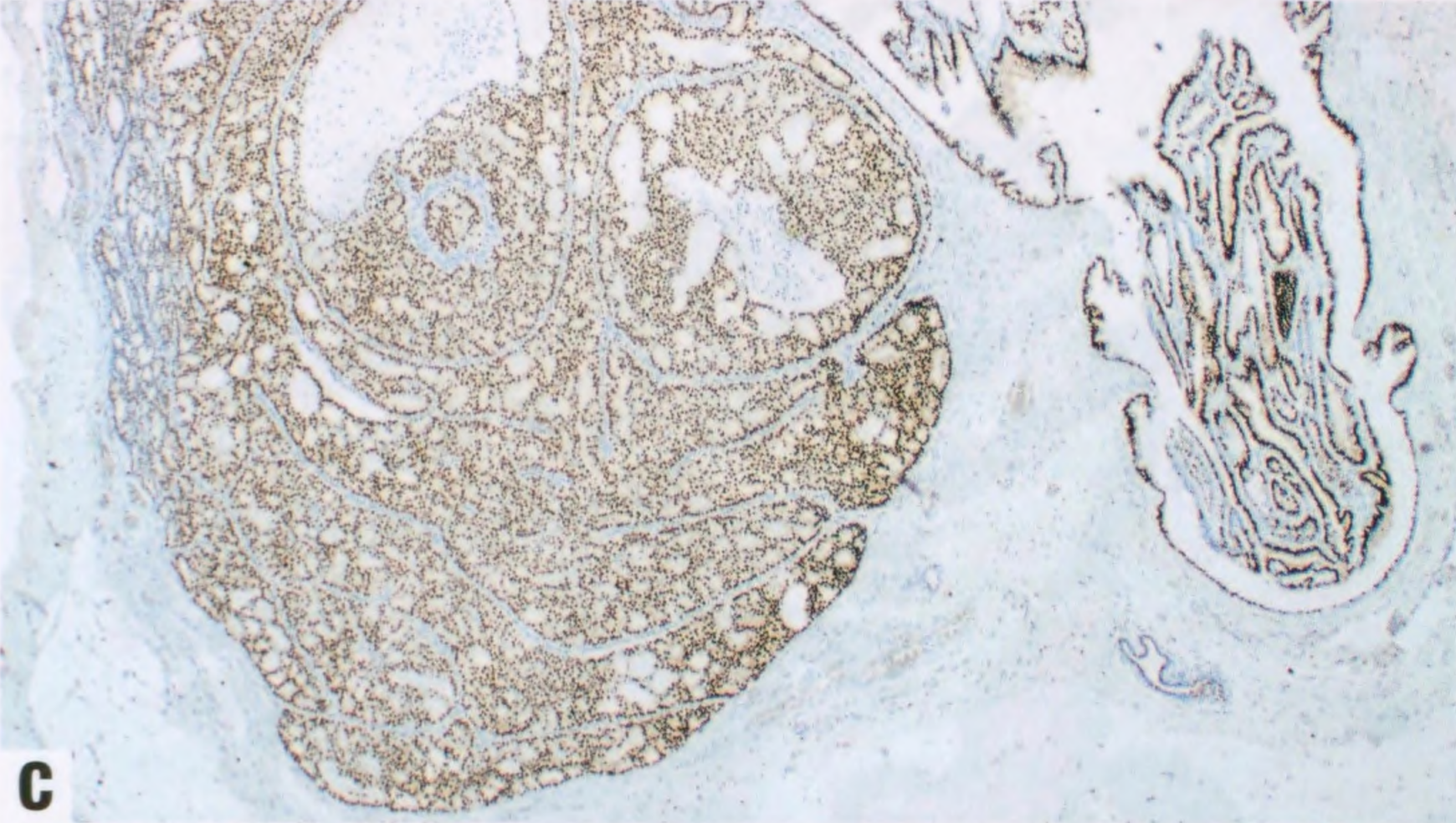
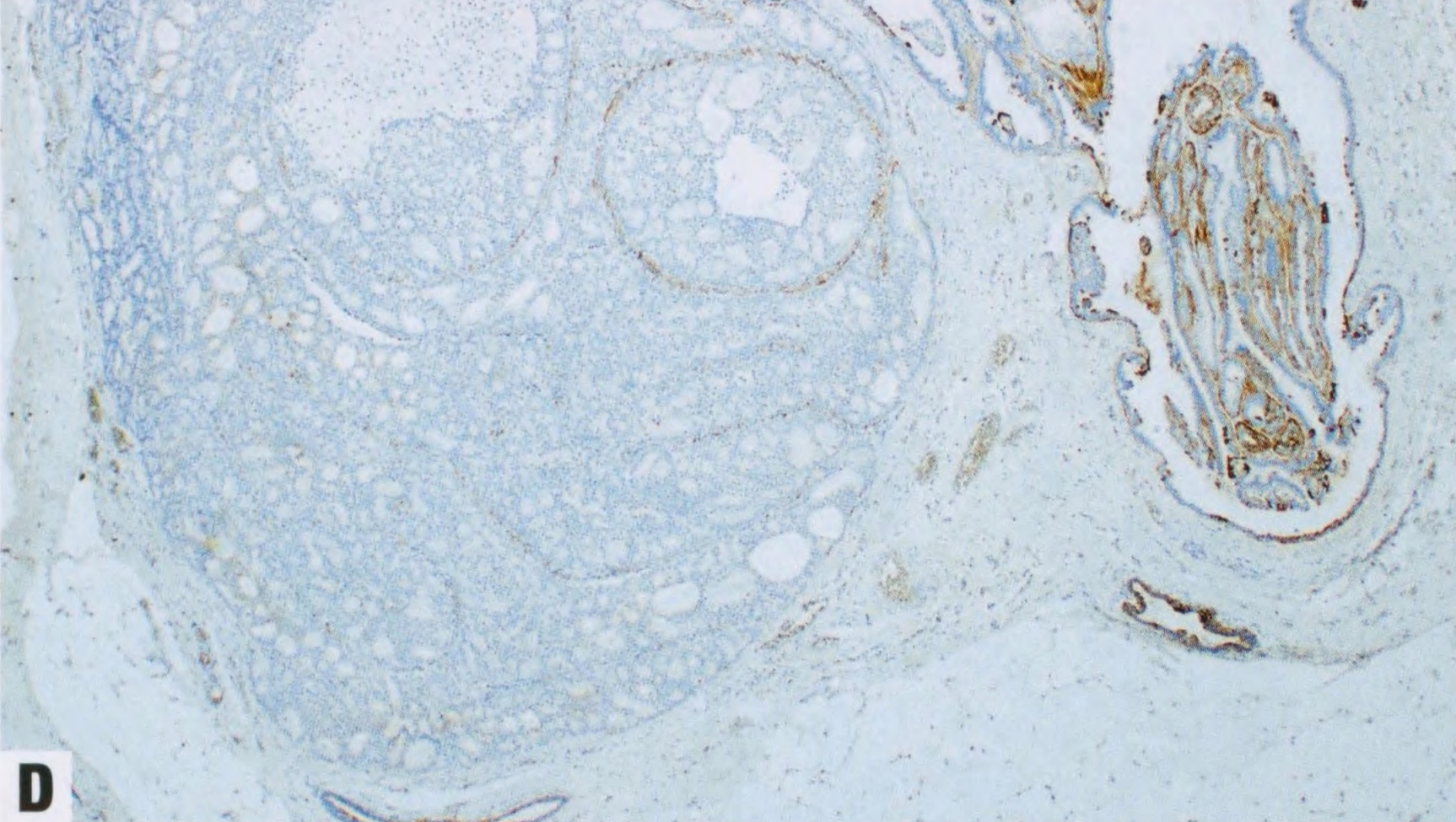 图2.40 IPa伴DCIS。A 低倍显示扩张的导管含有乳头(右),被覆无非典型的大汗腺和柱状上皮。病变左侧的筛状增殖大于3mm。B 中倍显示乳头状病变左侧的单一的上皮细胞伴低级别核。根据细胞学、结构和大小(>3mm),该病变诊断为IPa伴DCIS。C ER染色显示DCIS呈弥漫性强阳性(左),但乳头状瘤良性部分呈斑驳染色(右)。D DCIS呈CK5阴性(左),并显示乳头状瘤两部分纤维血管轴心的肌上皮细胞。这例良性上皮也是CK5阴性,因为上皮是大汗腺和柱状。CK5在乳头状瘤伴UDH通常呈阳性。
图2.40 IPa伴DCIS。A 低倍显示扩张的导管含有乳头(右),被覆无非典型的大汗腺和柱状上皮。病变左侧的筛状增殖大于3mm。B 中倍显示乳头状病变左侧的单一的上皮细胞伴低级别核。根据细胞学、结构和大小(>3mm),该病变诊断为IPa伴DCIS。C ER染色显示DCIS呈弥漫性强阳性(左),但乳头状瘤良性部分呈斑驳染色(右)。D DCIS呈CK5阴性(左),并显示乳头状瘤两部分纤维血管轴心的肌上皮细胞。这例良性上皮也是CK5阴性,因为上皮是大汗腺和柱状。CK5在乳头状瘤伴UDH通常呈阳性。
IPa伴ADH和DCIS
ADH或DCIS病灶可见于乳头状瘤,外周乳头状瘤比中心乳头状瘤更常见。IPa伴ADH和DCIS的特征是局灶性单一细胞群,具有低级别导管肿瘤的细胞学和结构特征。这些病灶中的肌上皮细胞可能稀少或缺失,非典型上皮细胞通常不表达高分子量CK(CK5/14),ER呈均匀阳性(表2.03和表2.04,见第50页)。范围和比例标准用于区分乳头状瘤内的ADH和DCIS。根据一些学者的观点,范围阈值为3mm:当非典型上皮细胞群<3mm时,诊断为IPa伴ADH,≥3mm时诊断为IPa伴DCIS。尽管有些学者使用30%作为阈值,但第4版乳腺肿瘤WHO分类采纳了3mm标准,尽管科学证据有限。当出现中度或高度核级别上皮增殖时,无论范围如何,都应诊断IPa伴DCIS。IPa伴DCIS必须区分pDCIS和EPC(见下文描述)。
pDCIS
见pDCIS(第57页)。pDCIS,以前称为囊内乳头状癌,由纤维血管轴心上被覆的DCIS组成,位于囊性扩张的导管内。乳头轴心没有肌上皮,但导管周围保留了肌上皮。除了传统型实性、筛状和微乳头状模式外,pDCIS可能貌似温良,具有复层化梭形、致密柱状或二态性模式。二态性模式的特征是第二种上皮细胞群具有透明胞质,可能貌似肌上皮;这种模式可以通过肌上皮免疫染色来识别。
pDCIS罕见单独发生。更常见的是,它是DCIS中的几种结构模式之一。与所有类型的DCIS一样,pDCIS根据肿瘤上皮的核异型性进行分级。原位SPC是pDCIS的一种特殊亚型,放在专门的章节中进行描述,见第63页SPC(原位和浸润性)。
IPa伴ALH和LCIS
导管内乳头瘤中若有小叶肿瘤应如实报道。
细胞学
FNA很难诊断乳头状病变。涂片细胞丰富,显示含有肌上皮和上皮细胞的3D乳头簇,通常包括柱状和大汗腺细胞,背景中有泡沫状组织细胞。细胞学很难区分良性乳头状瘤和更恶性的乳头状病变。
诊断分子病理学
与临床无关
诊断标准
必要标准:导管内发生的乳腺病变,成于有纤维血管轴心的乳头,被覆上皮和肌上皮层。
理想标准:免疫组化显示病变内和周围的肌上皮细胞。
分期
与临床无关
预后和预测
没有周围非典型改变的良性中央乳头状瘤,随后IBC风险增加2倍;而周围乳头状瘤增加3倍。据报道,对于非典型乳头状瘤,随后发生单侧或双侧浸润性癌的风险增加5-7.5倍。非典型乳头状瘤的后续癌症和局部复发的风险被周围乳腺实质内频繁并发的ADH或DCIS所掩盖。
Papillary ductal carcinoma in situ
乳头状导管原位癌(pDCIS)
定义
pDCIS是DCIS的一种形态学亚型,由纤细树枝状纤维血管轴心组成,被覆肿瘤性导管上皮不伴肌上皮,位于中央或外周导管内,外周保留有肌上皮。
ICD-11编码
8503/2 pDCIS
ICD-11编码
2E65.2&XH4V32乳腺DCIS&DCIS-NOS
相关命名
可接受:乳头状原位癌;导管内pDCIS。
不推荐:囊内乳头状导管癌;包裹性/SPC。
亚型
没有
部位
pDCIS通常并发具有其他结构模式的DCIS,可能累及中央或外周导管。中央/乳晕下导管中的pDCIS可能伴有EPC。
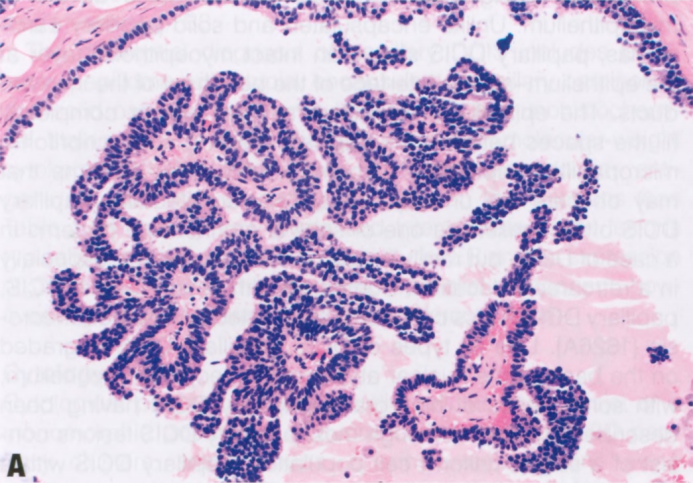
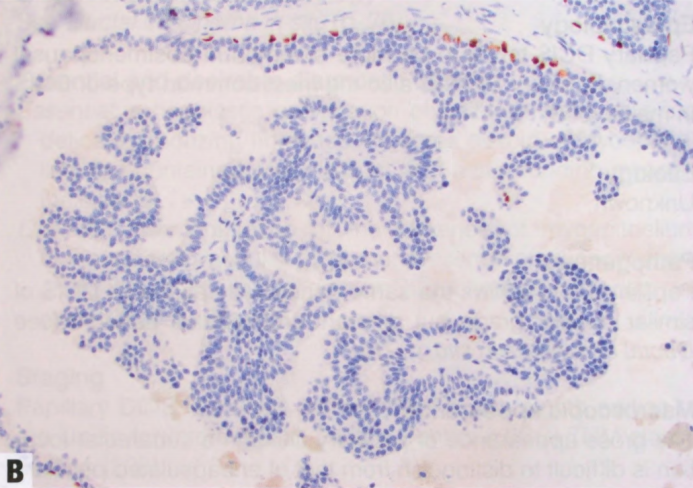
图2.41 pDCIS。A 小的囊性导管内具有低核级别的导管上皮细胞的单一增殖,被覆于纤细的分支纤维血管轴心。B p63免疫染色显示沿纤维血管轴心没有肌上皮,但导管周围肌上皮存在。
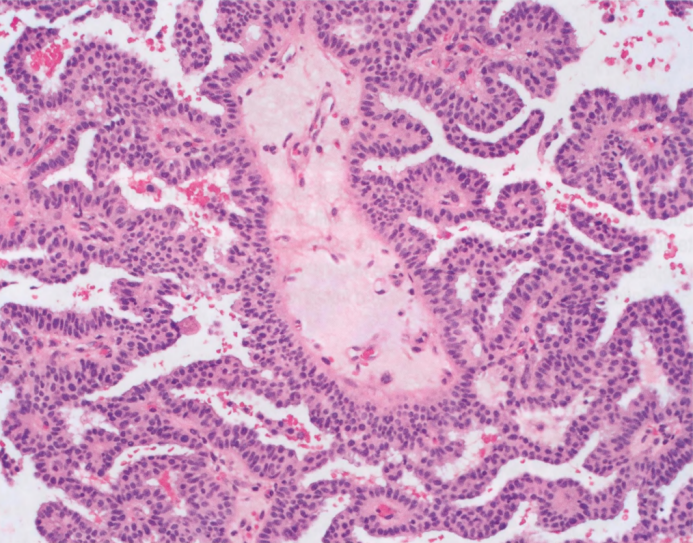
图2.42 pDCIS。纤细的分支纤维血管轴心被覆单一的上皮增殖,核级别低。
临床特征
发生在外周导管的pDCIS在临床上往往隐匿,通常由于伴有微钙化而被乳房X线检查发现,或者罕见表现为外周或散在的结节(见第76页DCIS临床特征)。具有乳头状、筛状和微乳头状模式的DCIS通常与EPC共存,尤其是在乳晕后位置。过去,EPC及其附近的DCIS归入囊内pDCIS(另见第60页EPC)。据报道,pDCIS约占DCIS的3%。
流行病学
pDCIS较常见于绝经后妇女。pDCIS也是男性DCIS中最常见的类型。
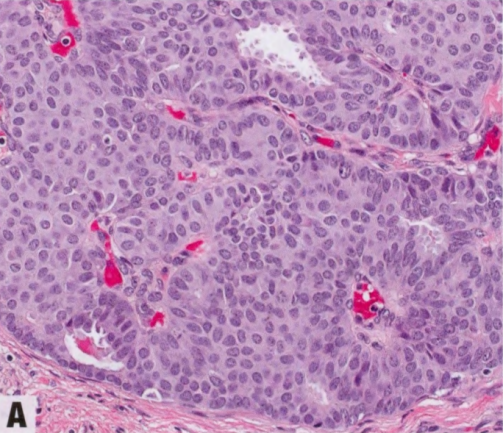
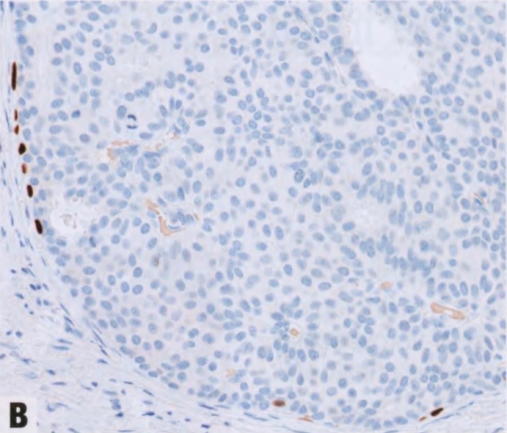
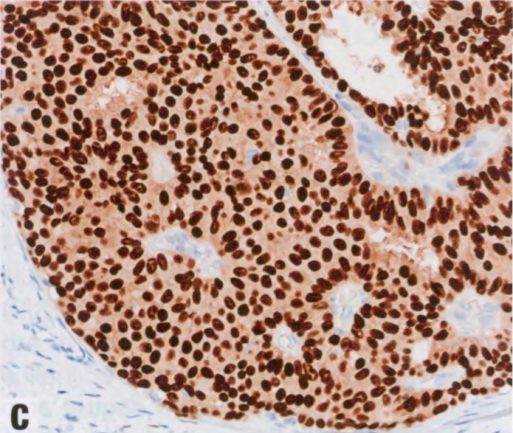
图2.43 原位SPC,pDCIS特殊亚型。A 均匀的导管上皮细胞伴中级别核,增殖并充满填充纤细分支纤维血管轴心之间的空间,形成实性和局灶筛状模式,可能掩盖潜在的乳头结构。B p63染色,纤维血管轴心没有肌上皮,而导管周围有肌上皮。C ER染色,核弥漫强阳性。纤维血管轴心及其周围的核和肿瘤细胞呈栅栏状排列。见第63页SPC(原位和浸润性)。
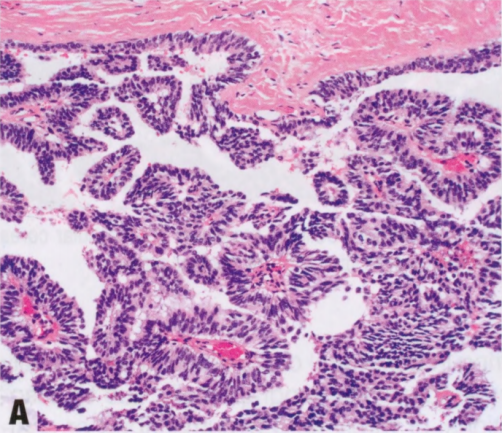
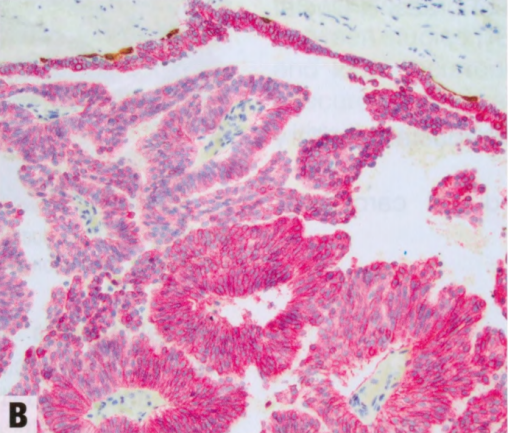
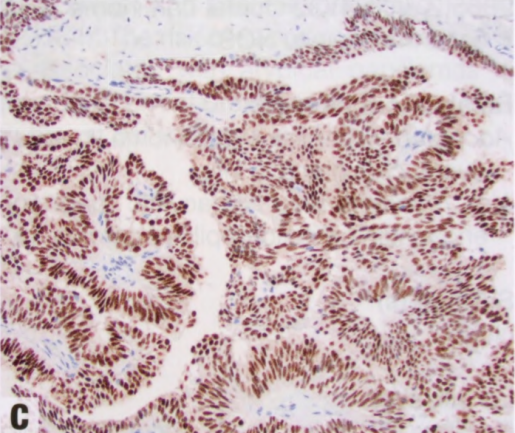
图2.44 pDCIS。A 另一例pDCIS。B ADH5鸡尾酒免疫染色。肿瘤上皮细胞表达管腔CK(CK7和CK18:红色),但基底CK阴性(CK5、CK14和核p63:棕色)。导管周围存在肌上皮细胞(棕色),但乳头轴心没有。C ER显示肿瘤细胞核呈弥漫强阳性。沿纤维血管轴心及其周围的核和肿瘤细胞呈栅栏状排列。
病因
未知
发病机制
pDCIS显示出与DCIS相同的遗传学改变,核级别相似,但结构模式不同(见第76页DCIS)。
大体表现
乳晕下pDCIS的外观很难区分EPC(见第60页EPC),因为这两种病变可能经常共存。
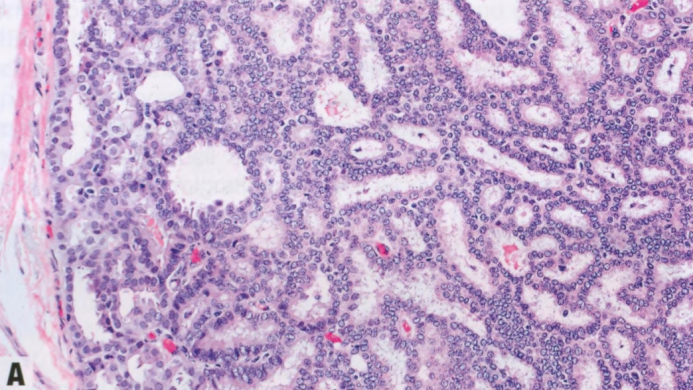
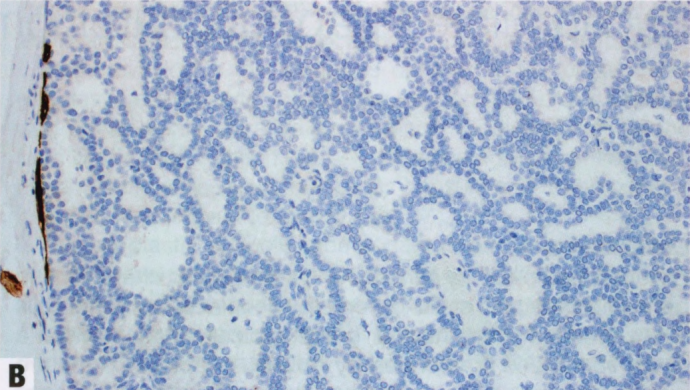
图2.45 pDCIS。A 具有低级别核的单一细胞形成筛状和腺腔,被覆于不明显的纤维血管轴心上。B CK5染色显示外周导管的肌上皮细胞,但纤维血管轴心无肌上皮细胞,提示pDCIS。
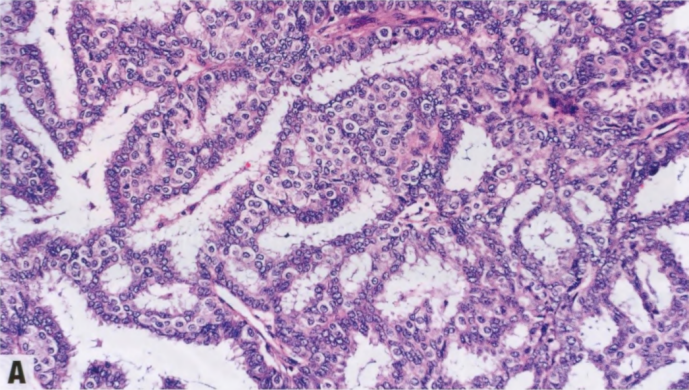

图2.46 pDCIS,二态。A HE染色显示两群细胞:管腔细胞和貌似增生性肌上皮(也称为球状细胞);然而,核增大。B p63染色阴性,提示两个细胞群都是上皮细胞。
组织病理学
pDCIS成于导管内肿瘤上皮增殖,被覆于树枝状纤维血管轴心,没有肌上皮。与EPC和SPC不同,pDCIS在受累导管周围的上皮-间质界面显示完整的肌上皮层。上皮增殖可能部分或完全填充乳头之间的空间,形成实性、筛状、微乳头状、梭形或致密的柱状模式,可能掩盖潜在的乳头结构。在某个具体病例中,pDCIS通常是DCIS的几种结构模式之一,罕见全是pDCIS模式,尤其是乳晕后位置。与其他类型的DCIS相比,pDCIS少见粉刺样坏死。与所有类型的DCIS一样,pDCIS根据肿瘤上皮的核异型性进行分级,已经描述了一些高级别pDCIS病例。
尽管大多数pDCIS病变由单一、均匀的细胞群组成,但二态模式的pDCIS已有描述。除了肿瘤性导管细胞外,它还具有大量具有丰富透明胞质的细胞(球状细胞);这些在形态学上类似于肌上皮细胞,但具有与明显上皮细胞成分相似的核特征和异型性。肌上皮免疫染色可以区分二态pDCIS与DCIS广泛累及的乳头状瘤(见第50页表2.04)。原位SPC是pDCIS的一种特殊亚型,单独描述,见第63页SPC(原位和浸润性)。
pDCIS的鉴别诊断包括乳头状瘤、乳头状瘤伴非典型、EPC和SPC。肌上皮标记物、高分子量CK(CK5/6和CK14)、ER和神经内分泌标记物的免疫染色可用于区分这些病变(见第50页表2.04)。低和中级别病变通常显示ER呈弥漫性核阳性,肿瘤性上皮成分不表达CK14或CK5/6;然而,高级别病变可能表现出不同的染色模式。
细胞学
涂片通常细胞丰富,由排列成3D乳头状簇、小群或单细胞的单形性导管细胞群组成,常有柱状形态。低-中核级别。背景中可能存在泡沫状组织细胞,但肌上皮细胞往往稀疏或缺失。鉴别诊断包括乳头状瘤、乳头状瘤伴非典型、EPC和SPC。大多数病例,仅凭细胞学检查不可能诊断pDCIS,特别是低核级别癌。
诊断分子病理学
参见DCIS(第76页)。
Encapsulated papillary carcinoma
包裹性乳头状癌(EPC)
定义
EPC是一种癌,其特征是纤细的纤维血管轴心被覆低或中核级别的肿瘤上皮细胞,通常发生在囊腔内并有纤维包膜。乳头轴心或病变周围通常没有肌上皮细胞。
ICD-11编码
8504/2 EPC
8504/3 EPC伴浸润
ICD-11编码
2E65.Y&XH9XV2其他特定的乳腺CIS&EPC
2C6Y&XH0GT6其他特定的乳腺恶性肿瘤&EPC伴浸润
相关命名
不推荐:囊内乳头状癌;囊性乳头状癌。
亚型
没有
部位
大多数肿瘤位于中央和乳晕下。
临床特征
这种病变表现为边界清楚的圆形肿块,伴或不伴乳头溢液。没有特定的影像学特征可以将EPC与其他乳头状病变区分开来;然而,EPC在发现时往往较大,呈囊性生长模式。
流行病学
包囊性乳头状癌主要出现在绝经后妇女中,主要发生在60多岁。
病因
未知
发病机制
EPC与低级别ER阳性IBC-NST具有相似的基因组特征,例如16q损失、16p增加和1q增加。PIK3CA突变率与ER匹配和分级匹配的IBC-NST相似。PAM50分型将大多数病例分为管腔A型和少数管腔B型。与分级和ER匹配的IBC-NST相比,EPC显示与增殖、细胞组装和组织、细胞运动和迁移相关的基因下调,以及与稳态和血管生成相关的基因过表达。
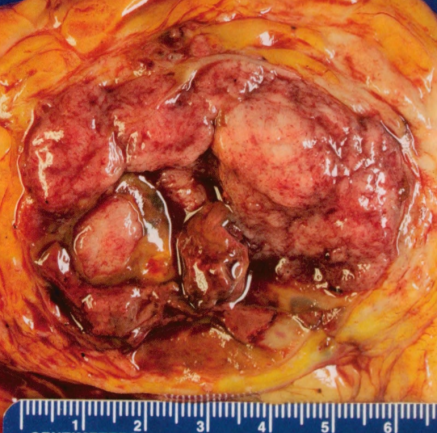
图2.47 EPC。大体表现。
大体表现
EPC通常表现为囊腔内的易碎肿块。
组织病理学
EPC通常由囊腔内乳头状肿块组成;少见由密集的结节组成。肿瘤具有圆形、推挤性边界,常有不同厚度的纤维包膜。病变含有多个纤细的纤维血管轴心,被覆单一形态的肿瘤上皮细胞群伴低或中级别核。上皮细胞单层或复层排列,也可形成微乳头或筛状结构,填充相邻乳头之间的空隙。乳头的上皮-间质界面通常没有肌上皮细胞。病变周围的肌上皮细胞通常也不存在,但偶尔可能存在。
EPS中明显的浸润定义为肿瘤成分穿透纤维包膜外,具有不规则的浸润性形态,最常见的形式是IBC-NST。(个人理解相当于传统的破坏性浸润。)必需鉴别纤维包膜内陷入的肿瘤细胞和活检部位内的上皮移位。
肿瘤上皮成分不表达高分子量CK。多种肌上皮标志物染色显示肌上皮细胞缺失。罕见病例中,肌上皮标记物可以显示病变周围不完整的肌上皮细胞层。EPC表达ER和(通常)PR,缺乏HER2基因扩增,低(偶尔中等)Ki-67增殖指数。鉴别诊断包括SPC、pDCIS、IPC和IPa伴DCIS,以及罕见的良性增生性乳头状大汗腺病变,后者表现为乳头状囊性病变,被覆良性大汗腺细胞,无核异型性或坏死,其中可能没有肌上皮细胞层。
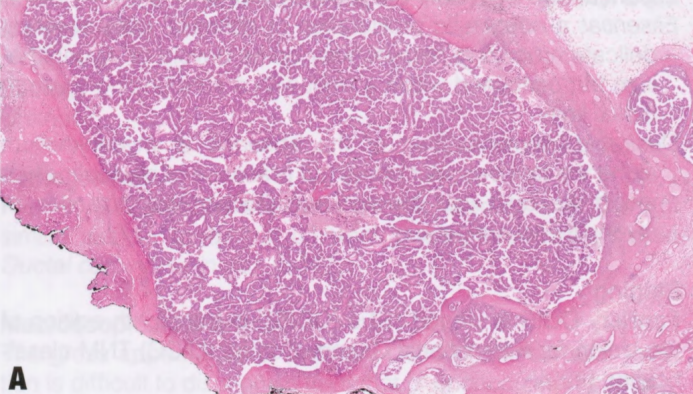
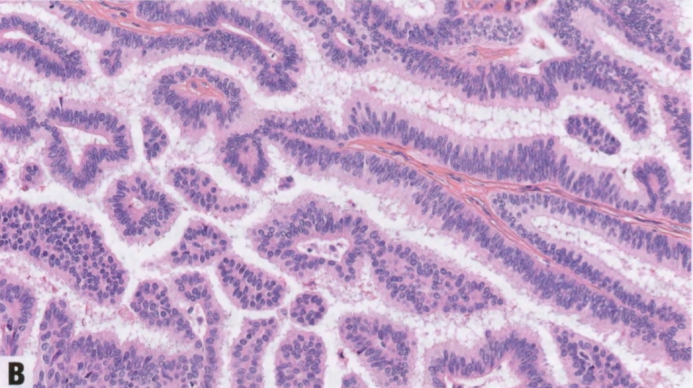
图2.48 EPC。A 囊腔内的乳头状肿块,有很多细小的纤维血管轴心。B 低级别核的肿瘤上皮细胞呈假复层排列,被覆于纤维血管轴心。
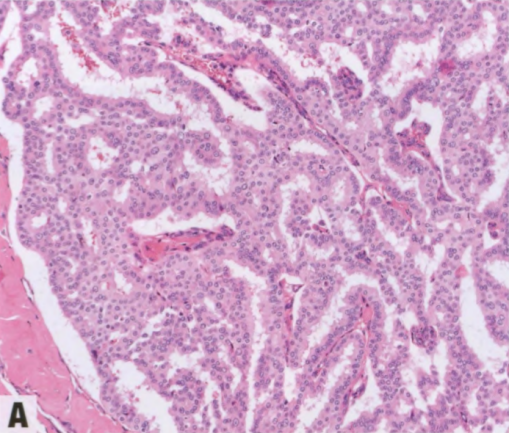

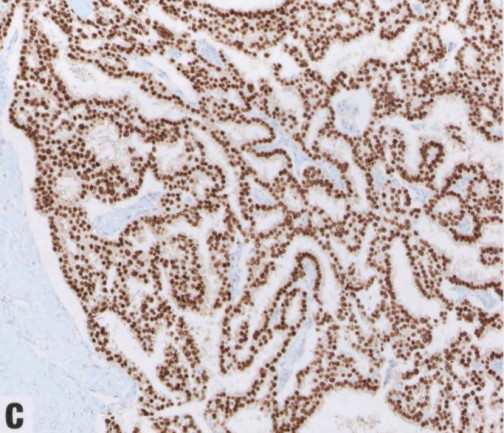
图2.49 EPC。A 低级别肿瘤上皮细胞排列成微乳头和筛状结构,填充相邻乳头之间的空隙。B CK14染色显示沿纤维血管轴心和外周(视野左边缘)没有肌上皮细胞,上皮细胞也不染色。C 肿瘤细胞呈ER弥漫强阳性。
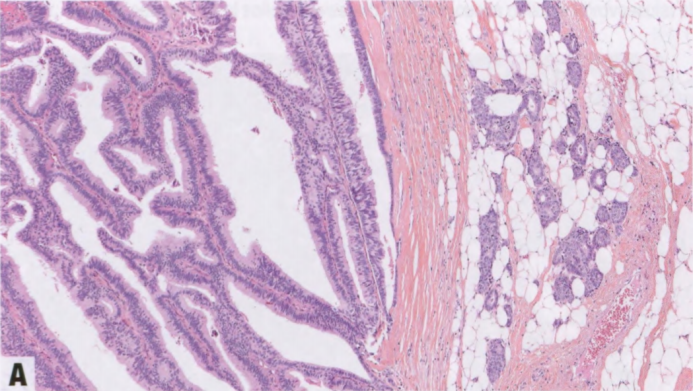
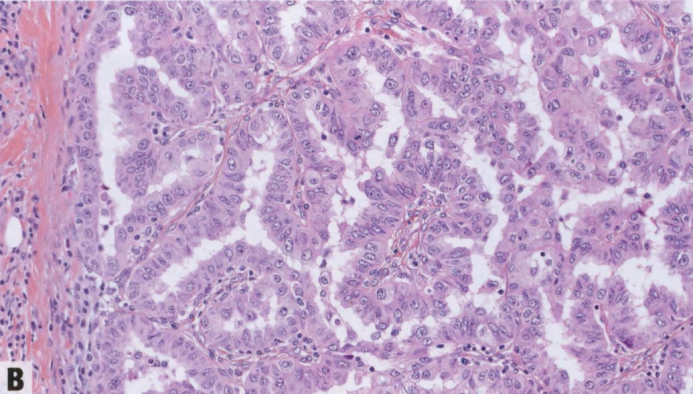
图2.50 EPC。A 明显的浸润定义为肿瘤成分穿透纤维包膜外,具有不规则的浸润性形态,最常见的形式是IBC-NST。B EPC伴高级别核特征,按浸润性癌进行分级、分期和管理。
细胞学
EPC的细胞学诊断困难,没有正式的细胞学特征可以区分良性乳头状病变。EPC的细胞学涂片高度富于细胞;存在细胞球(对应于大小可变的圆形粘附性上皮细胞簇,没有纤维血管轴心);具有轻度异型性、胞质保存和柱状形态的单细胞数量增多;乳头具有细长的纤维血管轴心,在碎片边缘呈分枝状。
诊断分子病理学
与临床无关
诊断标准
请参阅表2.03(第50页),表2.04(第50页),以及表2.05(第51页)。
分期
鉴于缺乏肌上皮细胞和腋窝淋巴结转移的罕见病例,目前认为EPC是一种自限性惰性浸润性癌,预后与CIS相似。在纤维包膜外没有明显浸润的情况下,应根据核级别分级,并分期为“pTis(DCIS)”,以防止过度治疗。在存在明显浸润的情况下,只对明显浸润成分按形态特征和病理大小来确定诺丁汉分级和肿瘤分期。只对明显浸润成分评估ER、PR和HER2状态。
预后和预测
不伴浸润性癌的EPC,只做适当足够的局部治疗,预后非常好。罕见病例有淋巴结转移的报道,转移显示典型的乳头状特征。邻近乳腺组织中并存DCIS会增加局部复发的风险。对病变进行完整的手术切除,并对周围的乳腺组织进行广泛取样,对于治疗和评估局部复发风险至关重要。病变的生长模式与EPC相似,但具有核多形性和核分裂象活性增加,和/或三阴性或HER2阳性表型,按IBC进行分级、分期和管理。
Solid papillary carcinoma (in situ and invasive)
实性乳头状癌(SPC)(原位和浸润性)
定义
SPC(原位和浸润性)特征是实性生长模式伴纤细的纤维血管轴心。常有神经内分泌分化和惰性生物学行为。
ICD-11编码
8509/2 SPC
8509/3 SPC伴浸润
ICD-11编码
2E65.Y&XH0134其他特定的乳腺CIS&原位SPC
2C64乳腺SPC伴浸润证据
相关命名
可接受:神经内分泌乳腺CIS;梭形细胞DCIS;神经内分泌DCIS;内分泌DCIS。
亚型
没有
部位
乳房的任何部位都可能受累,中央/乳晕下方最常见。
临床特征
SPC可能表现为可触及的乳腺肿块、乳房X线异常和/或血性乳头溢液。在乳房X线中,肿瘤可能表现为圆形、边界清晰的肿块,在超声检查中表现为实性、界限分明的低回声或异质性肿块。共存的间质变形提示共存浸润性成分。
流行病学
SPC主要发生在绝经后妇女中,主要发生在60多岁。
病因
未知
发病机制
未知
大体表现
大体检查可能显示一个柔软、边界清晰、红褐色的肿块。
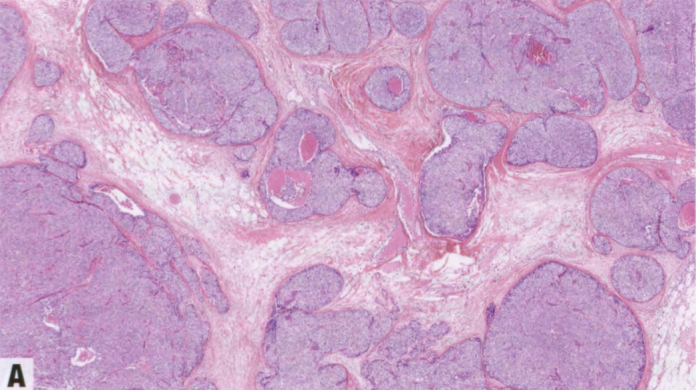
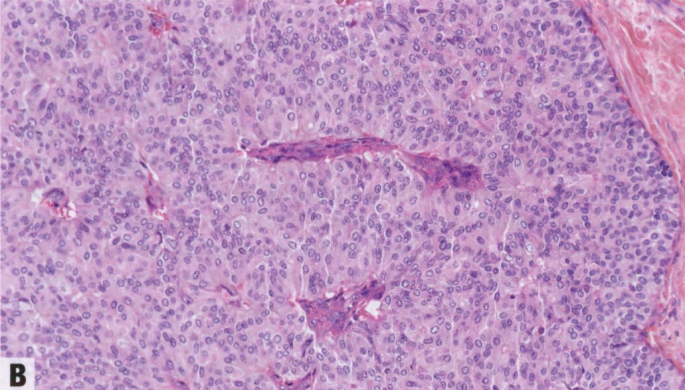
图2.51原位SPC。A 实性生长模式的膨胀性结节,具有不明显的、纤细的纤维血管轴心,没有明确的浸润证据。B 高倍,实性结节伴不明显的纤细的纤维血管轴心,和形态单一的圆形上皮细胞群伴低级别核。
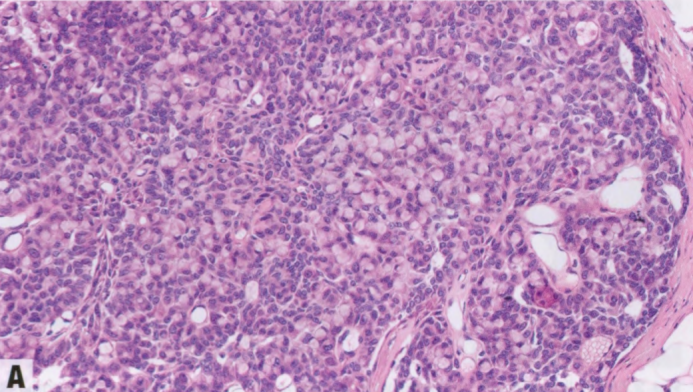
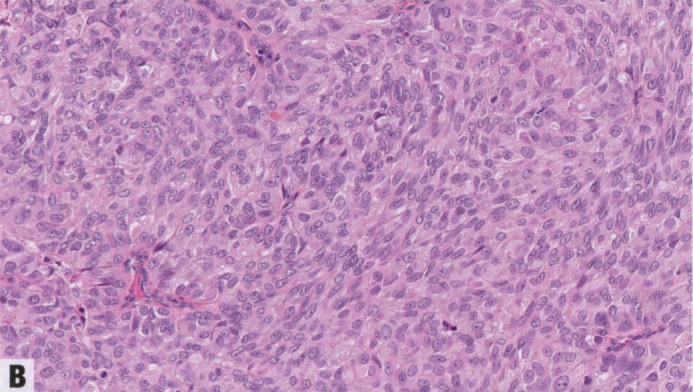
图2.52 SPC。A 肿瘤细胞群明显可见细胞内黏液(杯状细胞)。B 由梭形上皮细胞组成的实性结节。
组织病理学
SPC的特征是实性生长模式的膨胀性结节和不明显的、纤细的纤维血管轴心。增殖由单一的圆形至梭形上皮细胞组成,具有(通常)轻至中级别核和多少不等的核分裂象计数。细胞具有嗜酸性颗粒胞质,可能含有黏液空泡。印戒细胞特征可能明显。常见纤维血管轴心周围的核栅栏状排列。也可能存在细胞外黏液,但如果它很明显,就必须排除MC。
当结节具有圆形、边界清晰的轮廓,并有符合原位病变的分布模式时,无论结节周围是否存在肌上皮细胞层,都可以诊断SPC。这种肿瘤类型在pDCIS部分也有描述(第57页)。
当SPC伴有特征性条状或大簇肿瘤细胞的区域时,诊断为SPC伴浸润。浸润常见于细胞外黏液池内(通常浸润病变周围的环绕组织),对应于MC。浸润性成分也可能是更传统的类型,如非特殊型癌(NST)或小叶癌、ICC或TC。罕见的SPC病例可能表现出浸润性疾病的特征;当结节没有肌上皮细胞层,轮廓参差不齐,在促结缔组织增生性间质内形成地图样拼图模式时,诊断为浸润性SPC。在这些浸润性病例中,可能出现不规则的实性乳头状巢浸润脂肪和浸润血管。
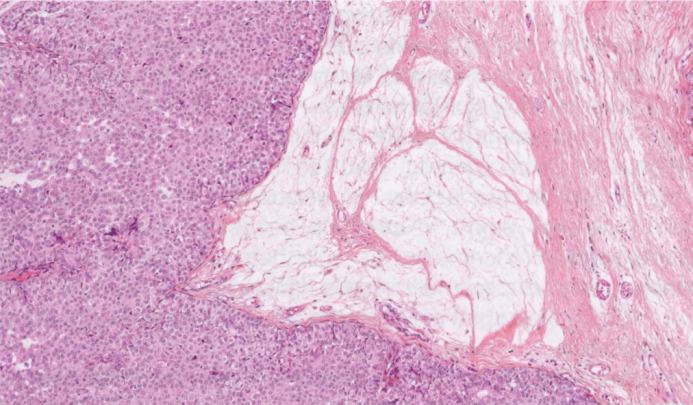
图2.53 SPC。也可能出现细胞外黏液,但其中没有漂浮的恶性细胞,不是MC。
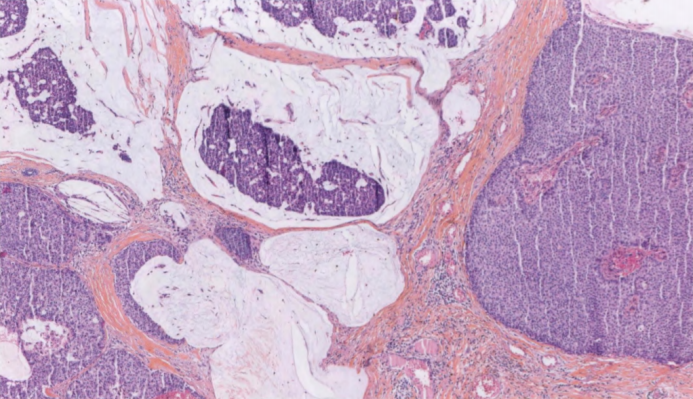
图2.55 SPC伴MC。圆形实性结节,伴有细胞外黏液池内的大簇肿瘤细胞。
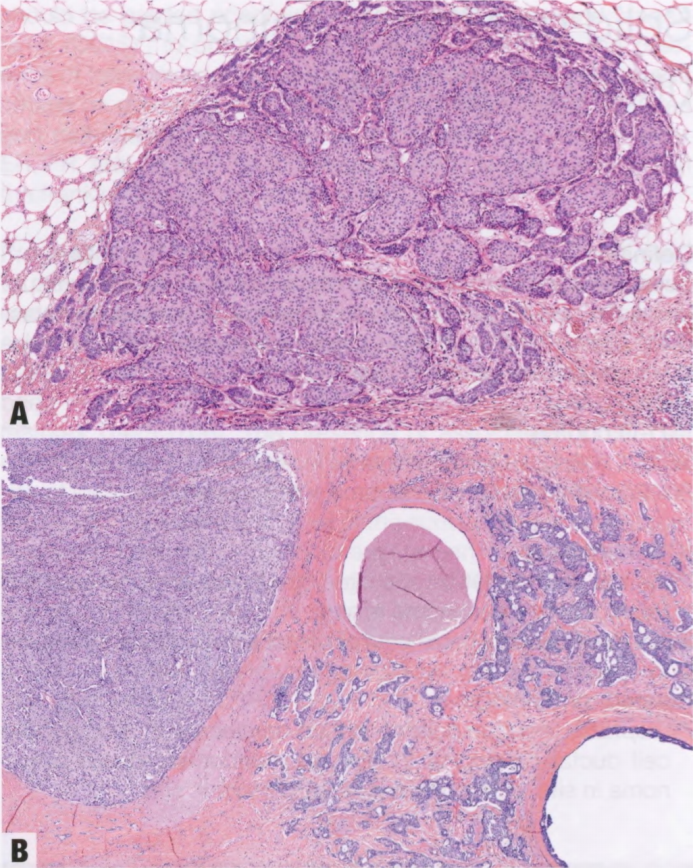
图2.54 SPC伴浸润性癌。A 结节没有肌上皮细胞层,轮廓参差不齐,在促结缔组织增生性间质内形成地图样拼图模式或浸润脂肪。B 不规则的肿瘤腺体和小梁,浸润SPC附近的乳腺实质。
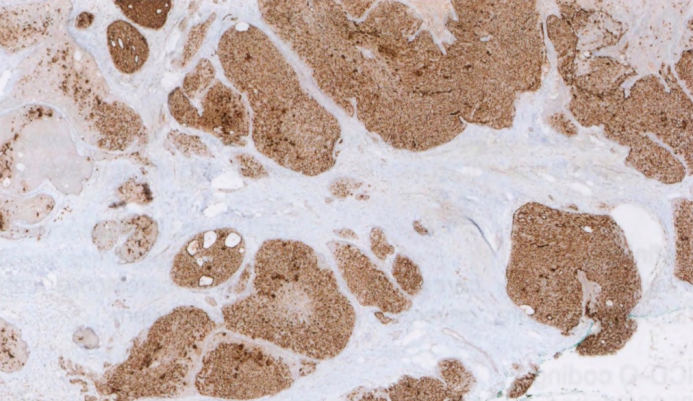
图2.56 SPC常见神经内分泌分化(CgA免疫染色)。
细胞学
SPC的细胞学涂片显示高度富于细胞;小到大块的高度非粘附性细胞簇,有许多孤立的细胞;肿瘤细胞严重过度拥挤;核呈圆形至卵圆形,细颗粒状,核多形性轻微;核的大小是小淋巴细胞核的1.5-3倍;具有胞质保存、低核质比和偏心核的孤立细胞;没有肌上皮细胞起源的卵圆形裸核。
诊断分子病理学
SPC的基因组相对简单,罕见拷贝数畸变,包括16q丢失、16p增加和1q增加。43%的病例中发现了PIK3CA突变。已研究的罕见病例根据PAM50分型归入管腔B型。与相同级别的浸润性导管癌NST相比,SPC与细胞增殖、粘附、迁移和运动相关的基因表达水平较低,提示低侵袭性表型。与人类癌症中神经内分泌分化相关的基因,包括RET、ASCL1和DOK7,在SPC中的表达水平远高于EPC。
诊断标准
请参阅表2.03(第50页),表2.04(第50页),以及表2.05(第51页)。
分期
在没有任何明显的传统型浸润成分或上述浸润性SPC特征的情况下,无论是否能识别肌上皮细胞层,SPC都分期为“pTis(DCIS)”,并根据其核特征进行分级。浸润性SPC仅根据浸润成分的大小进行分期。诺丁汉分级和激素受体状态评估也仅限于浸润性成分。浸润性SPC的分级和激素受体状态应与其他常规类型的癌一样进行评估。
预后和预测
SPC预后良好。在最近的一项综述中,76例无浸润病例中有0例报道扩散到腋窝淋巴结,71例有浸润病例中只有5例报道扩散。在129例无浸润的患者中,有0例观察到远处转移,在135例有浸润的病例中,有7例观察到远处转移。
Invasive papillary carcinoma
浸润性乳头状癌(IPC)
定义
IPC是一种浸润性癌,有被覆肿瘤上皮的纤维血管轴心。
ICD-11编码
8503/3 导管内乳头状腺癌伴浸润
ICD-11编码
2C60&XH8JR8乳腺癌,特殊型&乳腺乳头状癌
相关命名
没有
亚型
没有
部位
没有具体数据。
临床特征
没有特定的特征。
流行病学
这种病变极为罕见,没有具体的流行病学或临床数据。文献中报道的大多数IPC病例实际上是EPC或SPC,或其他部位原发癌的转移,尤其是卵巢。
病因
未知
发病机制
未知
大体表现
与临床无关
组织病理学
IPC表现出明显的浸润性生长模式,由轻度扩张的导管和含有乳头状结构的微囊组成。周围和乳头都没有肌上皮细胞。IPC根据诺丁汉分级系统进行分级。应根据是否存在由极化肿瘤细胞包围的边界清楚的中心管腔的结构来评估小管分化。没有(或小于10%)小管形成的肿瘤在3分制中得3分。
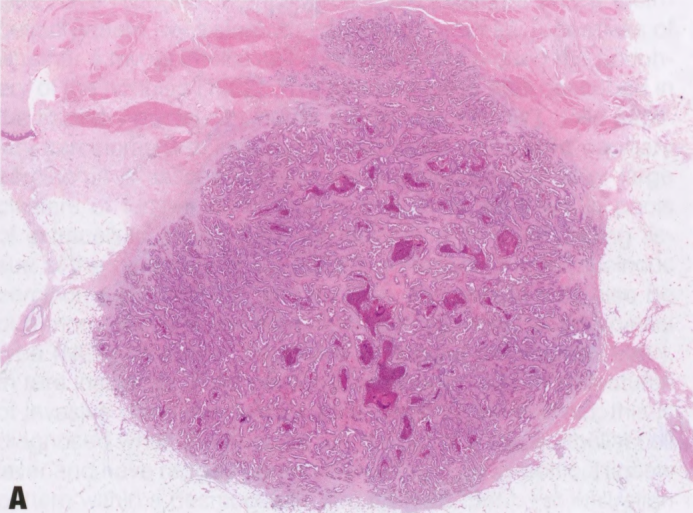
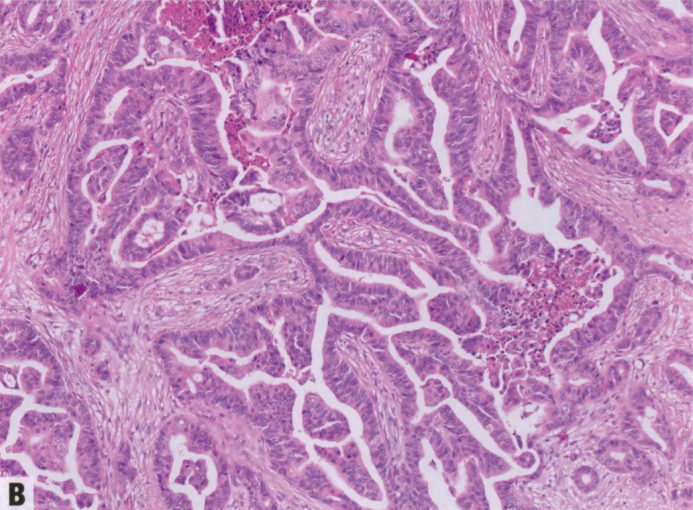
图2.57 IPC。A 低倍,乳腺癌伴乳腺实质的浸润。B 轻度扩张的浸润性导管和腺体,其中含有乳头轴心和坏死物。
这些肿瘤应区分IMpC和其他器官的转移癌。IMpC具有独特的生长模式,其特征是癌细胞簇缺乏纤维血管轴心,周围有透明的间质空隙。仔细评估形态学,卵巢浆液性癌、肺乳头状腺癌和甲状腺乳头状癌的转移可以区分乳腺癌,并要时加做起源部位标记物的免疫组化。IPC不同于EPC和SPC,后者根据其特定的形态特征进行分类。此外,该术语不应用于非乳头状癌并发EPC或SPC。
细胞学
与临床无关
诊断分子病理学
与临床无关
诊断标准
请参阅表2.03(第50页),表2.04(第50页),以及表2.05(第51页)。
分期
这些肿瘤应根据其病理大小和相应的腋窝淋巴结状态进行分期。
预后和预测
没有具体数据。
未完待续......































































共0条评论