往期回顾:
第二章 乳腺上皮性肿瘤
WHO乳腺上皮性肿瘤分类
良性上皮增生及其前驱病变
UDH
CCL,包括FEA
ADH
腺病和良性硬化性病变
SA
8401/0 AAa
MA
RS/CSL
腺瘤
8211/0 TA-NOS
8204/0 LA
8503/0 DA
上皮-肌上皮肿瘤
8940/0 PA
8983/0 AME-NOS
8983/3 AME伴癌
8562/3 上皮-肌上皮癌
乳头状肿瘤
8503/0 IPa
8503/2 pDCIS
8504/2 EPC
8504/3 EPC伴浸润
8509/2 SPC
8509/3 SPC伴浸润
8503/3 导管内乳头状腺癌伴浸润
非浸润性小叶肿瘤
ALH
8520/2 LCIS-NOS
经典型LCIS
旺炽性LCIS
8519/2 多形性LCIS
DCIS
8500/2 非浸润性导管原位癌-NOS
低核级别DCIS
中核级别DCIS
高核级别DCIS
IBC
8500/3 浸润性导管癌-NOS
8290/3 粒细胞癌
8314/3 富含脂质的癌
8315/3 富含糖原的癌
8410/3 皮脂腺癌
8520/3 小叶癌-NOS
8211/3 TC
8201/3 筛状癌-NOS
8480/3 黏液腺癌
8470/3 MSC-NOS
8507/3 乳腺IMpC
8401/3 大汗腺癌
8575/3 化生性癌-NOS
罕见和涎腺型肿瘤
8550/3 ACCa
8200/3 AdCC
经典型AdCC
实性基底样AdCC
AdCC伴高级别转化
8502/3 SeCa
8430/3 黏液表皮样癌
8525/3 PmA
8509/3 高细胞癌伴极性反转
神经内分泌肿瘤(NEN)
8240/3 神经内分泌瘤(NET)-NOS
8240/3 神经内分泌瘤(NET),1级
8249/3 神经内分泌瘤(NET),2级
8246/3 NEC-NOS
8041/3 NEC,小细胞
8013/3 NEC,大细胞
————
这些形态学代码来自《国际肿瘤学疾病分类》第三版第二次修订版(ICD-O-3.2)。肿瘤的行为编码/0表示良性;/1表示未明确、交界性或不确定的行为;/2表示原位癌和3级上皮内肿瘤;/3表示恶性肿瘤,原发部位;/6用于恶性肿瘤,转移部位。癌症登记处一般不使用行为代码/6。修订自第4版WHO分类,考虑到我们对这些病变的理解发生了改变。
2.1良性上皮增殖和前驱病变
定义
导管内增殖性病变(IDL)包括一组增殖性病变,细胞学和结构各不相同。它们最常见于TDLU,局限于乳腺导管小叶系统之内。它们伴有随后乳腺癌的不同程度的风险升高。其中有些病变最好当成风险指标,而另一些视为IBC的真正前驱病变。CCL(包括柱状细胞改变和柱状细胞增生)和FEA是TDLU的病变,通常见于因乳房X线微钙化而进行的活检。尽管分子证据提示它们是低级别乳腺肿瘤途径中的早期前驱病变,但流行病学研究的有限数据提示,它们进展为IBC的风险非常低。
译注:proliferation 增殖;hyperplasia 增生
病变起源部位和进展途径
绝大多数IDL起源于TDLU。少数起源于较大的输乳管。CCL和FEA出现在TDLU,通常不累及小叶外导管。
命名
乳腺IDL按传统分为三类:UDH、ADH和DCIS。大多数病例仅凭形态学即可对不同类型的IDL进行组织病理学区分,特别是通过组织病理学标准的标准化。然而,一些病变之间的区分(特别是ADH和一些小的、低级别DCIS)仍然存在问题。此外,基于人群的乳房X线筛查检出了更多显示细胞异型性伴或不伴管腔内增殖的病变,它们不符合诊断ADH或DCIS的组合的细胞学和结构标准。过去,缺乏可辨认增殖的病变被描述为贴壁性癌(单型)、非典型囊性小叶和非典型柱状细胞改变(以及其他术语),目前归入FEA。
向IBC进展
临床随访研究提示,IDL伴有随后发生IBC的不同风险,范围从UDH为参考人群的约1.5倍,到ADH的4-5倍,再到DCIS的8-10倍。最近的免疫表型和分子遗传学研究提出了新的见解,认为以前的癌进展观念过于简单。以前认为正常上皮UDH-ADH-CIS-浸润性癌呈线性进展,现在发现这些不同的IDL与IBC之间的相互关系要复杂得多。简言之,研究提示:(1)UDH与大多数ADH、DCIS或浸润性癌症几乎没有相似之处;(2)ADH与低级别DCIS有许多相似之处;(3)大多数病例,低级别DCIS和高级别DCIS似乎代表遗传学上不同的疾病,了导致不同形式IBC;(4)FEA代表一种克隆性肿瘤病变,与ADH和低级别DCIS具有共同的形态、免疫组化和分子特征。这些数据支持FEA、ADH和所有形式的DCIS代表上皮内肿瘤的观点。WHO肿瘤分类编辑委员会认为UDH不是一个重要的风险因素,大多数病例不太可能代表前驱病变。然而,有一些基因组数据提示,少数UDH可能携带克隆细胞群,在这种情况下偶尔会出现ADH等克隆性病变。流行病学研究的有限数据提示,CCL和FEA只有很低的IBC进展风险。
分类和分级
新兴的遗传学数据加上乳房X线检出越来越多的ADH和低级别DCIS,对目前IDL的分类方式提出了重大质疑。尽管世界各地的病理学实验室都在使用传统的分类系统,但该系统存在观察者之间的差异,特别是在区分ADH和一些小的、低级别DCIS方面。在过去的十年中,有人提出用导管上皮内肿瘤(DIN)系统取代传统术语,只给浸润性肿瘤使用“癌”字。DIN术语尚未得到广泛接受,部分原因是没有使用新的诊断标准,因此术语的改变无助于改善观察者之间的差异。分子分析正在完善,应当有助于改进传统的分类。IDL的分类应被视为一个不断发展的概念,随着更多的分子和遗传学数据的出现,这一概念可能被修改。
诊断重复性
多项研究评估了诊断IDL范围的可重复性,其中一些研究侧重于交界性病变。这些研究清楚地提示,如果不使用标准化标准,观察者之间的一致性差。使用标准化标准可以提高诊断的可重复性。然而,部分病例诊断中的差异仍然存在,特别是在ADH和有限形式的低级别DCIS之间的区别方面,因为这种区别在很大程度上是基于定量特征而非定性特征。在一项研究中,与评估整张切片相比,仅判读有限的特定图像时,诊断和分类的一致性没有显著改变,这反映了形态学解释差异引起的不一致性。临床随访研究通常提示,与UDH、ADH和DCIS相关的癌症风险水平不断增加,但对诊断重复性的担忧导致一些人质疑在个体患者层面使用这些风险估计的做法。
病因
一般来说,与IBC发展相关的因素也与IDL发展的风险增加有关。
遗传学
相似级别的浸润性癌和CIS之间的形态相似性及其在乳腺内的密切关联提示,这些增殖在生物学上是相关的。原位和浸润性病变之间的关系已通过多种方法进行了研究,包括免疫组化、杂合性缺失分析、比较基因组杂交和基因表达谱分析。这些数据揭示了DCIS与浸润性导管癌之间的密切关系。不同级别浸润性癌中发现的不同分子特征也反映在形态相似的浸润前病变中。其他浸润前病变更难沿着多步路径定位。以前把UDH当成ADH和DCIS的前驱病变。然而,在分子水平上,UDH中检测到相对较少的随机染色体改变。有证据提示,少数UDH病例可能存在ADH中也观察到的基因组改变,因此可能是ADH的前驱病变;然而,这些病变中的绝大多数不会进展,更有可能是死胡同增殖。最近的数据提示,ADH和低级别DCIS更可能的前驱病变是CCL/FEA。低级别病变的标志性遗传学特征,即16q的缺失,是CCL/FEA中最常见的重现性改变,CCL/FEA的分子特征和相关的更晚期病变存在一定程度的重叠。CCL中发现了乳腺癌相关基因(包括CCND1、ESR1和CDH1)的启动子甲基化和拷贝数改变,为其在乳腺癌发生中的潜在作用提供了进一步的证据。在浸润性癌附近和远离浸润性癌的正常乳腺组织中也发现了遗传学改变。在管腔上皮和肌上皮细胞中观察到独立的遗传学改变,提示这些改变可能发生在乳腺癌发展的早期。恶性肿瘤患者乳腺间质的遗传学改变也有描述,在乳腺肿瘤发生和进展中间质和上皮细胞关系已成为研究热点。目前尚不清楚个体患者正常乳腺组织改变的意义,但进一步的研究可能阐明癌症的发展和未来潜在的预防策略。
临床特征
患有IDL的女性的年龄范围很广,在青春期后7-8年。所有这些病变在青春期前都极为罕见;当它们发生在婴儿和儿童中时,通常是外源性或异常内源性激素刺激的反映。
大体表现
绝大多数IDL,特别是通过乳房X线检查发现的病变,大体检查未见明显病变。肉眼检查无法观察到CCL和FEA。
Usual ductal hyperplasia
普通型导管增生(UDH)
定义
UDH是一种良性上皮增殖,具有结构、细胞学和分子异质性,主要累及TDLU。
ICD-11编码
没有
ICD-11编码
GB20.Y其他特定良性乳腺疾病
相关命名
可接受:导管内增生;普通型增生;无异型性的增生;上皮病;普通导管内增生。
不推荐:增生(无进一步说明)。
亚型
没有
部位
UDH通常累及TDLU,但也可能发生在小叶外导管。UDH也可能伴有其他病变,如IPa、FA、RS/CSL和NiA。
临床特征
UDH不表现为肿块或乳房X线病变,偶尔伴有微钙化。
流行病学
发病率很难确定,因为UDH很少是乳腺活检的目标病变。活检证实的无异型性的良性增殖性病变(包括UDH和其他无非典型性的增殖,如SA和乳头状瘤,通常混合)中,UDH约占诊断的30%。在约12%的良性乳腺活检中,它是风险最高的病变。诊断时的平均患者年龄为54岁,比ADH女性年轻约4岁。
病因
尚未发现与UDH病因相关的具体因素。
发病机制
大多数研究没有发现与UDH相关的一致遗传学改变。有新的证据提示,PI3K/AKT/mTOR通路的激活是UDH发病机制的重要因素。UDH的克隆异常频率低(<15%),UDH中未发现ADH和低级别DCIS的特征性改变,提示UDH是乳腺癌发生的风险标记,但大多数病例不是直接的前驱病变。
大体表现
UDH是一种显微镜下发现,没有特定的大体表现。
组织病理学
UDH的特征是良性上皮细胞的粘附性增殖,细胞之间呈杂乱的方向。出现继发性管腔(二级管腔)或窗孔也是特征。窗孔通常位于周围,往往呈裂隙状,而低级别非典型增殖(ADH和低级别DCIS)的筛孔很圆、凿孔状。有些UDH增殖呈实性模式,没有窗孔。
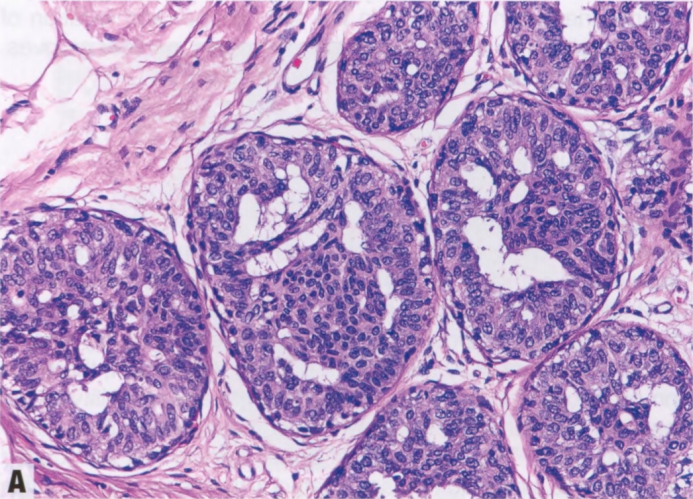
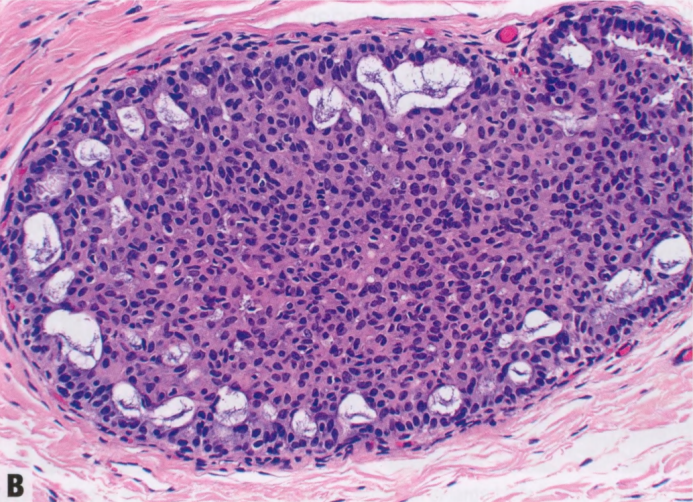
图2.01 UDH。A 上皮细胞大小和形状存在异质性,核大小、形状和分布也存在差异。管腔形状不规则。B 管腔位于IDL的外围。
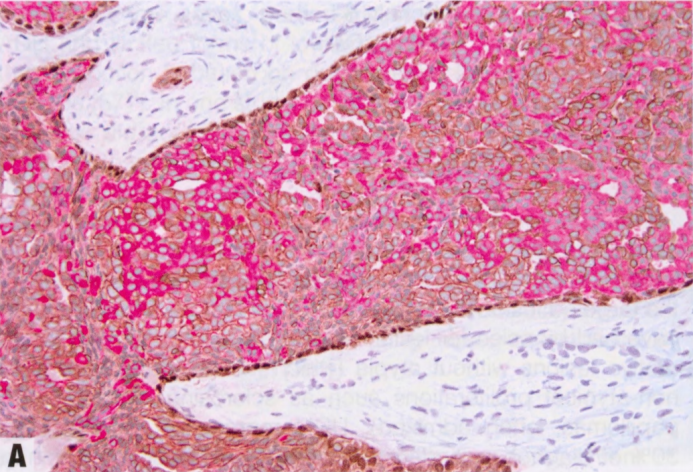
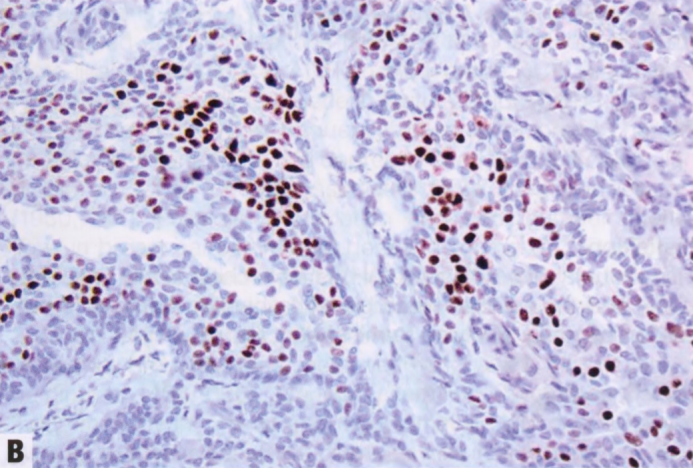
图2.02 UDH。A 三重染色显示细胞群的异质性。一些细胞表达低分子量CK(红色胞质),另一些细胞表达高分子量CK(棕色胞质)。病变周围的肌上皮细胞表达p63(棕色核)。B ER呈不同强度的核染色。
偶见类似于GyM的微乳头结构。UDH细胞排列不规则,细胞边界不清。核大小不一,常有核沟和核内胞质假包含体。细胞常有流水状或合胞体模式,在增殖灶中心尤为明显。与低级别非典型增殖(ADH和低级别DCIS)的僵硬上皮桥相反,UDH上皮桥薄而拉伸,核分布不均匀,通常平行于上皮桥。如有微乳头,则有宽基,顶端渐细,核深染,几乎呈固缩核。窗孔周围的核往往平行于管腔,而肿瘤性IDL(ADH和低级别DCIS)的核垂直于管腔,并形成新的“导管内导管”。UDH增殖可见混杂的上皮、肌上皮甚至大汗腺化生上皮细胞。还可以看到泡沫状组织细胞、钙化和(罕见)坏死灶。存在核分裂象不排除UDH。细胞群呈现混合表型,共表达低分子量CK(管腔型CK:CK7、CK8和CK18)和高分子量CK(基底型CK:CK5/6、CK14和34βE12[CK903]),后者呈异质性或镶嵌模式(注:也有形容成马赛克、斑驳模式)。UDH中的ER染色也是异质性,而低级别非典型增殖(ADH和低级别DCIS)中的ER呈弥漫强阳性。
细胞学
FNA标本可能高度细胞丰富,使人怀疑恶性。然而,它们形成平铺的、粘附性片段,上皮细胞相当温和,没有明显的核异型性。背景中存在双极裸核,是令人放心的特征。其他特征也可能存在(取决于具体病变),如乳头状结构、FA型间质、钙化和化生的大汗腺细胞。
诊断分子病理学
与临床无关
诊断标准
结构特征:窗孔、实性或微乳头模式;边窗,大小和形状不一,通常呈裂隙状,管腔周围细胞无极性;上皮桥细长,中间变细。
细胞学特征:异质细胞群,细胞边界不清,大小、形状和方向不一;核大小、形状和分布不一,包括核重叠、核沟和核内胞质假包含体。
分期
与临床无关
预后和预测
对患有UDH的妇女的长期随访提示,随后患癌风险略有增加,约为1.5-2倍。双侧乳腺都有这种风险,有强烈乳腺癌家族史的患者似乎略高。目前,没有任何预后因素可以可靠地预测UDH诊断后可能发生IBC。与UDH相关的乳腺癌风险与某些生殖因素(如初潮早期和更年期晚期)相关的风险相似,不应改变乳腺X线筛查的频率。
Columnar cell lesions, including flat epithelial atypia
柱状细胞病变(CCL),包括平坦上皮非典型增生(FEA)
定义
CCL是TDLU的克隆性改变,其特征是腺泡增大,不同程度扩张,内衬柱状上皮细胞。FEA的特征是低级别(单形性)细胞异型性。
ICD-11编码
没有
ICD-11编码
GB20.Y其他特定良性乳腺疾病
相关命名
CCL
可接受:柱状细胞改变;柱状细胞增生。
不推荐:盲管腺病;小叶柱状改变;柱状化生;增生性伸展小叶;增生性小叶单位增大;小叶单位增大伴柱状细胞改变。
FEA
可接受:柱状细胞改变伴异型性;柱状细胞增生伴异型性。
不推荐:贴壁性癌(单形性);非典型囊性小叶;A型非典型小叶。
亚型
没有
部位
CCL和FEA是乳腺TDLU的病变。
临床特征
这些病变最常见于乳房X线检查发现的成团的无定形钙化。也可能是显微镜下偶然发现。
流行病学
未知
病因
没有直接说明病因的数据。然而,鉴于它们与低级别乳腺肿瘤途径中的其他病变具有相同的免疫表型和分子改变,可以合理地推测它们的病因是相似的。
发病机制
现有证据提示,CCL是低级别乳腺肿瘤形成途径的最早阶段,是ADH、低级别DCIS和低级别IBC(包括TC)的非必然前驱病变。通过杂合性丧失(特别是16q的丧失)和比较基因组杂交,柱状细胞改变和柱状细胞增生的一些例子显示基因组异常。尽管传统认为UDH是ADH的前驱病变,但目前的证据提示,CCL和FEA实际上更可能是前驱病变。CCL和FEA的免疫表型类似于ADH/低级别DCIS。这些病变的增殖程度、结构异型性和细胞异型性在遗传学水平上反映出来,通过比较基因组杂交,染色体拷贝数改变的数量和复杂性逐步增加。此外,低级别病变的特征性遗传学改变,即16q的缺失,是CCL和FEA中最常见的重现性改变。研究还提示,CCL/FEA的分子遗传学谱与相关的更晚期病变的分子遗传学图谱存在一定程度的重叠,这意味着存在前驱病变-产物关系。
大体表现
CCL和FEA是显微镜下病变,肉眼检查不可见。
组织病理学
柱状细胞改变和增生的特征是TDLU不同程度地增大,腺泡扩张,内衬柱状上皮细胞,常有顶端胞质突起。受累腺泡通常轮廓不规则。核通常呈卵圆形,规则地垂直于基底膜,染色质均匀分散,核仁不明显。通常存在管腔分泌物和/或微钙化。仅有1-2层衬覆上皮细胞的病变归入柱状细胞改变;细胞复层化或细胞丛>2层细胞的病变称为柱状细胞增生。细胞异型性不是这些病变的特征;具有细胞异型性的CCL属于FEA类别。
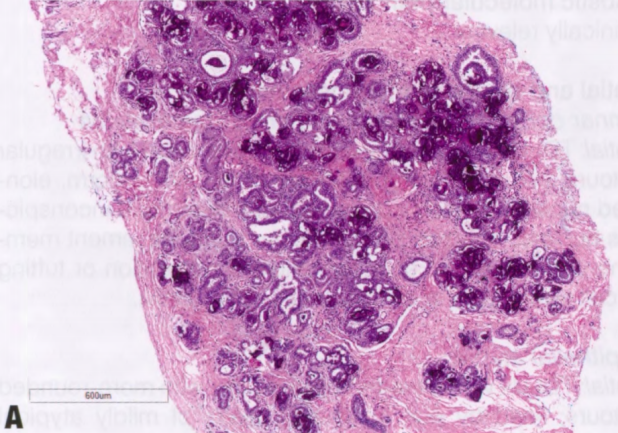
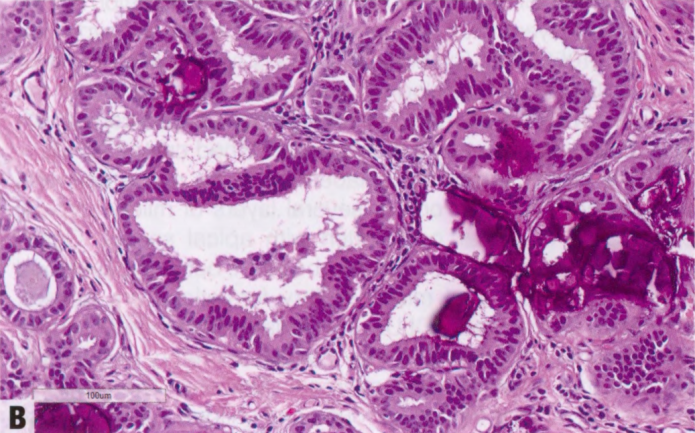
图2.03 CCL。A X线筛查钙化的粗针活检显示,小叶增大伴柱状细胞改变,有大量钙化。B 更高倍显示柱状上皮细胞衬覆的小管,核垂直排列。局灶性柱状细胞增生伴核复层化。
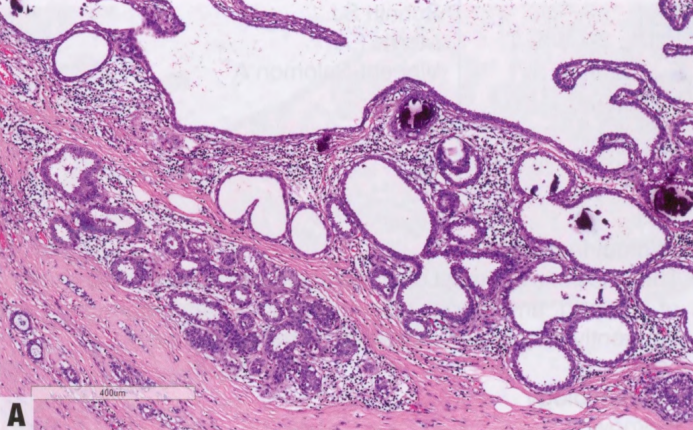
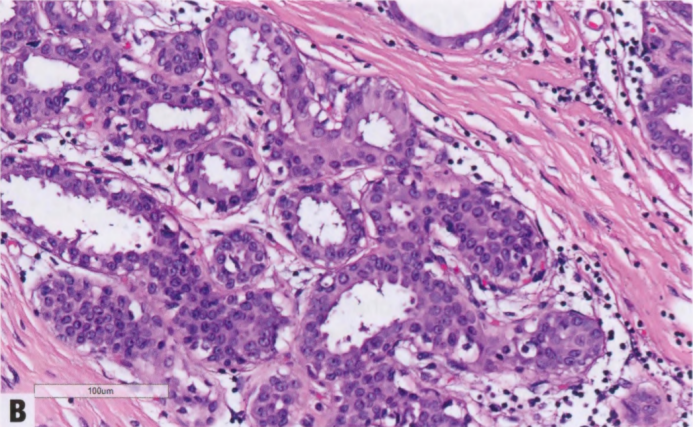
图2.04 FEA。A 小导管呈囊性改变,伴管腔钙化。B 更高倍显示立方形上皮细胞,具有顶端胞质突起,圆形、稍增大的空泡状核,轻度核异型性,可见核仁。
使用既定标准,柱状细胞改变/增生能够可靠地区分FEA。FEA的特征是TDLU的固有上皮细胞被一到几层轻度非典型立方形-柱状细胞所取代,常有顶端胞质突起。偶见细胞丛或小丘,但没有完好的拱形、上皮桥和微乳头结构。受累TDLU的腺泡呈不同程度的扩张,通常轮廓光滑,可能含有分泌物或絮状物质,通常含有微钙化。核呈圆形,均匀,有不明显的核仁显,就像低级别DCIS的核。受累TDLU的小叶内间质中可能存在淋巴细胞浸润。CCL和FEA的细胞总是呈ER弥漫强阳性核染色,而CK5/6等高分子量CK阴性。CCL和FEA通常伴有其他良性改变,如囊肿和IDL。这些病变与小叶肿瘤(LCIS和ALH)之间存在强相关,FEA通常伴有ADH、低级别DCIS和低级别浸润性癌症,特别是TC和ILC。这些观察结果,结合这些病变的共同分子改变,支持低级别乳腺肿瘤途径的存在。
细胞学
10例FNA描述了CCL,表现为平铺的细胞片段,核增大,细胞边界清晰,胞质细颗粒状,异型性从轻微到严重不等。其细胞学特征与乳头状肿瘤和高分化腺癌有很大重叠。因此,FNA不能可靠地诊断CCL。
诊断分子病理学
与临床无关
诊断标准
柱状细胞改变和柱状细胞增生
必要标准:TDLU腺泡增大、扩张,通常轮廓不规则;衬覆柱状细胞,核均匀、细长,染色质均匀分散,核仁不明显,垂直于管腔的基底膜;柱状细胞增生时细胞复层化或细胞丛>2层。
FEA
必要标准:TDLU伴腺泡扩大,轮廓更圆;由一层到几层轻度非典型的立方到柱状细胞组成,类似于低级别DCIS的单形性核。
分期
与临床无关
预后和预测
柱状细胞改变和增生的后续癌症风险略有增加(相对风险:约1.5)。然而,与这些病变相关的风险并不明显独立于与伴随的增殖性病变相关的危险。来自一些小型回顾性研究和一项大型流行病学研究的数据提示,一些FEA病例可能进展为浸润性乳腺癌,尽管进展的风险似乎非常低,并且这种病变与ALH和ADH相关的癌症风险不相同。因此,FEA的管理方式不应与ADH或ALH相同。小型回顾性研究提示,多达30%的粗针活检FEA患者在手术切除时病变更严重。然而,鉴于研究设计的局限性和报道的升级率差异很大,在粗针活检确诊FEA后是否需要常规手术切除尚不确定。如果活检后的乳房X线照片显示所有放射学微钙化都已被清除,则可能不需要手术切除。建议采用放射病理学相关性来指导这些病例的进一步治疗。
Atypical ductal hyperplasia
非典型导管增生(ADH)
定义
ADH是一种IDL,其细胞学和结构特征与低级别DCIS相似,但在结构、TDLU受累程度和邻近范围方面不够DCIS标准。
ICD-11编码
没有
ICD-11编码
GB20.Y其他特定良性乳腺疾病
相关命名
可接受:非典型导管内增生。
不推荐:非典型增生(仅用于无法确定导管与小叶时)。
亚型
没有
部位
ADH通常发生在TDLU。也可能发生在乳头状瘤和FA等病变中,罕见于大输乳管内。
临床特征
ADH最常见于乳房X线筛查发现的微钙化,少见于其他原因切除的组织样本的偶然发现。没有放射学特征有助于将与ADH相关的钙化与柱状细胞改变/增生或低级别DCIS等其他病变中存在的钙化区分开来。一般来说,包括ADH在内的IDL也可能是乳腺MRI上非肿块增强的原因。ADH通常不会表现为肿块,除非它累及乳头状病变或FA等形成肿块的病变。
流行病学
ADH的诊断频率随着乳房X线筛查的开展而增加,但在最近几十年维持稳定。ADH现在占筛查人群中乳腺活检诊断的2-14%。
病因
ADH是雌激素驱动的过程,其风险因素类似于ER阳性IBC。
发病机制
对ADH和低级别DCIS杂合性缺失的研究提示,存在类似的遗传学异常,为这些是相关的克隆过程提供了证据。目前癌症发病机制的模型将包括ADH在内的许多高危病变置于管腔型/ER阳性浸润性疾病的低级别途径中。ADH视为低级别DCIS和ER阳性、低级别浸润性导管癌发展过程中的一个非常早期的肿瘤步骤。在ADH和低级别DCIS中,等位基因失衡的频率相似,并且存在类似的杂合性缺失的复发区域,包括1q、16q和17p上的位点。
大体表现
ADH肉眼无法识别。
组织病理学
ADH是一种IDL,其细胞学和结构特征类似于低级别DCIS,但只累及部分导管腔,和/或均匀累及导管腔但范围局限。常有微钙化。细胞学特征包括均匀分布的单一细胞,圆核,染色质致密。没有中、高级别核特征。坏死极少见。细胞边界清晰。有些ADH病例中,ADH细胞夹杂不均一的细胞群,或伴有其他良性增殖性病变。
结构特征包括厚度均匀的僵硬上皮桥、棒状和拱形;球茎状微乳头(基部狭窄,尖端宽阔);以及筛状模式。ADH的实性和佩吉特样模式较少见,很难区分经典型LCIS。如果具有低级别DCIS细胞学和结构特征的IDL均匀地累及导管腔,那么大小/范围标准来区分ADH和DCIS。Page等人提出2个受累导管腔为阈值,<2个受累导管腔归入ADH。Tavassoli和Norris提出,连续范围≤2mm的病变归入ADH。这些阈值是人为制定的,应作为一般准则使用。由于这两个标准都是根据切除活检的结果而制定的,因此应谨慎应用这些标准。
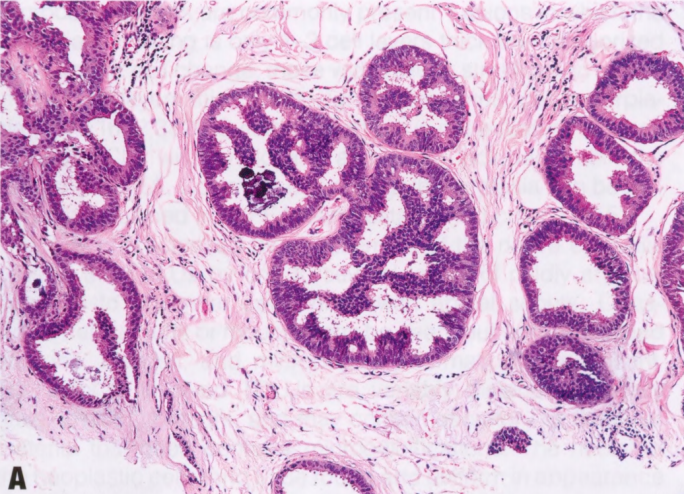
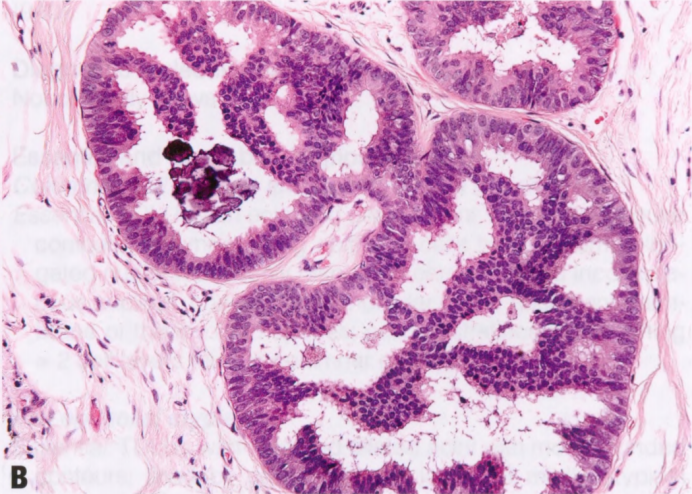
图2.05 ADH。A ADH谱系范围内的结构改变。横穿导管腔的僵硬上皮桥,以及较小的拱形。B 较高倍显示早期的球茎状微乳头,僵硬上皮桥和拱形结构。细胞单一,低级别。这些发现符合ADH。
WHO肿瘤分类编辑委员会建议,当发现范围有限的病变时,特别是在粗针活检中,可能无法看到整个病变时,采取保守的方法。正在等待临床试验结果。由于ADH代表了一系列非典型结构模式(从FEA到低级别DCIS),其诊断可能存在问题。ADH活检的诊断一致性低(40-60%),而高级别DCIS、浸润性癌和良性乳腺病变的诊断一致率高得多。诊断的差异通常与专业意见和诊断阈值的细微差异有关,当在免疫组化的帮助下进一步寻求的共识或第二次复片时,这种可变性可能降低。

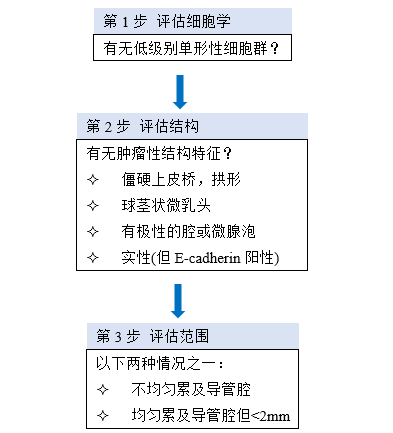
图2.06 IDL中ADH的诊断评估过程。
ADH通常呈ER弥漫强阳性,高分子量CK(如CK5/6)阴性。这种染色模式类似于低级别乳腺肿瘤途径中的其他病变(包括CCL、FEA和低级别DCIS)。相反,UDH中ER和高分子量CK呈异质性染色。
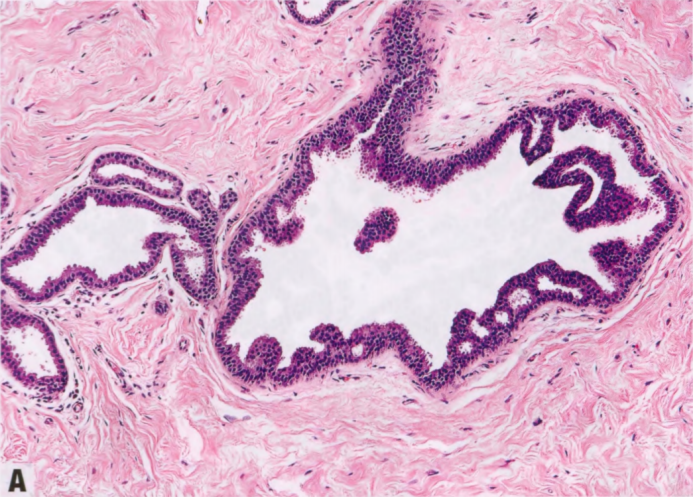
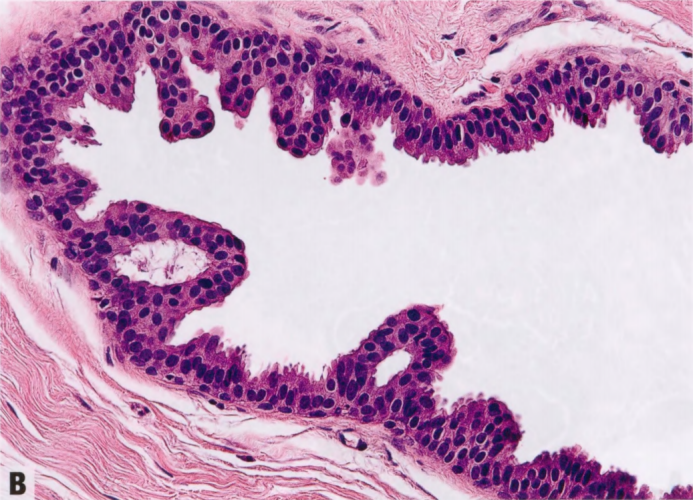
图2.07 ADH。A IDL伴早期肿瘤结构形式,如,累及部分导管腔的拱形和微乳头。B 较高倍显示拱形和微乳头的低级别单形性细胞学。这些发现符合ADH。
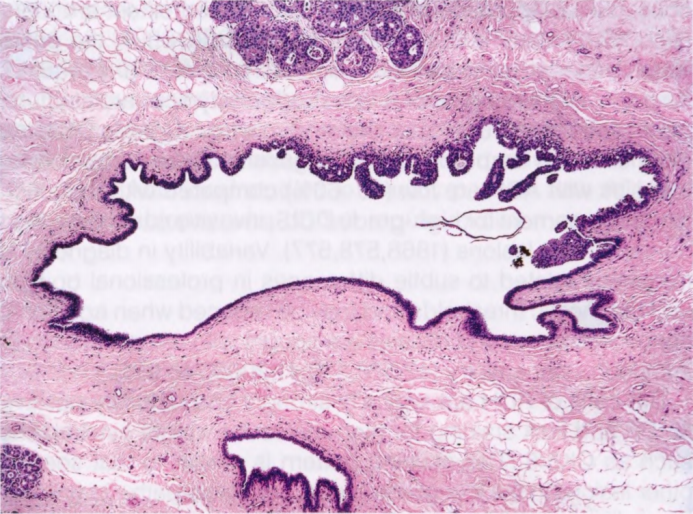
图2.08 ADH。导管内增生,部分累及导管腔,形成细长的球状微乳头。部分累及单个导管(如果低级别)符合ADH。
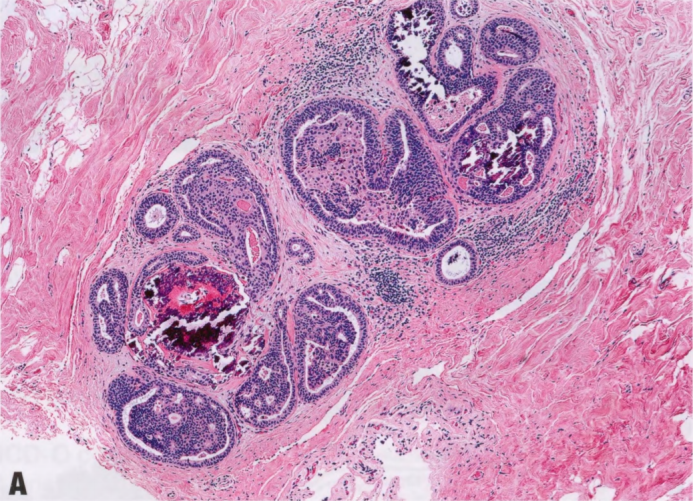
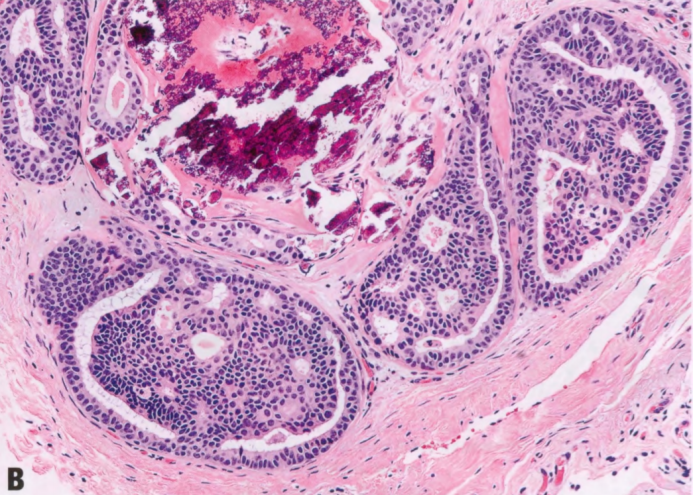
图2.09 ADH。A和B IDL显示早期筛状结构,含有极化管腔和单一细胞。受累面积≤2.0mm,符合ADH
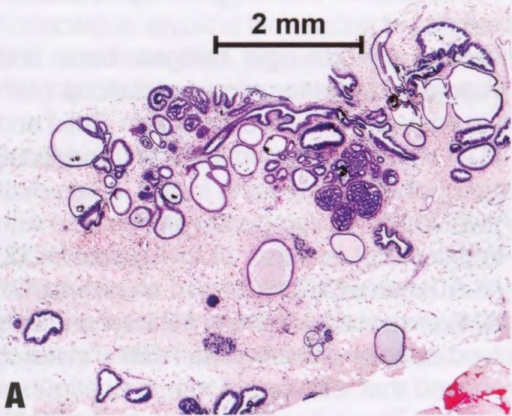
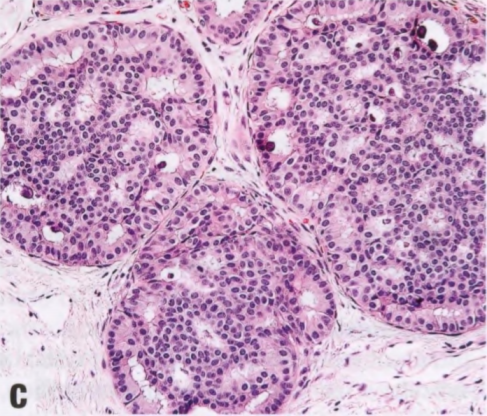
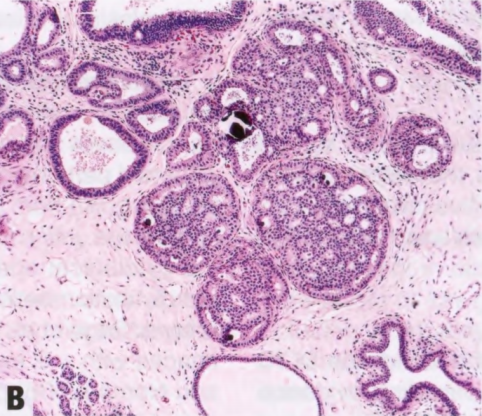
图2.10 ADH。A-C 粗针活检中的IDL,具有低级别DCIS的单形性细胞学和筛状、极化管腔,但范围有限(≤2.0mm),在粗针活检中最好归入ADH。
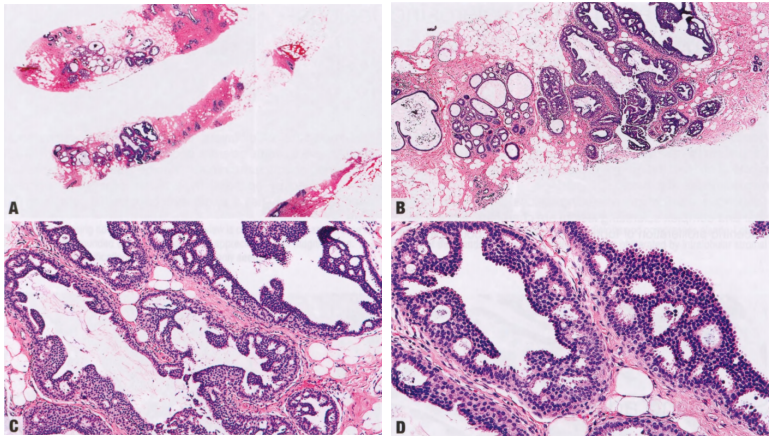 图2.11 ADH。A-D 一例粗针活检,含有低级别DCIS细胞学和结构特征的IDL,但导管受累的程度和范围的处于交界状态(接近2mm,ADH标准的上限)。粗针活检宜诊断ADH而不是低级别DCIS。
图2.11 ADH。A-D 一例粗针活检,含有低级别DCIS细胞学和结构特征的IDL,但导管受累的程度和范围的处于交界状态(接近2mm,ADH标准的上限)。粗针活检宜诊断ADH而不是低级别DCIS。
细胞学
无法在细胞学标本上诊断ADH,因为区分这种病变与低级别DCIS需要细胞学、结构和范围的结合。
诊断分子病理学
与临床无关
诊断标准
必要标准:
细胞学特征:类似于低级别DCIS的低级别单一细胞,均匀的圆核,分布均匀,胞界清晰。
结构特征:厚度均匀的僵硬上皮桥、棒状或拱形;或球茎状微乳头(基部狭窄,尖端宽阔);或筛状模式(不应只是平坦模式)。
范围:多个管腔的部分累及;或均匀累及管腔但连续范围≤2mm。
理想标准:
细胞均为ER阳性,CK5/6阴性。
分期
与临床无关
预后和预测
ADH伴有任一乳房IBC的风险增加3-5倍,但一些研究发现同侧乳房的风险更高。诊断为ADH后,至少25年内患癌的绝对风险约为每年1%,诊断后至癌发生的平均潜伏期为8-12年。几十年来,风险缓慢增加,并且(在一些但不是所有的研究中)显示,随着ADH病灶的数量增加,风险也会增加。三苯氧胺等激素药物可显著降低未来患浸润性疾病的风险。
对于在粗针活检中发现的ADH,报道的DCIS或IBC的升级率不一致;在具有仔细放射学病理学相关性的更现代的研究中,这一比例为10-20%。很少有可用的前瞻性研究使用了选择性标准来避免对一些粗针活检诊断的ADH患者进行切除,但事件罕见,目前随访有限。正在进行其他研究,以确定在粗针活检中不需要切除的ADH患者。

































共0条评论