往期回顾:
乳腺肿瘤WHO分类学习笔记(连载1)
乳腺肿瘤WHO分类学习笔记(连载2)
乳腺肿瘤WHO分类学习笔记(连载3)
乳腺肿瘤WHO分类学习笔记(连载4)
2.4 上皮-肌上皮肿瘤
简介:乳腺上皮-肌上皮肿瘤是由上皮细胞和肌上皮细胞组成的双相肿瘤。良性上皮-肌上皮肿瘤是PA和AME。恶性上皮-肌上皮肿瘤包括AdCC和恶性AME,其中恶性成分可能来自管腔上皮、肌上皮或两者。AdCC放在“罕见和涎腺型肿瘤”章节中。
Hamperl于1970年首次描述了乳房的AME,其形态与涎腺上皮-肌上皮癌相似。有人建议第5版考虑将乳腺术语与涎腺的术语统一,而涎腺不存在良性对应物(乳腺AME将被称为上皮-肌上皮癌)。然而,乳腺AME表现出一系列组织学模式,许多肿瘤具有良性临床行为,尽管有局部复发、恶性转化和转移的报道,包括罕见的组织学良性肿瘤转移的个案报道。最近的遗传学数据也证实了乳腺AME的形态异质性,ER阳性AME显示PIK3CA或AKT1激活突变,而ER阴性肿瘤则携带HRAS突变。考虑到切除后通常是惰性过程,以及如果术语统一被“癌”取代,可能过度治疗,因此决定保留“AME”一词,但承认一些肿瘤可能伴有恶性改变,应该通过仔细的组织学检查来确定。此类肿瘤应被称为恶性AME(AME伴癌),并描述相应的恶性成分,这将有助于适当的治疗。
上皮-肌上皮肿瘤中的肌上皮细胞可用免疫组化来证明,因此必需熟悉可用于检测的抗体的范围、敏感性和特异性。表2.01列举了肌上皮抗体,包括它们的交叉反应。建议使用有限的一组肌上皮标记物(如SMMHC和p63),而不是依赖于单一标记物。一些靶抗原不太稳定,固定不佳可能丢失。SMA等标记物虽然对肌上皮的特异性较低,但更为稳健,有助于评估固定不佳标本中的肌上皮细胞。肌上皮细胞抗体的选择也可能取决于所评估的病变,因为部分病例中,一些抗体可能不如其他抗体有用。例如,p63可用于区分CIS和浸润性癌,肌上皮细胞在CIS中保留,在浸润性癌中丢失,但在证实UDH方面,它不如高分子量CK有用。良性硬化性病变和DCIS中的肌上皮细胞可能在免疫表型上与正常肌上皮细胞不同,腺泡肌上皮细胞的肌丝发育较差,可能与导管肌上皮细胞的染色存在差异。
表2.01检测肌上皮细胞的抗体
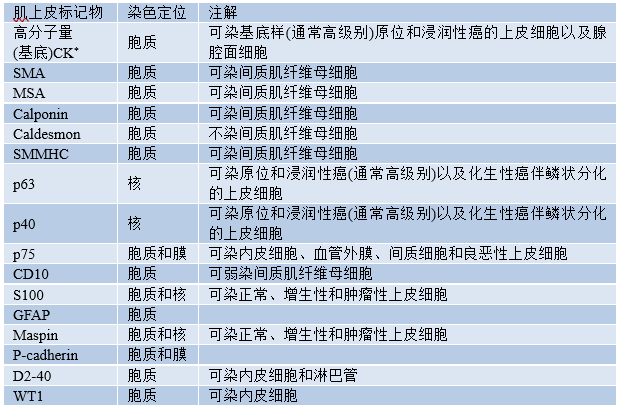
* 包括CK5,CK5/6,CK14,CK17。
Pleomorphic adenoma
多形性腺瘤(PA)
定义
PA是一种良性肿瘤,其上皮和肌上皮成分的细胞形态和结构表现各异,位于软骨黏液样间质内。
ICD-11编码
8940/0 PA
ICD-11编码
2F30.Y&XPI2KC1其他特定的乳腺良性肿瘤&PA
相关命名
没有
亚型
没有
部位
乳房PA通常发生在乳晕后方。
临床特征
PA表现为结节,主要累及成年女性。罕见病例累及男性患者。在乳房X线和超声检查中,PA表现为边界清晰的圆形病变,类似于FA。伴导管内生长的PA可表现为囊性病变。放射学诊断有时因微钙化而变得复杂,可能怀疑恶性肿瘤。
流行病学
PA在涎腺最常见,而乳腺罕见。乳腺PA主要是个案病例报道或小系列。因此,确切的发病率数据尚不清楚。
病因
未知
发病机制
涎腺中出现的PA显示PLAG1和HMGA2的重排。目前没有关于乳腺PA分子改变的数据。
大体表现
PA表现为实性结节,质硬,边缘清晰。大小通常为1-2cm。长期结节可以更大。
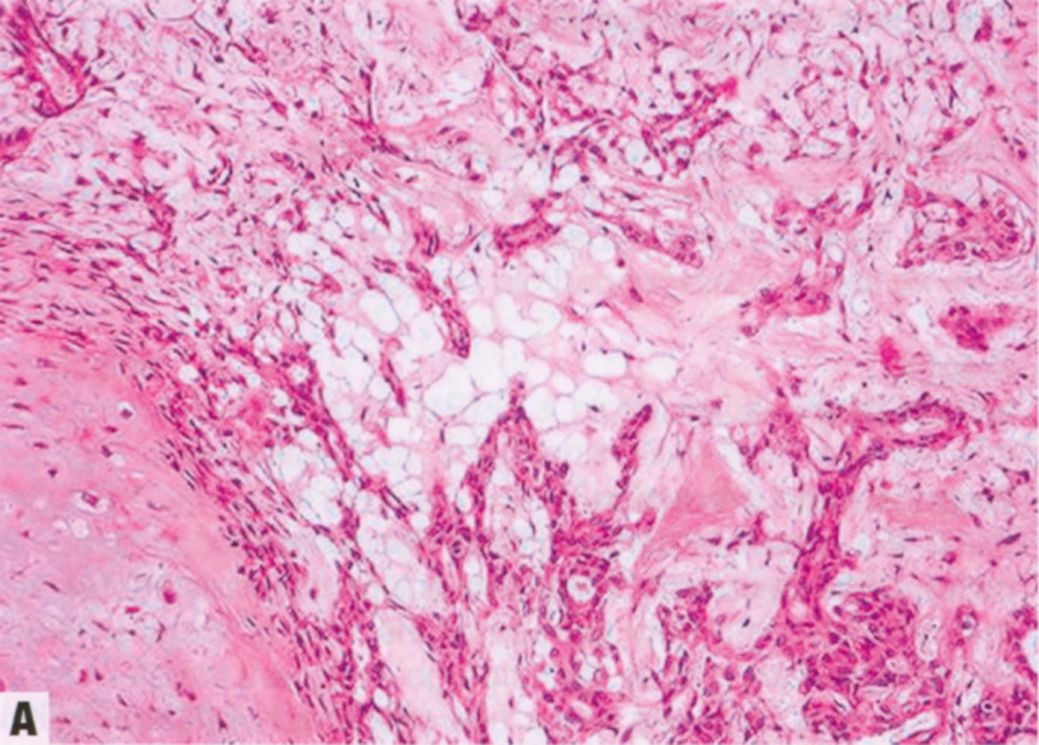
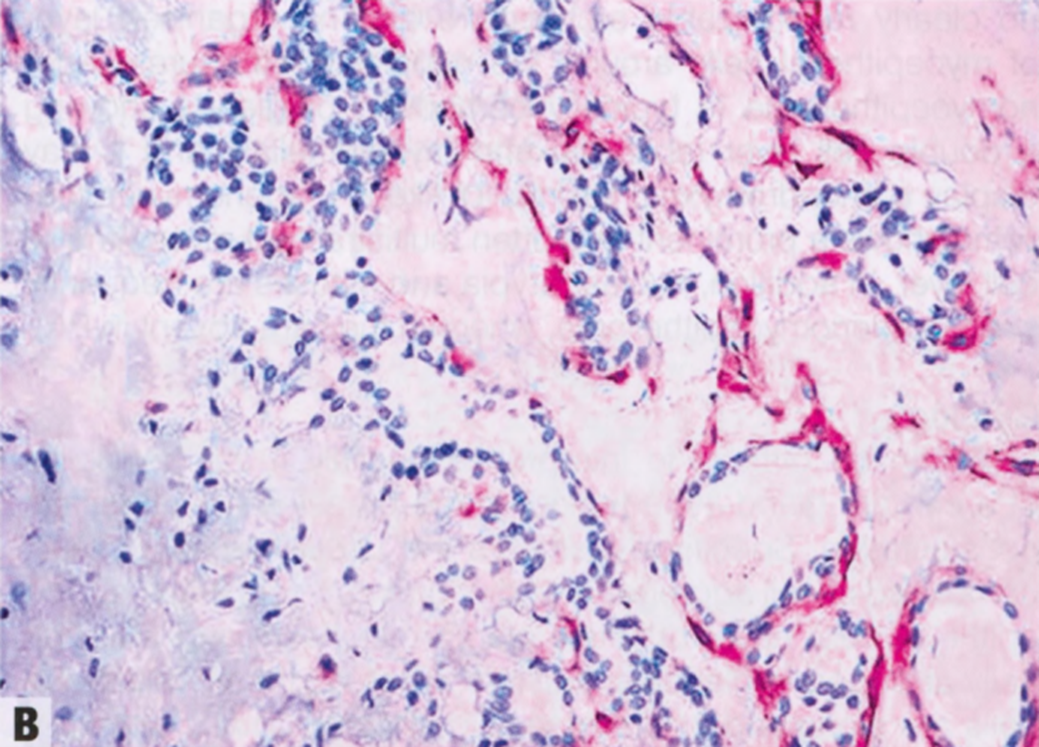 图2.28 PA。A PA由腺体组成,腺体内层为上皮细胞包围,外层有一圈薄的肌上皮细胞。单个星状细胞分散在间质中。B 肌上皮细胞标记物,如SMA,有助于识别外周的薄层肌上皮细胞。
图2.28 PA。A PA由腺体组成,腺体内层为上皮细胞包围,外层有一圈薄的肌上皮细胞。单个星状细胞分散在间质中。B 肌上皮细胞标记物,如SMA,有助于识别外周的薄层肌上皮细胞。
组织病理学
乳腺PA组织学特点类似涎腺PA。上皮细胞和肌上皮细胞的肿瘤性增殖,形成腺体结构和渗入黏液软骨样间质的条状结构。此外,还存在单个星状细胞。肿瘤腺体由内层上皮细胞和外层肌上皮细胞组成。多边形、卵圆形和星状细胞组成的条状结构主要含有肌上皮细胞。无细胞异型性、坏死或非典型核分裂象。间质通常粘软骨样,偶见软骨或骨化生。PA可以表现为导管内生长,有时类似于DA。部分病例中,PA显示息肉样导管内生长,导致多结节结构。此外,一些病例伴有DA的典型特征,提示这两种病变之间存在关联。
核异型性和核分裂象,而PA中则没有。
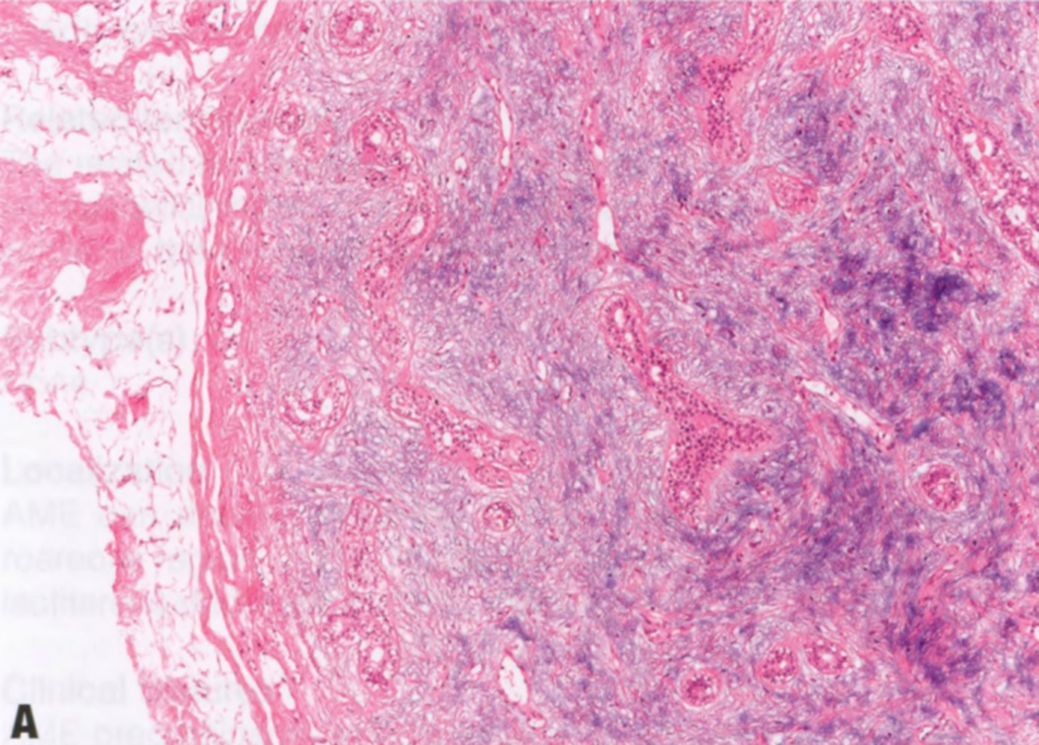
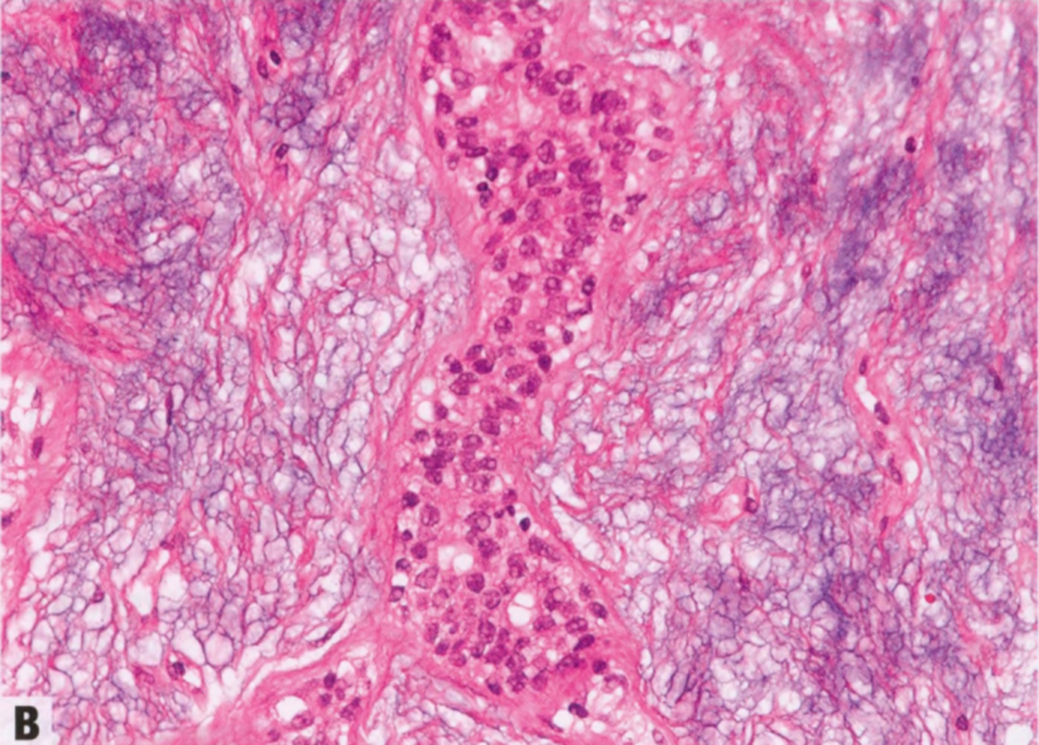 图2.29乳腺PA。A 乳腺PA与涎腺腺瘤具有相同的特征。低倍观,有纤维假包膜,腺体和细胞渗入黏液软骨样间质中。B 较高倍,软骨黏液样间质中的腺体和细胞。
图2.29乳腺PA。A 乳腺PA与涎腺腺瘤具有相同的特征。低倍观,有纤维假包膜,腺体和细胞渗入黏液软骨样间质中。B 较高倍,软骨黏液样间质中的腺体和细胞。
免疫染色显示上皮细胞和肌上皮细胞的双重成分。具体而言,肌上皮标志物,包括SMA、calponin、p63和CK14,通常在构成肿瘤腺体和肿瘤条索外层的细胞中呈阳性。相比之下,纯管腔细胞标记物,包括低分子量CK和EMA,标记上皮成分。
鉴别诊断包括具有黏液和黏液样间质的肿瘤(如MC和产生基质的化生性癌)和双相肿瘤,如AME。MC很容易排除,因为它由肿瘤上皮细胞组成,缺乏肌上皮,并且漂浮在上皮型黏液中。产生基质的化生性癌的鉴别可能细微。PA缺乏细胞异型性、非典型核分裂象和坏死。PA腺体具有良好的双相模式,外层为薄而连续的肌上皮细胞,内层为规则的上皮细胞。相比之下,产生基质的化生性癌具有非典型细胞并聚集成巢(并有频繁的非典型核分裂象),没有明显可的组织结构,肿瘤结构不围绕肌上皮细胞层。AME通常由显示双细胞层(上皮和肌上皮)的腺体组成,可能显示软骨黏液样间质。与PA不同,AME显示出明显且通常为多层的肌上皮细胞层。此外,AME中经常出现核异型性和核分裂象,而PA没有。
细胞学
细针穿刺很难判读,特别是如果不考虑乳腺涎腺型肿瘤的可能性。具体来说,涂片通常高度细胞丰富,由细胞聚集和软骨黏液样物质组成。上皮细胞具有圆形、饱满的胞质,通常排列成腺簇,而肌上皮细胞细长或浆细胞样。Giemsa染色可见异染软骨黏液样物质。非典型性、核分裂象和坏死的缺失对于区分PA和产生基质的化生性癌至关重要。
诊断分子病理学
与临床无关
诊断标准
必要标准:边界清晰;腺体有双层细胞(上皮和肌上皮),没有异型性或核分裂象,黏液软骨样背景。
分期
与临床无关
预后和预测
乳房PA良性。复发可能发生在以广泛息肉样导管内生长为特征的病例中,这些病例在手术时没有完全切除。涎腺的PA可以发生恶性转化。迄今为止,只有一篇论文描述了乳腺PA的恶性转化:Hayes等人报道了3例与PA密切相关的原位和IBC,其中一例导致患者死亡。
Adenomyoepithelioma
腺肌上皮瘤(AME)
定义
AME是一种双相肿瘤(通常良性),其特征是衬覆两种上皮的小腺腔增殖,内层为导管上皮细胞,外层为不同程度增大且明显可见的肌上皮细胞。两种上皮都可能发生恶性转化。
ICD-11编码
8983/0 AME-NOS
ICD-11编码
2F30.Y&XH2V57其他特定的乳腺良性肿瘤&AME,良性
相关命名
涎腺对应病变目前称为上皮-肌上皮癌,其组织学类似于ER阴性的乳腺AME。
亚型
没有
部位
乳腺实质和乳晕后方都可能发生AME。累及大的输乳管时,可能出现乳头溢液。
临床特征
AME主要累及老年女性,高峰年龄>60岁,但据报道,年龄范围很广,罕见病例累及男性患者。AME通常表现为可触及的结节,有时很大(达10cm)。乳腺癌筛查发现了较小的病变。在极少数情况下,AME可能伴有遗传学综合征,如神经纤维瘤病1型。
流行病学
AME罕见,真实发病率未知。在连续2078例经粗针活检诊断的乳腺肿瘤中,Cheung等人发现了一例AME(0.048%)。
病因
未知
发病机制
AME的遗传学驱动因素因ER状态而异。PIK3CA热点突变发生在两种亚型中(>50%),而AKT1热点突变可能仅限于ER阳性病例,高度重现性(>60%)的HRAS p.Gln61热点突变可能限于ER阴性病例。值得注意的是,HRAS p.Gln61热点突变也经常出现在涎腺上皮-肌上皮癌。CDKN2A的纯合性缺失也是ER阴性AME中的重现性突变,并且伴有并发癌的AME。
大体表现
AME通常表现为边界清楚的结节,伴推挤性边界。偶见囊性或乳头状区域。
组织病理学
经典型AME的腺体结构含有双层细胞:腺腔面的上皮细胞和外层肌上皮细胞。AME呈现出各种结构模式,包括分叶状、乳头状和管状,在同一病例中经常混合出现。低倍,AME显示多个分叶状轮廓和中央硬化区。主要肿块的周围可能出现小的卫星结节。
管状AME由相对均匀的小导管结构组成,有腺腔面上皮细胞层,外层围绕着明显的肌上皮细胞。梭形细胞AME的特征是梭形肌上皮细胞显著生长,包围并挤压由上皮细胞衬覆的腺体结构,有时难以辨认。分叶状AME显示肌上皮主为的肿瘤细胞巢,周围是致密的透明变化硬化胶原间质样物质,可能是基底膜物质过多所致。间质有时可能黏液样,甚至软骨样,就像PA间质。
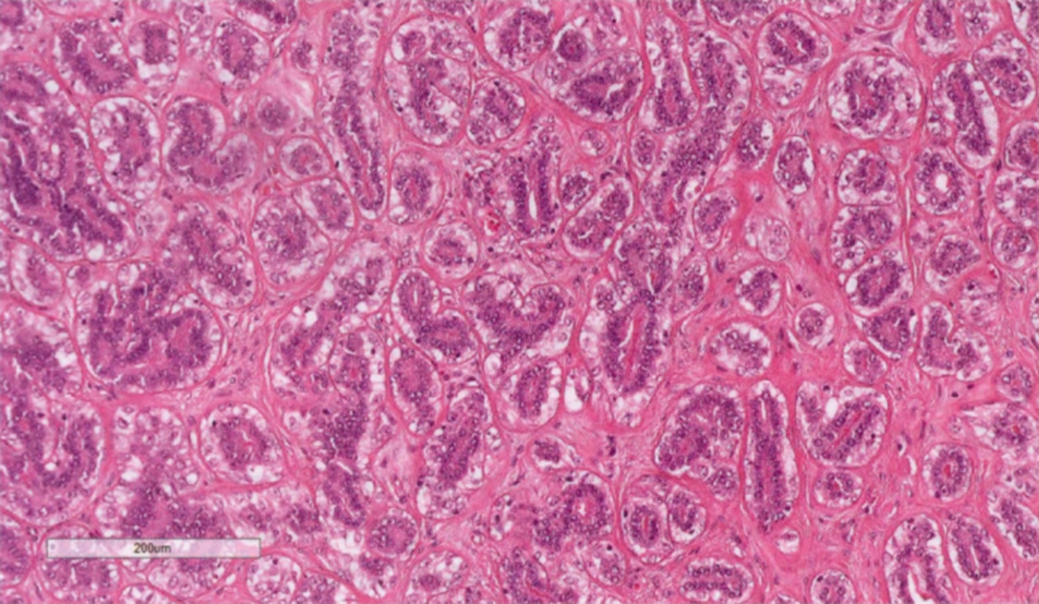 图2.31 AME伴管状生长。小管内衬一层上皮细胞,外层是明显的透明肌上皮细胞。
图2.31 AME伴管状生长。小管内衬一层上皮细胞,外层是明显的透明肌上皮细胞。
有时会出现IPa生长合并典型乳头状瘤或DA的特征。主要肿瘤结节周围的扩张导管中可能观察到乳头状成分。管腔面细胞显示大汗腺化生,HE染色很明显,GCDFP-15阳性。偶见鳞状分化或皮脂腺分化。肌上皮细胞可有多种形态特征,常有透明胞质(糖原),呈梭形、肌样或浆细胞样形状。AME偶见胶原小球样病灶。术前粗针活检诊断的数据有限。诊断应基于经典的双相上皮-肌上皮模式,并应注意排除其他病变,如IPa。
AME应鉴别多种良恶性乳腺病变。与正常小叶、结节性腺病或普通IPa相比,AME中的肌上皮细胞更多、更丰满、更大。管腔面细胞可有相当大的细胞异型性,成巢和受挤压的条索,因此像癌。AdCC和AME之间可能存在形态学重叠。尽管这两种病变都可以表达MYB,但AdCC常见MYB重排而AME未见。导管和肌上皮成分都可见核分裂象。
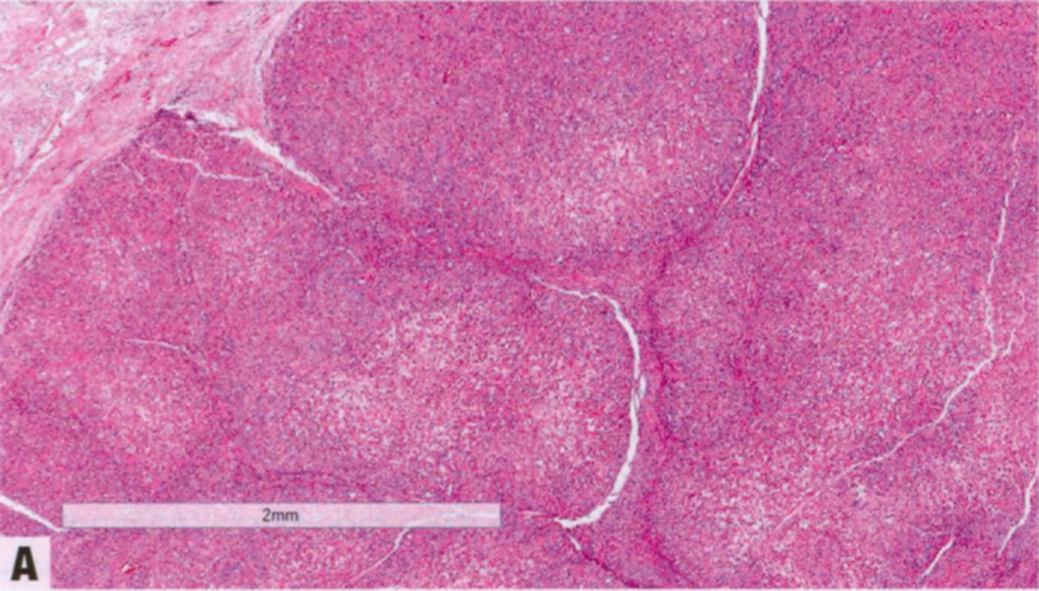
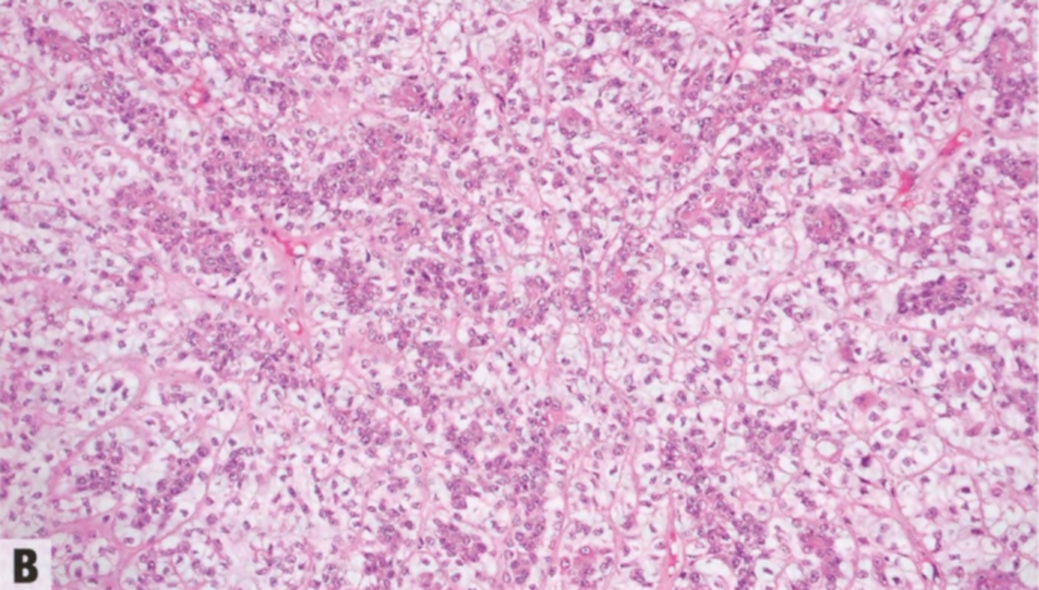 图2.30 AME。A 低倍,AME可出现分叶状边缘。B 肌上皮细胞有时会很明显,掩盖上皮成分。
图2.30 AME。A 低倍,AME可出现分叶状边缘。B 肌上皮细胞有时会很明显,掩盖上皮成分。
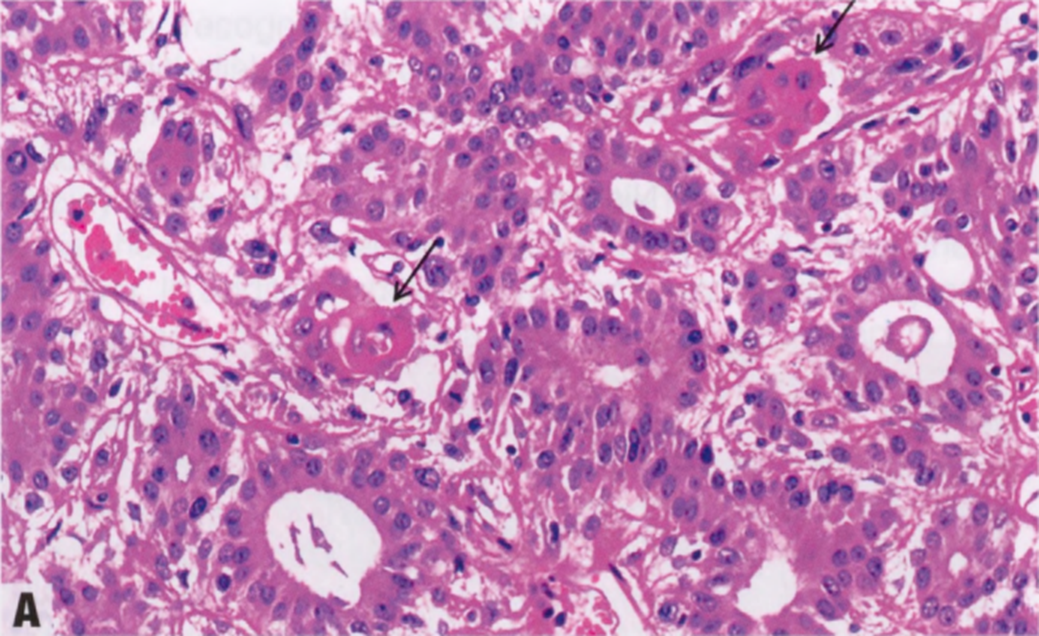
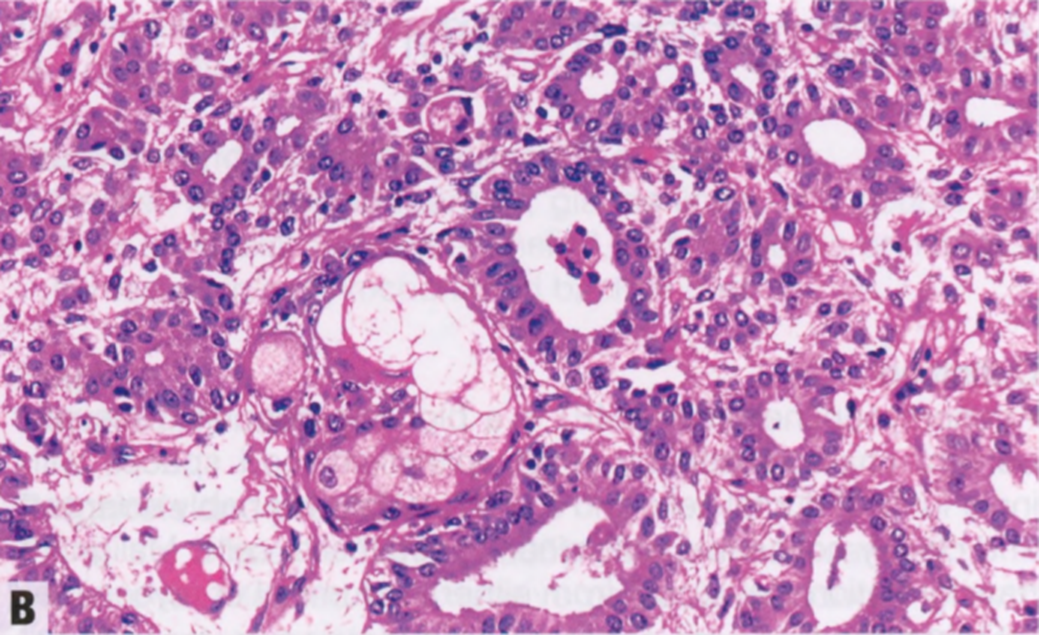 图2.32 AME。在极少数病例中,可以看到局灶性鳞状分化(A,箭头)或皮脂腺分化(B)。
图2.32 AME。在极少数病例中,可以看到局灶性鳞状分化(A,箭头)或皮脂腺分化(B)。
乳头状结构为主的AME可能难以区分IPa伴肌上皮增生。管状AME中的腺管样增生形成边界清楚的结节状肿块,而腺病中管状增殖边界欠清。腺管外围绕胞质透明的肌上皮细胞,这种形态学与涎腺上皮-肌上皮癌相同。肌上皮细胞增多增大,管状AME因此可区分TA。
免疫组化可显示两种细胞。然而,AME中肌上皮细胞的模式染色变化多端,不可预测。高分子量CK可能表现出独有的特征性矛盾染色模式,内层上皮细胞呈弥漫性阳性,外层肌上皮细胞呈阴性。
ER和PR可能局部阳性,主要表达于上皮细胞,而低级别导管癌常见弥漫强阳性。在一项包括43例AME的系列研究中,39%的病例完全不表达激素受体,并与核异型性、坏死和/或核分裂象活性增加有关。
细胞学
FNA涂片通常高度细胞丰富,由均匀的导管细胞组成,其中散布着肌上皮细胞,并有散在的肌上皮细胞来源的条纹状梭形核。这种细胞学特征应鉴别FA、纤维囊性改变和乳头状瘤。识别大量肌上皮细胞对于AME的诊断非常重要。肌上皮细胞中的非典型性,加上细胞数量的增加,可能是一个陷阱并导致假阳性诊断。细胞块或粗针活检标本的免疫组化很有帮助。
诊断分子病理学
与临床无关
诊断标准
必要标准:双相肿瘤,腺体有双层细胞(内层上皮细胞和外层明显的肌上皮细胞)。
分期
与临床无关
预后和预测
大多数经典型乳腺AME表现为良性临床过程,完全手术切除可治愈。然而,有记录显示,缺乏组织学异型性或增殖率增加的病例发生了远处转移。罕见转移性良性组织学病例的分子特征尚待研究。显示广泛导管内生长或卫星结节的病例可能因多结节生长而复发。由于转移病例少且可能发生恶性转化,AME可能更适合视为低度恶性潜能的肿瘤。组织学恶性转化的病例称为恶性AME(见恶性AME,第46页)。
Malignant adenomyoepithelioma
恶性腺肌上皮瘤(AME-M)
定义
AME-M是一种伴有癌的腺肌上皮癌(AME),其恶性成分可能来自管腔上皮或肌上皮成分,也可能两都是恶性(此时称为“上皮-肌上皮癌”)。
ICD-11编码
8983/3 AME伴癌
8562/3 上皮-肌上皮癌
ICD-11编码
2C6Y&XH7TL5乳腺恶性肿瘤&AME伴癌
相关命名
可接受:腺肌上皮癌。
亚型
AME伴癌;上皮-肌上皮癌
部位
正如良性对应物,AME-M可累及任何乳房象限。
临床特征
AME-M最常累及老年妇女。男性或年轻人没有病例报道。一些患者可能出现长期肿块,最近肿块迅速增大。一例发生于1型神经纤维瘤病已有报道。
流行病学
AME-M罕见,发病率尚无报道。目前只有个案和小系列病例报道。
病因
未知
发病机制
AME-M典型的恶性成分进行遗传学研究,提示源于先前存在的经典AME的恶性转化,但不能排除从头发生的AME-M。AME-M的遗传学数据有限。AME的常见遗传学驱动因素,即PIK3CA和HRAS p.Gln61热点突变,也存在于AME-M中。HRAS p.Gln 61突变与ER阴性、组织学不典型的AME有关,常见于伴有癌的患者。纯合CDKN2A缺失可能与ER阴性AME的恶性转化有关。AME-M中未见TP53突变,而传统型ER阴性乳腺癌常见TP53突变。
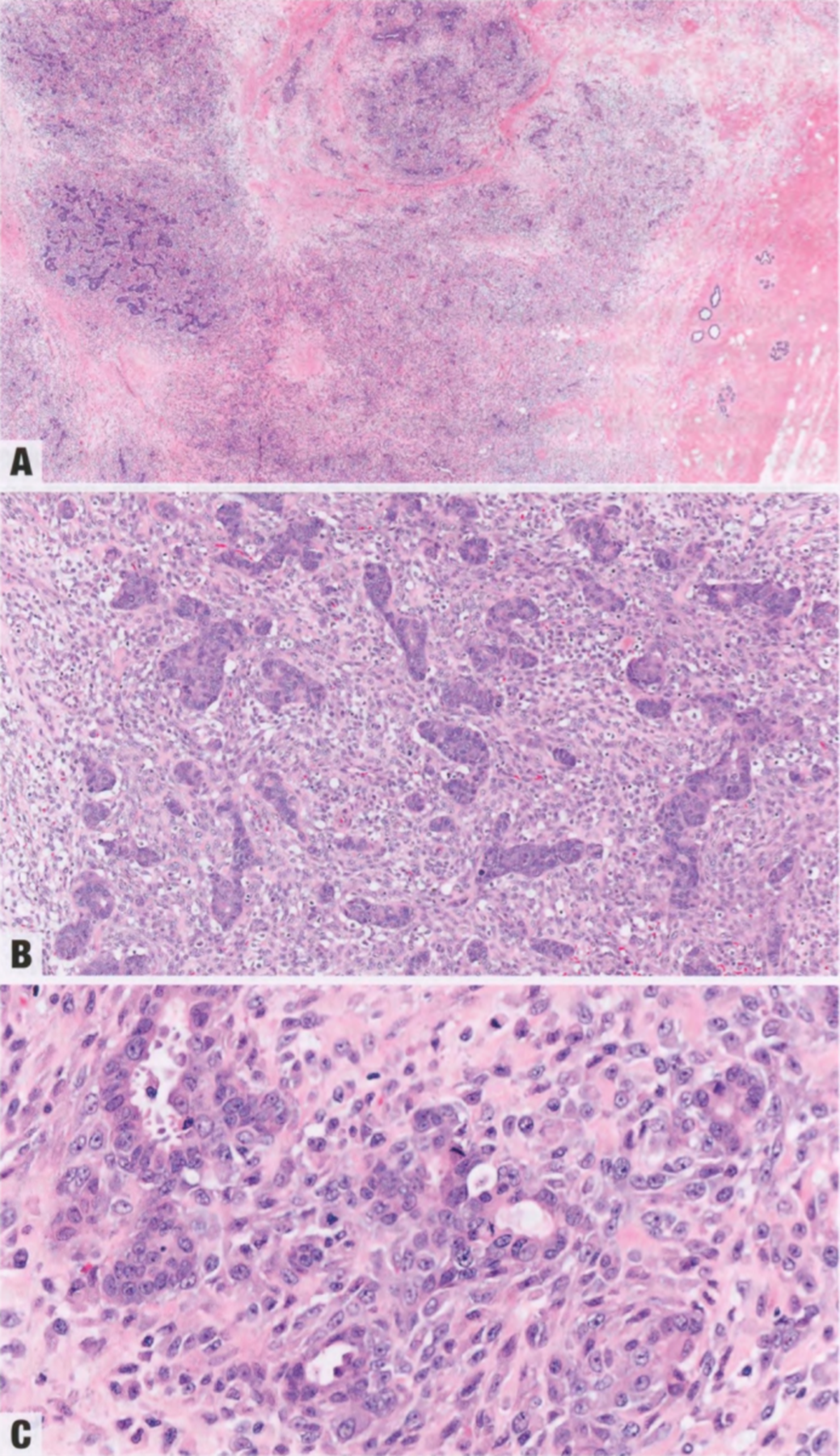 图2.33恶性AME。A 低倍显示不规则的边缘。B 较高倍,上皮和肌上皮细胞异型性都很明显。本例肌上皮超过上皮细胞。C 可见非典型核分裂象。
图2.33恶性AME。A 低倍显示不规则的边缘。B 较高倍,上皮和肌上皮细胞异型性都很明显。本例肌上皮超过上皮细胞。C 可见非典型核分裂象。
大体表现
恶性成分全是原位时,AME-M可能类似于经典型AME的多分叶状肿块。存在浸润性恶性肿瘤时,AME-M可有各种大体表现,呈浸润性边界;质硬、有弹性或肉样质地;呈灰色至黄白色。少数病例显示囊性变和坏死。大小各不相同,在长期病变中更大。
组织病理学
AME-M可以呈现广泛的形态特征。在管腔上皮和/或肌上皮成分发生恶变的AME中,可以识别AME的组织学外观,观察到向癌的转变,表现为细胞异型性、核分裂象增加和恶性成分坏死。当恶性转化主要累及上皮成分时,它可能包括IBG-NST、ILC和特殊类型癌的特征。当恶性转化主要累及肌上皮成分时,肌上皮细胞癌的特征占主导地位;此类病例的特征是梭形或上皮样肌上皮细胞过度生长,胞质透明或嗜酸性,核异型性和频繁的核分裂象。
浸润性癌成分属于化生亚型并不罕见;鳞状细胞癌、低级别腺鳞癌、梭形细胞癌、癌肉瘤和产生基质的癌都有报道。这些病例应广泛取样来寻找AME成分。
罕见恶性肿瘤累及上皮和肌上皮成分,导致由恶性上皮和肌上皮细胞混合组成的双相癌,后者通常是主要的细胞类型。低倍,多叶或多结节生长,罕见乳头状结构。可辨认经典型良性AME和AME-M特征之间的过渡。上皮-肌上皮癌显示管腔和肌上皮成分的恶性改变。具体而言,恶性区域的核分裂象计数增加。双相上皮-肌上皮性质,具有双重细胞类型,是与化生癌鉴别诊断的关键特征;免疫染色显示上皮和肌上皮细胞可能有助于诊断。核分裂象活跃的经典型AME可能难以区分AME-M。有人提出使用核分裂象计数;然而,其有效性和临床实用性尚未证实。
细胞学
AME-M的细胞学涂片高度细胞丰富,具有松散粘附的肿瘤细胞,就像IBC-NST。Giemsa染色显示异染间质,有助于鉴别诊断。间质物质围绕着肿瘤细胞巢,而AdCC的间质排列成球状。
诊断分子病理学
AME-M可能是ER阳性或ER阴性,经典AME的恶性转化更常见ER阴性。ER状态在经典和恶性成分中可能是一致的,但已有报道称ER阴性癌与ER阳性AME相关。未检测到HER2扩增。
诊断标准
恶性AME:
必要标准:伴发经典AME的恶性肿瘤,其管腔上皮或肌上皮成分(或两者)均为恶性。
上皮-肌上皮癌
必要标准:管腔上皮和肌上皮成分均为恶性,核分裂象活性高,无论是否存在可识别的良性AME。
分期
AME-M根据其他类型IBC采用的标准进行分期。
预后和预测
报道的病例数量相对较少,随访时间较短,限制了AME-M预后特征的可用信息。转移可能在初次诊断后几年出现,也可能在没有非典型组织学特征的AME中出现(见AME,第43页)。
由于这些病例罕见,上皮和肌上皮成分(上皮-肌上皮癌)恶性转化病例的预后难以评估。血源性扩散似乎比淋巴性扩散更常见,肺和脑是最常见的转移部位。
AME-M合并浸润性癌的预后取决于浸润性疾病的组织学亚型。鉴于该成分最常见的是化生癌,预后可能较差,肺部是最常见的转移部位。然而,腺鳞癌的病例显示较好的结果。AME-M与浸润性癌的遗传学特征及其预后可能与与AME无关的相同亚型浸润性疾病的遗传学特征不同。
淋巴结转移罕见,没有足够的数据提示腋窝淋巴结清扫术。然而,按浸润性疾病管理可能是谨慎的。
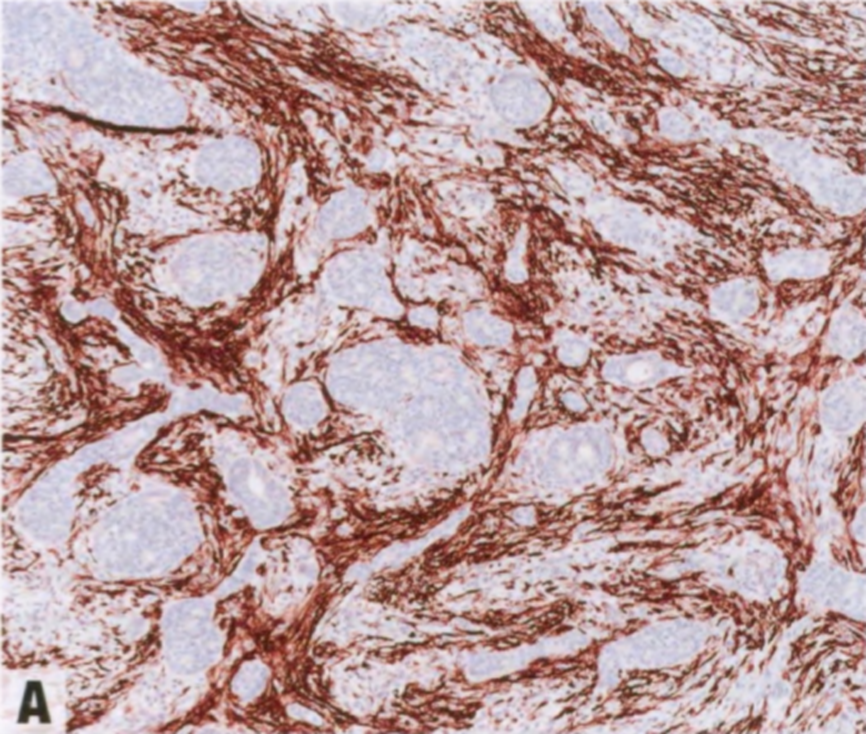
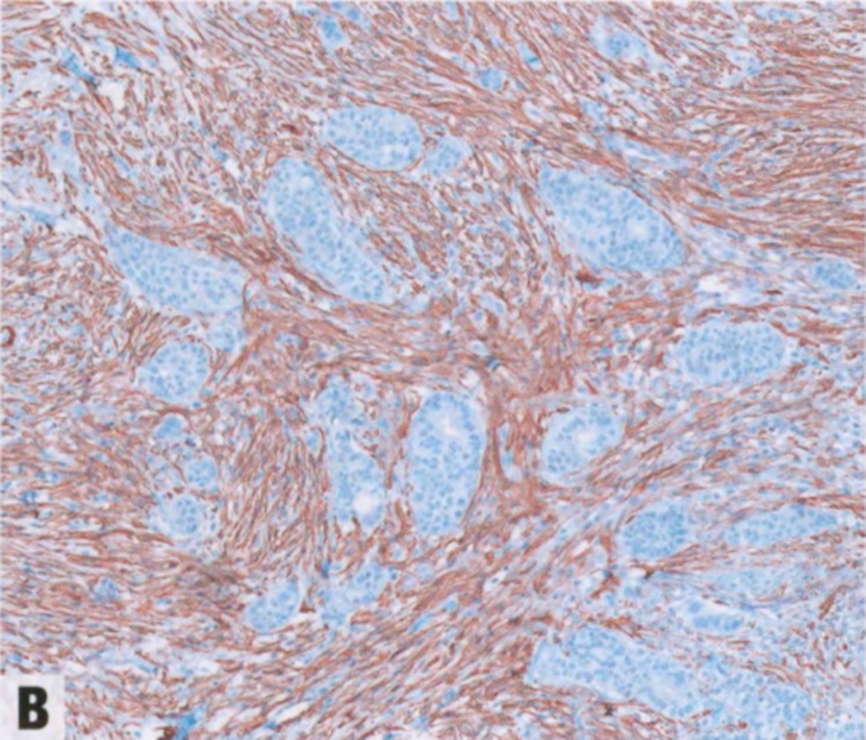
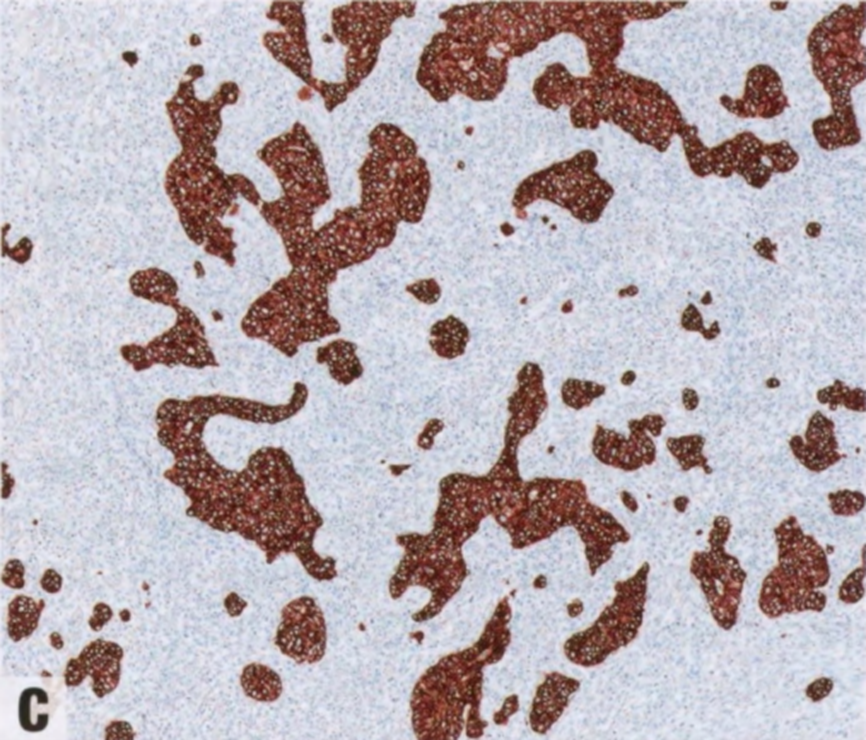 图2.34恶性AME。免疫染色显示上皮和肌上皮成分。CK14(A)和SMA(B)显示肌上皮细胞,低分子量CK(C)显示上皮成分
图2.34恶性AME。免疫染色显示上皮和肌上皮成分。CK14(A)和SMA(B)显示肌上皮细胞,低分子量CK(C)显示上皮成分
未完待续......



























共0条评论