[导读] 编译:张波
摘要:CIC-重排肉瘤是一种罕见的小圆细胞肉瘤。肿瘤通常位于深部软组织,年龄范围分布广,具有高度侵袭性,对化疗反应差,并且比尤文肉瘤的预后更差。CIC-重排肉瘤具有特征性和可识别的组织学形态,圆形/上皮样瘤细胞呈分叶状生长,局灶性黏液样变,细胞核轻度异型。免疫组化ETV 4和WT 1核阳性表达。CIC融合可以运用较多方法检测;然而,即使是下一代测序也可能存在不完美的敏感性,尤其对于CIC::DUX 4融合情况可能检测不到。
前言
尤文肉瘤是小圆细胞肉瘤的典型肿瘤,具有FET基因家族成员EWSR 1基因重排和ETS转录因子家族成员的基因融合。近来研究显示,不具有FET:ETS基因融合的未分化小圆细胞肉瘤已被确认为“尤文样肉瘤”。随后的分子病理学和表型研究已确定“尤文样肉瘤”不是一个单一的实体,而是包括几种与尤文肉瘤不同类型的肿瘤。最新的WHO分类新增3种此类肿瘤类型:包括CIC-重排肉瘤、具有BCOR遗传变异的肉瘤和具有EWSR 1::非ETS融合的圆细胞肉瘤。CIC-重排肉瘤是最常见的类型,约占尤文样肉瘤病例的60%-70%。尽管肿瘤由CIC重排定义,但分类并不仅仅基于基因表型,因为CIC-重排肉瘤在显微镜下表现出特有的组织学和免疫组织化学特征。此外,CIC融合的分子检测即使使用下一代测序(NGS)也可能检测不到。基于此,根据最新的WHO软组织和骨肿瘤分类,CIC融合的检测对于诊断并不是强制性的。
本文综述了CIC-重排肉瘤的现状,重点是组织学和免疫组化特征和诊断缺陷,包括分子检测中的假阴性结果。
肿瘤发现的历史背景
CIC-重排肉瘤可能长期被归类为尤文样肉瘤和其他未分化肉瘤类别中。1992年发表的两篇文章描述了染色体t(4;19)(q35.1;q13.1)和t(4;19;12)(q35;q13.1;q13)变异分别发生在“胚胎性横纹肌肉瘤”和“未分化/胚胎性横纹肌肉瘤”中。随后的一些研究显示,具有未分化圆细胞组织学和局灶性黏液样特征的高度侵袭性儿童肉瘤显示t(4;19)(q35;q13.1)变异。然而,直到2006年Kawamura-Saito和其同事在2例具有t(4;19)(q35;q13)的“尤文样肉瘤“中鉴定出CIC::DUX 4融合转录物时,CIC-重排肉瘤才被广泛认识。此后,文献报道了200多例CIC-重排肉瘤。Sugita及其同事描述了第1例CIC::FOXO 4融合突变型肉瘤。基于CIC::DUX 4肉瘤的重叠表型以及转录组和DNA甲基化特征,目前确定CIC::NUTM 1融合肉瘤是CIC-重排肉瘤的一种变体,而不是NUTM 1重排肿瘤。
分子发病机制
CIC(19q13.2)编码转录抑制因子CIC,其与ATXN 1和ATXN 1 L形成复合物。CIC蛋白包括HMG盒DNA结合结构域,其识别T(G/C)AATG(A/G)A。CIC重排一致地发生在外显子内,最常见于外显子20内,很少发生在外显子12、15、16、18或19。断裂点处的碱基序列通常含有微同源序列和/或插入。在某些情况下,CIC与DUX 4的非翻译区融合,导致在断裂点后立即产生终止密码子。在CIC融合产物中,CIC的C末端丢失,而HMG盒DNA结合结构域保留。因此,CIC的抑制功能转变为反式激活,CIC靶基因异常过表达,包括PEA 3家族基因(ETV 1、ETV 4和ETV 5)、CCND 2和MUC 5AC等。
DUX4是最常见的CIC融合伙伴基因(-95%)。DUX4位于4q35和10q26中亚端粒区域的D4Z4重复序列内。DUX 4在早期胚胎发生中起重要作用,但在成熟的体细胞组织中转录沉默,睾丸和胸腺除外。DUX 4::IGH融合及DUX 4过表达可导致青少年和年轻人急性B细胞淋巴细胞白血病的复发。除DUX 4外的CIC融合伙伴基因还包括NUTM 1(15 q14), NUTM 2A(10 q23), LEUTX(19 q13),FOXO 4(Xq 13), CREBBP( 16 p13),AXL(19 q13),CITED 1(Xq 13),SYT(9 q22)和其他未注释区域。 CIC融合伙伴基因通常含有转录激活结构域。
其他复发但不一致的遗传突变包括MYC扩增、8号染色体三体和1p缺失。核型通常很简单,但有时更复杂,特别是在化疗后更常见。
临床特征
CIC-重排肉瘤可发生于任何年龄,最常见于中位年龄为33岁的年轻人,男性稍多。原发部位为深部软组织(-85%),包括四肢和体腔。浅表肿瘤部位主要为皮肤。肿瘤不常见于内脏器官(-10%),受累脏器包括中枢神经系统(CNS)、心脏、肺、胸膜、肾脏、子宫和胃肠道。与尤文肉瘤不同,原发性骨的病例罕见(-5%)。CIC::NUTM1肉瘤易发于中枢神经系统和椎旁区域,常累及骨。CIC-重排肉瘤具有高度侵袭性,通常(-40%)诊断时常已发生肺和淋巴结等多处转移。
影像学特征
MRI检查显示,CIC-重排肉瘤常是深部肿块,有时也可是较表浅的肿物,通常为巨大分叶状(图1A)。特征性表现包括显影增强、坏死、病灶周围水肿和空洞。研究显示,常无钙化,平均SUVmax为13.2。
大体特征
大体上,CIC-重排肉瘤为棕白色的柔软或肉质外观,通常表现为周围分叶状生长,伴有大量中央坏死和出血(图1B)。
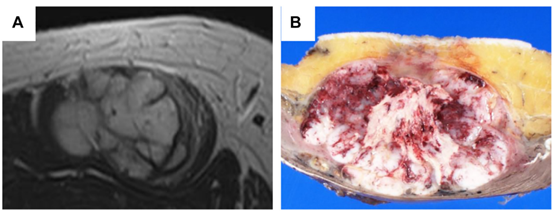
图1.CIC-重排肉瘤的影像学和大体检查。MRI T2加权像上,CIC-重排肉瘤表现为信号不均匀的巨大分叶状肿块(A)。大体上,CIC-重排肉瘤表现为棕白色肉质外观,伴分叶状生长、大量坏死和出血(B)。
镜下特征
在低倍镜下,肿瘤被纤维结缔组织分割成叶状(图2A和B),地图状坏死和出血常见(图2C)。典型瘤细胞呈弥漫性片状生长(图2D),局灶性黏液样变伴网状或筛状是特征性表现(图2E)。肿瘤可局灶性显示梭形细胞的束状形态(图2F)。高倍镜下,肿瘤由相对均匀的小圆形细胞组成,细胞核轻度异型性(图3A),染色质呈空泡状,核仁常可见。可局部观察到上皮样(图3B)和横纹肌样(图3C)细胞。细胞质轻度嗜酸性,偶尔透明(图3D)。很少能观察到与尤文肉瘤完全一致的小圆细胞形态(图3E)。核分裂活跃(图3F)。局部可见黏液样改变及网状或筛状结构和上皮样细胞。胞浆嗜酸性小球和软骨分化罕见。新辅助治疗后,瘤细胞可能显示出明显的多形性。
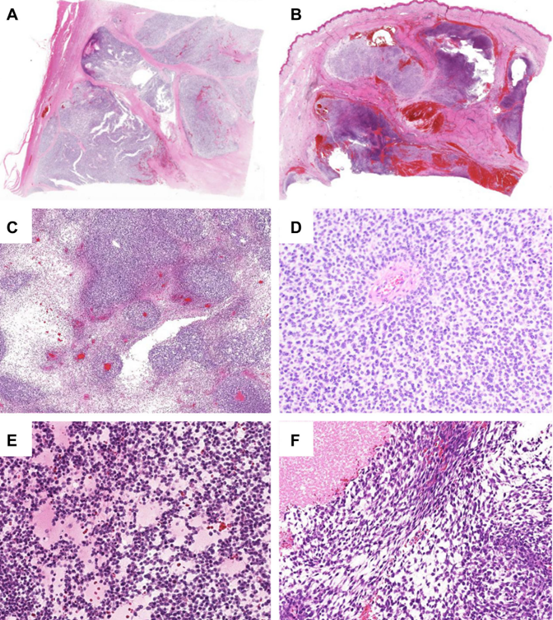
图2.CIC-重排肉瘤的组织学表现。在低倍镜下,肿瘤呈分叶状生长,由纤维组织分割(A)。常见局部坏死和出血(B,C)。圆形肿瘤细胞呈弥漫片状生长(D)。局灶性黏液样改变伴特征性网状或筛状生长(E)。局部可观察到梭形瘤细胞束状生长(F)。
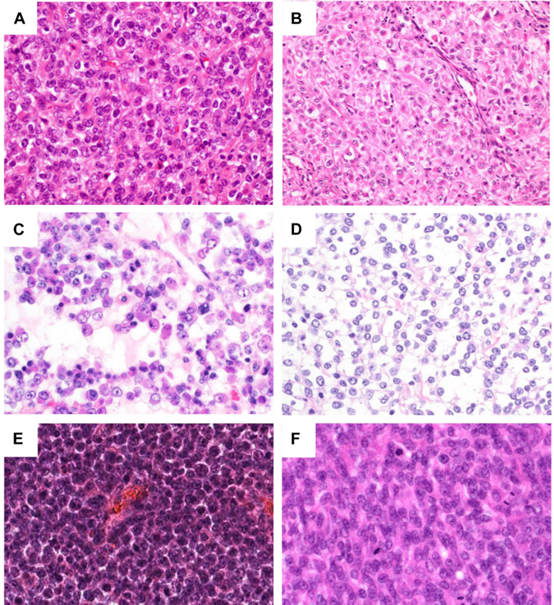
图3.CIC-重排肉瘤的组织学表现。在高倍镜下,圆形肿瘤细胞具有相对均匀且最低程度多形性的泡状核,具有明显的核仁和嗜酸性至嗜两性细胞质。肿瘤可能表现为圆形(A)、上皮样(B)和/或横纹肌样(C)细胞形态。偶尔可见细胞质稀少(D)。肿瘤很少表现出与尤文肉瘤(E)难以区分的均匀小圆细胞形态。核分裂象较多(F)。
免疫组织化学特征
大多数CIC-重排的肉瘤CD99阳性,然而,染色通常是异质性的(图4A),不像在尤文肉瘤中观察到的典型弥漫性强膜阳性。ETV4是唯一最有用的诊断标记物,在小圆细胞肉瘤中敏感性和特异性为90%~95%(图4 B)。WT 1核阳性是另一个有用标记物,其在70%~95%的病例中可观察到阳性(图4C),通常伴有细胞质染色。其他阳性标志物还包括DUX 4 。CIC::NUTM 1肉瘤还可显示NUT蛋白的弥漫性核表达(图4D)。NUT染色模式不同于BRD 4/3::NUTM 1癌斑驳状染色。
与其他融合驱动的肉瘤相似,CIC-重排肉瘤表现出一种“混乱”的免疫表型,这对诊断是一种挑战。角蛋白(图4E)和MUC4可呈局灶性阳性。 TLE1和钙视网膜蛋白常表达。 S100蛋白、结蛋白和突触素标记很少阳性。CIC-重排肉瘤还通常表达ERG,在一小部分病例中,CD31通常以异质性染色模式共表达(图4F)。NKX2.2、PAX7、BCOR、SOX 10、myogenin和CD45通常为阴性。
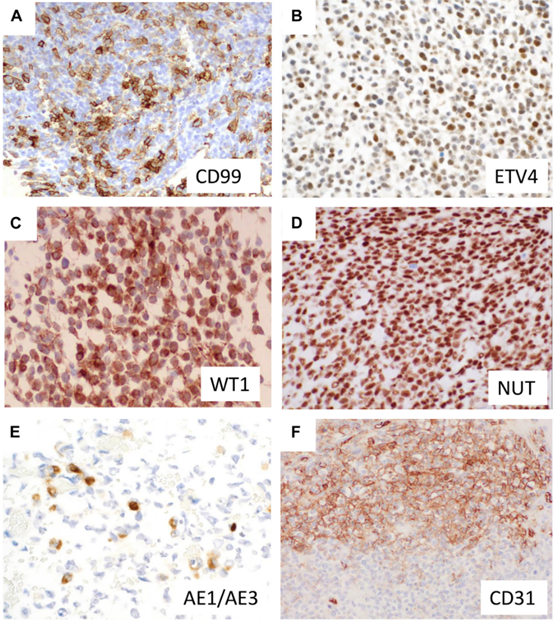
图4.CIC-重排肉瘤的免疫组织化学表现。尽管大多数CIC-重排肉瘤CD 99阳性,但染色通常为局灶性和异质性(A)。ETV 4是一种高度敏感和特异型标记物(B)。细胞核WT 1阳性,通常伴有细胞质染色,对CIC-重排肉瘤相对敏感和特异(C)。CIC ∷ NUTM 1-阳性实例显示弥漫性核NUT表达(D)。角蛋白可为局灶性阳性(E)。CD 31(F)和ERG可以以异质性方式共表达。
诊断性分子检测
荧光原位杂交(FISH)
CIC分裂FISH被广泛使用,因为它只需要一个未染色的薄切片,不需要伴侣基因。除了正常融合的5'/3'信号外,正分离模式通常由分离的5'和3'信号组成(图5A)。在<10%的情况下,可能会观察到孤立的5'信号,此时不应被视为阴性。与其他FISH一样在检测中都需要进行定量评估,并且应使用最佳的增殖阳性细胞率临界值(例如,20%)。不幸的是,CIC分离FISH不是一种高度敏感的方法;尽管存在CIC融合体,但14%-25%的病例产生阴性信号模式(图5 B)。这种假阴性FISH结果主要与CIC::DUX4相关。CIC::LEUTX也可能难以检测。
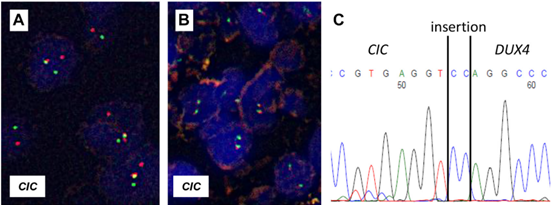
图5.CIC-重排肉瘤的分子检测。CIC分离FISH通常在CIC ∷ DUX 4肉瘤中显示分离信号(A,分离的绿色和橙色信号提示CIC重排)。然而,大约15%的CIC ∷ DUX 4肉瘤显示阴性FISH结果(B)。在这种特殊情况下(如B所示),RT-PCR可成功检测到CIC ∷ DUX 4融合转录物(C)。
逆转录多聚酶链式反应(RT-PCR)
RT-PCR也是一种广泛使用的检测方法(图5C)。然而,由于多个外显子内断裂点和非DUX 4融合伙伴,RT-PCR的灵敏度可能受到限制。此外,从FFPE块提取的片段化RNA可能妨碍融合转录物的可靠检测。
下一代测序
靶向RNA测序和全转录组测序是新兴的诊断工具。重要的是,当使用融合发现算法(例如FusionMap、FusionFinder、ChimeraScan、FusionSeq、STAR-Fusion、Manta-Fusion和TopHat-Fusion)分析测序数据时,尽管嵌合读段被映射到CIC基因上,但CIC::DUX 4融合通常不能被发现。鉴于此,CIC::DUX 4融合在NGS报告中不能读取,而是仅在特征性肿瘤表型提示在基因组查看器上仔细检查CIC读数后才被检测到。这些假阴性结果的原因可能是由于DUX 4序列的重复性质,嵌合读段被作为噪音过滤掉。相比之下,CIC::LEUTX,CIC::FOXO 和CIC::NUTM通常使用融合发现算法来检测。据报道,几种方法,如ArcherDX FusionTM,已经检测到CIC::DUX 4融合转录本。
鉴别诊断
(1)与尤文肉瘤相比,CIC-重排肉瘤中分叶状、局灶性黏液样改变、局灶性梭形细胞改变和显著的核仁明显更常见。肿瘤细胞比尤文肉瘤具有更多的多形性核和更丰富的胞浆。尤文肉瘤是典型的CD 99阳性的弥漫性强膜性模式,不像CIC-重排肉瘤的异质性染色。更特异性的尤文标记物NKX2.2和PAX 7通常在CIC-重排肉瘤中呈阴性,相反,尤文肉瘤对核WT 1和ETV4呈阴性。尤文肉瘤的遗传标志是EWSR 1/FUS和ETS家族基因之间的融合,如FLI 1和ERG。(2)具有BCOR基因改变的肉瘤通常表现为黏液样或血管间质背景,瘤细胞为均匀的椭圆形至梭形细胞,常呈BCOR和SATB 2阳性,ETV 4和WT 1阴性。(3)促结缔组织增生性小圆细胞肿瘤(DSRCT)表现为促结缔组织增生性间质中的圆形细胞巢,形态与CIC-重排肉瘤相似,DSRCT以角蛋白和结蛋白的表达为特征。虽然核WT 1(C-末端)在DSRCT中表达,但核WT 1(N-末端)表达缺乏。DSRCT由EWSR 1::WT 1融合驱动。(4)当黏液样改变以网状生长模式为主时,CIC-重排肉瘤可误诊为细胞外黏液样软骨肉瘤(EMC)。EMC通常发生在中老年患者中,EMC的诊断值得在儿童和年轻人中重新审视,特别是当肿瘤具有侵袭性时。EMC对ETV4和WT1呈阴性,但对S100蛋白和神经内分泌标志物呈阳性。EMC具有NR4A3融合体。(5)在CIC-重排肉瘤中以上皮样为主要形态时可能会误诊为癌或间皮瘤,尤其是在体腔活检中。因CIC-重排肉瘤也可表达CK、WT 1、calretinin、D2-40等间皮标记物,故当诊断小圆细胞恶性肿瘤时应谨慎使用这类抗体panel。相比前者,BAP 1缺失和HEG 1表达是间皮瘤的较好抗体,而claudin-4则对癌敏感。(6)在一小部分出血性裂隙样间隙和胞浆内空泡化的CIC-重排肉瘤中,ERG和CD31的共同表达可能被误诊为上皮样血管肉瘤。实际是CIC-重排肉瘤缺乏真正的血管结构,ERG和CD31在CIC-重排肉瘤中的表达是异质性的,通常是局灶性或弱表达,而不是像在血管肉瘤中观察到的均匀弥漫性强表达。(7)其他鉴别诊断包括横纹肌肉瘤和SWI/ SNF缺陷肿瘤,包括上皮样肉瘤。CIC-重排肉瘤始终缺乏myogenin和myoD 1标记,并始终保留SMARCB 1/INI 1和SMARCA 4/BRG 1表达。
治疗及预后
目前,尚未有最佳治疗策略。患者通常接受多模式治疗方案,包括手术、化疗和/或放疗。晚期患者倾向于接受化疗;然而,反应通常很差,与尤文肉瘤和其他高级别梭形细胞肉瘤的治疗效果没有显著差异。值得注意的是,有一些接受了尤文型治疗方案的患者可以长期存活。据报道,帕唑帕尼、派姆单抗和紫杉醇的反应也很差。
5年总生存率为17%-43%,中位生存期为12-18个月。CIC-重排肉瘤患者的预后明显差于尤文肉瘤患者。决定预后的因素尚未确定。
未来研究的领域
ATXN 1/ATXN 1 L重排肉瘤
近年来,在CNS中报道少量肉瘤在没有CIC融合的情况下表现出与CIC-重排肉瘤重叠的表型或DNA甲基化谱。尽管其中一些肿瘤在CIC基因中含有移码突变,但这些肿瘤中的大多数都含有涉及ATXN 1或ATXN 1 L的替代融合体,包括ATXN 1/ATXIN 1 L::NUTM 2A、ATXN 1::DUX 4和ATXN 1::NUTM1。 ATXN 1及其平行类似物ATXN 1 L通过其进化保守的AXH结构域与CIC形成转录抑制复合体,并在正常脑发育中发挥重要作用。ATXN 1/ATXN 1 L::NUTM 1/NUTM 2A/DUX 4融合蛋白保留了ATXN 1/ATXN 1 LAXH结构域形成复合物。这些肿瘤似乎以类似于CIC靶基因激活方式激活CIC靶基因。根据ATXN 1/ATXN 1 L重排肉瘤的重叠组织学、免疫表型和/或DNA甲基化特征,ATXN 1/ATXN 1 L重排肉瘤可能属于CIC重排肉瘤家族,这表明疾病概念谱系的扩展。
寻求新的治疗选择
CIC-重排肉瘤对现有的化疗方案反应不佳,迫切需要新的治疗策略。在临床前研究中已经研究的潜在有效的治疗方法包括硼替佐米(26 S蛋白酶体抑制剂),克唑替尼(一种多靶点酪氨酸激酶抑制剂), dinaciclib(CDK 2抑制剂),林西替尼(IGF-1 R抑制剂), BCI(DUSP 6抑制剂),iP 300 w(P300/CBP抑制剂),adavosertib(WEE 1抑制剂),dactolisib(AKT/ mTOR双重抑制剂)。
总结
CIC-重排肉瘤在以前被认为是相对常见的尤文样肉瘤。肿瘤具有特征性和可识别的组织学和免疫学特征,这些表型发现通常有助于诊断。CIC融合的分子检测,即使使用下一代测序,也可能提供假阴性结果。CIC-重排肉瘤侵袭性强,预后明显差于尤文肉瘤。


















共0条评论