往期回顾
乳腺肿瘤WHO分类学习笔记(连载1)
乳腺肿瘤WHO分类学习笔记(连载2)
乳腺肿瘤WHO分类学习笔记(连载3)
乳腺肿瘤WHO分类学习笔记(连载4)
乳腺肿瘤WHO分类学习笔记(连载5)
乳腺肿瘤WHO分类学习笔记(连载6)
2.6非浸润性小叶肿瘤
简介:术语“小叶肿瘤(LN)”是一组疾病谱,包括一组非典型上皮病变,起源于TDLU,特征为非粘附性单形性(通常小)细胞增殖,伴或不伴终末导管的佩吉特样受累。ALH和LCIS被广泛用于描述单个小叶单位的不同范围的受累。
Foote和Stewart于1941年首次使用“LCIS”进行了明确的临床病理描述。他们描述了LCIS细胞与ILC细胞之间的形态相似性。他们推断,LCIS可能是浸润性癌症发生的一个既定的前驱步骤,就像DCIS那样的方式。因此,在接下来的几十年里,LCIS患者常规接受乳房切除术治疗。在20世纪70年代末,Haagensen提议将整个病变谱称为“小叶肿瘤(lobular neoplasia)”,推翻了传统观念,认为LN代表一种良性增殖,应当视为任一侧乳房后续发生乳腺癌的风险因素。尽管LN术语本身未被普遍采用,但LN的概念模型导致了患者临床管理方式的重大转变。到20世纪90年代,LN患者的非手术治疗实践被完全采用,并一直持续到今天。也有人提出类似的“小叶上皮内肿瘤(lobular intraepithelial neoplasia)”一词,但在临床实践中未广泛使用。
LN的一些重要问题涉及适当的命名、缺乏特定的乳房X线异常、其作为风险指标或非必然前驱病变的作用、文献中关于其生物学和临床意义的相互矛盾的观点、形态变异、浸润性癌的发生风险,以及通过粗针活检诊断为LN的患者的最佳临床治疗方法。
Atypical lobular hyperplasia
非典型小叶增生(ALH)
定义
ALH是一种起源于TDLU的非粘附性小细胞的非浸润性肿瘤性增殖,伴或不伴终末导管的佩吉特样受累。TDLU中不到一半的腺泡被肿瘤细胞填充和扩张。
ICD-11编码
没有
ICD-11编码
没有
相关命名
可接受:小叶肿瘤。
不推荐:小叶上皮内肿瘤。
亚型
没有
部位
ALH通常是多中心和双侧发生。
临床特征
ALH缺乏临床和乳房X线征象。通常是其他病变的乳腺活检中显微镜下偶然发现。
流行病学
ALH在普通人群中的真实发病率尚不清楚。ALH存在于广泛年龄段的女性(平均年龄:约50岁),约占良性乳腺粗针活检的0.5-1.2%和缩乳术标本的1.6-2.9%。
病因
关于ALH的风险和易感因素的信息非常少。乳房X线密度高的女性比没有致密乳房的女性更有可能患有ALH。乳腺活检中CCL的存在与邻近乳腺组织中ALH的发生率较高有关,提示这些实体可能具有相似的风险因素。
发病机制
E-cadherin失活是小叶病变的标志,是ALH中已经存在的早期事件。通过介导细胞间粘附和维持组织完整性,E-cadherin充当肿瘤抑制因子。E-cadherin功能受损导致小叶细胞特征性的非粘附性生长。关于ALH的分子研究虽然稀少,但已提供证据提示ALH是一种克隆性肿瘤增殖。一项早期研究报道了ALH中11q13杂合性的丧失。通过染色体比较基因组杂交和阵列比较基因组杂交,在ALH中鉴定出7p、16p、16q、17p和22q的染色体物质缺失以及2p和6q的物质获得。这些改变多与并发的LCIS和/或浸润性癌相同,支持ALH是小叶癌途径中的早期病变,并提示ALH可能具有非必然前驱病变作用。最近一项使用全外显子组测序的研究提示,LCIS的基因组特征与ILC相似,81%的病变中存在CDH1突变。ALH的基因组结构可能与LCIS相似,包括频繁的CDH1突变。
大体表现
与临床无关
组织病理学
ALH显示非粘附性单形性上皮细胞的实性增殖,使TDLU中<50%的腺泡膨胀,伴或不伴终末导管的佩吉特样受累。在小叶腺泡未受累的情况下,有些ALH病例可能以佩吉特样模式累及导管。出于实用诊断目的,一些学者采用了以下两种方法作为腺泡膨胀的指南:(1)将受累腺泡的口径与相邻未受累小叶的腺泡口径进行比较——如果受累腺泡大于未受累腺泡,则认为其扩张;以及(2)估计受累腺泡中的细胞数量——如果受累腺泡横切面上有≥8个细胞,则认为它们已经膨胀。然而,用大小标准来定义膨胀缺乏科学证据。
增殖细胞有两种类型,单独或混合:A型细胞胞质稀少,核均匀一致、圆形、小到稍大(淋巴细胞核大小的1-1.5倍),核仁不明显;B型细胞具有更丰富的胞质和更大的核(是淋巴细胞核的大小的2倍)),大小和形状的变异更大,核仁更明显。A型和B型细胞之间的区分意义未知。常见胞质内空腔,呈印戒细胞样形态,但并非小叶肿瘤特有。
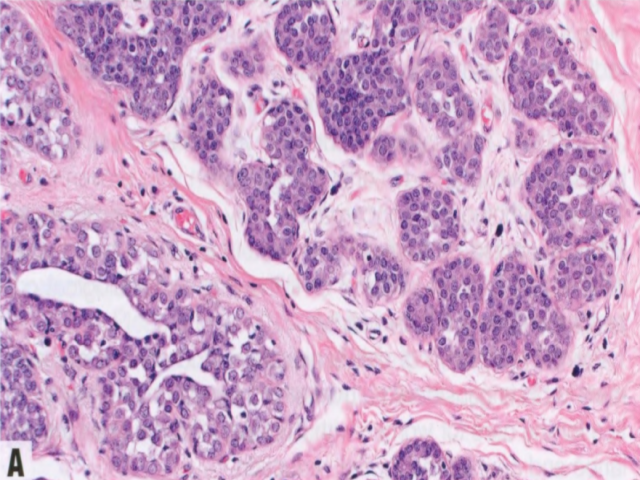
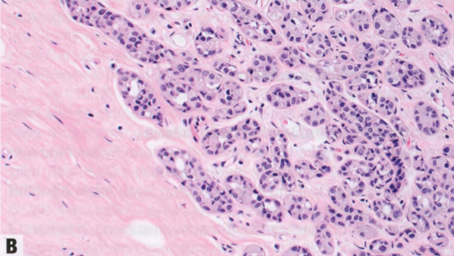
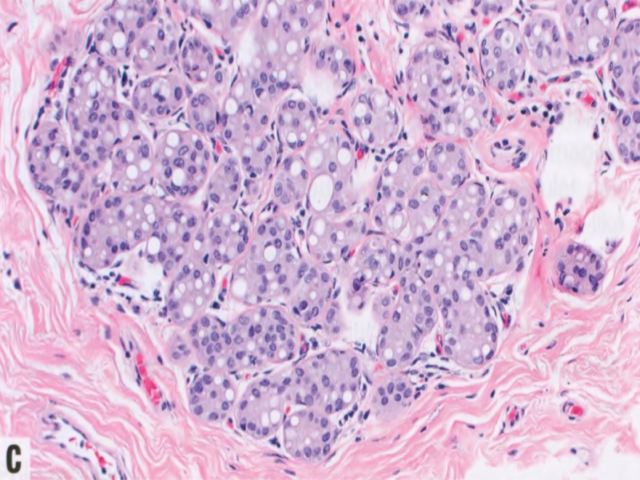
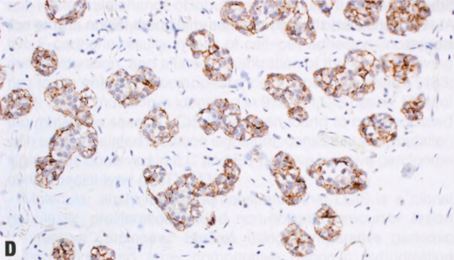
图2.58 ALH。A TDLU(视野中心)的腺泡被松散的非粘附性单形性细胞填充并轻微膨胀(≥8个细胞的腺泡<50%),胞质稀少,核小而均匀,核仁不明显。这是A型小叶细胞。视野的左下角,ALH以佩吉特样模式累及导管,ALH细胞浸润在导管基底膜和残余的变薄的导管上皮层之间。B 本例ALH细胞具有更丰富的胞质和更大的核,大小和形状有轻度至中度差异,核仁更明显。这是B型小叶细胞。C 许多肿瘤细胞含有胞质内空腔,部分细胞中空腔足够大,呈印戒细胞样。D E-cadherin染色显示肿瘤细胞阴性。残余导管上皮细胞阳性,不要误认为肿瘤细胞阳性并排除小叶表型。
膜E-cadherin失表达是小叶病变(包括ALH)的定义性免疫组化特征。β-catenin、α-catenin和p120-catenin(它们与E-cadherin形成复合体)也是膜失表达;p120-catenin在胞质中异常定位,并上调。然而,大约15%的小叶病变保留了E-cadherin的表达,但具有异常的染色模式,不要误判并排除小叶表型。这些免疫组化标记应结合详细的组织学分析进行解读。
细胞学
FNA细胞量少,显示松散的小而均匀的细胞群,含有透明空泡和偏心的轻微非典型核,提示存在小叶病变(ALH、LCIS或ILC)。然而,目前还没有可靠的细胞学标准来区分ALH/LCIS和ILC。与粗针活检相比,FNA对不可触及的病变(包括ALH和LCIS)的敏感性和特异性较低,非诊断结果率较高。
诊断分子病理学
与临床无关
诊断标准
必要标准:非粘附性小细胞,核均匀深染(A型)到稍大的空泡状核伴轻度核差异(B型),填充和膨胀TDLU中不到一半的腺泡。
理想标准:必要时,证实膜E-cadherin染色缺失。
分期
ALH视为高风险的非恶性病变,不分期。
预后和预测
ALH反映乳腺癌易感性显著增加,双侧乳房后续发生不同组织学类型癌的风险升高(同侧为主)。ALH的相对患癌风险是无ALH女性预期的4-5倍。单独ALH累及导管的风险低于同时累及小叶和导管的ALH。据估计,与ALH相关的癌,绝对风险约为每年1%,并且随着时间的推移相当稳定,25年时的累计发病率为30%。
诊断ALH时年龄较小的患者、组织学钙化和年龄较小的小叶复旧会进一步增加患癌风险,而化学预防会降低风险。一些(但不是全部)研究提示,ALH家族史阳性和多发病灶会增加风险。
由于切除后ALH向癌(包括浸润性癌和DCIS)的升级率范围很广(0-67%),因此对粗针活检诊断的ALH的管理一直存在争议。然而,最近的研究报道称,当发现与不同靶病变的放射学病理相关性一致时,单独发生ALH或小叶肿瘤(组合ALH和LCIS病例)的偶发病例,切除升级率非常低(0-4%)。因其他良性病变在粗针活检中偶然发现ALH,并证实了放射学病理一致性,这些患者仅观察也是安全的。如果存在另一种病变本身就需要切除,或者如果与活检目标没有组织学相关性,则应进行切除。
出于风险评估和临床管理的目的,ALH视为风险增加的标记。ALH患者管理的最佳做法是强调密切监测和咨询以降低风险。
Lobular carcinoma in situ
小叶原位癌(LCIS)
定义
LCIS是一种起源于TDLU的非粘附性细胞的非浸润性肿瘤性增殖,伴或不伴终末导管的佩吉特样受累。TDLU中超过一半的腺泡被肿瘤细胞填充和扩张。
ICD-11编码
8520/2 LCIS-NOS
8519/2 LCIS,多形性
ICD-11编码
2E65.0&XH6EH0乳腺LCIS&LCIS-NOS
相关命名
可接受:小叶肿瘤。
不推荐:非经典型LCIS;变异性LCIS;小叶上皮内肿瘤。
亚型
经典型LCIS;多形性LCIS;旺炽性LCIS
部位
多达80%的LCIS患者为同侧乳腺的多中心病变,30-67%的患者累及双侧乳腺。多形性LCIS和旺炽性LCIS呈单灶性连续分布,通常与ILC共同发生在多中心经典型LCIS的背景。
临床特征
经典型LCIS没有特定的临床特征;通常是其他原因进行的乳腺活检中显微镜下偶然发现。罕见的经典型LCIS病例(<2%)伴有影像学异常,可能成为活检的目标,包括乳房X线上成团的无定形或颗粒状钙化,或MRI上持续增强的异质性非肿块样增强。相比之下,多形性LCIS和旺炽性LCIS常有微钙化,并在乳房X线筛查中检出。
流行病学
LCIS发生在0.5-3.6%的良性乳腺活检和0.04-1.2%的缩乳术标本。流行病学研究提示,在引入乳房X线术后(1978-1998年),LCIS的发病率迅速上升,并在2001-2004年期间急剧下降,这很可能是由于更年期激素替代疗法的使用减少。经典型LCIS主要诊断于绝经前妇女(平均年龄:约50岁)。多形性LCIS和旺炽性LCIS主要诊断于绝经后妇女(平均年龄:约60岁)。
病因
LCIS的许多危险因素与DCIS和IBC的危险因素相似。基于人群的研究报道称,LCIS的风险增加与乳腺癌家族史、既往良性乳腺活组织检查、未产、首次足月分娩年龄较大、更年期年龄较大和乳腺X线密度高有关。在绝经后妇女中,激素替代疗法会增加LCIS的风险。
CDH1(编码细胞粘附蛋白E-cadherin的基因)位于16q22.1,在小叶病变的发病机制中起着重要作用。CDH1的种系突变具有高度渗透性,伴有遗传性弥漫性胃癌(HDGC)风险增加和小叶癌(包括双侧LCIS伴或不伴ILC)风险增加。在已知的与ER-阳性乳腺癌风险增加相关的种系SNP中,一些还显示出与ILC相关,特别是与LCIS相关。
发病机制
CDH1失活导致E-cadherin功能丧失或受损,是小叶病变的早期事件和标志。E-cadherin介导细胞间粘附,在维持小叶结构中起着关键作用。它还可以抑制乳腺癌细胞的生长和浸润。E-cadherin缺陷导致细胞间粘附丧失,细胞增殖增加,小叶组织改变,导致小叶肿瘤的特征性形态。81%的LCIS病例中发现了CDH1突变。LCIS中发现的大多数突变都与年龄相关的突变特征有关,这与ILC和ER阳性非特殊型浸润性癌(NST)中观察到的突变特征一致。分子分析提示,LCIS是一种克隆性肿瘤增殖,是浸润性癌的非必然前驱病变。使用比较基因组杂交和阵列比较基因组杂交的研究提示,经典型LCIS、多形性LCIS和旺炽性LCIS都在1q出现重现性染色体增加,在16q出现丢失,这是低级别乳腺肿瘤途径的典型模式。多形性LCIS和旺炽性LCIS表现出比经典型LCIS更大的基因组不稳定性,这提示这些形态亚型在遗传学上比经典型LCIS更为晚期。比较LCIS和并发ILC的研究强调了共享拷贝数畸变,提示LCIS是ILC的非必然前驱病变。
大规模的平行测序研究提示,LCIS可能与ILC克隆相关,偶尔也会与同一象限中的DCIS克隆相关。这些研究还提示,LCIS是一种遗传学上晚期的病变,具有与ILC相似的拷贝数改变和体细胞基因突变,但TP53和PTEN突变非常罕见。LCIS中最常见的突变基因是CDH1(在多达81%的病例中发生突变)、PIK3CA(41%)和CBFB(12%)。HER2的突变(和扩增)是多形性ILC和多形性LCIS中常见的分子改变。最近的一项微阵列基因表达谱研究提示,经典型LCIS在转录组水平上是异质的,并确定了潜在的浸润前驱病变候选基因,其生物学和临床意义值得进一步探索。
大体表现
LCIS没有肉眼可识别的异常。
组织病理学
经典型LCIS的特征是A型和/或B型上皮细胞的非粘附性增殖。A型细胞小,核均匀深染核,而B型细胞具有稍大的空泡状核,大小和形状略有改变,并有小核仁。单个病变中细胞群可以混合存在。TDLU中超过50%的腺泡被肿瘤细胞填充和扩大,才能符合LCIS的标准。无腺体结构,少见核分裂象和微钙化。经典型LCIS可能罕见单个细胞凋亡和/或微小坏死灶。LCIS可以显示导管中的佩吉特样生长,并可能累及其他病变,包括UDH、SA、RS、乳头状病变、FA和胶原小球病。
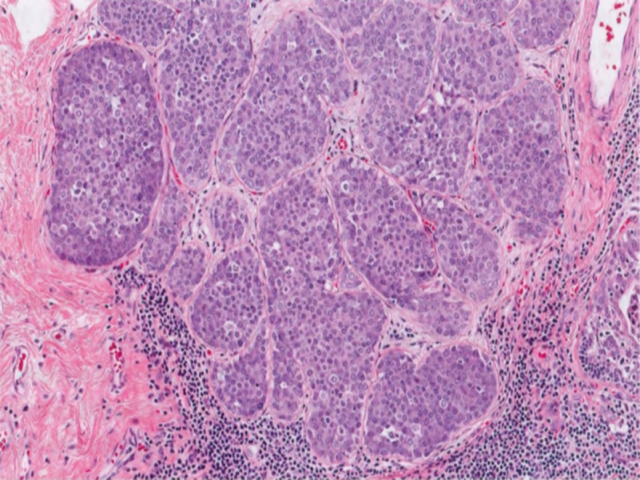
图2.59经典型LCIS。TDLU中50%以上的腺泡被松散的非粘附性单形性细胞填充和扩张,这些细胞胞质稀少,核小而均匀。
其他两种形态亚型是多形性和旺炽性。多形性LCIS由具有明显核多形性的较大细胞组成,其大小是淋巴细胞的4倍以上/相当于高级别DCIS的细胞,伴或不伴大汗腺特征。旺炽性LCIS细胞显示经典型LCIS的细胞学特征,但TDLU或导管明显扩张,形成融合的团块状结构。旺炽性LCIS应至少具有以下两个结构特征之一:在受累TDLU的明显扩张的腺泡之间几乎没有间质分隔,和一个大小阈值,即扩张腺泡或导管填充直径上约40-50个细胞。介于由B型细胞组成的经典型LCIS和多形性LCIS之间的LCIS病变应归入B型细胞构成的经典LCIS。同样,具有经典型LCIS细胞学特征的病变,腺泡扩张程度界于经典型和旺炽性LCIS之间,应称为经典型LCIS,即使LCIS范围很广。
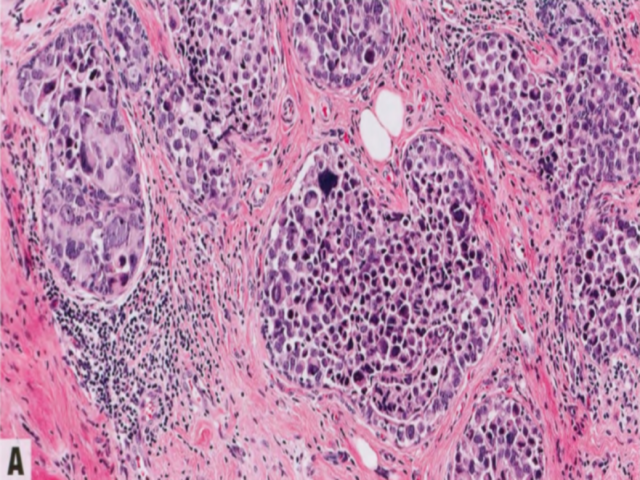
图2.60多形性LCIS。A 多形性LCIS的结构特征是非粘附性细胞的实性增殖,就像经典型LCIS,但具有明显的核多形性,相当于高级别DCIS。B 多形性LCIS缺乏膜E-cadherin表达。
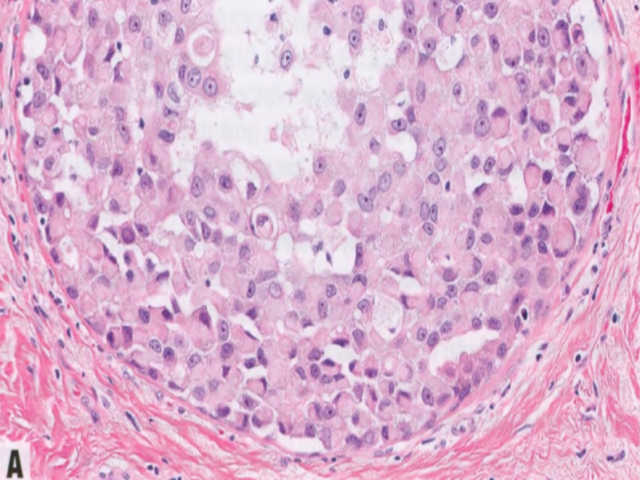
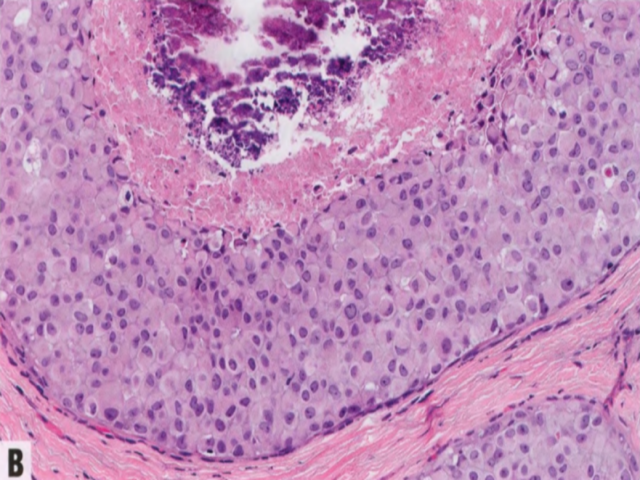
图2.61大汗腺多形性LCIS。A 多形性LCIS根据大汗腺细胞学进一步分类为大汗腺型,大细胞具有丰富的嗜酸性颗粒性胞质并有明显核仁的圆形至卵圆形核。B 多形性LCIS常有粉刺样坏死和钙化,乳房X线能检出。
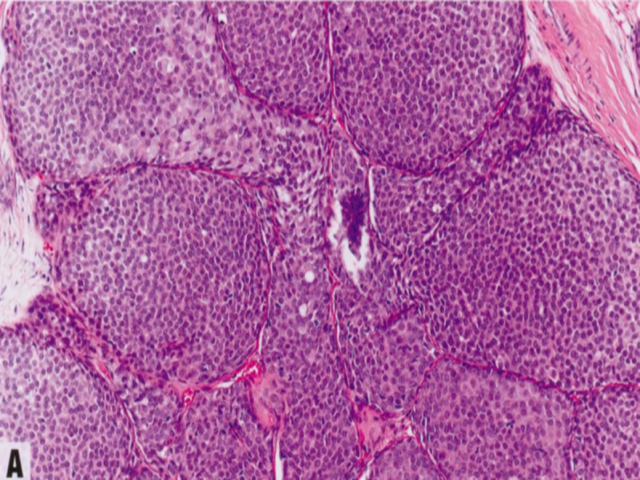
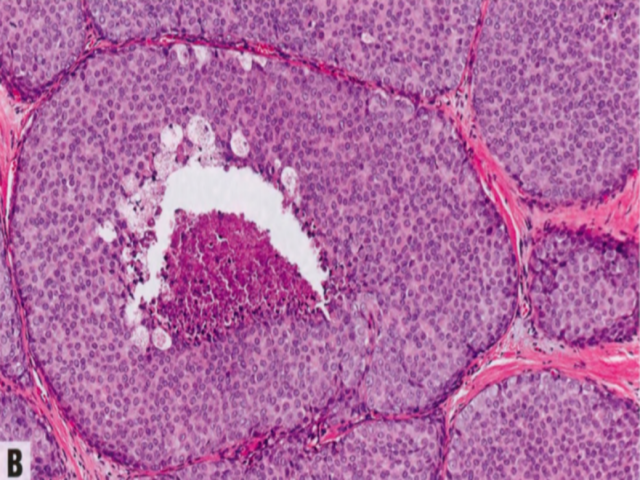
图2.62旺炽性LCIS。A 其细胞学特征类似经典型LCIS(A型和/或B型细胞),但TDLU显著扩张,受累腺泡之间几乎没有间质分隔。B 腺泡或导管明显扩张(至少充满一个高倍视野,相当于直径上>40-50个细胞),通常伴有中心坏死。
多形性LCIS和旺炽性LCIS通常表现为粉刺样坏死和钙化。这两种亚型常伴有浸润性癌(高达87%),其中大多数(84-100%)是ILC,因此检测到两种亚型应促使仔细寻找邻近乳腺组织中的微浸润。在任何形态亚型中都可以看到印戒细胞。在临床实践中,这些亚型有其他几个术语,包括“非经典型LCIS”和“变异性LCIS,未进一步说明”。WHO肿瘤分类不推荐这些术语,因为缺乏足够的特异性来指导患者管理。
膜E-cadherin失表达是所有形式LCIS的免疫组化特征。大约15%的ILC保留了异常的E-cadherin表达,LCIS也是如此。因此,不要根据破碎的膜和/或胞质异常染色而诊断DCIS。LCIS细胞显示p120-catenin弥漫强阳性胞质染色和膜β-catenin失表达。然而,LCIS和DCIS之间的区别不能仅依赖于这些免疫组化标记,应结合详细的形态学评估来解释。
经典型和旺炽性LCIS通常对ER呈弥漫强阳性,Ki-67增殖指数低,罕见HER2过表达或基因扩增或TP53突变。多形性LCIS更有可能是ER阴性(尤其是大汗腺多形性LCIS),可能是AR阳性,可能表现出HER2过表达和基因扩增或TP53突变,并且具有中-高Ki-67增殖指数。大约10%的多形性病例为三阴性。
细胞学
FNA显示小而均匀的细胞形成松散的非粘附性细胞群,偶有胞质内空腔、偏心的规则核和轻微核异型性。然而,LCIS中>50%的FNA标本被诊断为良性或非诊断性。没有可靠的细胞学标准来区分LCIS和ILC。
诊断分子病理学
与临床无关
诊断标准
经典型LCIS
必要标准:非粘附性小细胞,具有均匀深染的核(A型)到稍大的空泡状核并有轻度差异(B型),填充和扩张TDLU中一半以上的腺泡。
理想标准:E-cadherin膜染色缺失。
多形性LCIS
必要标准:非粘附性大细胞,具有明显的核多形性,>4倍于淋巴细胞/相当于高级别DCIS细胞,伴或不伴大汗腺特征。
理想标准:E-cadherin膜染色缺失。
旺炽性LCIS
必要标准:经典型LCIS产生融合的大片结构;在受累TDLU的明显扩张的腺泡之间几乎没有间质分隔,和/或大小阈值,膨胀的腺泡或导管填充了直径上约40-50个细胞。
理想标准:E-cadherin膜染色缺失。
分期
根据国际癌症控制联盟(UICC)第八版TNM分类和美国癌症联合委员会(AJCC)癌症分期手册,LCIS不再作为Tis分期。多形性LCIS不包括在pTis分类中。
预后和预测
LCIS既是IBC的危险因素,也是其非特异性前驱病变。经典型LCIS的乳腺癌相对风险是普通人群的8-10倍。癌症的绝对风险在每年1-2%的范围内,20年的累积长期发病率>20%,终身风险为30-40%。风险是双侧的,浸润性癌可以是小叶癌或导管癌。然而,同侧癌为主,ILC的比例很高;因此,LCIS也视为一种非必然的前驱病变,尽管进展为浸润性癌的风险很低。这得到了分子研究的进一步支持。
目前,经典型LCIS的管理包括对双侧乳房进行积极监测和降低风险的策略。ASCO指南包括抗雌激素治疗作为化学预防,以降低LCIS的乳腺癌风险。在粗针活检中诊断的经典型LCIS的管理一直存在争议,因为据报道切除后癌(包括浸润性癌和DCIS)的升级率范围很广(0-60%)。在这些研究中,当没有解决放射学病理相关性或LCIS代表放射学目标时,升级率更高,在肿块活检和影像学组织学不一致的病例中,升级率甚至更高(高达66%)。然而,最近具有一致影像学发现的研究报道称,偶然发现的经典型LCIS(和ALH)向癌的切除升级率非常低(约1-4%)。因此,在粗针活检中偶然发现经典型LCIS的患者,其影像学组织学表现一致,可以免于手术切除。没有迹象提示将经典型LCIS切除至阴性边缘是有用的,即使在共存多形性LCIS、旺炽性LCIS和/或ILC的情况下,也没有必要评估或报道经典型LCIS的切除边缘状态。
关于多形性LCIS和旺炽性LCIS的自然史的信息极其有限,对于这些切除的形态学LCIS亚型患者的最佳治疗方法尚不清楚,包括是否实现阴性边缘以及辅助放疗是否有任何潜在益处。据报道,接受保守手术治疗的多形性LCIS的复发率从0%到高达57%不等,无论是否接受抗雌激素治疗,复发病变可能是多形性LCIS、DCIS、ILC或浸润性导管癌。目前尚不清楚阳性切缘状态是否可能影响复发,但这些研究的结果一般支持实际工作中尽可能对多形性LCIS获得阴性切缘。建议报告多形性LCIS和旺炽性LCIS的切缘状态,以帮助进一步的管理决策。
粗针活检上大约25-60%的多形性LCIS和旺炽性LCIS病例在切除后升级为癌。尽管此类研究得出的数据存在局限性,但WHO肿瘤分类建议对粗针活检诊断的多形性LCIS和旺炽性LCIS进行切除。
未完待续......























共0条评论