乳腺肿瘤WHO分类学习笔记(连载9)
往期回顾
2.8 IBC
2.8.1 概述
定义
术语“IBC”是指乳腺腺体成分的一大组异质性恶性上皮性肿瘤。
ICD-11编码
没有
ICD-11编码
没有
相关命名
没有
亚型
在后续章节中,IBC分类为形态学定义的多种亚型。值得注意的是,出于治疗目的,所有IBC都根据ER和HER2状态分为以下生物标记物定义的亚型/组:
•ER阳性、HER2阴性
•ER阳性,HER2阳性
•ER阴性、HER2阳性
·ER阴性、HER2阴性。
尽管它们的形态特征重叠,但这些生物标记物定义的亚型显示出不同的临床结局和治疗反应,它们的全基因组和转录组谱也有差异。
部位
大多数乳腺癌(约90%)是单发性,可以发生在乳房的任何象限,外上象限较多见。约2%的患者同时患有对侧肿瘤。约0.1%的乳腺癌表现为腋窝转移,没有明确的乳腺原发灶。
临床特征
在未经筛查的人群中,IBC最常见临床表现为可触及肿块,可能出现皮肤回缩、乳头内翻、乳头溢液,以及(较少见)乳房大小或形状的改变或皮肤颜色或质地的改变。在极端病例中,可能出现皮肤溃疡。炎症性乳腺癌是乳腺癌的一种临床表现,其特征是累及三分之一或更多乳房皮肤的弥漫性红斑和水肿。乳腺癌的所有症状也可能是由良性乳腺疾病引起的,因此通过影像学和组织学取样以及CNB或FNA进行评估,可以确定最终诊断。
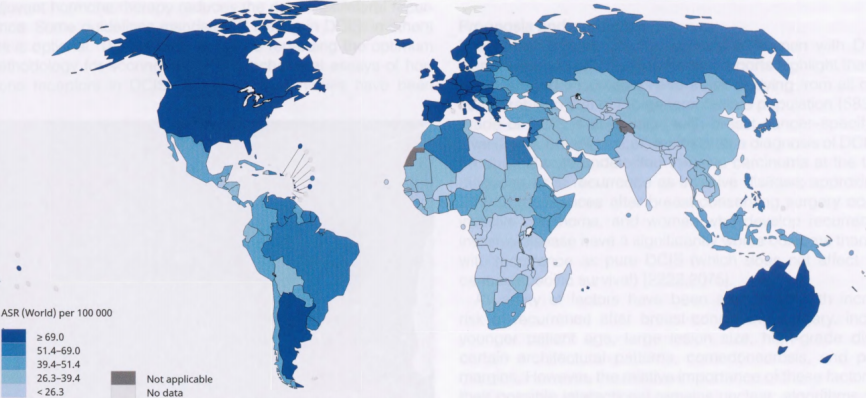 图2.72 2018年乳腺癌估计年龄标准化发病率(ASRs;世界),每10万人每年。
图2.72 2018年乳腺癌估计年龄标准化发病率(ASRs;世界),每10万人每年。
在筛查人群中,伴或不伴钙化的毛刺状肿块是乳腺癌的典型表现,也可能表现为结构扭曲、边界清楚的肿块或仅有钙化。大约5-15%的可触及癌在乳房X线照片上看不到,其中大多数可以通过靶向超声检查来识别。超声检查也可以加入筛查方案,以提高乳房X线密度高的女性的敏感性,是40岁以下女性乳房影像学检查的首选方法。钼靶和超声联合检查的假阴性率很低,在0%-3%之间。除非根据影像学检查能作出明确的良性诊断,如囊肿,否则通常需要组织取样来排除癌。
MRI是检测乳腺癌最敏感(但不是最特异)的方法;因此,仅限于风险很高女性(如BRCA1或BRCA2突变携带者)的筛查。在一些中心,在最初诊断为小叶癌后或作为乳腺癌分期检查的一部分,也采用MRI检查。
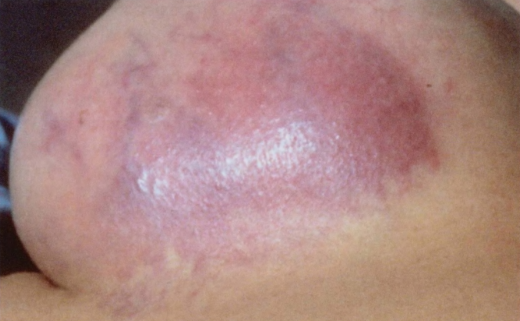
图2.73炎性乳腺癌。临床上,炎性乳腺癌表现为弥漫性红斑和水肿,累及乳腺三分之一或更多皮肤。
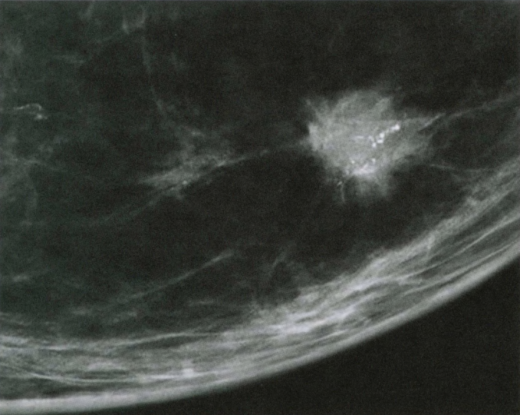
图2.74IBC。数字乳腺摄影显示一个典型的小毛刺乳腺癌伴钙化。
当体格检查、影像学检查和穿刺活检/细胞学检查结果均为良性且结果一致,癌的漏诊风险极低。然而,当这些检查方法中的任何一种不一致或无法评估时,需要重复活检或手术诊断性活检。
流行病学
乳腺癌是女性最常见的癌症(占所有女性癌症的24%),也是全球女性癌症死亡的首要原因。乳腺癌占男女癌症总数的11.6%,总体上是第二常见的癌症。最近几十年来,大多数中低收入国家的IBC发病率一直在上升。在美国、加拿大、英国、法国和澳大利亚等高收入国家,发病率在21世纪初下降,部分原因是妇女健康倡议试验公布后,绝经后激素治疗的使用减少,该试验确定了绝经后激素的使用与乳腺癌风险的关联。然而,随着人口老龄化,全球乳腺癌负荷总体上有所增加。2018年,全球估计有210万例乳腺癌新增病例和62.7万例死亡病例。发病率在地理上也相差10倍以上。澳大利亚、欧洲和北美的富裕人群风险最高,其中8-9%的女性在75岁之前被诊断出患有IBC。地理改变、时间趋势和对从低风险地区向高风险地区迁移的人口的研究提示,移民人口的风险在一两代人内接近东道国的风险;这提示环境因素在这种乳腺癌的病因中起着重要作用。对美国乳腺癌亚型变异的研究提示,临床/生物标记物亚型的频率因人群特征而异。在筛查人群中,激素受体阳性乳腺癌是最常见的亚型,HER2阳性乳腺癌占10-15%,ER-阴性/HER2-阴性乳腺癌占13-17%;在未筛查的人群中,亚型频率有所不同,ER阴性/HER2阴性乳腺癌(20-40%)和HER2阳性乳腺癌(15-25%)的比例较高。
病因
乳腺癌起源涉及多种因素。大多数研究指出激素、饮食、生殖因素和遗传学是一般的危险因素。从描述性流行病学数据中可以清楚地看出,乳腺癌是富裕社会和西方生活方式的诊断,其特征是富含动物脂肪和蛋白质的高级饮食,加上缺乏体育锻炼和肥胖,初产年龄较大,产次较低,哺乳期缩短。这种疾病更常见于初潮早、未产妇、孩子少、首次分娩年龄大的女性。流行病学研究也有压倒性的证据提示,外源性性激素(雌激素和孕激素)在乳腺癌的发生中起重要作用。随着年龄的增长,乳腺癌的发病率在绝经前(每年约8%)比绝经后(每年约2%)增加得更快,此时卵巢雌激素和孕酮的合成停止,卵巢雄激素的产生逐渐减少。
饮酒一直与乳腺癌的中度风险增加有关,尤其是激素受体阳性癌。目前的证据提示,主动吸烟与乳腺癌之间没有因果关系;然而,一项大型荟萃分析报道称,初产前开始吸烟的女性,主动吸烟与乳腺癌风险增加之间存在联系,并提示吸烟可能在乳腺癌的发生中发挥作用。国际癌症研究机构(IARC)对体力活动与乳腺癌风险之间的关系进行了评估,得出的结论是,活动水平越高,风险越低。
与大多数其他人类肿瘤相比,乳腺癌表现出家族聚集性。已经确定了两个高外显率基因(BRCA1和BRCA2),这两个基因大大增加了患乳腺癌的风险。最近还发现了其他多态性和基因(主要是通过全基因组关联研究),它们具有中等或低外显率,风险较低。证据提示,这种疾病可能是多基因起源的(见下文的诊断分子病理学)。
特定的病因风险因素对IBC的各种生物标记物/临床亚型的风险有所不同。种系BRCA1突变与三阴性(ER阴性、PR阴性和HER2阴性)乳腺癌的风险有关,而种系BRCA2突变与激素受体阳性乳腺癌有关。初潮早、更年期晚、绝经后激素替代治疗、未产和首次分娩年龄较大与激素受体阳性乳腺癌风险增加相关。产次可能与三阴性肿瘤的风险增加有关。母乳喂养时间越长,所有亚型的风险越低。绝经后妇女的体重指数与乳腺癌风险之间的正相关关系在激素受体阳性乳腺癌中更强。在绝经前女性中,有人提出了一种微弱的负相关关系,在这些女性中,较高的体重指数可能与激素受体阳性乳腺癌的风险降低有关,但与三阴性乳腺癌的风险增加有关。有证据提示,酒精、吸烟和体育活动与激素受体阳性乳腺癌的风险有关。然而,对特定种族人群的研究提示,在开发乳腺癌特定生物标记物/临床亚型的风险因素方面,可能存在基于人群/种族的差异。
发病机制
乳腺癌的发病机制有以下几种途径。已经描述了癌症发生、转化和进展的多个线性模型,这些模型主要基于激素受体状态和形态。ER阳性模型将FEA、ADH和ER阳性DCIS视为浸润性和转移性乳腺癌的非必然前驱病变。ER阴性模型将ER阴性DCIS和MA视为ER阴性乳腺癌的前驱病变。
在细胞起源水平上,描述了乳腺癌发生的两个主要模型:散发克隆演化模型和癌症干细胞模型。在分子水平上,有强力证据提示乳腺癌沿着两种不同的分子进展途径而演化,主要与激素受体有关。分子数据还提示,ER阳性和ER阴性乳腺癌是根本不同的疾病,在ER阳性乳腺癌中,组织学分级和增殖与遗传学异常的程度、复杂性和类型密切相关。
第一条途径(ER阳性途径)的特征是1q获得、16q缺失、17q12的少见扩增,以及主要由与ER阳性表型相关的基因组成的基因表达特征。这些病变表达激素受体,缺乏HER2过表达,不表达基底样标记物,并且具有相对简单的二倍体或近二倍体核型。总体上,该途径主要由低-中级别肿瘤组成,此外还有少数(约9%)形态学定义的高级别肿瘤。
第二种途径称为ER阴性途径,最常见的特征是13q缺失、染色体区域11q13获得、17q12扩增,以及与细胞增殖和细胞周期过程相关的基因群集的基因表达特征。该途径主要由形态学定义的中-高级别肿瘤组成。
这两种途径都常见PIK3CA突变,ER阴性途径常见TP53突变。已发表的数据还提示,低级别肿瘤向高级别肿瘤的进展可能优先发生在管腔表型的乳腺癌。ER阴性乳腺癌包括HER2阳性和HER2阴性两组。这两组(大多是高级别、遗传学不稳定和非整倍体)常见TP53突变。在ER阴性HER2阳性组中,除了17q12扩增,PIK3CA突变也非常频繁。ER阴性HER2阴性乳腺癌生物学包括高增殖活性、免疫浸润增加、基底样和间叶性表型以及缺乏同源性重组。

图2.75乳腺癌发病机制的示意图,包括乳腺上皮细胞系模型(细胞起源)、细胞系和分子亚型之间的关系(基于大肿瘤基因表达谱)、每个亚型中频繁或特有的遗传事件、间叶性与上皮性癌症干细胞(CSC)不同比例的模型,以及不同亚型乳腺癌对应的正常发育中的分化细胞系。MaSC,乳腺干细胞;TNBC,三阴性乳腺癌。
大体表现
大多数IBC表现为明显的肿块,可看到或触到,具有不规则的星状轮廓或结节状结构。肿瘤边缘通常边界不清或欠清,缺乏清晰的边界。典型的IBC触摸质硬,甚至坚硬,切面可能有砂砾感(但某些类型的DCIS,如粉刺型,可能有类似的砂砾质地,并不总是容易区分浸润)。然而,有些IBC,包括新辅助治疗的病例,可能非常不明显,大体检查和组织取样时需要与影像学仔细对比。大体评估应包括对影像学结果的回顾(如有),对病变数量、预期病变大小、预期定位夹/标记及其位置心中有数,从而正确剖切和适当取材。较大标本的X线照相有助于识别定位夹、钙化和其他线索,以指导大体检查。理想情况下,手术标本应涂抹不同颜色的墨水,并连续切开,切成约0.5cm厚的组织薄片,以确保充分固定,并检出较小的浸润性癌。按上述规范进行组织取样,才能准确地获得乳腺癌的T分期。密切相关的大体病变之间的取材也很重要,以便病理医师能够记录它们真正多灶性或一个较大的癌,用于分期。肉眼观,病灶范围或大小不明显时,通常需要将较大病变全部取材,制作包埋盒照片或示意图。在新辅助治疗后尤其如此,因为残留癌变得更软,更难触到,而且可能只存在纤维瘢痕区域(除非没有治疗反应或反应轻微)。另一种需要广泛组织取样的情况是广泛的DCIS病例,这样就可以识别任何浸润病灶。
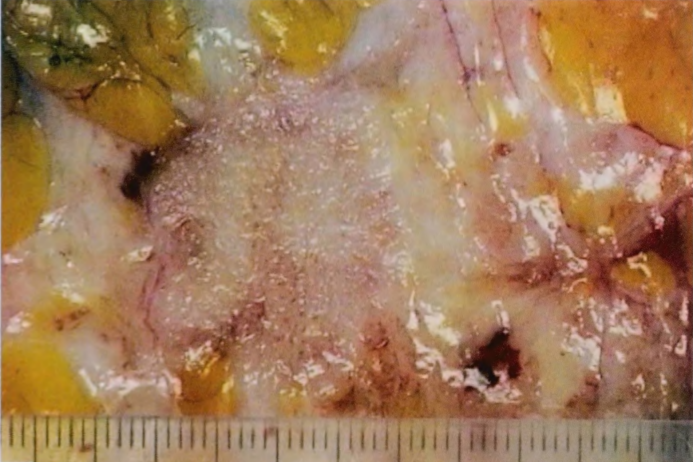
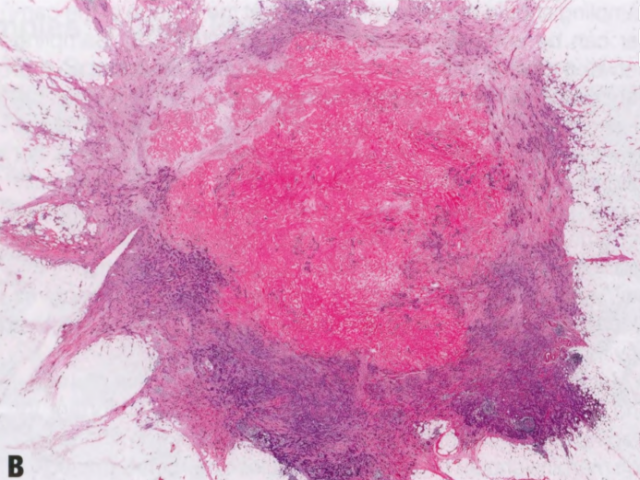
图2.76乳腺癌。A 大体表现。B IBC-NST。注意不规则的星状轮廓和中央瘢痕。
皮肤溃疡、乳头改变和分开的皮肤结节(如有)的大体评估对于分期也很重要。应记录大体明显的癌与切缘的距离,对近切缘取材,以便显微镜下分析。最后,应记录组织处理参数,如外科医生取出标本的时间、放入固定剂的时间、固定和组织样本处理之间的时间,以便明确冷缺血时间(从身体取出到放入固定剂之间的时间)和处理前的固定时间,这些参数涉及受体(ER/ PR和HER2)检测、分级和淋巴管血管浸润的评估。
组织病理学
IBC的组织学表现具有广泛的变化范围。四种组织学特征用于进一步界定生物学特征:(1)基于肿瘤结构、核特征和间质特征的组织学亚型;(2)诺丁汉分级(详见下文);(3)血管淋巴腔有无扩散(仅评估肿瘤周围的淋巴管血管浸润,并区分组织收缩假象);以及(4)共存的原位成分。分类中其他重要的特征包括肿瘤大小、切缘距离、间质改变和肿瘤浸润淋巴细胞(TIL)。同样重要的是,要能意识到不同寻常的或与激素受体或HER2状态不一致的乳腺癌组织学特征。例如,ER阴性或HER2阳性的低级别乳腺癌是很不寻常的/不一致的,建议进一步检查以确保准确的组织学分型、分级和生物标记物状态。在本章的后续章节中,IBC按形态学亚型进行编排,但大多数病例属于非特殊型(NST)。
组织学类型
在90%以上的肿瘤中显示特殊组织学模式的乳腺癌命名为纯特殊肿瘤类型,如小叶癌、MC和TC。缺乏这些特定特征的肿瘤称为浸润性癌NST,它占大多数病例,包括那些具有混合模式的病例。
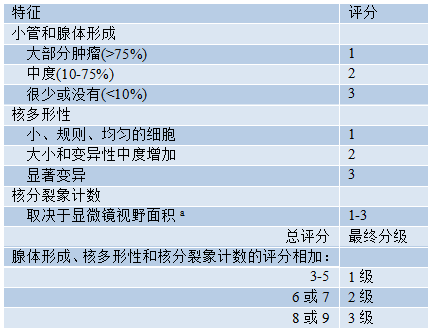
组织学分级
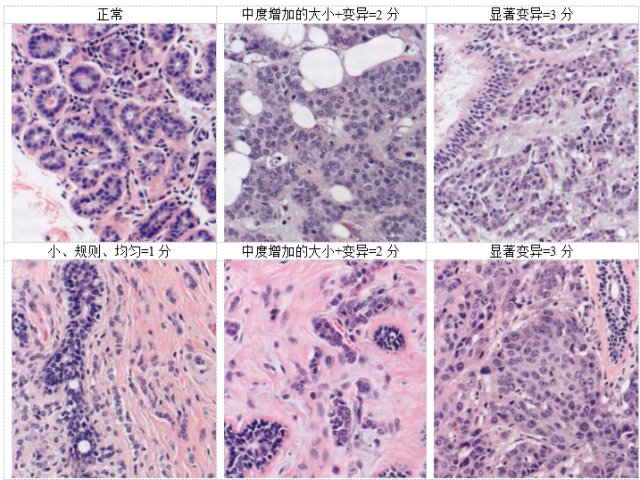
评估三个特征:小管形成表示腺体分化、核多形性和核分裂象计数。每个特征单独评估,各自评分1-3分(见表2.06)。在低倍镜下评估整个肿瘤的小管和腺体/腺泡形成;被极化肿瘤细胞包围的、有明显中央管腔的结构才纳入计数。腺体/肿瘤面积的75%和10%作为阈值,用于评分(见图2.78)。
与邻近乳腺组织中正常上皮细胞的核大小和形状的规则性相比,在多形性程度最高的区域评估核多形性(见图2.77)。核轮廓的不规则性增加以及核仁的数量和大小也是有用的多形性评分指标。1分核的大小与先前存在的良性上皮细胞的核非常相似(<1.5倍大小),显示轻微多形性、均匀的染色质模式,核仁不可见或非常不明显。2分核较大(是良性上皮核大小的1.5-2倍),具有轻度至中度多形性,核仁可见,但小而不明显。3分核更大(良性上皮核大小的2倍以上),空泡状染色质;大小和形状明显不同,常有明显的核仁。核评分的首选放大倍数为40倍物镜。
诺丁汉分级示例:核多形性
图2.77IBC诺丁汉分级:核多形性评分。
诺丁汉分级示例:小管形成
图2.78 IBC诺丁汉分级:小管形成评分。
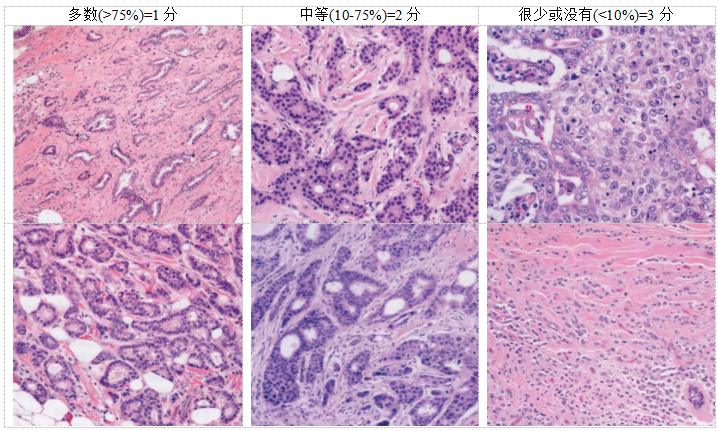
表2.06评估乳腺肿瘤组织学分级的半定量方法
a见表1.01(第6页)。
核分裂象评估需谨慎,前提是理想的组织固定和制备良好的切片。只计算明确的核分裂象;深染核和固缩核很可能是凋亡而不是细胞分裂,因此应忽略。核分裂象计数需要标准化,根据固定的视野面积,因为不同显微镜具有不同的视野面积。记录每10个高倍视野的核分裂象总数。评分阈值取决于视野面积大小,使用的显微镜应通过测量高倍视野(40x物镜)的直径进行校准(见表1.01,第6页)。对表现出最高频率核分裂象的区域(热点法)进行评分,通常是肿瘤的外周前沿。如果存在异质性,则应选择核分裂象频率较高的区域。一旦选择了热点并考虑了第一个区域,随后的区域选择是通过选择区域的随机弯曲进行的,但仅应评估具有代表性肿瘤细胞负荷的区域。
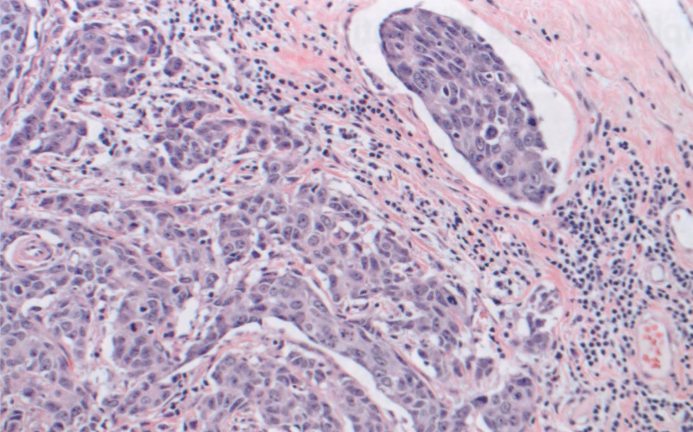
图2.79IBC。血管淋巴管腔的侵犯。
将上述三项值相加,得到3-9分,分为以下级别:3-5分=1级,高分化;6-7分=2级,中分化;8-9分=3级,低分化。为了保证质量,建议在报告中包括各项评分,如“浸润性乳腺癌,非特殊型,评分3+2+2=7分,中分化”。在新辅助治疗时代,小组织样本(如CNB样本)的分级是可能的,并且通常是必要的,但应认识到其局限性,特别是由于准确评估核分裂象频率的固有能力降低。这可能导致低估此类标本的真实级别。
免疫组化
IBC细胞通常对低分子量CK(CK7、CK8/18、CK19)、EMA、E-cadherin、BCL2和GATA3呈阳性(低分化IBC可能有一个或多个失表达)。部分IBC(通常分化较好)表达GCDFP-15、mammaglobin、乳脂球(milk fat globule)、乳清蛋白(lactalbumin)、CEA和B72.3。约30%的IBC表达一种或多种基底样标记物,包括高分子量CK(CK5/6、CK14、CK17)和EGFR(HER1),它们在ER阴性肿瘤中更常见阳性。一定比例的IBC表达S100,但肌上皮也表达。乳腺癌CD34阴性,CK20和p63通常阴性(但有例外,如化生性癌和涎腺样癌表达p63)。大多数乳腺癌不表达其他组织特异性标记物(如CDX2、PAX8、WT1、TTF1、HMB45、melan-A、CD20和CD3),但CD138可能阳性。
激素受体:IBC应评估核ER表达,可用于预测内分泌治疗的临床获益,并可用于ER阳性与ER阴性乳腺癌的各种临床治疗策略(见图2.80)。PR表达变化更大,有助于说明PR对ER阳性病例进一步分层预后类别的有效性,但用于此目的的特定PR阈值没有得到很好的验证(见下文的预后和预测)。根据2010年ASCO/CAP关于乳腺癌ER和PR免疫组化检测的指南,少至1%的乳腺癌细胞核呈弱的ER染色应视为阳性,因为有证据提示内分泌治疗具有潜在获益,2019年更新的指南保持了这一阈值。ER阳性率为1-10%的IBC应报告为ER低阳性,并在备注中进一步解释和建议。关于内分泌治疗对本组患者的获益,目前的数据比较有限,但指南认为内分泌治疗可能有益,因此认为患者适合内分泌治疗。然而,这组IBC异质性,ER低阳性癌的生物学行为可能与ER阴性乳腺癌更相似。在决定其他辅助治疗和整体治疗途径/分类时应考虑这一点。应始终评估外对照(使用适当的阳性和阴性组织),内对照也应按预期染色。有关ER检测解读的最新信息,请参阅指南的最新版本。激素受体表达可能存在区域差异,报告的百分比应反映所检测的IBC整个标本中阳性细胞的百分比(而不仅仅是最高表达区域)。当染色强度有变化时,可以将其报告为强度范围或平均强度,许多报告系统使用范围为0、1+、2+和3+。可以使用不同的评分系统来组合总评分的强度和百分比信息(例如H评分或Allred评分)。除了百分比和强度结果外,报告中还应包括ER/PR阳性或阴性的判读。低倍镜扫描通常不足以检测局部或弱水平的激素受体表达;因此,在低倍镜呈阴性的情况下,应在高倍镜下扫描,以排除弱激素受体阳性。
激素受体染色解读(ER和PR)
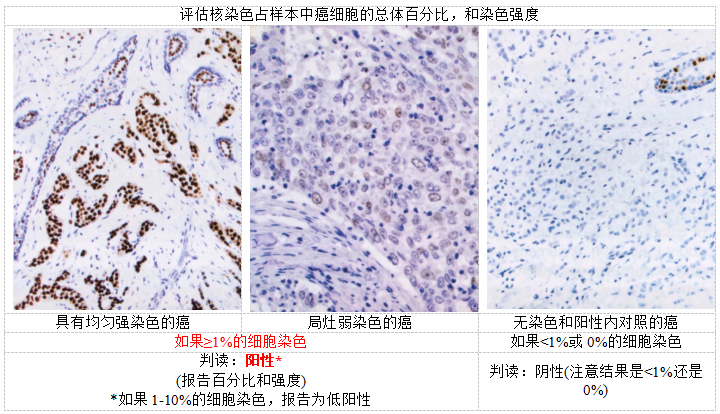
图2.80IBC。激素受体染色判读(ER和PR)。
HER2:HER2是生长因子受体家族成员,该家族也包括EGFR(HER1)、ERBB3(HER3)和ERBB4(HER4)。它们调节正常细胞增殖、发育和存活。HER2在正常乳腺上皮细胞表面低表达。在10-20%的IBC中,HER2基因扩增,导致HER2蛋白在细胞表面过表达,进而导致侵袭性更强的肿瘤生物学,这是由于肿瘤增殖、细胞运动和血管生成的增加。目前有许多HER2靶向疗法,其中一些与第一个(仍然是标准治疗)抗HER2生物疗法曲妥珠单抗(赫赛汀)联合使用。任何新发的IBC-NST都需要进行HER2检测,因为阳性病例可以在化疗的基础上进行HER2靶向治疗,从而显著提高生存率。HER2蛋白的过表达可通过免疫组化进行评估,或通过原位杂交鉴定HER2扩增。详细的检测能力和判读建议可参阅本国制定的特定指南,例如ASCO/CAP发布的指南。由于免疫组化具有简便和廉价的优势,许多实验室使用免疫组化作为第一步检查进行;如果结果模棱两可(2+染色),病例自动转诊原位杂交(内部或参考实验室)。2018年更新的ASCO/CAP HER2检测指南建议更加重视使用免疫组化来指导异常原位杂交类别(所谓的组2、3和4)的判读和检测。HER2免疫组化和原位杂交的判读标准见图2.81(第89页)、图2.82和表2.07。

图2.81 IBC中HER2免疫染色的判读流程。
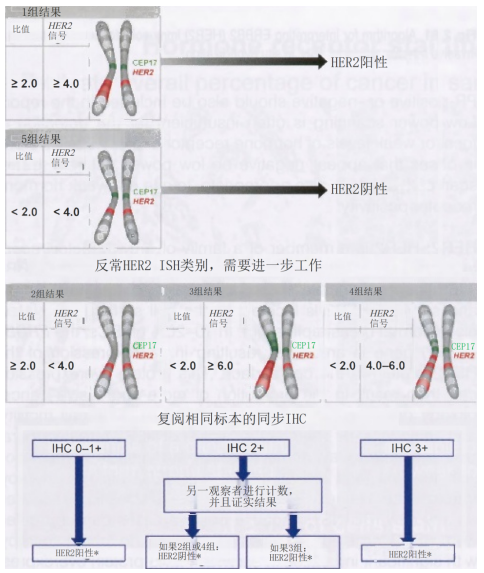
图2.82双探针HER2原位杂交(ISH)结果判读。
CEP17,染色体计数探针17;*由IHC和ISH共同确定。报告建议;详见ASCO/CAP指南。
染色强度的评估对于正确判读HER2免疫组化状态也至关重要,过度判读染色强度是HER2免疫组化(阳性)和原位杂交(阴性)之间不一致的最常见原因之一。染色强度与阴性(0-1+)和阳性(3+)对照的比较应作为强度评估的参考。一种实用的方法是使用放大倍数规则,该规则考虑到评估染色所需的放大倍数,如下所示:使用10倍目镜,如果用2-5倍物镜能观察到染色,则可以认为强染色;使用10-20倍物镜检测到的染色视为弱到中强度;仅在40倍才能检测到的染色视为弱/几乎看不到。判读者应注意异常的染色模式(例如聚集的异质性)和不一致的结果(例如1级癌呈3+HER2染色)。评估HER2免疫组化和/或HER2原位杂交的实验室和病理医师应参加外部质量保证活动,以确保结果的准确性。
表2.07 IBC标准要求的生物标记物:目的、报告和评分标准
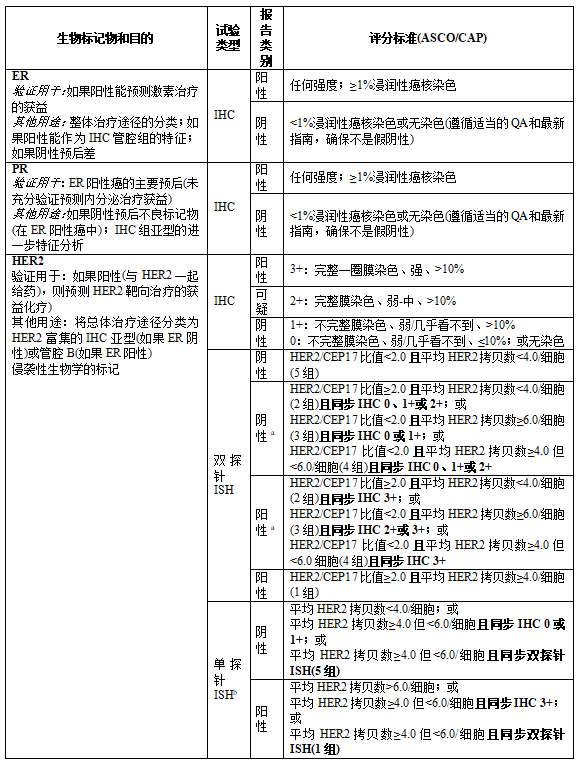
a 对于双探针2-4组,最终ISH结果基于对同步IHC的复片,如果IHC为2+,则由另一观察者重新计数ISH。
对第2组阴性结果的评注:在HER2/CEP17比值≥2.0和平均HER2拷贝数<4.0/细胞的一小部分病例中,HER2靶向治疗的疗效证据有限。在第一代辅助曲妥珠单抗试验中,该亚组中随机分配到曲妥珠单抗组的患者似乎没有获得无病生存期或总生存期的改善,但此类病例太少,无法得出明确结论。HER2的IHC表达应当用于补充ISH和确定HER2的状态。如果IHC结果不是3+阳性,建议认为该标本为HER2阴性,因为ISH导致的HER2拷贝数较低,且缺乏蛋白过表达。
对第3组阴性结果的评注:在HER2比值<2.0的情况下,关于HER2靶向治疗的疗效的数据不足,因为这些患者不符合第一代辅助曲妥珠单抗临床试验的条件。当同时进行的IHC结果为阴性(0-1+)时,建议认为该标本为HER2阴性。
对第4组阴性结果的评注:在没有蛋白过表达的情况下,≥4.0和<6.0的平均HER2信号/细胞和HER2/CEP17比值<2.0的患者在没有蛋白过表达(IHC 3+)的情况下是否从HER2靶向治疗中获益,是不确定的。如果标本检测结果接近阳性的ISH比值阈值,则重复检测很有可能仅仅是偶然导致的不同结果。因此,当IHC结果不是3+阳性时,建议标本考虑为HER2阴性,不对同一标本进行额外检测。
b 对于单探针ISH:建议复阅同步的IHC,作为判读单探针ISH结果的一部分。ASCO/CAP也优先建议使用双探针而不是单探针ISH分析。
激素受体阳性乳腺癌的组织学:激素受体阳性乳腺癌有多种形态和级别。其范围从高分化癌(形态温和的细胞形成管状/导管结构)到低分化癌(具有显著核多形性和更多片状生长)。然而,大多数ER强阳性和HER2阴性的乳腺癌属于中-低级别谱系。值得注意的是,低百分比ER阳性细胞(且HER2阴性)的癌的组织学特征更像高级别三阴性癌。由于典型的ER强阳性乳腺癌的发生途径包括其他高表达ER的非必然前驱病变/风险病变,如DCIS(主要为低-中核级别)、ADH、FEA以及小叶原位病变,这些病变常在ER阳性IBC NST背景下发现,有时占初始影像学表现的很大比例。种系BRCA2突变相关癌常为ER阳性。

图2.83乳腺癌分子亚型与临床病理特征的相关性。
三阴性乳腺癌的组织学:虽然三阴性(激素受体阴性,HER2阴性)乳腺癌也可以有多种形态(包括特殊类型,如AdCC和化生癌),但大多数IBC是高级别,肿瘤细胞显示高核质比、实性生长模式、常有推挤性边界和示地图样坏死。核分裂象计数通常很高(增殖指数通常>80%)。病灶可以有中心瘢痕和/或一个大的中心少细胞区,一些三阴性癌有密集的淋巴细胞间质浸润,这与更好的治疗反应有关。DCIS在三阴性癌中的检出率低于激素受体阳性癌。种系BRCA1突变相关癌常有这种形态。如上所述,ER阳性细胞百分比低(且HER2阴性)的癌组织学特征通常就像高级别三阴性癌。
HER2阳性乳腺癌的组织学:这些IBC通常为高级别组织学,常有高级别粉刺样DCIS背景。常有显著的核多形性,胞质比三阴性癌丰富、嗜酸性,有时使细胞呈模糊的大汗腺形态。增殖指数高,但平均低于三阴性癌(范围20-60%)。典型的生长模式包括浸润性条索状或实性细胞巢,偶见单行排列。
间质反应模式与肿瘤微环境
间质成分变化极大。可能有高度富细胞性纤维母细胞增生,很少结缔组织成分,或明显的玻璃样变。在导管周围或静脉周围也可出现弹性纤维增生灶。有些IBC NST显示纤维化病灶,定义为肿瘤内大于1 mm的过度反应性肿瘤间质形成区域,伴或不伴凝固性坏死,已报道这种病例显示更强侵袭性,独立于其他因素。
肿瘤中的免疫浸润称为TIL。TIL是浸润肿瘤及其间质的单个核淋巴细胞;它们反映了宿主对肿瘤细胞的免疫反应。IBC中TIL的范围作为预后标记物变得越来越重要,在三阴性和HER2阳性乳腺癌中,高数量的TIL伴有更好预后和对新辅助治疗的更好反应(见下文的预后和预测)。
对于TIL的量化,建议遵循内部共识评分建议。图2.84概述了这些步骤。建议在CNB或手术标本的HE染色组织切片上,在最具代表性的肿瘤组织块上以20-40倍物镜、10倍目镜进行定量分析。应在癌区之间的间质中对TIL进行评分,应包括所有的单个核细胞(淋巴细胞和浆细胞)。只计算间质面积中的间质TIL占比—总评估表面积不应包括癌细胞。瘤周淋巴滤泡聚集灶和具有生发中心的三级淋巴结构提示免疫反应活跃,但不应包括在间质TIL评估中。TIL定量应报告为百分比—基于分析的可用组织的平均得分。如果TIL分布不均匀,则应报告平均值,忽略热点。未来可能实现自动计数。
新辅助治疗后的形态学特征
乳房中的残留乳腺癌或瘤癌床及淋巴结中的反应可作为新辅助治疗反应的指标,可提供有价值的预后信息,应予以评估和报告。临床、影像学、大体和显微镜检查结果的多学科协作和融合,对于准确取样和组织学量化治疗反应至关重要。残留癌负荷指数是经过临床验证的标准化报告系统,它将乳腺反应和淋巴结反应纳入一个评分,可与其他新出现的预后因素相结合。
残留肿瘤细胞的改变,如有,变化程度极大。在耐受治疗的癌中,未检测到形态学改变。更常见的是,癌细胞变少,通常表现为散布在瘤床上的小巢。应记录整个残留癌灶的大小和细胞量,因为残留浸润癌的范围和淋巴结状态是预测长期生存的有力指标。少数病例中,残留癌细胞变得奇异,核大而不规则。残留癌细胞的胞质可能变成空泡状(约40%的病例)。部分病例中,唯一的残留癌位于淋巴管腔内,与新辅助治疗后的复发有关。残留癌的核分裂象计数通常较低。然而,组织学分级仍然是新辅助治疗后的预后因素,因此可能需要报告(这不是标准)。完全缓解后,只有结缔组织中疏松、水肿、血管化的纤维弹性组织区域与慢性炎性细胞和巨噬细胞,作为识别瘤床的标记。当只有不典型细胞的小病灶时,免疫组化研究可能有助于区分IBC和CIS的癌细胞与良性组织细胞。DCIS可能出现在无残留浸润癌的情况下。这一发现并不排除病理完全缓解,这些患者预后好。有时实施了初始性新辅助内分泌,但罕见导致病理完全反应。治疗后的癌可能有一个中心区域的纤维瘢痕。
新辅助治疗后,正常乳腺上皮结构可能显示非典型,表现为核增大,偶见多形性。它们可能与浸润性肿瘤部位有一定距离,存在于整个标本,而不仅仅位于瘤床附近;应注意不要过度诊断为原位疾病。辐射可使间质致密,细胞减少。导管和小叶的上皮细胞可显示稍不规则和深染的核,小叶可硬化。可见放射反应的纤维母细胞,也可见奇异的间质细胞。
鉴别诊断
IBC应鉴别乳腺恶性原位病变(CIS)和良性浸润性病变(硬化性病变、MA)。大多数IBC具有浸润性生长模式,但更明显的巢状模式可能貌似原位病变,如DCIS。相反,DCIS累及硬化性病变可能貌似IBC。良性硬化性病变,如SA和RS可能貌似浸润性病变的浸润模式。必需借助肌上皮染色来区分,浸润性病变周围缺乏肌上皮细胞。然而,肌上皮染色的正确判读很重要,因为部分病例中间质或血管染色可能貌似肌上皮细胞层。除了胞质染色(如calponin或SMMHC)外,核染色(如p63)有助于避免判读中的陷阱。
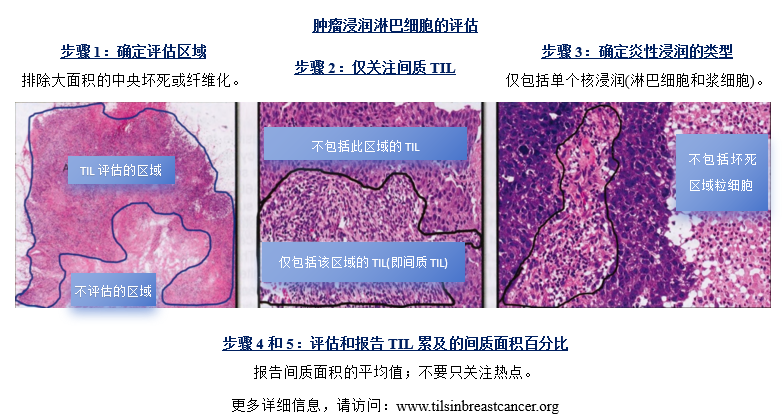
图2.84乳腺癌肿瘤浸润淋巴细胞(TIL)的评估。
可能假冒原发性IBC的罕见乳腺病变包括MA(貌似高分化IBC)和原发性乳腺黑色素瘤和淋巴瘤(貌似低分化IBC)。此外,原发性乳腺肉瘤可能类似(常有化生特征,但有时也像IBC-NST)IBC。恶性PT(特别是当病变缺乏PT的特征性上皮区域时)、原发性乳腺肉瘤-NOS和原发性或继发性乳腺血管肉瘤(上皮样亚型)也会遇到诊断困难。虽然罕见,但当出现异常生长模式或有既往病史或临床问题时,应考虑乳腺转移癌。最常见的乳腺转移癌包括肺腺癌、卵巢癌、子宫癌和肾癌。临床病史和免疫组化检查对正确诊断至关重要。IBC还应与原发性或转移性皮肤癌相鉴别,包括鳞状细胞癌(与化生性乳腺鳞癌鉴别)、皮肤附件癌和皮肤黑色素瘤。罕见病例中,原发性乳腺涎腺样癌可能需要与转移性涎腺癌进行鉴别,特别是如果有类似类型的涎腺癌的临床病史。
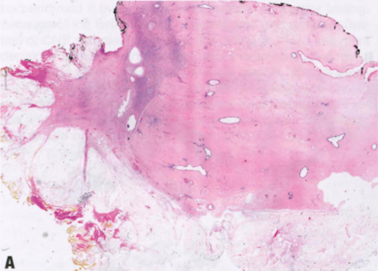
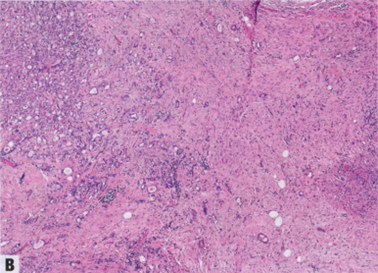
图2.85乳腺癌。A 低倍,乳腺癌新辅助化疗后,表现为部分反应,无残留癌的纤维化区域代表瘤床。部分瘤床可见残留的浸润性癌。B 高倍,新辅助治疗后残留乳腺癌。与活检相比,瘤床的肿瘤细胞量减少。
细胞学
由于无法从细胞学上区分CIS和IBC,CNB已在很大程度上取代了乳腺FNA,但在图像引导活检受限的情况下除外。然而,从可疑腋窝淋巴结或其他可疑转移部位的细针穿刺标本中制备的细胞学标本通常用于排除转移性乳腺癌,具有可接受的敏感性和高度特异性。FNA标本上ER/PR和HER2的分析应局限于转移病例,避免检测非癌乳腺组织。IBC的细胞学表现为高度富于细胞、松散粘附和单个不典型细胞的合胞体排列和极性丧失。核深染;核膜不规则增厚;核仁;核质比增加。细胞常呈三维簇状或合胞体排列,有时呈腺泡状或腺体样排列。恶性细胞通常比淋巴细胞或良性导管细胞大,但在高分化癌中,恶性细胞的增大不明显。核可偏心,呈浆细胞样。双极裸核不是特征。偶见胞质空泡、印戒细胞或细胞内腔。低分化癌的涂片可能含有多形性、奇异细胞和多核恶性细胞。
CNB
多年来,CNB作为一种非手术方法被广泛应用于乳腺病变的初始评估,与切除(开放)活检相比,它可以更快速地诊断可触及和不可触及的影像学检查结果。在影像学指导下,CNB对乳腺癌的诊断和初步分型具有高度的敏感性和特异性。CNB与开放性切除活检结果具有良好的相关性,对CNB的诊断符合率也较高。有时,在有限的CNB样本中不可能明确诊断浸润性癌。如果不能100%确定CNB侵犯的诊断,则将病变分为“可疑”、“不确定”、“不能排除浸润”或“恶性潜能不确定”等模棱两可的分类可能最为合适,并将其推迟至手术标本进行明确分类。当在CNB上诊断为浸润时,应报告初步的组织学分级,如果有足够的浸润癌可供检测,则可进行ER/PR和HER2检测。由于冷缺血时间有限,CNB样本固定良好,并且能够在手术前就可能的新辅助治疗作出治疗决定,因此CNB是这些辅助试验的首选样本类型。因此,所有乳腺穿刺活检应在处理前按照指南在福尔马林中进行充分的总固定时间(至少6小时),且不应匆忙处理。
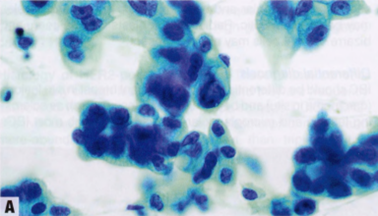
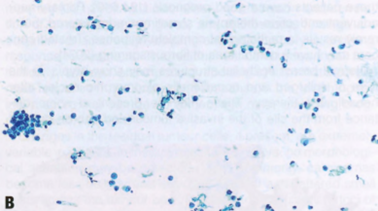
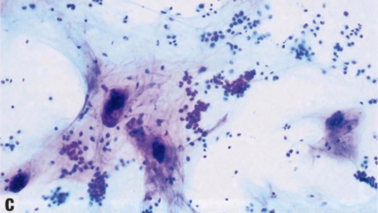
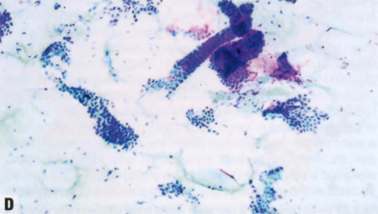
图2.86 FNA的形态学特征(巴氏染色)。A IBC-NST。B ILC,经典型。C 浸润性MC。D TC。
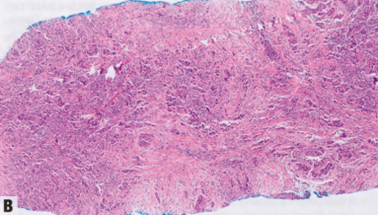
图2.87 IBC-NST。A 乳腺肿瘤的CNB显示IBC-NST。B 中倍镜下,IBC-NST表现为不规则的恶性肿瘤条索,位于慢性炎症细胞之间。
诊断性分子病理学
乳腺癌的分子分类
乳腺癌在分子水平上具有异质性,不同的基因表达模式导致行为和预后的差异。过去数年努力在分子水平描述和分类乳腺癌,以有效地定制治疗。然而,由于时间和成本的限制,在绝大多数医疗保健系统中,替代分子乳腺癌分类仍然主要基于生物标记物(ER、PR、HER2和Ki-67)的免疫组化评估。尽管如此,对全球基因表达模式(特别是参与调节细胞生长和细胞行为的其他重要方面,如浸润的基因)的研究已导致确定具有生物学和临床意义的内在分子亚型以及预测治疗结果或反应的基因特征。
内在亚型分类
在同一肿瘤的重复样本(即内在基因)之间和不同肿瘤之间的基因(变化更大)进行分层聚类分析(Hierarchical cluster analysis),发现存在四种主要的乳腺癌内在亚型(管腔A、管腔B、HER2富集和基底样),以及正常乳腺样组。其他罕见的亚型也被加入,如“claudin低”亚型,主要由三阴性肿瘤组成,预后不良。还尝试对主要亚型(包括HER2富集和三阴性亚型)进行进一步分类。为了提高固有亚型分类的标准化和可重复性,提出了一种基于50个基因(PAM50基因特征)的定量RT-PCR检测方法。选择这些基因将IBC分为管腔A、管腔B、HER2富集型和基底样亚型。由于高通量转录组分析成本高昂,而且并不广泛,因此进一步研发基于上述免疫组化生物标记物的分类,将肿瘤分为简表2.01(第96页)所示的五种亚型。
简表2.01第13届St.Gallen国际乳腺癌会议(2013)专家小组通过的早期IBC亚型的临床病理学替代定义,基于ER、PR、HER2和Ki-67的免疫组化,并在适当的情况下进行原位杂交确认

整合簇集分类(Integrative cluster classification)
根据基因组和转录组数据的整合,该分类将乳腺癌分为10个整合簇集亚组(IntClusters)。每个亚组都有不同的拷贝数畸变模式,并与不同的临床结局和治疗反应相关。其中6个亚组(Intcluster 1、2、3、6、7和8)主要包括ER阳性肿瘤和PAM50亚型管腔A和管腔B,但具有明显的基因组改变。IntCluster 10主要由ER阴性肿瘤组成,具有高度的基因组不稳定性和较差预后。IntCluster 4主要包括肿瘤内广泛淋巴细胞浸润。
三阴性乳腺癌分子亚类
三阴性乳腺癌(TNBC)是指免疫组化检测发现ER、PR和HER2表达缺失,导致靶向治疗选择有限。这是一组异质性肿瘤,具有不同的分子驱动因素和预后。利用基因表达数据,将TNBC分为以下四种肿瘤特异性亚型(TNBCtype-4):基底样1和基底样2(免疫反应不同)、间叶性和管腔AR。这些亚型表现出不同的生存模式和对新辅助化疗的敏感性。结合RNA和DNA分析也产生四种不同的亚型:管腔AR、间叶性、基底样免疫抑制和基底样免疫激活。每种亚型都有特定的治疗靶点(如管腔AR亚型中的AR和细胞表面黏蛋白EMA[MUC1]),并有不同的预后(如基底样免疫激活亚型的预后优于基底样免疫抑制亚型)。然而,尽管做出了多项努力,TNBC分类尚无确定的或临床验证的诊断方法。
IBC突变谱
乳腺癌亚型具有不同的突变模式,影响治疗反应和预后。管腔A型肿瘤有高频PIK3CA突变(49%),而基底样肿瘤主要是TP53突变(84%)。在早期疾病的情况下,PIK3CA总突变率为32%,且与患者年龄较大有关;组织学上分化良好且较小的肿瘤;ER阳性、HER2阴性肿瘤状态。最近批准了使用PIK3CA突变检测方法(通过RT-PCR)来确定晚期ER阳性乳腺癌患者是否适合接受alpelisib(PI3K抑制剂)治疗。
已尝试对TNBC的各种分子亚型的基因组驱动因素进行特征分析。基底样1亚型的基因组最不稳定,TP53突变率高(92%),DNA修复相关基因(BRCA2、MDM2、PTEN、RB1和TP53)拷贝数缺失。管腔AR肿瘤也发现较高的突变负荷,PIK3CA(55%)、AKT1(13%)和CDH1(13%)突变显著富集。
随着二代测序技术的广泛应用,越来越多的乳腺肿瘤被检测出多种突变和/或其他基因改变,如PIK3CA、HER2和ESR1突变。最近,全基因组测序的使用导致了突变特征的识别。这些特征可能反映病因学或生物学,例如,由于紫外线(UV)辐射或缺陷DNA修复途径造成的损伤。在乳腺癌中,已知BRCA1或BRCA2的遗传学突变(存在于约1-5%的乳腺肿瘤中)导致同源重组缺陷,并且可以使用全基因组测序来识别特征性标记。在没有BRCA1/2种系突变的患者中,也可能发现BRCA1/2功能异常的肿瘤,如散发性基底样/三阴性肿瘤。这导致了检测同源重组缺陷的工具的发展(例如HRDetect分析)。最近,复发性或4期HER2阴性的乳腺癌患者和已知BRCA1或BRCA2种系突变的患者视为针对这种缺陷的候选治疗方法,即聚(ADP-核糖)聚合酶(PARP)抑制剂。
利用二代测序技术,还可以量化肿瘤的总突变负荷,这与免疫治疗的治疗反应有关。乳腺癌的总突变负荷不如黑色素瘤高,但TNBC的总突变负荷(1.68突变/Mb)高于管腔型肿瘤(0.84-1.38突变/Mb)。在TNBC中,管腔AR亚型的总突变负荷似乎高于间叶性干细胞样亚型。因此,免疫治疗对某些亚型的乳腺癌,特别是TNBC亚型可能是有用的。
诊断标准
必要标准:乳腺上皮的浸润性恶性疾病,缺乏外周肌上皮细胞层(可能需要免疫组化),伴或不伴CIS;ER、PR和HER2免疫组化以指导分类、治疗和预后。
分期
国际癌症控制联盟(UICC)和美国癌症联合委员会(AJCC)发布的TNM系统是目前应用最广泛的乳腺癌分期系统。该系统获得关于原发部位(肿瘤,T)、区域淋巴结(淋巴结,N)和远处转移部位(转移,M)的肿瘤范围的信息。不需要特殊的分类技术,因此可以跨时间在不同地点收集可比信息。结合T、N和M信息来定义五个分期(0、I、II、III和IV),总结关于区域性疾病(肿瘤大小、皮肤或胸壁浸润以及淋巴结受累)的范围和远处转移的的信息。在个别病例中,这些信息对于作出有关控制局部疾病的决定以及确定系统治疗的价值非常重要。确定肿瘤分期对于组织类似患者进行临床试验、流行病学研究或其他类型的调查进行比较也是必不可少的。
临床分期和病理分期均适用于乳腺癌患者。临床分期取决于体格检查和影像学检查,无论是否经FNA或CNB确认。T和N的病理分类主要依赖于手术切除标本的大体和显微镜检查。在大多数患者中,T取决于浸润性癌的大小。如果存在多个浸润区域,则T分类基于最大病灶。有时,最好通过在玻片上测量肿瘤的大小来评估小肿瘤。为了确定最佳T分类,通常需要将大体、显微镜和影像学表现进行相关性分析。淋巴结应切成2 mm薄片进行评估,以确定所有大转移(转移>2 mm)。淋巴结中<2 mm但>0.2 mm(或>200个细胞)的转移性沉积灶称为微转移,并将病例定义为淋巴结阳性(pN1mi),而仅具有孤立肿瘤细胞(<0.2 mm)的病例被视为淋巴结阴性(pN0i+)以进行分期。M分型主要根据影像学检查结果确定,部分病例活检后病理证实。
约48%的乳腺癌表现为Ⅰ期,34%的乳腺癌表现为Ⅱ期,13%的乳腺癌表现为Ⅲ期,5%的乳腺癌表现为Ⅳ期。然而,分期分布取决于几个因素,包括人种/种族、患者年龄、ER状态;基于人群的乳腺癌筛查,这与就诊时较早分期有关。各组成部分之间也存在相关性;例如,只有19%的pT1肿瘤与淋巴结转移相关,只有1%与远处转移相关,而pT3肿瘤分别高达40%和10%。
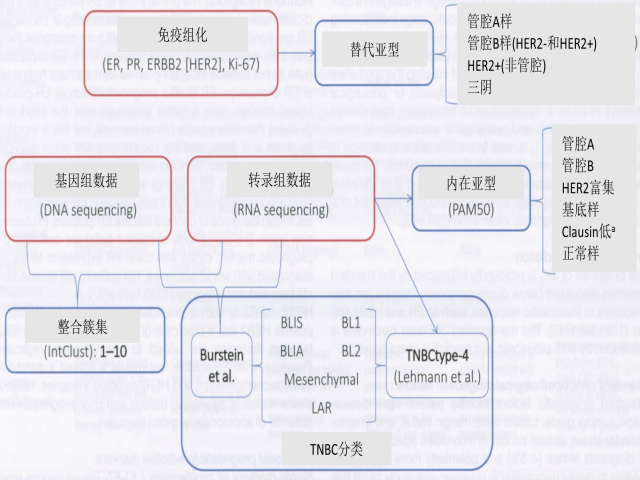

图2.88NST乳腺癌的分类(NST)。BL1,基生状1;BL2,基生状2;BLIA,基底样免疫激活;BLIS,基底样免疫抑制;LAR,管腔雄激素受体;TNBC,三阴性乳腺癌。a不包括在PAM50特征的分类中。
大多数乳腺癌首先通过引流肿瘤的淋巴管转移到区域淋巴结。第一站引流淋巴结称为前哨淋巴结。有1级证据提示,对该淋巴结进行取样评估可获得准确的分期,这种方法避免了无转移患者进行腋窝淋巴结清扫术和淋巴水肿风险。前哨淋巴结可以通过术前注射蓝色染料和放射性标记物到肿瘤周围的组织中来识别。腋窝淋巴结清扫术在转移灶总体<2.0 mm的患者中通常是不必要的。通常不需要免疫组化,但部分病例中(例如小叶癌或新辅助治疗后病例),它可用于阐明可疑或非典型细胞的性质。术中分子检测(如一步核酸扩增)高度敏感但尚未广泛使用,而冰冻切片或印迹细胞学不太敏感但更常用。然而,高分辨率超声评估淋巴结可以提供类似的作用,无需术中评估。在新辅助治疗中,前哨淋巴结检查的价值和残留孤立肿瘤细胞的临床意义尚不清楚,期待正在进行中的临床试验结果。
生物检测,如受体状态和基因表达谱,可以通过估计未来转移或复发的风险或预测可能的治疗反应来补充分期信息。AJCC癌症分期手册TNM分期系统的第八版与传统的解剖分期有很大不同,它引入了一个乳腺癌预后分期,该分期将解剖TNM信息与肿瘤内在生物学结合起来:即组织学肿瘤分级和预测性生物标记物(ER、PR和HER2表达),以及一个亚组患者的多基因检测。纳入这七个变量(T、N、M、ER、PR、HER2和分级)的拟议预后分期旨在改善患者的预后分层。在最终手术治疗(即新辅助或术前治疗)之前开始治疗,这种做法越来越普遍,要求结合来自临床检查、影像学和病理学检查的信息,以确定最可能的T、N和M分类,以及治疗前的肿瘤分级和受体状态。治疗后yT和yN分级在最终手术后确定。确定治疗前后的分期可提供重要的预后信息。
预后与预测
IBC的预后深受以下标准变量的影响。一些预后指标也是治疗反应的预测因素,如ER和HER2状态。乳腺癌的治疗受预后和预测特征的影响。
标准临床病理预后因素
标准预后因素包括患者年龄、疾病分期、肿瘤分级、肿瘤类型、切缘状态和淋巴管血管状态。诊断时年龄<35岁的乳腺癌患者罕见(<5%),具有更强的侵袭性潜能,导致更多的化疗。然而,一项研究发现,诊断时年龄较大的患者比年轻患者的疾病特异性死亡率高17%。据报道,小的早期乳腺癌(TNM T1a/bN0M0期)相关的10年乳腺癌特异性死亡率低至4%。局限性乳腺癌患者(约占患者的60%)的5年相对生存率大于95%,累及区域淋巴结者降至85%,转移性疾病者约为25%。切除的完整性也是影响局部复发的一个重要因素,但已证实,对保乳手术后局部复发有显著影响的唯一切缘状态是切缘阳性(0 mm,肿瘤位于墨水处)。因此,大多数指南支持IBC的“墨水处无浸润性肿瘤”切缘和DCIS的2 mm切缘(DCIS不伴浸润)是足够的。若有淋巴管血管侵犯(血液或瘤周淋巴管中的瘤栓),应予以报告,因为它与局部复发(即使乳腺切除术中也可能需要放射治疗)和远处复发的风险有关,特别是淋巴结阴性患者。
标准要求的预后/预测标记物
激素受体和HER2状态:IBC细胞的激素受体(ER和PR)状态和HER2状态视为IBC治疗决策中不可或缺的预测和预后因素,正如St.Gallen国际乳腺癌专家组、ESMO、ASCO和NCCN发布的指南。激素受体和HER2状态的评估是强制性的,通常对所有IBC都是自发执行的。
激素受体:ER状态的主要作用是作为预测标记物:核表达ER>1%的乳腺癌患者比表达<1%患者(不受益)更可能受益于内分泌治疗。大多数ER阳性乳腺癌具有高水平的ER表达。ER也是预后因素:ER强阳性乳腺癌在短期(5年)内的预后优于ER阴性乳腺癌,但这一情况会因分级和分期而改变,并且在最初诊断后几十年内可能发生晚期复发。ER低水平(通常定义为1-10%ER染色)的乳腺癌少见,但其预后似乎比ER高表达的乳腺癌更差。在ER阳性乳腺癌组中,PR表达水平(染色细胞的百分比)视为一个预后标记物:PR表达水平较低的病例预后较差,但患者仍能从内分泌治疗中获益。
HER2:HER2是预测和预后的标记物。当HER2靶向治疗加入化疗方案时,HER2检测阳性可预测生存获益。因此,HER2阳性检测使患者成为化疗和HER2靶向治疗的候选对象。在缺乏合适的靶向治疗的情况下,HER2也是侵袭性生物学和不良预后的标记物。
其他预后/预测标记物
单一增殖标记物/Ki-67:在治疗决策中,尤其是在化疗方面,乳腺癌增殖指数是评估疾病侵袭性的重要参数。Ki-67未普遍使用或正式推荐,原因是缺乏关于评分和阈值的国际共识,以及可能缺乏重复性。尽管如此,它可能具有临床价值(如果可用和准确评分),作为一个补充,以确定预后和潜在的化疗效益的分级。由于ER阴性、HER2阳性和ER阴性、HER2阴性的乳腺癌具有高度增殖性(Ki-67增殖指数:30-100%),因此这些乳腺癌的生长速度更快,并且更常接受化疗。ER阳性肿瘤的增殖范围更广,高增殖形式与侵袭性更强的行为相关,但大多数病例的Ki-67增殖指数<20%。14%或15%的阈值有助于区分可能与侵袭性更强的管腔B分子亚型(Ki-67增殖指数>14%或15%)相关的病例与侵袭性不太强的管腔A分子亚型(Ki-67增殖指数<14%或15%)相关的病例。然而,作为对化疗反应的预测,这一阈值尚未被验证。基于一组检测项目的基因表达分析主要是增殖驱动的,如21基因复发评分(RS;见下文),已经在ER阳性乳腺癌中验证了这一目的。值得注意的是,IHC4是一种基于免疫组化的四种标记物的检测方法,包括Ki-67,在ATAC试验中显示,它与21基因RS一样能够预测辅助内分泌治疗患者的远处复发残留风险,尽管尚未获得监管机构的认可。通常,Ki-67被用作一种初步、廉价但非预测性的增殖标记物。将Ki-67结果与其他发现(如分级、ER状态或HER2状态)相关联,也有助于确保所有发现相互关联良好,并准确描述乳腺癌生物学特征,以预测预后。
AR状态:最近的系统评估和荟萃分析数据提示,免疫组化AR表达和联合基因分析高AR mRNA水平与早期乳腺癌患者无病生存率和总生存率的提高相关。然而,AR在ER阳性和ER阴性乳腺癌中的作用似乎是复杂的,AR作为激素/雄激素靶向治疗反应预测因子的数据目前有些不足,仍在研究中。因此,AR检测目前并不是所有乳腺癌病例的标准做法,但在某些临床环境中可能需要AR检测。
新辅助治疗反应的评估:新辅助治疗后病理完全缓解对HER2阳性和三阴性乳腺癌的预后有很高的预测价值。残留癌症负荷指数可用于确定与残留疾病复发相关的风险等级。要量化和报告的参数以及计算器可在线获取。
基因表达特征:基因表达特征可用于某些国家的临床实践(如可用和/或报销),用于ER阳性、HER2阴性乳腺癌的化疗决策。由基因表达特征定义的低风险患者可以免于化疗,而高风险患者应该从化疗中获益。有几种特征分析可用(见表2.08,第99页)。第一代标记(21个基因RS和70个基因标记)在检测中心执行,其预后价值得到1a级证据的支持。ASCO、ESMO、欧洲肿瘤标记物小组(EGTM)和St.Gallen小组在某些临床情况下认可使用这些分析方法。一致认为,对于ER阳性、HER2阴性、淋巴结阴性的早期乳腺癌(根据传统标准,其被认为具有较高的临床复发风险),基因组风险评分结果较低的患者可以安全地避免使用辅助化疗。在1-3个淋巴结阳性的患者中使用这些标记更具争议。
21基因RS:基于21个基因(16个癌症相关基因和5个参考基因)表达的定量RT-PCR标记,用于福尔马林固定石蜡包埋组织样本提取的RNA。该评分是一个数学函数,用于预测ER阳性、HER2阴性、淋巴结阴性乳腺癌患者10年后远处复发的风险。它是10年内远处复发风险相关的连续变量(范围从0到100),也是ER阳性、淋巴结阴性的乳腺癌患者接受辅助内分泌治疗(即他莫昔芬和芳香化酶抑制剂)的独立预后因素。根据21基因RS分为低危(评分<18分)、中危(评分18-31分)和高危(评分>31分),10年复发率分别为7%、14%和30%。对于ER阳性、HER2阴性的乳腺癌,它也与化疗获益相关。对它进行了一项随机前瞻性试验,获得了1a级证据的支持,这些证据使用了新的RS阈值,根据RS和患者年龄的组合对增加化疗的获益进行了分层。NCCN、ASCO、ESMO、EGTM和St.Gallen小组也支持21基因RS用于ER阳性、HER2阴性、淋巴结阴性的乳腺癌。它在3个淋巴结阳性患者中使用的试验正在进行中。21基因RS和70基因RS已被纳入AJCC癌症分期手册第八版乳腺癌分类。低基因组风险结果可使ER阳性、HER2阴性、淋巴结阴性的肿瘤下降至与T1a-bN0M0相同的预后类别。
表2.08 ER阳性、HER2-阴性乳腺癌中用于化疗决策的基因表达特征
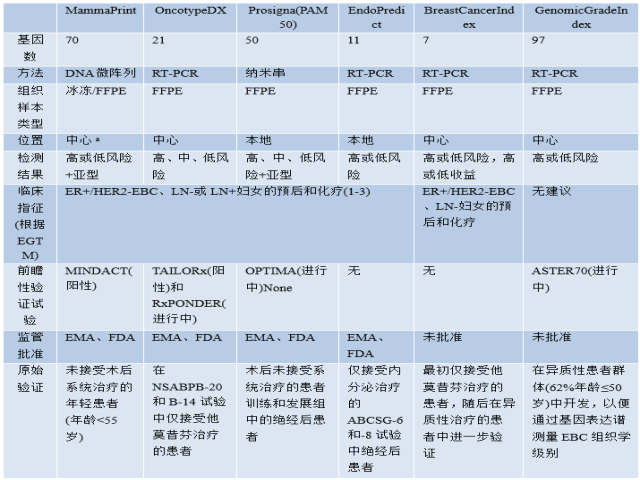
EBC,早期乳腺癌;EGTM,欧洲肿瘤标记物组;EMA,欧洲药品管理局;FDA,美国食品和药品管理局;FFPE,福尔马林固定、石蜡包埋;LN,淋巴结;NSABP,国家外科辅助乳腺和肠道项目;RT-PCR,逆转录酶PCR。a Descentralization允许进行本地测试,正在进行中。
70基因特征:70基因预后特征是一种基于微阵列的检测方法,可用于判断I期或II期、肿瘤大小<5.0 cm的淋巴结阴性IBC患者的预后。随后,在3个淋巴结阳性的患者中进行了检测。这种二分法测试将肿瘤分为预后良好或不良,这是远处转移的独立预测因素。70基因标记提供的预后信息主要来源于ER相关和增殖相关基因的表达水平;因此,对于ER阳性、HER2阴性的乳腺癌是有用的,但对其他乳腺癌亚型的作用有限或不存在。该试验目前可在福尔马林固定的石蜡包埋组织中进行,其分析有效性相当于新鲜冷冻组织。70基因特征的预后价值得到1a级证据的支持,其使用得到ASCO、ESMO、EGTM和St.Gallen小组的认可。一致认为,对于ER阳性、HER2阴性、淋巴结阴性的早期乳腺癌(根据传统标准,其被认为具有较高的临床复发风险),具有70个基因特征码且基因组风险较低的患者可以安全地避免使用辅助化疗。在1-3个淋巴结阳性的患者中使用这种检测更具争议。高基因组风险(如特征所定义)已被证明与对新辅助化疗的更高敏感性相关。因此,在新辅助治疗的临床试验中,70基因也被用作选择因子。可使用专用仪器评估第二代特征。对于接受激素治疗的ER阳性、HER2阴性患者的预后价值,他们有1b级证据。高风险第二代特征预测晚期复发,但这一信息的临床价值低,因为目前具有高风险特征的患者接受辅助化疗。因此,回顾性试验产生的数据在这种情况下是无效的,因为试验参与者只接受激素治疗。
预后评分系统
预后评分系统,如诺丁汉预后指数(NPI)和Adjuvant!Online(www.adjuvantonline.com)纳入患者年龄、疾病分期、ER状态和肿瘤分级等临床参数,但不包括HER2状态。另一种预测方法,Predict(https://breast.predict.nhs.uk/),不包括HER2状态。这些方法可以指导治疗决策。基于Magee方程的RS是一种基于肿瘤病理特征(Scarff-Bloom-Richardson分级、ER和PR的H评分、HER2状态、Ki-67增殖指数和肿瘤大小)的非商用性预测工具,可用Magee方程估计21个基因RS。如果估计的Magee得分明显高或低,则可以使用Magee方法代替实际的21个基因RS。
肿瘤浸润淋巴细胞
TIL的检测作为一种预后指标越来越重要。在三阴性和HER2阳性乳腺癌中,高数量的TIL与更好的预后和对新辅助治疗的更好反应相关(1b级证据)。TIL在改善接受标准辅助/新辅助化疗(1b级证据)治疗的早期TNBC的远处无复发生存率、无病生存率和总生存率的估计方面具有很强的预后价值。这一发现基于病理医师在诊断时(治疗前)和新辅助化疗后残留疾病中使用HE染色玻片的评估。IBC中TIL的存在和范围因肿瘤而异。在诊断过程中,HE染色组织切片上TIL的定量是可行的,并遵循国际建议。计算病理学方法的发展很可能在未来几年内实现自动计数。临床效用(用于治疗分配)正在调查中。TIL应被视为临床试验中的一个分层因素,并应纳入累及或评估预后的研究。建议遵循国际共识评分建议来量化TIL。
与免疫检查点治疗相关的标记物(PD-L1测试)
关于多种肿瘤类型(包括乳腺肿瘤)的免疫检查点阻断治疗的临床试验证据正在迅速发展。针对PD1/PD-L1通路或CTLA-4的单克隆抗体被认为通过消除对抗肿瘤免疫反应的抑制而发挥作用。来自III期临床试验的数据提示,转移性TNBC中>1%免疫细胞的免疫组化PD-L1表达可预测当一线阿替唑珠单抗添加到蛋白结合紫杉醇(nab紫杉醇)中时,无进展生存率和总生存率的改善。如果进行检测,建议使用经批准和验证的抗体及其相应的器官特异性评分系统。然而,该领域正在迅速发展,其他生物标记物可能出现,这对于预测对检查点抑制剂的反应非常重要。
Invasive breast carcinoma of no special type
2.8.2 浸润性乳腺癌(IBC)-非特殊型(NST)
定义
“IBC-NST”是指在形态学上不能归类为任何特殊组织学类型的一大组异质性IBC。
ICD-11编码
8500/3 浸润性导管癌(infiltrating duct carcinoma,IDC)-NOS
8290/3 嗜酸细胞癌
8314/3 富脂质癌
8315/3 富糖原癌
8410/3 皮脂腺癌
ICD-11编码
2C61.0&XH7KH3 IBC-NOS&IDC-NOS
相关命名
可接受:IBC-NOS-NOS;IDC;浸润性导管癌(invasive duct carcinoma,IDC)。
不推荐:浸润性乳腺癌(invasive mammary carcinoma,IMC)-NST。
亚型
IBC-NST可见多种组织学模式,包括一些特殊的形态学模式(见下文组织病理学),但这些模式不视为临床上不同的亚型。为便于管理,IBC-NST根据ER和HER2状态进一步分为以下生物标记物定义的亚型/组:ER阳性、HER2阴性;ER阳性、HER2阳性;ER阴性、HER2阳性;ER阴性、HER2阴性。
部位
IBC-NST除了都是乳腺原发的浸润性癌外,没有独特的部位特征(见“2.8.1 概述”;第82页)。
临床特征
见“2.8.1 概述”(第82页)。
流行病学
见“2.8.1 概述”(第82页)。
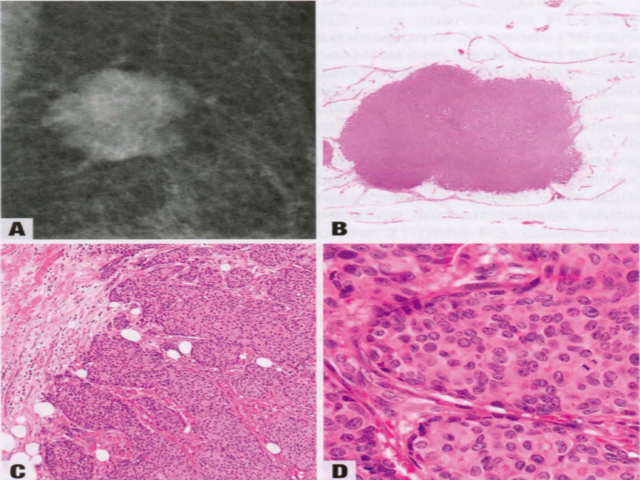
图2.89 IBC-NST呈膨胀性生长模式。A 乳腺X线,边缘微分叶状的多边形肿块。B 肿瘤的全组织切片。C 肿瘤由浸润性癌的实性和大巢组成。D 肿瘤组织学分级为2级,中分化,ER阳性,PR阳性,HER2阴性。
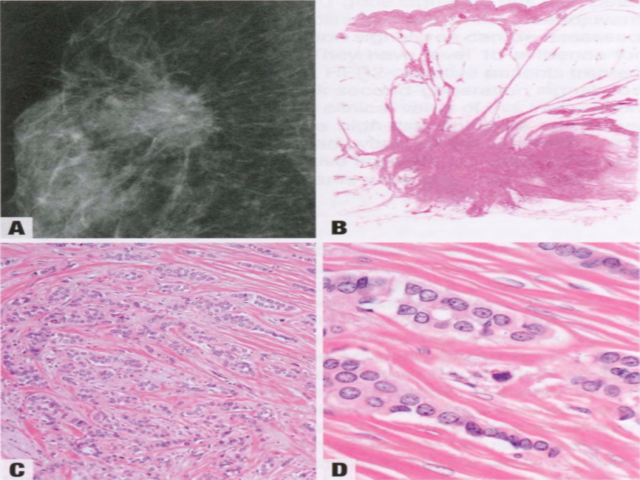
图2.90 IBC-NST,呈毛刺状浸润模式。A 乳腺X线,不规则、毛刺状肿块。B 全组织切片示星形肿瘤。C 尽管可见小梁模式和单行浸润伴明显纤维化,但ILC的细胞形态学特征缺失。D 肿瘤组织学分级为2级,中分化,ER阳性,PR阳性,HER2阴性。
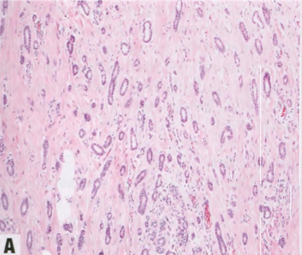
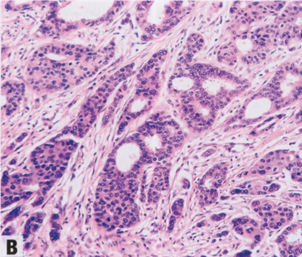
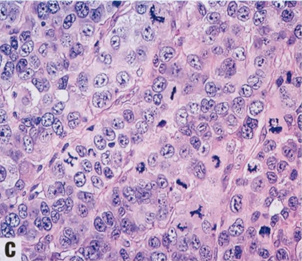
图2.91 IBC-NST。A 诺丁汉1级。B 2级。C 3级。
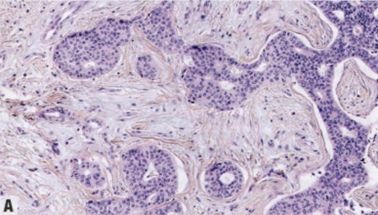
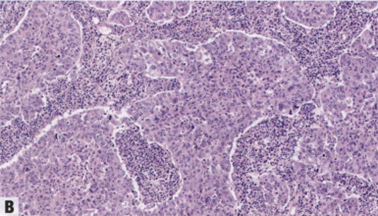
图2.92 IBC-NST。A 肿瘤浸润淋巴细胞稀少(约1%)。B 肿瘤富含肿瘤浸润淋巴细胞(约95%)。
病因学
总体上乳腺癌(见“2.8.1 概述”,第82页)和IBC-NST的已知危险因素之间没有公认的差异。
发病机制
见“2.8.1概述”(第82页)。
大体表现
见“2.8.1 概述”(第82页)。
组织病理学
一般组织学特征
不同病例之间,IBC-NST的组织学特征有相当大的差异,甚至在同一病例中也可能有所不同。所有类型的肿瘤边缘均可观察到,从高度侵袭性(穿透周围的间质并破坏正常的小叶单位)到连续的推挤性边缘和膨胀性生长模式。在结构上,肿瘤细胞可以排列成条索状、簇状和小梁状,一些肿瘤的特征是以实性或合胞体浸润模式为主,只有很少相关的间质。在一定比例的病例中,腺体分化可能形成明显的管状结构,有中心管腔,位于肿瘤细胞群中。偶见单行浸润或靶环样特征,但缺乏ILC的细胞形态学特征;与小叶癌相比,肿瘤细胞常有更明显的多形性,并且通常表达膜E-cadherin。可见广泛的核分裂象和凋亡活性以及坏死。与形态学变化相似,诺丁汉分级也呈现宽广的变化范围(关于分级的详细信息,参见“2.8.1 概述”,第82页)。
间质成分变化极大。可能有高度富细胞性纤维母细胞增殖,结缔组织成分稀少,或明显的玻璃样变。一些IBC NST伴有明显的纤维化,呈硬癌模式,形成不规则毛刺状肿块,弥漫性浸润周围组织。弹性组织增生灶也可出现在导管周围或静脉周围。可能存在局灶性坏死,偶尔广泛坏死并形成继发性囊腔。在少数病例中,可发现明显的肿瘤相关淋巴浆细胞浸润。
图2.93 IBC-NST和特殊亚型的混合。IBC-NST(左上)与ILC(左下)混合。
高达80%的病例伴有DCIS灶,部分病例有广泛的DCIS。并存的DCIS通常与浸润性癌具有相同的核级别。约20-30%的IBC NST显示淋巴管血管浸润或神经周围浸润。淋巴管血管瘤栓通常见于淋巴管腔,罕见于血管腔。脉管瘤栓可见于整个肿瘤,但在乳腺癌中只有肿瘤外淋巴管血管浸润才需要常规评估,并区分组织收缩假象。
IBC-NST和特殊亚型的混合
某些IBC可能同时包含IBC-NST和特殊亚型。如果特殊亚型占肿瘤的10-90%,可使用“IBC-NST和特殊亚型混合癌”一词。对于这种混合癌,建议报告存在两种成分,以及特殊亚型的占的总体百分比,例如,“IBC-NST和ILC(占30%)混合癌”。应报告两种成分的级别和生物标记物状态,因为它们可能不同。含有<10%特殊亚型的癌应归类为IBC-NST,在报告备注中可选择描述局灶性特殊亚型。含有>90%以上特殊亚型的肿瘤应归入特殊亚型癌。
特殊形态学模式
嗜酸细胞癌、富含脂质癌、富含糖原癌、透明细胞癌和皮脂腺癌是罕见的肿瘤,没有足够的临床证据将其命名为特殊的肿瘤亚型,其特定模式视为IBC-NST分化谱系的一部分。与此相似,伴髓样模式的癌、伴神经内分泌分化的癌、伴多形性和绒癌模式的癌、伴黑素细胞特征的肿瘤目前视为IBC-NST的特殊形态学模式。无论其分化程度/模式如何,这些肿瘤都视为IBC-NST的形态学模式,显示任何这些模式的肿瘤不适用定义特殊亚型的90%规则(见下文)。
髓样模式(Medullary pattern):以往描述为髓样癌、不典型髓样癌或具有髓样特征的癌,以前视为一种特殊类型的边界清楚的乳腺癌,组织学分级高,推挤性边界,合胞结构、无腺体结构,坏死区域,显著的肿瘤浸润淋巴细胞(TIL),临床预后优于其他分期匹配的高级别癌。这些肿瘤通常激素受体(ER和PR)和HER2为阴性(三阴性),并且它们可变地表达基底样标记物,如CK5/6、CK14、EGFR(HER1)和p53。然而,也可弱表达激素受体。这些高级别肿瘤常见基因组不稳定性,并高度增殖。作为一个诊断类别,“具有髓质特征的癌”在观察者之间的可重复性差,其特征与具有基底样分子特征的癌和与BRCA1突变相关的癌重叠。此外,最近发现TIL在高级别乳腺癌中的预后重要性似乎可以解释这些乳腺癌的良好预后(以及不符合髓样癌严格标准的高级别乳腺癌)。
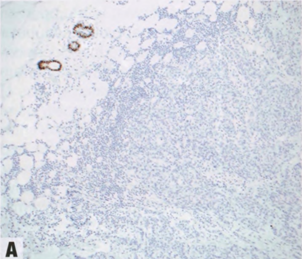

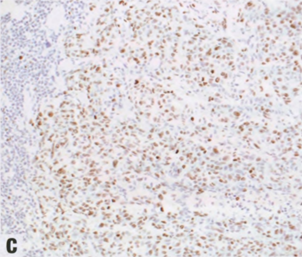
图2.94 IBC-NST伴基底样或髓样模式。A 肿瘤不表达ER(内对照阳性),但也可能弱表达,不排除该诊断。B 肿瘤常表达基底样标记物,如CK5/6(如图),但不是诊断所必需。C 肿瘤具有高增殖,Ki-67增殖指数通常>50%,如本例所示。
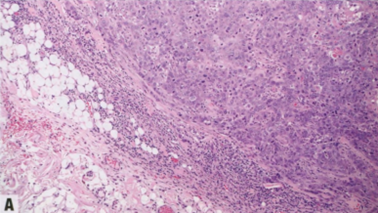
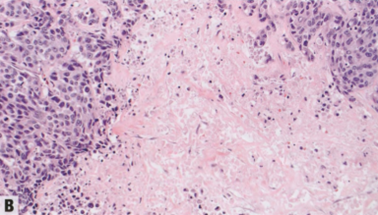
图2.95 IBC-NST伴基底样或髓样模式。A 以基底样或髓样模式为特征的高级别IBC-NST,诺丁汉分级高,推挤性边界,合胞体结构,肿瘤边缘常有明显的肿瘤相关淋巴细胞。B 常见地图样坏死区。
因此,出于临床目的,现在建议将具有髓样模式的癌视为代表富含TIL的IBC NST谱系的一端,而不是一个独特的形态学亚型,并使用术语“具有髓样模式的IBC-NST(IBC-NST with medullary pattern)”。这些肿瘤可以描述为具有与基底样分子谱相关的组织学特征,如果与临床相关,则可以对TIL的程度进行一些量化。然而,在诊断时将它们归入IBC-NST,加上描述髓样模式或基底样特征的修饰语。具有这些特征的肿瘤属于三阴性肿瘤的免疫调节亚组,其主要特征是免疫相关和炎症基因的高水平表达。
伴有神经内分泌分化的浸润性癌(Invasive carcinoma with neuroendocrine differentiation):经组织化学和免疫组化分析,10-30%的NST癌检测到某种程度的神经内分泌分化,但在某些特殊型癌中更常见,特别是MC和SPC(分别为20%和72%)。具有神经内分泌分化的浸润性癌NST与乳腺高分化神经内分泌肿瘤(NET,其表现类似于以前的类癌)和更高级别的NEC(见第156页神经内分泌肿瘤和第159页NEC)的区别是基于浸润性癌中神经内分泌分化的组织学特征的存在和程度。如果神经内分泌组织学特征和神经内分泌标记物表达不明显或不一致,不能将一种肿瘤归类为乳腺少见的NET或NEC,而是诊断为具有神经内分泌分化的IBC-NST。虽然神经内分泌标记物在乳腺癌中的表达可能被低估,但由于目前神经内分泌分化作为一个独立的特征并没有临床意义,因此不推荐对IBC进行常规的神经内分泌标记物染色。这些乳腺癌通常是激素受体阳性和HER2阴性。
伴有破骨细胞样间质巨细胞的癌(Carcinoma with osteoclast-like stromal giant cells):尽管在任何类型的乳腺癌间质中都可以发现破骨细胞巨细胞,在此进行详细描述。伴有破骨细胞样间质巨细胞的癌常伴有炎性、纤维母细胞性、富血管性间质,红细胞、淋巴细胞、单核细胞以及单核和双核组织细胞外渗,其中一些含有含铁血黄素。在淋巴结转移和复发中可观察到巨细胞和富血管反应性间质。病变的癌变部位通常是高分化至中分化IBC,但也观察到所有其他组织学亚型(最常见的ICC),鳞状和其他化生型。巨细胞CD68表达均匀,S100和肌动蛋白表达阴性。角质蛋白、EMA、ER和PR均为阴性。巨细胞对酸性磷酸酶、NSE和溶菌酶呈强阳性,而碱性磷酸酶呈阴性,这提示巨细胞与组织细胞和破骨细胞的形态相似。在含有破骨细胞样间质巨细胞的浸润性癌中观察到的基因组畸变支持其分类为IBC-NST。预后与相关癌的特征有关,且不受间质巨细胞的累及。
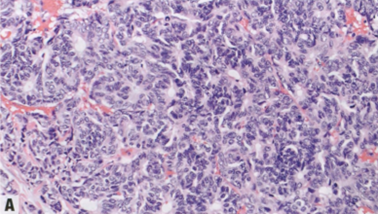
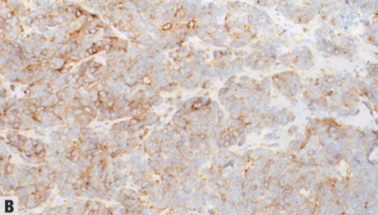
图2.96 IBC-NST伴神经内分泌分化。A 本例特点是胞质稀少的细胞巢缺乏,低-中级别核围绕流产的管腔并有极性。免疫组化,这些肿瘤通常不同程度地表达神经内分泌标记物。重要的是,没有罕见的高级别NEC(例如小细胞或大细胞癌)的特征,也没有特殊亚型(例如黏液性或SPC)的特征。乳腺少见的低级别肿瘤(神经内分泌肿瘤;NET)的诊断应保留在具有特别一致的神经内分泌特征和类癌样外观的乳腺癌,尽管目前缺乏将该实体与具有神经内分泌分化的浸润性癌区分开来的严格标准。B 神经内分泌分化浸润性癌表达Syn。
多形性模式(Pleomorphic pattern):多形性癌是高级别IBC-NST的一种罕见模式,其特征是多形性和奇异(有时多核)的肿瘤巨细胞增殖占背景中腺癌或具有化生性梭形和鳞状分化的腺癌的肿瘤细胞的50%以上。这些肿瘤可能是IBC-NST去分化的极端或化生性梭形细胞癌分化一部分。激素受体通常阴性,但有部分病例过表达HER2。腋窝淋巴结转移率占病例的50%,大部分病例中累及≥3个淋巴结。许多患者为晚期疾病。一项研究报道,在这些肿瘤中存在梭形细胞化生成分与不良预后相关。
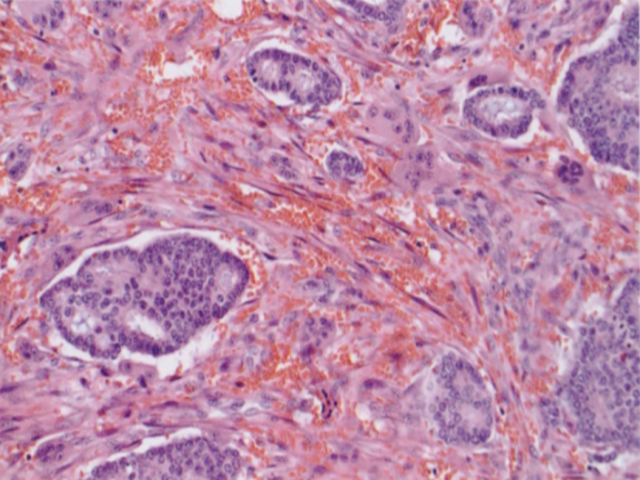
图2.97 IBC-NST,破骨细胞样巨细胞模式。A 高分化浸润性癌伴显著的富血管间质、红细胞外渗的和多个破骨细胞样巨细胞。具有破骨细胞样巨细胞的浸润性癌呈不同的区域分布。

图2.98 IBC-NST,多形性癌模式。有广泛的多形性、增大和奇异的细胞,部分细胞有多核。
绒癌模式(Choriocarcinomatous pattern):IBC-NST患者血清hCG水平可能升高,高达60%的病例含有hCG阳性细胞。然而,绒癌分化的组织学证据非常罕见,只有少数病例报道;均为50-70岁女性。

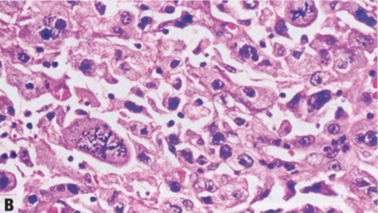
图2.99 IBC-NST伴绒癌特征。A、B 多核肿瘤细胞具有污浊核,胞质不规则、伸长并围绕着成簇的单核肿瘤细胞,貌似绒癌的双相生长模式。注意高级别癌中异常的核分裂象。
黑色素模式(Melanotic pattern):少数病例描述了乳腺实质的个别肿瘤,似乎代表导管癌和黑色素瘤的组合。部分病例中似乎存在两种细胞类型的过渡。一例遗传学分析显示,在肿瘤的所有组成部分的相同染色体位点的杂合性丢失,这提示起源于同一肿瘤克隆。仅在乳腺癌细胞中存在黑色素不是黑色素细胞分化的证据,因为当乳腺癌侵犯皮肤并累及皮肤表皮交界处时,癌细胞可能发生黑色素沉着。此外,必须区分乳腺癌中脂褐素沉积。大多数乳腺黑色素瘤代表乳腺外起源的黑色素瘤的转移。原发性黑色素瘤可能起源于乳房皮肤的任何地方,但乳头乳晕复合体起源者极为罕见。乳头乳晕区黑色素瘤的鉴别诊断必须包括Paget病,其细胞可能偶尔含有黑色素。
嗜酸细胞模式(Oncocytic pattern:):部分乳腺癌呈嗜酸细胞分化,胞质含有大量线粒体,呈嗜酸性颗粒状。其临床特征与IBC-NST无异;因此,这些特征主要涉及与大汗腺分化的鉴别。一项研究中,76例连续的IBC-NST中有19.7%存在富含线粒体的特征,即>50%的肿瘤细胞的强阳性线粒体免疫染色。嗜酸细胞型的肿瘤细胞以实性生长为主,具有片状、岛状和推挤性边界的巢状结构。偶见乳头状、丛状和腺样结构。胞质丰富,有明亮的嗜酸性颗粒,胞质边界清楚。核圆形,位于中央,核仁明显。这些乳腺癌通常表现为11q13.1-q13.2和19p13的染色体获得,这可能与线粒体积累有关。这些染色体区域的改变常见于肾和甲状腺的嗜酸细胞肿瘤。ER、PR和HER2表达不一致。ER表达率为78%,PR表达率为62.5%,HER2表达率为25%。CIS检出率为64.4%。由于伴有嗜酸性颗粒性胞质的乳腺癌并不少见,“IBC-NST伴嗜酸细胞癌模式”一词仅适用于具有典型形态和适当免疫组化和/或超微结构特征的病变。这些病变应鉴别大汗腺分化的肿瘤,后者通常为激素受体阴性和AR阳性。
富含脂质模式(Lipid-rich pattern):胞质含有丰富的中性脂质,形成胞质空泡,苏丹红Ⅲ或油红O染色阳性,而PAS、AB或黏液卡红染色阴性。核不规则,中重度异型性,有一个或多个核仁。核分裂象易见。大多数病例归入组织学3级。据报道,大多数病例ER和PR均为阴性,倾向于HER2阳性和高增殖。文献中HER2阳性率为50%-100%。肿瘤细胞表达α-乳清蛋白(lactalbumin)、乳铁蛋白(lactoferrin)、EMA和嗜脂蛋白(adipophilin),但不表达CK5/6、CK14、S100或肌上皮标记物。
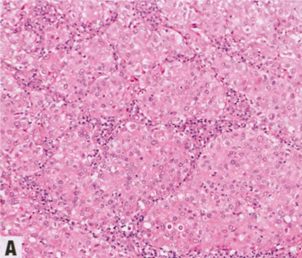
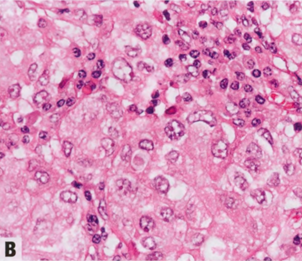
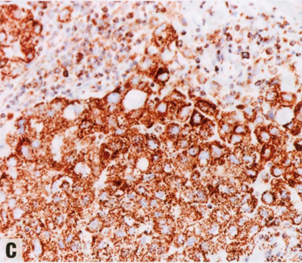
图2.100 IBC,嗜酸细胞模式。A 肿瘤细胞含有丰富的嗜酸性颗粒性胞质。B 核圆形,核仁明显。C 线粒体抗体免疫染色呈强阳性。
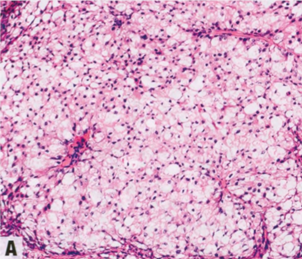
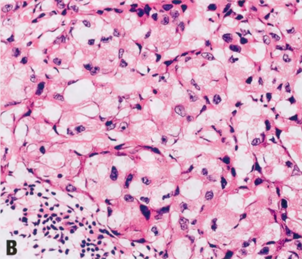
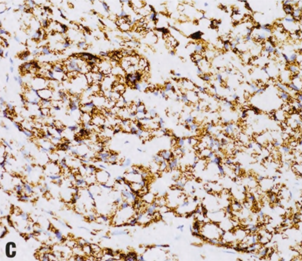
图2.101 IBC,富含脂质模式。A、B 肿瘤细胞大,多角形,胞质丰富,胞质呈泡沫状或含有多个空泡。C 嗜脂蛋白染色阳性。
富含糖原的透明细胞模式(Glycogen-rich clear cell pattern):有大量含有糖原的透明胞质。大多数富含糖原的透明细胞癌(GRCC)呈片状、巢状或线状生长,也可见乳头状、小叶状或管状。肿瘤细胞往往有清晰的边界和多边形轮廓。透明或细颗粒的胞质含有PAS阳性、淀粉酶敏感的糖原。核圆形或卵圆形,染色质粗块状,核仁明显。有些病例可以观察到胞质内糖原但没有明显的透明细胞形态,并且透明细胞形态可由糖原以外的物质引起,因此诊断这种模式需要这两种特征(糖原丰富和透明细胞形态)同时存在。可能需要鉴别富含脂质的癌、皮脂腺癌、SeCa、组织细胞样癌和肌上皮肿瘤。虽然非原发性乳腺透明细胞肿瘤(如肾转移性透明细胞癌)极罕见,但也要鉴别。35-50%的病例呈ER阳性,而PR多为阴性。有些报道HER2的扩增率与乳腺癌相似;其他报道低扩增率。2019年SEER项目数据库回顾比较了155例GRCC与非GRCC乳腺癌的临床病理特征,发现GRCC更可能是高级别、晚期和三阴性(44.8%的病例为ER阴性和HER2阴性)。因为GRCC少见,预后仍有争议。大多数报道提示,GRCC倾向于遵循侵袭性临床过程,但匹配的肿瘤大小、分级和淋巴结状态时,与IBC-NST的预后没有区别。
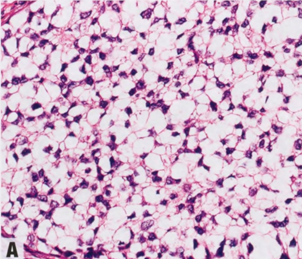
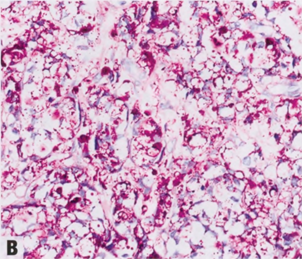
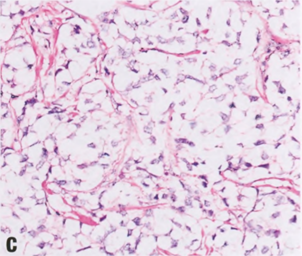
图2.102 IBC,富含糖原的透明细胞癌。A 肿瘤细胞胞质丰富透明,核呈圆形或卵圆形,染色质粗块状。B、C 透明胞质含有PAS阳性(B)和淀粉酶敏感(C)的糖原。
皮脂腺模式(Sebaceous pattern):罕见,存在显著的皮脂腺分化。肿瘤必须起源于乳腺实质,缺乏任何证据提示起源于皮肤附件皮脂腺。肿瘤细胞由皮脂腺细胞组成,胞质丰富、透明、空泡状,固定或新鲜组织冰冻切片油红O染色阳性。皮脂腺成分的核从小的、单形的、深染的小细胞到具有明显核仁的多形性大细胞不等。核大部分偏位。肿瘤的第二个组成部分由较小的卵圆形至梭形细胞组成,胞质为非空泡状嗜酸性或嗜碱性。这些细胞主要存在于小叶的边缘,但也可与皮脂腺细胞混合或形成单独的成片肿瘤。在一项研究中,每10个高倍视野(未注明)有5-39个核分裂象。间质可以是致密的胶原或黏液样。肿瘤细胞嗜脂蛋白阳性。文献中ER、PR、HER2阳性率分别为7/12、8/12、3/9。据推测,乳腺皮脂腺癌是具有异常分化潜能的局部多能干细胞的恶性转化的结果。然而,有必要进行基因研究以评估这一假设。
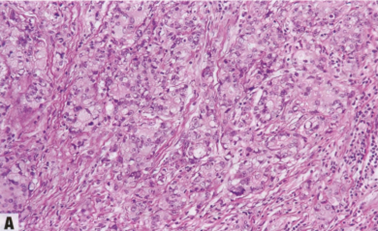
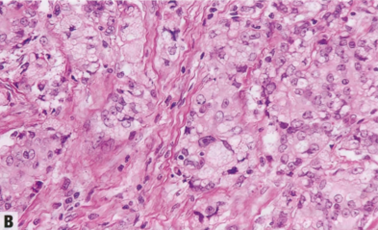
图2.103 IBC,皮脂腺癌模式。A 肿瘤细胞呈空泡状,胞质含脂,胞质透明。B 高倍。
细胞学
见“2.8.1 概述”(第82页)。
诊断性分子病理学
见“2.8.1 概述”(第82页)。
诊断标准
必要标准:浸润性癌,有乳腺上皮起源的形态学证据,伴或不伴免疫染色证实;如有单纯特殊亚型的特征,则占肿瘤的90%以下(默认诊断)。
分期
见“2.8.1 概述”(第82页)。
预后与预测
IBC-NST占乳腺癌的大部分,其预后特征和治疗都相似或稍差,10年生存率为65-78%,而乳腺癌总体生存率约为80%。预后受患者年龄、肿瘤组织学分级、肿瘤分期、淋巴管血管浸润和TIL(见“2.8.1 概述”,第82页)等经典变量以及治疗反应的预测因素(如ER、PR和HER2状态)的显著影响。Ki-67增殖指数和AR状态有预后价值。约70-80%的IBC NST为ER阳性,12-20%的病例为HER2阳性。IBC-NST的治疗也受到这些预后和预测特征的影响。在一项研究中,诊断年龄>50岁的乳腺癌患者的疾病特异性死亡率比年轻患者高17%。在另一项研究中,中年患者(40-60岁)的预后优于青年和老年患者。一般来说,同样的预后和预测概念适用于其他IBC(见“2.8.1 概述”,第82页)。
Microinvasive carcinoma
2.8.3 微浸润癌(MiCa)
定义
浸润<1 mm的IBC。
ICD-11编码
MiCa没有ICD-0编码,它不代表某个独立的生物学或表型实体。最好根据肿瘤类型进行编码,例如,
8500/3 (非特殊型癌)或
8520/3 (ILC)。
ICD-11编码
2C61.0是原发IBC的代码,因此包括微浸润性癌。
相关命名
不推荐:CIS伴微浸润。
亚型
各种形态亚型都可能存在浸润<1 mm;IBC-NST最常见,其他组织学亚型(如ILC)可能较少见。MiCa在分子亚型上也是异质性,在免疫组化定义的替代分类中,它可以属于管腔A样、管腔B样、HER2-过表达(非管腔型)或三阴性。
部位
MiCa可见于乳腺的任何部位,通常位于CIS附近(通常为高级别DCIS)。微小ILC罕见伴有经典型、旺炽性或多形性LCIS。
临床特征
MiCa无特定临床特征。不可触及,通常是显微镜下评估CIS时偶然发现。临床和/或影像学表现为伴随原位成分的特征。
流行病学
MiCa的发生率与DCIS病变的级别和大小有关,因此在文献中差异很大。其中一组发现DCIS病灶<5 mm的微浸润风险为3%,6-10 mm的微浸润风险为6%,肿瘤>50 mm的微浸润风险高达23%。尽管有数据提示8-9%甚至>20%的CIS病灶可能存在微浸润,但大多数提示MiCa较罕见。虽然理论上所有CIS进展为浸润性癌在其演变过程中都经历了这一阶段,但组织学上罕见捕捉到发生这一阶段的确切时刻。因此,与乳腺癌发病率相关的数据由于人群乳腺筛查的差异、定义的差异随时间而改变以及相对常见的误诊而存在偏差。
病因学
MiCa的病因与IBC相同。
发病机制
MiCa的发病机制尚未完全阐明(由于其体积小、发病率低),但与IBC相似,MiCa是其早期表现。除了导致肌上皮/基底膜屏障破坏的肿瘤相关因素外,炎症反应也可能起作用。MiCa的分子病理学尚不清楚,研究难度较大。它可能反映了与浸润有关的最早改变。根据不同的分子表型,MiCa似乎没有独特的生物学特性。
大体表现
MiCa具有CIS的大体特征。到目前为止,高级别DCIS是最常见的原位病变,通常表现为边界不清的纤维区。仔细检查,切面挤出粉刺样坏死,但肉眼可能看不到。少见的CIS也缺乏大体特征。
组织病理学
MiCa是形态学上最早发现的浸润性癌,以CIS为主(通常为高级别DCIS,但有时也有低级别DCIS、LCIS或乳头Paget病)。只有在一个病灶或多个明显独立的病灶中发现明确的浸润证据,且所有病灶均不大于1 mm时,才能诊断为MiCa。一些早期的定义要求浸润到非特异性间质,但这不再是一项要求。在正常乳腺组织学中,通常可以区分小叶内和导管周围(特化)间质与非特化(小叶间)间质,但当炎性浸润和水肿使边界模糊时,区别就不那么明显。因此,在微浸润性疾病的背景下,浸润意味着超出肌上皮和基底膜的原位成分。小的成度的肿瘤细胞簇(或较少见的单个细胞)浸润间质,常伴有反应性改变(例如单个核炎症浸润、水肿和促结缔组织增生性改变)。当怀疑有微小浸润时,应进行更切片检查,以排除较大的浸润灶。这样也可以显示病变的轮廓(边界清晰、圆形的肿瘤细胞簇不太可能代表微浸润),并有助于避免误诊为类似病变。
诊断MiCa的一致性并不理想:一项研究发现,在109例诊断或怀疑微小浸润的病例中,只有1/5病例在复片时证实MiCa。另一研究中,专家们对相当多的病例持不同意见,50例HE染色切片中只有9例100%同意。由于病变很小,它们可能在深切片或随后的免疫组化切片中消失,这也可能影响观察者之间的重复性。对这些案例的同行审查可能有价值。连续切片HE染色通常比免疫组化更有价值,但后者可能兼顾诊断评估和可重复性。免疫组化通常用于显示MiCa细胞周围缺乏肌上皮或基底膜。然而,在一些良性病变或DCIS周围,肌上皮标记物可能缺失(或几乎缺失),并且在一些浸润性病变周围可能存在不完整的基底膜(层粘连蛋白或IV型胶原染色)。用CK免疫组化来显示少量浸润的肿瘤细胞可能是有价值的。
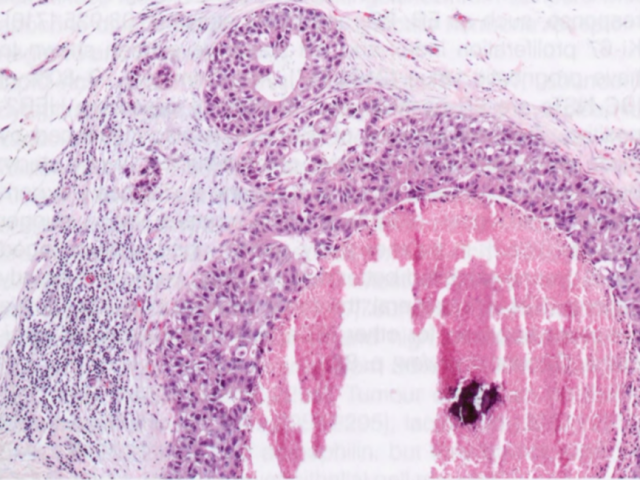
图2.104 MiCa。高级别DCIS病例,癌旁组织微浸润灶(<1 mm)。视野左上方存在单个细胞浸润,支持微浸润的诊断。
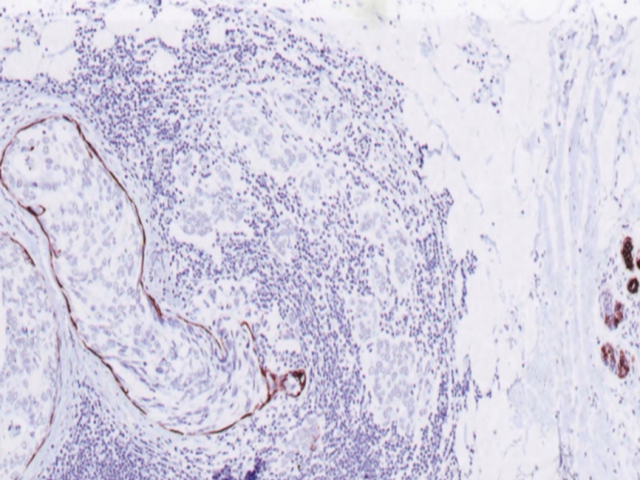
图2.105 MiCa-NST。CK5染色显示肌上皮细胞,左侧中级别DCIS周围阳性,右侧小叶正常腺泡周围阳性,而中部MiCa周围阴性。注意淋巴细胞反应。
容易过诊断为MiCa的病变包括DCIS累及小叶和累及SA、硬化性病变中挤压和变形的上皮、穿刺(特别是乳头状病变)引起的癌细胞移位、烧灼或挤压假象,以及CIS累及的导管和小叶周围淋巴细胞浸润。
值得注意的是,DCIS周围的三级淋巴结构在微浸润病例中更常见;因此,在这种情况下,有必要对微浸润进行特别仔细的评估。当微浸润发生时,多灶性并不少见,因此建议进一步寻找(微)浸润灶。如果任一浸润灶>1 mm,则称定为浸润性癌,而其他病灶代表卫星灶或多灶癌的一部分。
对微浸润的诊断有疑问时,或如果关注的病变在任何进一步切片中消失时,建议(按照标准化TNM实践)将该病例诊断为原位病变,没有明确的(微)浸润的证据。在粗针活检样本考虑MiCa诊断时,建议谨慎。MiCa有转移的风险:应尽可能检测激素受体和HER2状态。
细胞学
与临床无关
诊断性分子病理学
与临床无关
诊断标准
必要标准:浸润性癌<1 mm;深切片排除更大病灶,以避免诊断不足,并排除非浸润性假冒病变,以避免过度诊断。
理想标准:有先前存在的病变,多为CIS(通常为高级别DCIS)。

图2.106 MiCa伴高级别DCIS。CK(红色)和p63(棕色)双重免疫染色(B)确定国起源于高级别DCIS的MiCa。
图2.107微小ILC。中心区为<1 mm的ILC伴水肿性间质反应;周围为小叶肿瘤(LCIS)。
分期
MiCa定义为pT1mi,与微小浸润灶数目无关。肿瘤大小四舍五入至最接近mm的一般规则不适用于MiCa界定;即,1.1mm癌归入浸润性疾病,pT1a。
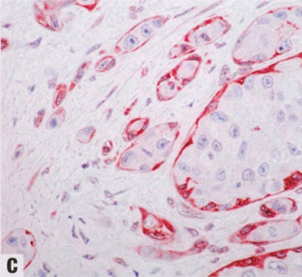
图2.108 DCIS扩散至SA。这是一种常见的微浸润假象。A 低倍,小叶结构扭曲。B 中倍,小腺泡受累提示微浸润,肿瘤细胞巢呈随意排列。C calponin染色显示所有肿瘤细胞簇和巢周围的肌上皮变薄。
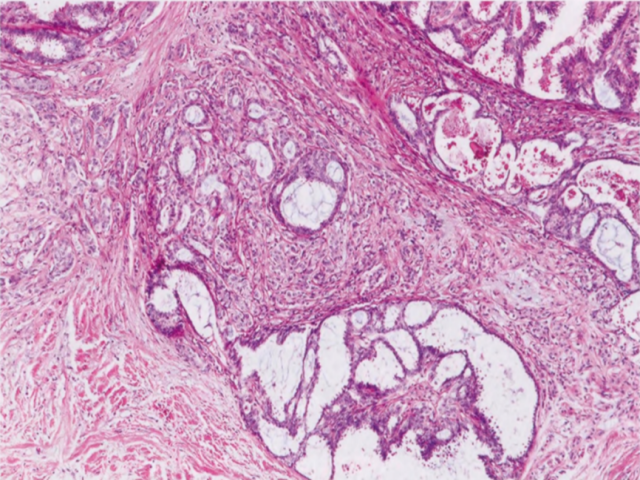
图2.109貌似MiCa的假浸润。低级别筛状DCIS和乳头状瘤邻近的SA,假冒浸润。
预后与预测
MiCa伴淋巴结受累的发生率在文献中有所不同,这取决于是否进行前哨淋巴结活检,是否应用增强组织病理学(深切片和免疫组化)以及如何定义淋巴结阳性。最近对968例MiCa(无中心综述)进行的荟萃分析发现,前哨淋巴结阳性率为3.2%(宏转移)和4%(微转移)。MiCa的预后有争议,很可能是由于诊断和发病率的差异。长期以来,一直认为微浸润性癌与DCIS的预后相同,有些研究支持这一观点。其他最近发表的文献提示,其预后更接近于非常小的浸润性癌。有证据提示,HER2阳性微浸润患者未接受抗HER2治疗或化疗的预后较差。然而,总体预后非常好,SEER项目数据集分析中,有微浸润的DCIS20年乳腺癌特异性死亡率为9.65%(DCIS为4.00%),而在另一个SEER项目数据集分析中,有微浸润的DCIS为6.9%。



图2.110貌似MiCa的假浸润。CK(红色)和p63(棕色)双染显示肌上皮。
Invasive lobular carcinoma
2.8.4 浸润性小叶癌(ILC)
定义
由非粘附性细胞组成的IBC,癌细胞通常单个散在分布或排列成单行线性模式。
ICD-11编码
8520/3 小叶癌-NOS
ICD-11编码
2C61.1&XH2XR3乳腺ILC&小叶癌-NOS
相关命名
不推荐:(infiltrating lobular carcinoma) ILC。
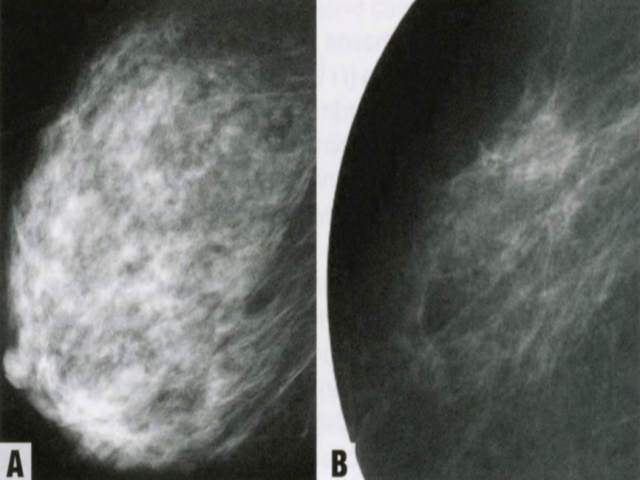
图2.111 ILC(乳腺X线)。A 腋尾部结构扭曲,对应于可触及的增厚区域。B 放大示腋尾结构扭曲。

图2.112 ILC。大体检查,示病灶边界不清。
亚型
无
部位
ILC可累及乳腺的任何部位,但一项研究发现,中心位置的ILC比IBC-NST稍多见。部分研究中,多中心肿瘤的发生率高,但其他基于临床或放射学分析的系列研究中没有发现上述现象。据报道,对侧肿瘤,特别是同时发生的对侧肿瘤的发生率为5-19%,高于IBC-NST。
临床特征
大多数女性患者表现为边界不清的可触及的乳腺肿块,影像学最常见表现为毛刺状肿块伴结构扭曲。触诊、钼靶X线/超声检查甚至可能表现为亚临床肿瘤(检测不到),但已转移。钙化不常见。乳腺X线对ILC的检出敏感性(57-89%)低于IBC-NST,假阴性率高达19%。超声检查较敏感(78-95%),但肿瘤大小可能低估。MRI有助于诊断ILC,尤其是多灶性病变,但可能导致假阳性和高估肿瘤大小。因此,在CNB活检标本上诊断ILC时,大多数指南要求结合MRI。
流行病学
ILC占所有IBC的5-15%。自20世纪80年代以来,ILC的发病率相对于IBC-NST有所上升。这可能是由于增加使用激素替代疗法或增加饮酒。ILC患者的平均年龄为57-65岁,略高于IBC-NST患者。
病因学
ILC的病因包括多种因素,包括可能的生活方式、激素和遗传学因素。已证明累及CDH1的有害种系突变是HDGC和ILC的原因,它们使ILC发生的风险高达42%。
发病机制
绝大多数经典ILC表达ER和PR,缺乏HER2基因扩增/过表达。高达85%通过基因表达谱归入管腔A型。基因表达谱和免疫组化研究还显示,ILC也可有管腔B型,罕见HER2富集型或基底样型。多形性/大汗腺性ILC可能偶尔缺乏激素受体并过表达HER2。
ILC表现为典型的体细胞遗传学改变模式,包括16q和16p的获得和16q的缺失,此处含有16q22.1上的CDH1基因位点。目前认为E-cadherin功能丧失是小叶癌细胞产生特征性缺乏粘附性和浸润模式的原因。事实上,绝大多数ILC含有累及CDH1的有害突变,通常伴随着野生型等位基因杂合性缺失。在少数缺乏CDH1突变的病例中,已经报道了累及α-catenin和cadherin-catenin家族其他潜在成分的改变;相反,CDH1基因启动子甲基化在ILC中E-cadherin表达缺失中的作用仍存在争议。
基于基因表达的多基因分类(预测复发)虽然没有正式的相互比较,但仅将少数ILC归因于高风险组。通过聚类分析在基因表达水平上确定了ILC的不同亚群,其中一个亚群称为“免疫相关”。但是,它们的定义需要标准化。在这种情况下,最近的一项研究提示,ILC的TIL水平低于ER阳性、HER2阴性的IBC-NST,只有15%的病例显示TIL>10%。
数千个ILC已经被测序,揭示其突变情况。最常见的体细胞基因组改变是染色体臂16q缺失(几乎在所有病例中都可见)、CDH1突变(50-80%)和PIK3CA突变(45%)。其他重现性突变基因包括RUNX1、TP53、TBX3、PTEN、FOXA1、MAP3K1、HER2和HER3。与管腔A型IBC-NST相比,ILC更容易携带CDH1、PTEN、TBX3、HER2、HER3、ARID1A和FOXA1的体细胞突变,而GATA3、MAP2K4和CTCF的体细胞突变较少。AKT1或HER2突变的肿瘤与早期复发风险增加相关。具有治疗意义的是,HER2靶向药物可用于治疗HER2(和可能HER3)突变但大多数缺失HER2扩增、且存在CDH1突变的病例。
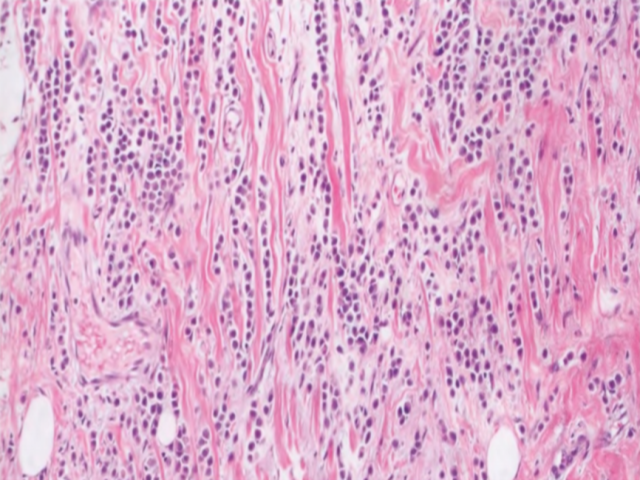
图2.113经典型ILC。注意非粘附性小细胞增殖,排列成单行线状条索,浸润间质。通常罕见宿主反应或背景结构的扭曲。
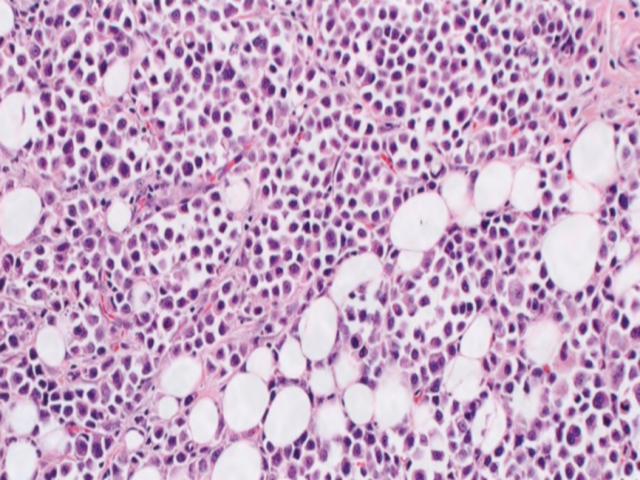
图2.114实性生长模式ILC。注意小叶形态的非粘附性小细胞呈片状生长。
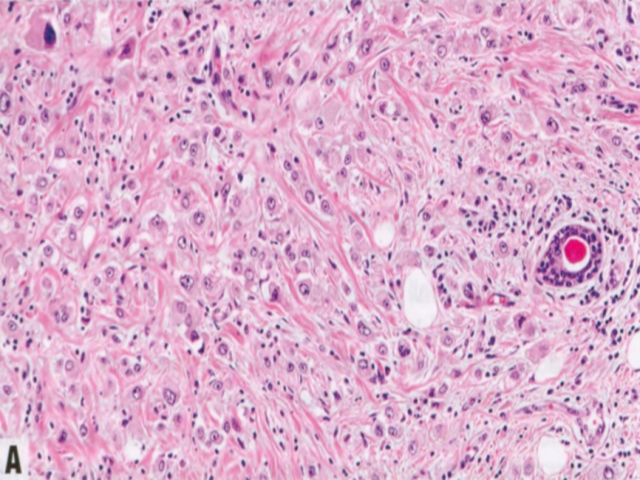
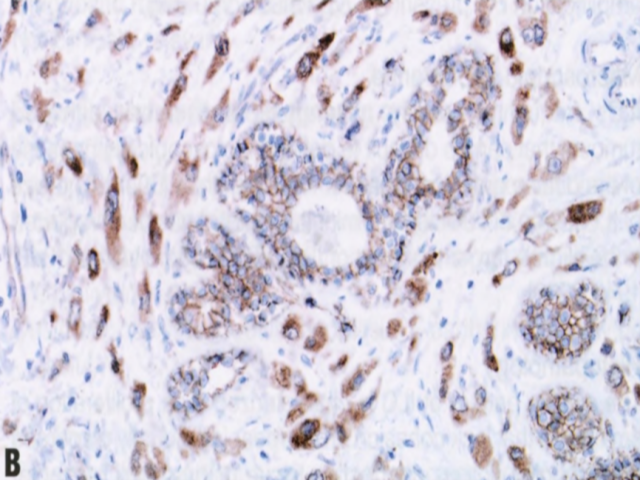
图2.115多形性ILC。A 多形性细胞伴或不伴大汗腺特征,核分裂象计数高于经典型ILC。B p120染色显示肿瘤细胞呈胞质染色。
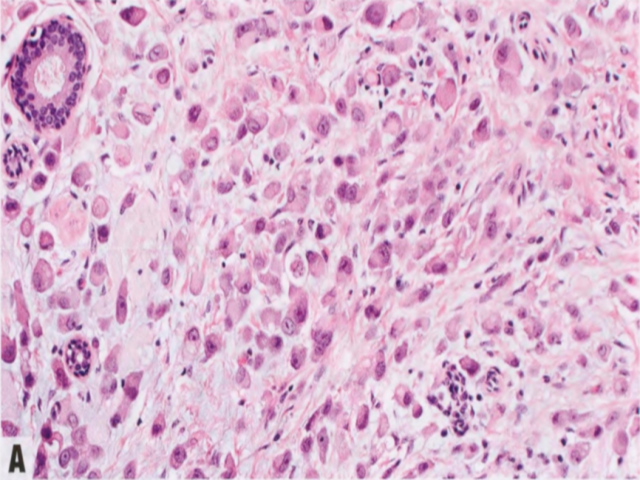
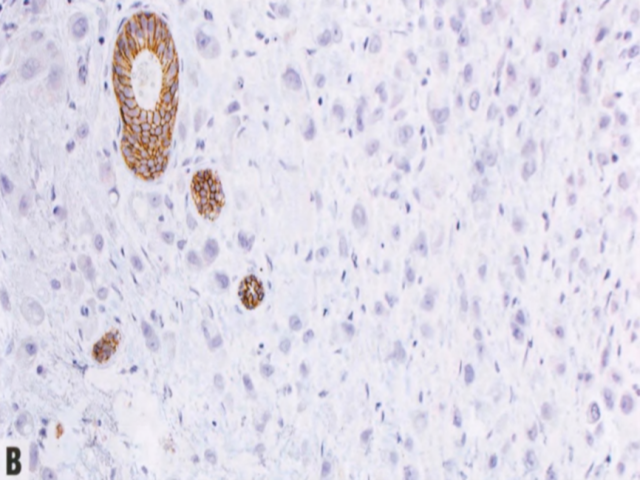
图2.116多形性ILC伴大汗腺特征。A 注意多形性细胞伴大汗腺特征。B E-cadherin染色显示肿瘤细胞呈膜染色阴性。
大体表现
ILC通常表现为不规则和边界不清的肿瘤,由于细胞浸润的弥漫性生长模式,肉眼难以确定边界。ILC的大小也很难确定,尽管据报道在某些研究系列中ILC略大于IBC-NST。
组织病理学
ILC经典型模式的特征为小细胞增殖,缺乏粘附性,单个分散在纤维结缔组织中,或排列成单行线状条索(印第安列兵),浸润间质。这些浸润条索通常呈同心圆模式围绕正常导管(靶环)。通常罕见宿主反应或背景结构的扭曲。圆形核或有切迹的卵圆形核,有一圈薄的胞质边缘,偶有胞质内腔隙,腔隙中央常有黏液。核分裂象通常少见。这些典型的细胞学特征与ALH和LCIS相同,58-98%的LCIS病例伴有ILC。淋巴管血管浸润少见。就组织微环境而言,与管腔型IBC-NST(校正年龄和分级后)相比,管腔型ILC具有更高的肿瘤相关纤维母细胞增殖(如α-SMA免疫组化所定义)和更高程度的肿瘤新生血管,但成熟肿瘤血管较少。因此,尽管ILC基因表达谱与IBC-NST基因表达谱相似,但ILC的组织微环境显示不同状态。
描述了许多ILC模式,与经典ILC相比,它们或有相同的细胞学模式,或有相同的生长模式,但都缺乏细胞间粘附性。实性模式的特征是小叶形态的典型的非粘附性小细胞,但与经典型相比,细胞成片生长,核分裂率较高。腺泡模式的细胞主要排列成球状聚集体(至少20个细胞)。多形性小叶癌(PLC)保留小叶癌独特的生长模式,但有更显著多形性(具有明显核多形性的较大细胞,>淋巴细胞核的4倍/相当于高级别DCIS核,伴或不伴大汗腺特征)和更高的核分裂象计数。PLC常伴有相同多形性细胞学特征的LCIS。PLC可呈大汗腺或组织细胞样分化,可由印戒细胞组成。管状小叶状模式由管状生长模式和均匀小细胞排列成线性模式混合而成。约三分之一的管状小叶状模式伴有LCIS。组织细胞样ILC可能细胞学温和,因此可能与组织细胞混淆,或者与颗粒细胞瘤混淆(如果叠加大汗腺特征)。
混合组由经典型与上述一个或多个模式混合而成。经典型ILC型和混合模式占据小叶性肿瘤的大部,多达所有病例的75%。此外,约5%的IBC兼有IBC-NST和小叶分化特征(称为浸润性导管小叶癌,invasive ductulolobular carcinoma),尽管二种成分的形态学不同,但最近的一项研究提示,它们起源于共同的祖先。
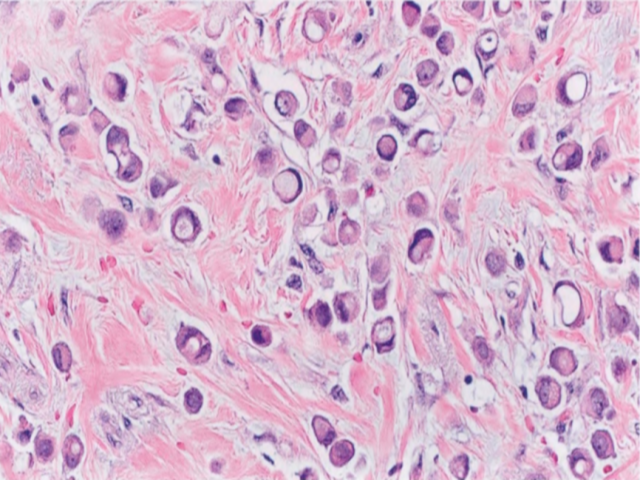
图2.117具有印戒细胞特征的ILC。注意具有印戒细胞特征的肿瘤细胞。
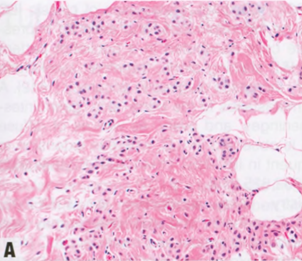
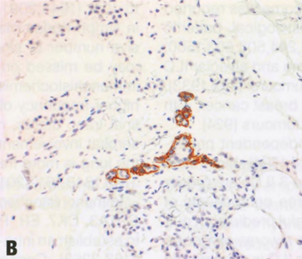
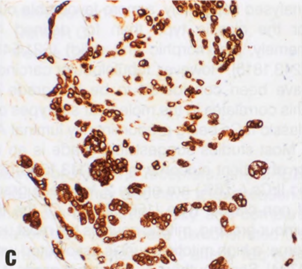
图2.118组织细胞样ILC。A 浸润性肿瘤细胞有丰富的淡嗜酸性胞质,类似于组织细胞,低-中级别核。B E-cadherin阴性证实小叶表型。C CKAE1/AE3阳性证实上皮表型。
尽管文献提示80-95%的ILC呈ER阳性,但在目前的实践中,经典型ILC几乎恒定ER阳性。相比之下,70-80%的IBC-NST呈ER阳性。这两种肿瘤类型中,PR阳性率为60-70%。ER在经典型和亚型中均有表达,其中腺泡亚型阳性率最高(100%),PLC最低(10%)。ILC罕见HER2扩增和过表达,但在某些PLC中明显。
ILC及其不同模式中最一致的分子改变之一是细胞-细胞粘附分子E-cadherin的失表达缺,导致粘附复合物的破坏,进而导致小叶肿瘤细胞的特征性失粘附性。粘附复合物完整性的改变也可能是由于其他成分的缺失,如α-catenin、β-catenin和γ-catenin,导致p120-catenin从细胞膜到胞质的错误定位。分析E-cadherin、α-catenin、β-catenin和p120的表达可能有助于区分根据形态学标准难以分类的小叶型和低级别IBC-NST;然而,约15%的ILC(和大多数导管小叶癌)表达E-cadherin,因此不应根据其阳性染色将小叶病变重新分类为IBC-NST。相反,NST形态的肿瘤也可能表现出E-cadherin表达缺失。ILC罕见表达p53、CK14、CK5/6、EGFR[HER1]和肌上皮标记物(SMA和p63)。MIB1/Ki-67标记的增殖在经典型ILC中通常低,但其他形态学模式高。
细胞学
FNA标本上经典型ILC的细胞形态学特征包括低细胞量、轻度失粘附性、核小、核仁不清楚、轻度多形性,以及无大汗腺改变、印戒细胞形态、坏死和核分裂象。相比之下,PLC的特点是更大的细胞,核多形性和深染;明显的核仁;核分裂象活性高,更像非特殊型乳腺癌。
诊断性分子病理学
与临床无关
诊断标准
经典型ILC
必要标准:IBC,含有散在的或线性的非粘附性细胞,低-中核级别,低核分裂象计数;ER阳性,HER2阴性/非扩增。
理想标准:并存小叶肿瘤;E-cadherin缺失可能有用。
多形性ILC
必要标准:中-高或高核级别/多形性。
分期
国际癌症控制联盟(UICC)TNM分类现行(第8版)与美国癌症联合委员会(AJCC)癌症分期手册在ILC分期方面没有不一致之处。
预后与预测
尽管ILC具有良好的预后特征(即低级别、ER阳性、HER2阴性和低增殖),但ILC患者与IBC-NST患者的预后有无差异,仍存在争议。一些研究报道ILC的预后比IBC-NST好,但其他研究没有发现ILC有显著差异或预后较差。在大宗研究中,ILC更可能更大(>5 cm)和更晚期(lll/IV期),淋巴结阳性率高于IBC-NST,更多见于老年患者。两个系列研究中发现一个重要结果,ILC患者在诊断后前10年的预后优于或类似于IBC-NST患者;然而,ILC的长期预后比IBC-NST差。ILC发生率较高的事件(远处转移、复发和死亡率)是诊断后的长期事件。对ILC组织学亚型分型研究,经典型临床结局比其他组织学模式(即多形性和实性)更好,而小管小叶癌和腺泡亚型ILC视为低级别肿瘤。这与乳腺癌的分子亚型相关,经典型ILC主要是管腔A型。
大多数研究提示,分级是ILC患者预后的独立预测因素。大多数经典型ILC(约76%)为2级,而3级ILC大多为非经典型。在肿瘤分级的三个组成部分中,核分裂象计数是最有用的预后预测指标;核分裂象计数高与预后差有关。一些作者认为ILC中的2级与IBC-NST中的3级具有可比性。Ki-67增殖指数临界值的探索性分析得出结论,对于ILC,较低的临界点(4%)比IBC-NST的15%临界点更好地预测疾病进展。
新辅助化疗后,观察到ILC的病理完全缓解率低于IBC-NST,新辅助激素治疗可能较合适。然而,这种对细胞毒治疗的相对耐药性可能与ILC的分子特征(尤其是低增殖)有关,而与组织学亚型无关。
ILC的淋巴结转移模式不同于IBC-NST。ILC腋窝淋巴结转移率低于IBC-NST,差异在3%-10%之间。经典型ILC在淋巴结中的转移灶可能不明显,仅凭HE染色,即使大量霰弹模式分布的单个细胞也可能漏诊;因此,CK免疫组化可提高诊断准确率。在ILC中,转移到骨、皮肤、胃肠道、子宫、脑膜和卵巢以及弥漫性浆膜受累的频率较高,而在IBC-NST中,转移到肺的频率较高。
使用GCDFP-15、GATA3、CK7、ER、PR、E-cadherin和p120-catenin,可能有助于确定腹腔内肿瘤为转移性ILC。伴随表达谱显示三种ILC分子模式(反应性样、免疫相关和增殖性)与预后相关;然而,这些模式与广泛接受的乳腺癌分子亚型明显缺乏相关性。
已认证了几种预测乳腺癌预后的多基因表达分析,但其对ILC的临床价值仍在研究中,因为这些肿瘤的表达谱可能不同于IBC-NST。在大多数检测中,ILC主要归入低风险肿瘤。因此,一些作者不鼓励使用ILC的基因组/转录预后检测,因为ILC的预后通常良好,或者建议使用更经济的常规免疫组化分类。
Tubular carcinoma
2.8.5 小管癌(TC)
定义
TC是一种低级别的浸润性癌,由完好的小管组成,管腔开放,内衬单层肿瘤细胞。
ICD-11编码
8211/3 TC
ICD-11编码
2C60&XH4TA4特殊型乳腺癌&管状腺癌
相关命名
无
亚型
无
部位
没有特殊。
临床特征
TC没有特有的临床特征可区分其他类型的乳腺癌。尽管如此,TC更可能发生在老年患者,并且往往体积较小。大多数TC是通过乳腺X线筛查偶然发现,TC可能形成一个独立的肿块,但最常表现为小的毛刺状病变;有无钙化不一致。超声检查通常表现为边界不清的低回声肿块和后方声影。MRI资料有限,但这些肿瘤在T2加权像上表现为高信号,有或无暗内隔样表现。约10-20%的TC为多灶性。
流行病学
TC约占IBC的1.6%,发生于绝经后妇女(67%),患者年龄中位数为63岁;只有17%的TC患者年龄<50岁。在美国,白人女性的发病率略高于黑人女性。
病因学
见“2.8.1 概述”(第82页)。
发病机制
基因表达谱研究提示,TC属于管腔A分子分型乳腺癌,这是其良好临床疗效的生物学基础。TC通常ER阳性,HER2不扩增,基因组改变频率低。杂合性缺失和比较基因组杂交技术已证明,在TC中检测到的最常见的改变累及16q(缺失;78-86%)和1q(增加;50-62%),并且这些通常同时发生。其他改变包括16p获得,以及8p、3p(FHITgene位点)和11q(ATM基因位点)缺失。尽管这些染色体改变在其他低级别乳腺癌(即低级别IBC-NST和ILC)中很常见,但在转录组水平上发现了微小但重要的差异。
大体表现
TC特征性表现为边界不清的毛刺状肿瘤,质硬到坚硬,淡灰色。大多数TC小,平均直径12 mm。约14%的TC>20 mm。
组织病理学
90%以上肿瘤由小管和腺体组成才诊断TC,含10-90%TC的肿瘤归入混合性肿瘤。
低倍镜下,TC呈星状轮廓,侵犯邻近正常乳腺实质。TC由小的、圆形到卵圆形或成角的腺体和小管组成,管腔开放,位于纤维性或纤维弹性促结缔组织增生间质内。小管衬单层立方形至柱状细胞,核相对均匀一致,小或中等大小。小管的腔面可见顶泌突起,管腔内可见分泌物或钙化。根据定义,TC为1级癌;如果诺丁汉分级提示其他情况,则排除TC的诊断。显著细胞异型性、复层化或高分裂活性排除TC的诊断。
TC中的小管周围没有肌上皮,这有助于将其与良性疾病如SA和RS进行鉴别。在这些良性疾病中,小结构被肌上皮包围,可用肌上皮标记物(如p63、SMMHC)和高分子量CK来证实。
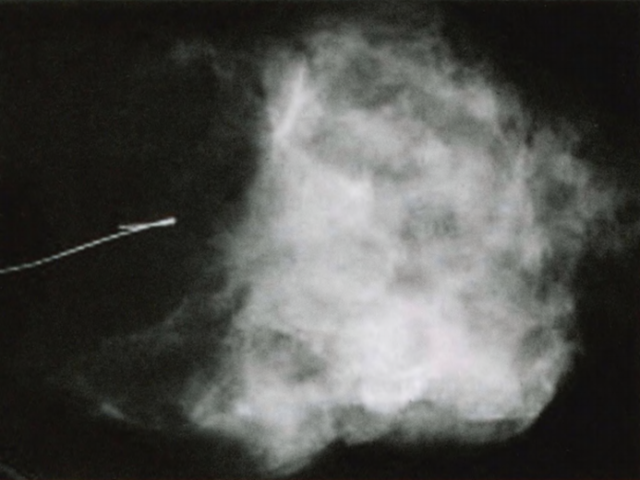
图2.119 TC标本的X线照片。
TC可伴有前驱病变;在147个肿瘤和前驱病变的研究中,95%的纯TC伴有CCL,尤其是FEA。ADH/DCIS占89%。CCL、ADH/DCIS和TC的共存见于85%的患者,大多数患者的细胞学核形态相似。这提示TC可能是一个多步骤过程的结果,该过程始于FEA水平。
TC呈ER弥漫性强阳性,通常也呈PR阳性。TC为HER2阴性,如果肿瘤为HER2阳性,则应重新考虑TC的诊断。TC细胞具有管腔表型(CK8/18阳性,CK5/14阴性)和低Ki-67增殖指数(通常<10%)。E-cadherin阳性,而EGFR(HER1)、p53、p63和P-cadherin阴性。高分子量CK的表达和/或ER阴性(特别是活检小标本)应怀疑基底样癌伴小管形成的可能性,如AdCC或低级别腺鳞癌。基因表达谱将TC归入管腔A组(ER阳性,HER2阴性,低增殖)。
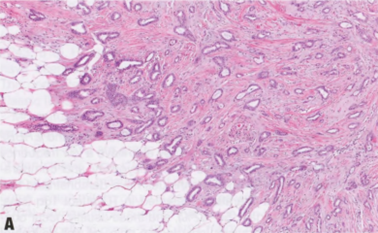
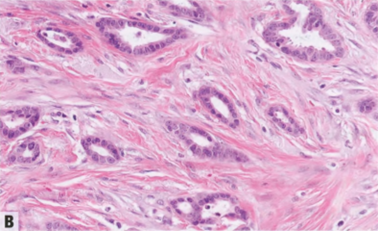
图2.120 TC。A 管腔开放的圆形成角小管无规则分布,衬单层上皮细胞,由大量反应性纤维母细胞间质分隔。B 泪滴状小管内衬的肿瘤细胞缺乏明显异型性。
细胞学
FNA标本诊断TC有问题。标本含有小管和不规则腺体,相对平淡和均匀的上皮细胞,无肌上皮细胞。尽管恶性肿瘤的特征(核异型性、细胞分离和肌上皮细胞缺失)通常存在,但恶性表现很微妙,即使在专家手中,恶性肿瘤的确诊率也仅为50%。穿刺活检是术前诊断较为可靠的方法。
诊断性分子病理学
与临床无关
诊断标准
必要标准:90%以上的IBC肿瘤由开放管腔的圆形到卵圆形或成角小管组成,衬单层上皮细胞,低级别核和稀少的核分裂象(1级);ER阳性,HER2阴性。
分期
大多数TC出现在相对早期阶段。约86%为T1期肿瘤,85%为N0。TC的分期与其他类型的IBC相似(见“2.8.1 概述”,第82页)。
预后与预测
在大型机构系列研究和基于癌症登记的研究中,TC患者的长期预后良好,据报道5年生存率为88%(总生存率)至96%(相对生存率)。这得到了许多回顾性研究的支持。结果提示,TC的预后优于1级IDC,患者的长期预后与年龄匹配的非乳腺癌患者相似。完全切除很少复发。在一些研究中,腋窝受累与预后不良无关。鉴于一贯观察到良好的预后,有人认为,辅助性全身治疗或腋窝淋巴结清扫可能不适合TC的常规管理。
Invasive Cribriform carcinoma
2.8.6 浸润性筛状癌(ICC)
定义
ICC是一种低级别浸润性癌,其肿瘤细胞岛含有完好的筛孔。
ICD-11编码
8201/3 ICC-NOS
ICD-11编码
2C60&XH1YZ3特殊型乳腺癌&ICC-NOS
相关命名
无
亚型
无
部位
没有特殊。
临床特征
ICC的临床特征与其他类型乳腺癌没有差异。ICC可表现为肿块,但临床上常为隐匿性。乳腺X线,ICC通常形成毛刺状肿块,可能存在微钙化。10-20%的病例表现为多灶性。
流行病学
单纯ICC少见,约占所有IBC的0.4%。中位发病年龄63岁,50岁以下患者仅占25%。
病因学
见“2.8.1 概述”(第82页)。
发病机制
ICC具有与TC相似的基因组和转录组学特征(均属于管腔A分子类),具有相似的免疫表型(激素受体的一致表达和HER2过表达的缺乏),并且两者均与同一家族的低级别前驱病变相关。
大体表现
ICC与IBC-NST之间无明确的大体鉴别特征。ICC通常由一个质硬/坚硬的毛刺状肿块组成,平均大小为31 mm。据报道ICC大至20 cm。
组织病理学
ICC由浸润性上皮岛组成,其中包含边界清晰的圆孔,就像筛状型DCIS。上皮岛轮廓呈卵圆形或成角,位于促结缔组织增生间质内。肿瘤细胞小到中等大小,复层化,形成二级腺腔,衬立方形到柱状细胞。有时出现顶端胞质突起,腔内可能含有黏液分泌物,伴或不伴钙化。核分裂象稀少,无显著核异型性。如果分级标准严格ICC应为诺丁汉1级肿瘤(筛状模式的小管形成评分为1)。间质破骨样巨细胞已有描述。80%的病例存在低或中级别DCIS,常有筛状结构。
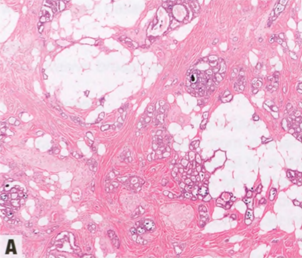
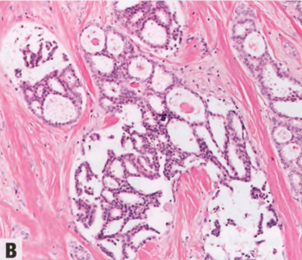
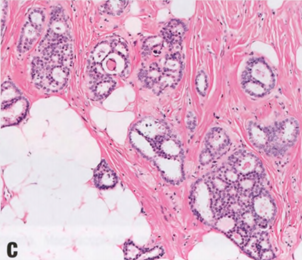
图2.121 ICC。A 低倍,筛状形态的浸润性上皮岛。B 上皮岛轮廓呈卵圆形或成角,位于促结缔组织增生间质内。C 上皮岛含有完好的圆孔,就像筛状DCIS。小到中等大小细胞,复层化。
肌上皮标记物的免疫组化可用于区分ICC和筛状DCIS。ICC常为ER阳性(95-100%)和PR阳性(69-89%),HER2阴性(94%),构成低级别乳腺肿瘤形成途径的一部分。
细胞学
FNA对ICC的诊断有问题。直接涂片显示相对粘附性片段和三维细胞簇,略微温和的上皮细胞。细胞群呈筛状。无双极核和肌上皮细胞。细针穿刺活检罕见(如果可能的话)能明确诊断ICC,仅凭细胞学检查无法与筛状DCIS鉴别。因此,穿刺活检是术前诊断的首选方法。
诊断性分子病理学
与临床无关
诊断标准
必要标准:IBC,90%以上的肿瘤由低级别核和核分裂象稀少的筛孔状上皮细胞岛组成(1级);ER阳性,HER2阴性。
分期
一般来说,ICC出现在相对早期,76%为T1,83%为NO。
预后与预测
与TC一样,ICC患者的预后良好;10年总生存率为90%-100%。混合型ICC患者的预后不如单纯型,但优于IBC-NST患者。ICC的生物学行为与TC相似;然而,许多肿瘤没有管状成分,ICC作为一个独特的临床病理实体的定义似乎是合理的。
Mucinous carcinoma
2.8.7 黏液癌(MC)
定义
MC是一种IBC,其特征是上皮肿瘤细胞聚集在细胞外黏液池中。
ICD-11编码
8480/3 黏液腺癌
ICD-11编码
2C60&XH1S75特殊型乳腺癌&MC
相关命名
可接受:胶样癌;黏液样癌;胶质癌;黏液样癌;黏液腺癌;产生黏液的癌。
亚型
无
部位
与其他类型乳腺癌相似。
临床特征
MC在乳腺X线检查中表现为边界清楚或分叶状肿块,可能与良性病变相似。超声检查,大多数肿瘤是低回声。MRI在T2加权像上显示持续的增强模式和高信号。
流行病学
MC约占所有乳腺癌的2%。它通常发生在老年妇女,患者的中位年龄为71岁。
病因学
见“2.8.1 概述”(第82页)。
发病机制
MC属于管腔A分子亚型,在转录水平上不同于级别和分子亚型匹配的IBC-NST。A型MC的转录组学特征不同于B型MC,后者的基因表达模式与NEC相似。纯MC呈低水平的遗传学不稳定性,少见1p获得和16q缺失、PIK3CA和AKT1体细胞突变(低级别ER阳性IBC-NST的标志性基因组改变),并表现出MUC2的异常DNA甲基化。混合性MC的不同形态成分是单克隆性,其基因组非常类似于纯MC。微卫星不稳定性是结直肠MC的常见特征,在乳腺MC中极为少见。
大体表现
大体检查显示一个有边界的有光泽的胶样结节,质地柔软粘稠。肿瘤大小从<1 cm到>20 cm不等。
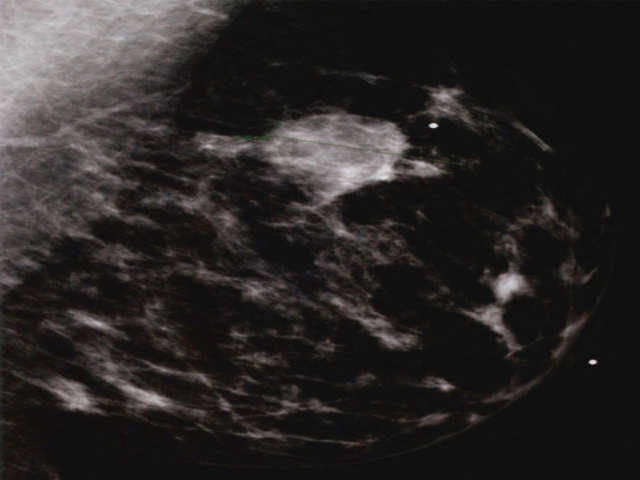
图2.122 MC。乳腺X线显示不规则形状的高密度肿块伴细小多形性微钙化。
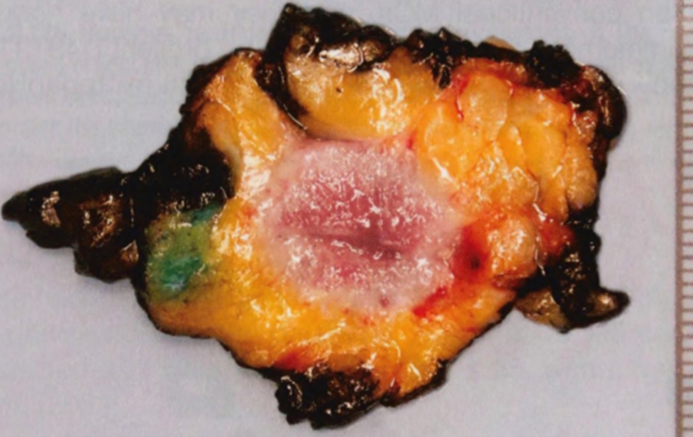
图2.123 MC。大体检查呈胶状切面。
组织病理学
MC由大量悬浮在细胞外黏液中的成簇或成片肿瘤细胞组成,由含有毛细血管的纤细的纤维间隔分隔。肿瘤簇的大小和形状各不相同。低或中核级别。高核级别肿瘤也有描述,但它们最好归入IBC-NST伴黏液产生。如Capella等人所述,A型MC细胞较少,含有大量的细胞外黏液,而B型MC则细胞丰富,由大块或大片的上皮组成,通常显示神经内分泌分化。纯MC要求黏液成分的占比大于90%;占比10-90%者称为混合性MC,占比<10%者也应提及。

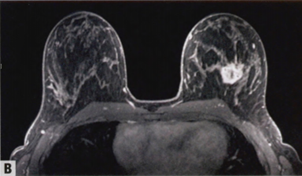
图2.124MC。A 超声显示不规则形状的低回声肿块,边缘成角。B MRI显示不规则形状的不均匀强化的毛刺状肿块。
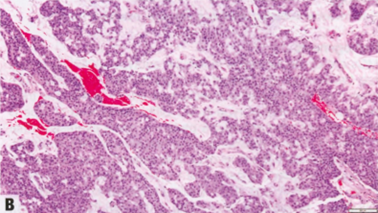
图2.125MC。A A型MC细胞稀少,在大量细胞外黏液中有稀疏的肿瘤细胞簇。B B型MC通常细胞丰富,大片肿瘤细胞,细胞外黏液相对较少。
偶尔,纯MC可有微乳头状模式,由桑椹样簇悬浮在黏液池中,使人联想到IMpC。与传统型MC相比,它们通常核异型性更明显,并且可能有鞋钉样细胞;可有砂粒样钙化。与传统的单纯MC相比,微乳头型MC发病年龄小,淋巴管浸润和淋巴结转移更频繁。一组报道,与单纯MC相比,微乳头型>50%的MC预后更差,但另一组没有发现差异,但病例较少。
ILC伴丰富的细胞外黏液已有描述。所有病例均存在非黏液性ILC成分。尚不清楚这些肿瘤是ILC还是MC亚型。
印戒细胞分化癌由大量细胞内黏液组成,这些黏液将核推到一边,形成具有特征性的印戒细胞形态。有印戒细胞、无细胞外黏液的癌不属于MC。印戒细胞形态在ILC中最常见,但也可能出现在IBC-NST中,在其他特殊组织学亚型中罕见。因此,具有印戒细胞分化的癌并不代表一个独特的实体,没有特有的临床或分子特征。伴印戒细胞分化的原发性乳腺癌必需鉴别转移(其他器官原发的印戒细胞癌转移到乳腺),特别是来自胃肠道的转移。
MC的鉴别诊断包括非肿瘤性黏液囊肿样病变(MLL)伴间质黏液,可能难以鉴,尤其是在CNB标本。充满黏液的导管的上皮无细胞异型性,黏液池中出现的上皮条带有附着的肌上皮细胞,倾向于无异型性的MLL而非MC。在靶向钙化的CNB中,若放射-病理一致,无异型性的MLL在切除后升级率<3%。部分MLL伴有ADH、DCIS或MC;然而,无异型性的MLL不会显著增加后续发生癌的风险。
MC通常ER、PR阳性,AR阳性率为80%。HER2过表达和/或扩增在MC中罕见,但在10%以上的微乳头型MC中发现。纯MC和混合MC均表达WT1和GATA3。
细胞学
细胞学表现包括三维上皮簇和小到中等大小的单个细胞,有轻度到中度的核异型性,偶见胞质内空泡,悬浮在含有少量分支毛细血管的丰富黏液中。
诊断性分子病理学
与临床无关
诊断标准
必要标准:纯MC的特征是黏液成分>90%,低-中核级别细胞簇悬浮在细胞外黏液池中;通常ER/PR阳性;HER2阴性。
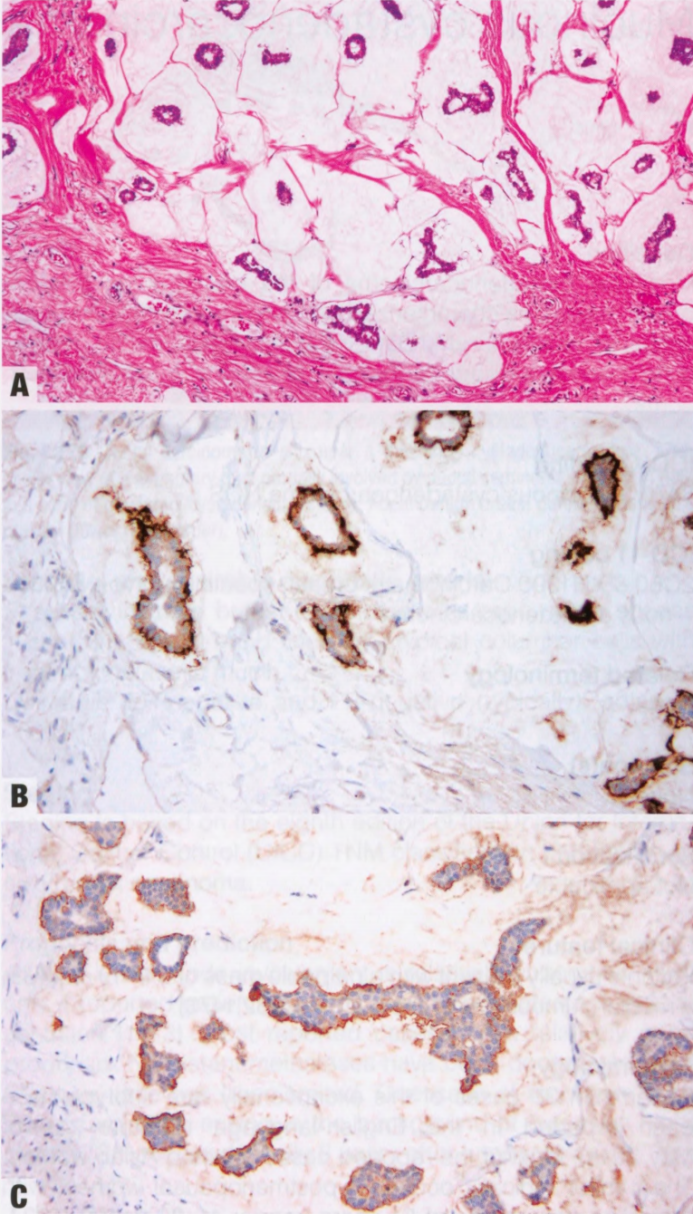
图2.126具有微乳头特征的MC。A 肿瘤由桑椹状上皮簇和环状结构组成,悬浮在大量的细胞外黏液中,由纤细的纤维带包裹。B、C EMA(MUC1)显示细胞膜朝向间质面,提示极性反转。
分期
MC的分期与其他类型的IBC相似(见“2.8.1 概述”,第82页)。
预后与预测
单纯MC通常具有低的局部和远处复发率以及良好的5年无病生存率。晚期可发生远处转移。回顾性分析SEER数据库中11422个纯MC,5年、10年、15年和20年的乳腺癌特异性生存率分别为94%、89%、85%和81%。A型和B型MC的预后无差异。在一项回顾性研究中,微乳头成分>50%的MC预后较差。混合型MC与单纯MC预后差。21基因检测结果显示,大多数单纯MC的复发评分(RS)较低或中等。在一个单机构的33个纯MC中,中位数RS为13(范围:3-28),除1例外,其余均为RS<25。在21基因分析中心数据库的回顾性分析中,16 116例黏液性癌中90.6%的RS<25,平均得分为15。
Mucinous cystadenocarcinoma
2.8.8 黏液性囊腺癌(MSC)
定义
MSC是一种IBC,其特征是囊性结构衬覆高柱状细胞伴丰富的胞质内黏液,就像胰胆管或卵巢的MSC。
ICD-11编码
8470/3 MSC-NOS
ICD-11编码
2C60&XFI1390特殊型乳腺癌&MSC
相关命名
无
亚型
无
部位
不适用
临床特征
患者通常表现为可触及的肿块,大小0.8-19cm,中位数3cm。
流行病学
英语文献中不到30例(截至2018年5月),多为亚洲妇女。肿瘤通常发生在绝经后妇女,中位年龄61岁(范围:41-96岁)。
病因学
未知
发病机制
未知
大体表现
MSC是一种边界清楚的囊实性肿块,囊腔通常含有胶样物质。
组织病理学
MSC的特征是囊腔内衬高柱状细胞,复层化、丛集并形成乳头。核位于基底部,含有丰富的胞质内黏液,囊腔内也有黏液。细胞异型性程度不一,即使同一肿瘤也是如此。囊腔呈圆形,但周围缺乏肌上皮细胞。邻近的乳腺导管和小叶可能存在DCIS。
MSC应鉴别纯MC(见MC,第123页)和EPC(见EPC,第60页),后两种癌通常呈ER和PR弥漫强阳性。EPC也缺乏胞质内黏液。在没有DCIS的情况下,必须排除胰胆管来源的转移性MSC。
大多数乳腺MSC呈ER、PR和HER2阴性。罕见的HER2阳性病例也有报道。一些肿瘤表达CK5/6和EGFR(HER1)。乳腺原发性MSC呈CK7阳性,但CK20和CDX2阴性;有助于区分转移性胰胆管MSC,后者也可能CK7阳性,但通常表达CK20和CDX2。
细胞学
这种罕见的肿瘤亚型只有少数细胞学描述。常有丰富的细胞外黏液(就像纯MC的细胞学标本),但黏液内的肿瘤细胞呈柱状,比纯MC异型性更大,染色质粗糙,核仁明显;背景中常有坏死碎片。
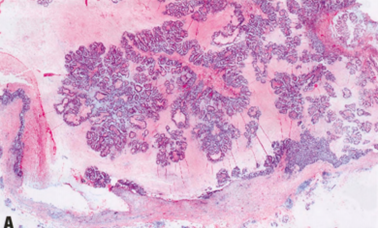

图2.127 MSC。A 低倍,囊性肿瘤伴囊内乳头状结构。B 囊腔和乳头状结构衬覆高柱状肿瘤细胞伴丰富的胞质内黏液。
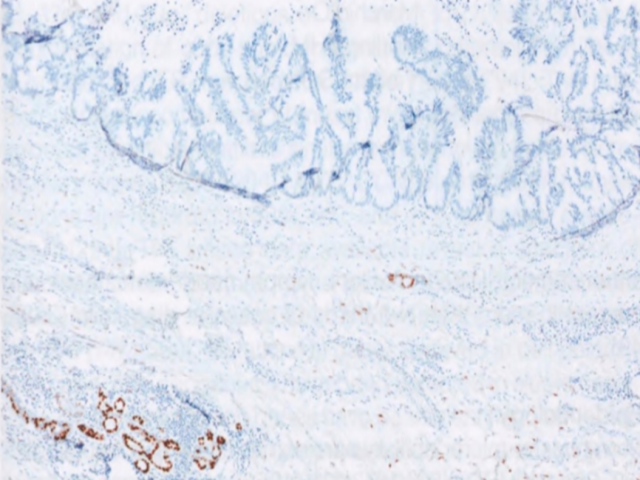
图2.128 MSC细胞不表达ER。内对照阳性。
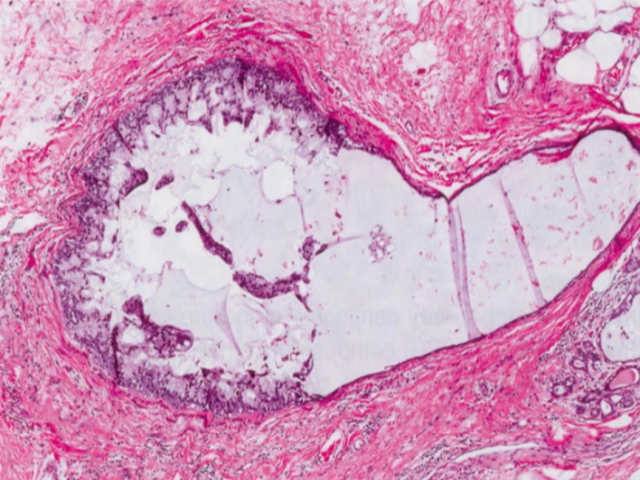
图2.129 MSC附近的DCIS。低倍,一例MSC中DCIS(左半)部分累及乳腺导管。也存在局部良性乳腺实质(右下角)。
诊断性分子病理学
与临床无关
诊断标准
必要标准:IBC伴大囊腔,囊内含有黏液,衬非典型柱状细胞伴胞质内黏液。
理想标准:ER阴性和PR阴性(通常);相邻DCIS。
分期
根据第八版的UICC TNM按IBC进行分期。
预后与预测
腋窝淋巴结受累相对少见,只有4例报道淋巴结转移。多数病例预后较好。没有远处转移的记录,但随访时间有限。1例MSC发生在广泛高级别DCIS背景下,肿瘤切除8年后局部复发。
Invasive micropapillary carcinoma
2.8.9 浸润性微乳头状癌(IMpC)
定义
乳腺IMpC是一种IBC,由小的、中空的或桑椹状恶性细胞簇组成,围绕透明空隙,伴极性反转(里面朝外)生长方式。
ICD-11编码
8507/3 乳腺IMpC
ICD-11编码
2C60&XH9C56特殊型乳腺癌&IMpC
相关命名
可接受:微乳头状癌。
亚型
无
部位
IMpC没有特定象限。诊断时常见腋窝淋巴结转移。
临床特征
IMpC通常表现为可触及肿块。乳腺X线显示,肿瘤呈致密不规则肿块,边缘模糊。可有钙化。超声示低回声或偶有等回声肿块。MRI呈不规则肿块,不均匀强化。诊断时超过2/3病例有腋窝淋巴结转移。
流行病学
单纯IMpC少见,占IBC总数的0.9-2%。混合型更为常见,7.4%的IBC可见微乳头状区域。IMpC可发生于女性和男性患者。单纯型和混合型IBC患者的平均年龄与非特殊型(NST)ER阳性IBC患者的年龄重叠。
病因学
IMpC与普通乳腺癌相似,没有特异的病因。
发病机制
目前还没有明确的发病机制或高度重现性的分子改变。体外实验结果提示,EMA(MUC1)表达增加,降低了细胞间粘附,也降低了细胞与细胞外间质的粘附,提示EMA在细胞膜面向间质表面的表达可能是细胞从间质中分离的部分原因。基因表达谱分析,IMpC是管腔A或B型。阵列比较基因组杂交分析检测到8q、17q和20q的重现性获得;6q和13q删除;以及多种不同于等级匹配和ER匹配IBC-NST的拷贝数改变。混合型微乳头状癌的非微乳头成分具有类似于微乳头区的基因改变。MYC、CCND1和FGFR1扩增的报道率分别为33%、8%和17%。有限的可用数据提示,突变谱类似于管腔B型IBC-NST,PIK3CA、TP53、GATA3、MAP2K4和NBPF10中存在重现性突变。单个病例中检测到累及细胞极性、细胞形状和纤毛发生的基因突变。未发现重现性融合基因。据报道,与顶底极性(特别是高水平的LIN7A表达)、细胞粘附和细胞迁移相关的基因表达失调。
大体表现
与临床无关
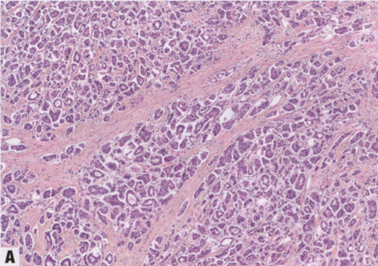
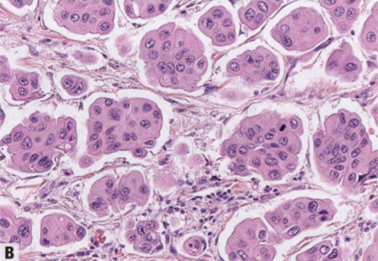
图2.130 IMpC。A 桑椹状和中空的癌细胞簇位于间质空隙内。B 立方形到柱状的肿瘤细胞,没有纤维血管轴心。细胞团呈里面朝外的生长模式,陷入间质空隙内。间质由纤维母细胞和结缔组织形成纤细的间质框架。
组织病理学
纯IMpC>90%肿瘤由中空的或桑椹样细胞簇组成。细胞簇缺乏纤维血管轴心(微乳头)。细胞簇周围有透明空隙,由纤维母细胞和结缔组织形成纤细的间质框架。透明空隙可能貌似淋巴管,但无内皮。细胞簇常显示极性反转,即,细胞膜的顶端朝外,朝向透明空隙,而不是朝向细胞簇的中心。HE切片中,可通过细胞膜外分泌物和分泌空泡来辨认这种模式;电镜显示,朝向间质的细胞表面存在微绒毛。细胞呈立方形至柱状;胞质嗜酸性,致密,或有细小颗粒。可能存在大汗腺特征。中或高核级别,不同程度的多形性。一些纯IMpC可有多核破骨样巨细胞,有些巨细胞与微乳头一样大。高达75%的IMpC为诺丁汉组织学2级或3级。一种罕见模式是微乳头状MC(见MC,第123页)。大多数癌呈ER阳性和PR阳性,但部分研究中15-20%的病例为三阴性。据报道,不同比例的病例存在HER2过表达和扩增。HER2免疫反应性可产生整个细胞膜上连续的完整的强染色(评分:3+),或以U形基底外侧模式的弱至中度染色,而细胞膜的管腔面不染色。后者应视为HER2免疫组化不确定(评分:2+),并进行反馈性原位杂交检测。少数病例表达基底样标记物。
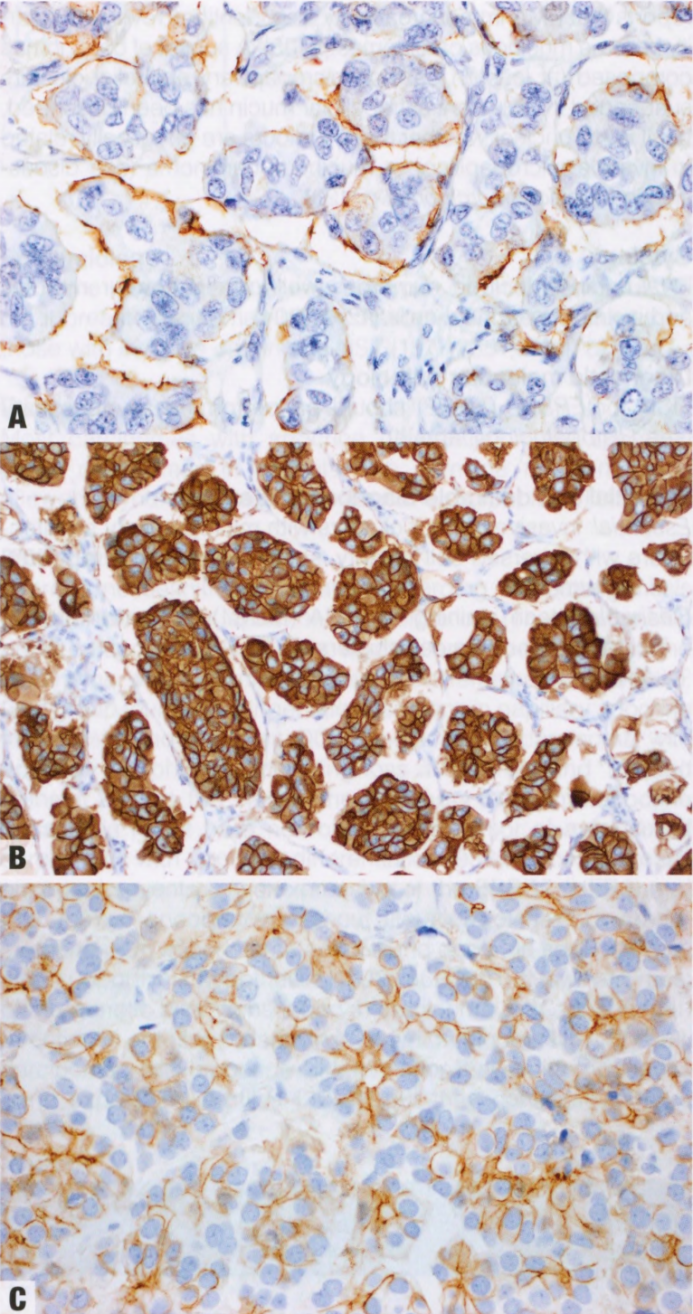
图2.131 IMpC。A EMA(MUC1)染色显示独特的极性模式,面向间质的外围细胞膜阳性,证实了里面朝外(极性反转)的生长模式。B HER2呈强而完整的膜染色(评分:3+)。C 这例HER2显示中度至强烈染色,但不是完整的膜染色(U形或基底侧染色)(评分:2+)。HER2FISH显示HER2基因扩增(HER2/CEP17比值:2.5)。
EMA(MUC1)在高分化IBC-NST细胞膜的管腔侧表达,但在IMpC中细胞膜的间质面染色,提示极性反转。EMA免疫染色可用于区分IBC-NST细胞膜的真极性反转和可能的间质收缩假象。在IMpC中,粘附蛋白(E-cadherin,p120)在基底外表达,与EMA互补,也提示极性反转。一组MC由悬浮在大量细胞外黏液中的微乳头状上皮簇组成(至少部分),但尚不清楚这些肿瘤是否与浸润性微乳头状癌或MC有遗传学相关(见MC中的讨论,第123页)。
细胞学
FNA发现包括许多完好的桑椹状肿瘤细胞和孤立的恶性细胞。
诊断性分子病理学
如有必要,应进行HER2的FISH检查(见上述组织病理学)。
诊断标准
必要标准:超过90%的浸润性肿瘤细胞簇呈微乳头结构的,极性反转,位于透明空间内。
理想标准:细胞簇的面向间质的边缘表达EMA(MUC1)。
分期
与其他类型的IBC相同。
预后与预测
IMpC较IBC-NST更易侵犯瘤周淋巴管和腋窝淋巴结。因此,微乳头形态与相同大小未经选择的IBC-NST预后较差相关。然而,与患者年龄、肿瘤大小和分级、瘤周淋巴管血管侵犯、免疫组化定义的分子亚型和阳性淋巴结数量相匹配的IBC相比,微乳头组织学类型似乎没有增加与疾病复发风险或总体生存率相关的独立信息。荟萃分析包括14项研究中的1888个微乳头状癌,显示微乳头状癌患者的局部区域复发率高于IBC-NST患者;然而,总生存率、疾病特异性生存率和无远处转移生存率差异无统计学意义。
Carcinoma with apocrine differentiation
2.8.10 大汗腺分化癌(CaAD)
定义
CaAD是一种浸润性癌,其特征是大细胞具有丰富的嗜酸性颗粒性胞质,核增大,核仁明显,类似于大汗腺。
ICD-11编码
8401/3 大汗腺癌
ICD-11编码
2C61&XH4GA3乳腺浸润性癌&腺癌伴大汗腺化生
相关命名
可接受:浸润性大汗腺癌;大汗腺癌。
亚型
没有
部位
其定位与IBC-NST相似。
临床特征
其临床特征与IBC-NST相似。CaAD通常表现为质硬、边界不清的肿块。乳房X线可能看到微钙化,特别是伴有DCIS。
流行病学
CaAD是一种罕见的亚型,约占所有乳腺癌的1%。患者往往比浸润性癌NST更年长。
病因
大多数CaAD是散发性。携带种系PTEN突变(Cowden综合征)的患者中,一些乳腺癌可能具有大汗腺形态。
发病机制
关于CaAD的发病机制,目前还没有明确的信息。大汗腺化生、非典型AAs和CaAD之间的关系仍然存在争议。一组研究人员在乳头状大汗腺化生和邻近DCIS以及CaAD中发现了类似的遗传学改变,包括1p、16q和17q的缺失,和2q和13q的获得,提示一些大汗腺化生性病变可能是CaAD的非必然前驱病变。关于大汗腺化生和AAs中早期致癌事件的报道——HER2和MYC(c-MYC)癌蛋白的过表达,而相应基因没有改变——也可能支持这一假设。然而,在CaAD中发现的大多数遗传学改变也存在于IBD-NST中。总的来说,CaAD具有异质性的基因表达谱,但如果仅分析大汗腺形态和三阴性癌,则它们构成了较同质的组合。CaAD经常携带TP53和PIK3CA/PTENIKT基因突变。MAPK通路内的突变(如KRAS、NRAS和BRAF)较少见。
基因表达谱研究已经确定了一种分子大汗腺特征(分子大汗腺乳腺癌或管腔AR),其特征是AR上调,无ER激活。然而,分子大汗腺乳腺癌/管腔AR亚型癌可能不等同于根据形态学定义的CaAD。
大体表现
大体表现无特异性,与浸润性癌NST相似。
组织病理学
细胞具有丰富的颗粒性嗜酸性或空泡状胞质,细胞边界清晰。核增大,圆形至卵圆形,明显或中度异型性,核仁明显;少见低度核异型性。实性生长模式为主,但可能有任何结构模式。核分裂活性通常为中-高度。因此,大多数CaAD为2或3级。常有大汗腺DCIS,中或高核级别,伴粉刺坏死和钙化。
CaAD表达GCDFP-15,这是在大汗腺化生中发现的抗原。激素受体表达谱有特征性,即ER阴性、PR阴性和AR阳性。CaAD恒定表达AR。在30-60%的病例中,AR激活伴有HER2过表达和/或HER2。在三阴性癌中,50-80%的CaAD呈AR阳性。GATA3表达于90%的CaAD和70%以上的AR阳性三阴性癌。
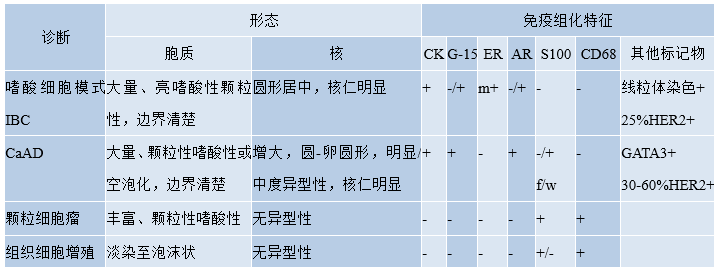
大汗腺异型性/大汗腺DCIS累及硬化性病变时,可能类似于大汗腺异型性/大汗腺DCIS。肌上皮染色可能有助于鉴别。大汗腺化生的肌上皮层可能不明显或缺失,但无核异型性。颗粒细胞瘤具有丰富的颗粒性嗜酸性胞质,ER阴性,但无核异型性,不表达角蛋白,CD68和S100呈弥漫强阳性,而CaAD仅显示S100局灶弱阳性。乳腺嗜酸细胞癌非常罕见,可能显示GCDFP-15和HER2阳性;它们通常是ER阳性,线粒体染色阳性。在一些特殊亚型的浸润性癌中也观察到大汗腺形态,包括MC、微乳头状癌和多形性小叶癌。由具有明显的空泡状或泡沫状胞质的、就像组织细胞的大汗腺细胞(GCDFP-15阳性)组成的罕见癌已有描述,这些肿瘤大多呈E-cadherin失表达,可能代表一种具有大汗腺分化的ILC亚型。组织细胞样大汗腺细胞组成的乳腺癌可能与组织细胞增殖相混淆,但CK和CD68的免疫染色可用于区分。表2.09(第131页)总结了具有嗜酸性颗粒性细胞的乳腺肿瘤和病变的鉴别诊断。
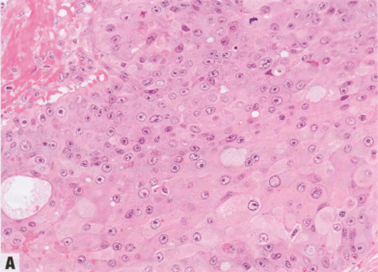
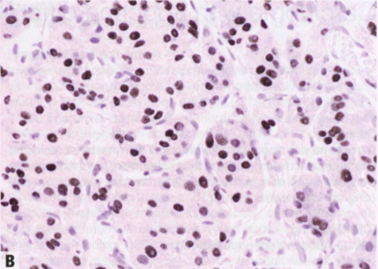
图2.132CaAD。A较高,显示核特征,核仁大而明显。B AR强阳性核染色。
表2.09具有嗜酸性颗粒性细胞的乳腺肿瘤和病变的鉴别诊断
m+,大部分+;f/w,局灶/弱;G-15,GCDFP-15
细胞学
CaAD的细胞学标本由丰富的单个细胞和中度至明显异型性上皮簇组成,胞质丰富,空泡化至强嗜酸性。恶性肿瘤的明确诊断需要高度富于细胞、细胞非粘附性和显著核异型性,以排除累及形成肿块的硬化性病变中的非典型大汗腺腺病的鉴别诊断。大汗腺囊肿上皮的退行性改变也可能需要鉴别。
细胞学
没有特定的诊断分子测试可用。可根据需要进行HER2 FISH检测。
诊断标准
必要标准:90%以上的肿瘤细胞具有大汗腺形态。
理想标准:ER阴性、PR阴性和AR阳性。
分期
CaAD根据TNM分类系统进行分期。
预后和预测
由于对CaAD的诊断标准不同,临床随访研究的结果往往相互矛盾。最近的研究报道称,CaAD患者的临床预后比浸润性癌NST患者差;然而,在SEER计划基于人群的数据分析中,在调整了人口统计学和临床病理特征后,结果有所改善。一些研究发现,与其他三阴性肿瘤相比,AR阳性三阴性CaAD患者的总体生存率和乳腺癌特异性生存率更好,而其他研究没有发现差异。关于新辅助化疗的病理反应的信息非常有限。一组报道了约30-50%的CaAD对新辅助化疗的部分或完全病理反应。然而,在另一个丛书中,CaAD对新辅助治疗的反应较差,但患者的预后良好。同样,在一项评估基因表达谱定义的乳腺癌三阴性亚型的研究中,管腔AR癌在新辅助化疗后的病理完全缓解率仅为10%,但肿瘤在临床上表现更像ER阳性癌,结果良好。
Metaplastic carcinoma
2.8.11 化生性癌(MeCa)
定义
MeCa是一组异质性IBC,其特征是肿瘤上皮向鳞状细胞和/或看似间叶性细胞分化,包括但不限于梭形细胞、软骨样细胞和骨细胞。
ICD-11编码
8575/3 化生性癌-NOS
ICD-11编码
2C6Y&XHORD4乳腺化生性癌&化生性癌-NOS
相关命名
可接受:MeCa
不推荐:癌肉瘤;肉瘤样癌;癌伴假肉瘤化生;癌伴假肉瘤间质。
亚型
没有
部位
MeCa可以累及乳腺的任何解剖区域。
临床特征
MeCa的临床特征与ER阴性IBC-NST相似;然而,MeCa更可能是晚期。大多数病例(85%)表现为可触及的肿块,超声(100%)或乳房X线(78%)检测为肿块。钙化少见(17%);存在钙化时,通常伴有DCIS和/或骨分化。
流行病学
据报道,MeCa占所有IBC的0.2-1%。这种发生率的差异源于不同作者对MeCa的不同定义。
病因
MeCa有多种致病因素,它似乎与IBC-NST(特别是三阴性亚型)没有区别。
发病机制
尽管乳腺MeCa构成了一组具有独特形态特征的异质性肿瘤,具有明显的瘤间和瘤内异质性,但遗传学研究支持MeCa异质性成分为单克隆起源,有些学者支持肿瘤去分化的晚期改变的概念,而不是起源于基底样干细胞。然而,尚不清楚体细胞突变是否会导致分化,从而产生MeCa亚型,并且尚未发现MeCa的特异性致病突变。在MeCa中经常发生突变的基因包括TP53和PIK3CA。据报道,鳞状化生和梭形细胞形态的MeCa显示EGFR过表达和突变以及p63免疫染色阳性。其他遗传学异常包括PTEN和CDKN2A的缺失。MeCa表现出干细胞样表型,CD44阳性,CD24阴性。MeCa是三阴性乳腺癌的一部分,其特征是GATA3调节基因和负责上皮间质转化和细胞粘附的基因表达低,波形蛋白和E-cadherin阻遏物分子(SNAI1[SNAIL]、SNAI2[SLUG]、TWIST)上调,E-钙粘素下调。这些分子特征提示,MeCa起源于相对抵抗化疗的乳腺上皮前驱病变。
大体表现
MeCa的大体表现通常不特异,肿瘤可以表现为边界清晰的肿块,也可以显示模糊、不规则的边界。囊性变并不少见,特别是伴有鳞状细胞癌的MeCa。鳞状和软骨样化生区域可见珍珠色、白色和有光泽的切面,而骨化生区域的切面可能砂砾状和质硬。与IBC-NST相比,MeCa往往更大,平均大小为3.9cm,范围从2cm到>10cm。强烈建议对病变进行彻底取样。
组织病理学
MeCa是一组具有不同临床结局的独特的组织病理学模式,但经常有重叠。鉴于MeCa的异质性,WHO肿瘤分类根据化生成分的类型维持了描述性分类系统。MeCa可以是单相(只有一种化生成分)或双相(有两种或多种成分)。这两种成分可能都是化生性组织学,如鳞状细胞和/或梭形细胞伴间叶性/产生基质成分,或可能是一种化生成分和一种腺癌成分(IBC-NST最常见)。如果发现多种成分,建议注明每个成分及其在肿瘤内的大致百分比。根据组织学模式,MeCa也可分为纯上皮癌(LGASC、高级别腺鳞癌或纯鳞状细胞癌)、纯(单相)肉瘤样(梭形细胞或产生基质)癌,以及双相上皮和肉瘤样癌。部分IBC-NST可能只有非常局灶的化生成分,应在报告中注明。
LGASC
低级别腺鳞癌(LGASC)模式显示完好的腺体和管状结构,与梭形细胞背景中的鳞状细胞实性条索密切混合。癌成分的特征是小腺体结构(具有圆形而非成角的轮廓)和上皮细胞的实性条索,其中可能含有鳞状细胞、角化珠或鳞状囊肿。浸润性肿瘤成分通常在周围显示出细长的延伸,并浸润到正常乳腺结构之间。淋巴细胞簇通常出现在外周,有时呈霰弹模式。由于该肿瘤预后良好,应区分其他(高级别)腺鳞癌。还应区分乳头(汗管瘤样)腺瘤和RS/CSL的早期富细胞阶段。
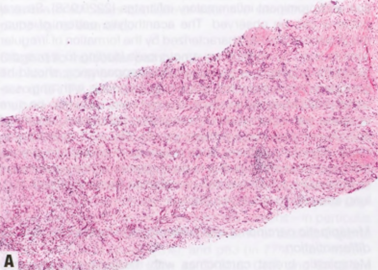
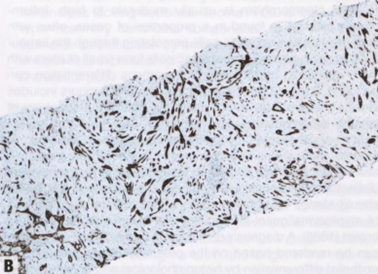
图2.133 MeCa,LGASC。A CNB显示HE切片上存在明显的浸润性病变。B CK5/6弥漫强阳性,不同于增生性病变的镶嵌模式。
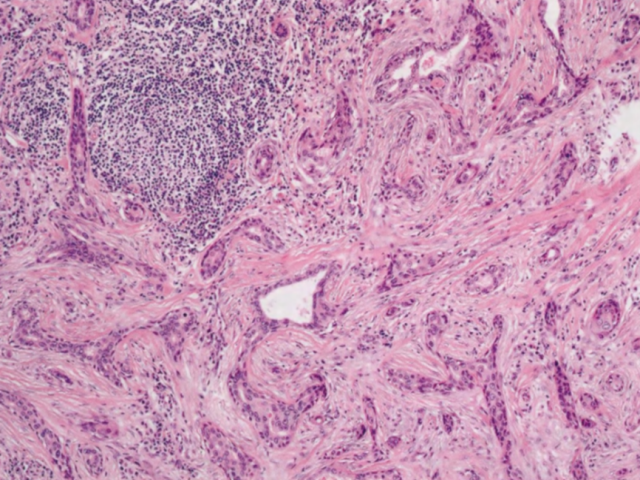
图2.134MeCa,LGASC,特征为浸润性腺体,细胞学检查平淡,局灶性鳞状细胞分化,促纤维增生间质和淋巴聚集。一些浸润腺体可能显示外周肌上皮样细胞。
补充:以下内容来自第3版《乳腺病理活检解读》
低级别腺鳞癌少见,似乎代表着一种独立的临床病理实体。肿瘤可新发,亦可继发于先前存在的良性硬化性病变,如复杂性硬化性病变、硬化性乳头状瘤和腺肌上皮瘤。肿瘤通常小于其他化生性癌,中位大小为2-2.8cm(范围0.5-8.6cm)。肿瘤质硬,切面黄色,边缘不规则。组织学上,低级别腺鳞癌由完好的腺体和实性条索排列的鳞状分化细胞按不同比例混合而成,呈杂乱无章地排列和浸润性生长。腺体常拉长,管腔挤压,可能提示汗管瘤样分化(图10.26),可见充满角化物的微囊。间质由温和的梭形细胞组成,形成纤维瘤病样改变或较明显的胶原化。间质细胞丰富,呈同心圆围绕肿瘤细胞巢是特征性改变。部分病例中间质梭形细胞较丰富,并有细胞异型性,提示病变向高级别梭形细胞癌进展。肌上皮标记物(如p63、SMM、CD10和calponin)可以显示部分肿瘤腺体和细胞巢周围的肌上皮,这些肌上皮可以呈连续性或间断性或完全缺失,同一病例中以上各种情况都可能出现。SMM和calponin染色显示腺体周围间质细胞呈层状分布,管腔上皮细胞的CK表达强度高于基底部细胞,均为特征性表现。
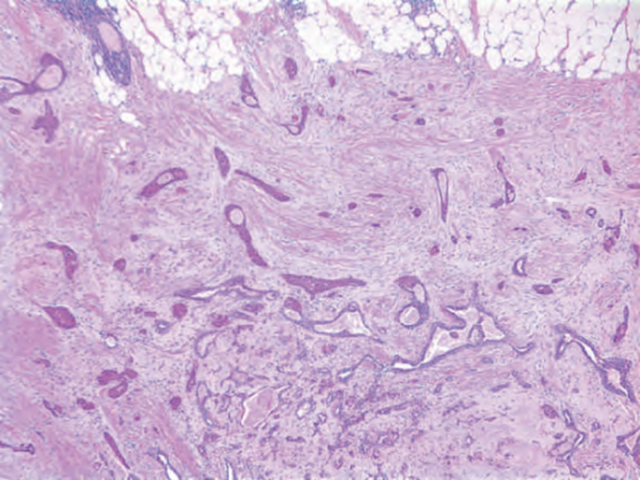
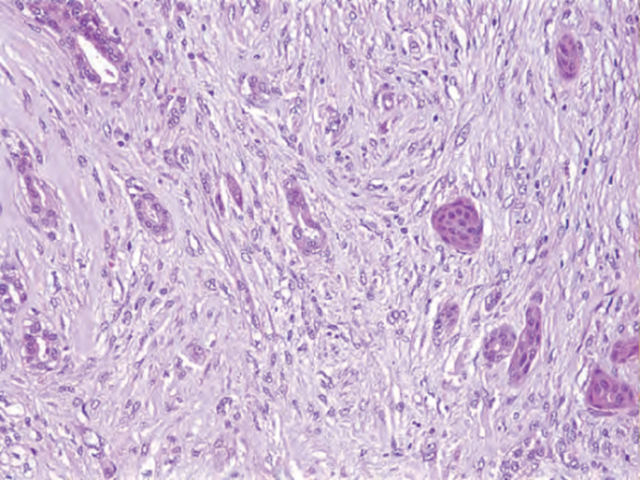
图10.26 低级别腺鳞癌。A:肿瘤由分布于间质内的完好的腺体和鳞状上皮巢组成。B:高倍,示腺体和鳞状细胞均表现为温和的细胞学特征
低级别腺鳞癌的鉴别诊断包括乳头部汗管瘤样腺瘤、反应性鳞状细胞化生和小管癌。低级别腺鳞癌可局部侵袭性生长,但比其他化生性癌的预后好。
纤维瘤病样MeCa
特征是>95%的肿瘤由形态温和的梭形细胞组成,细胞质呈淡嗜酸性,核细长,两端渐细,染色质细腻均匀。间质具有不同程度的胶原化。无高级别核,仅有轻度核异型性。梭形细胞通常排列成波浪状、交织的束状,或者形成长束状手指状延伸渗透到相邻的乳腺实质中。电线和线束
通常发现丰满的梭形细胞和更明显的上皮样细胞形成条索和细胞簇;似乎形成血管周围分布的模式。可能发现局灶性鳞状分化。经常观察到从丰满细胞向梭形细胞成分的逐渐过渡。这些肿瘤几乎总是p63阳性;角蛋白总是表达,偶尔局部表达,常局限于丰满梭形细胞和上皮样细胞的表达。纤维瘤样MeCa应始终作为乳腺形态温和的梭形细胞病变的主要鉴别诊断。通过组织病理学和/或免疫组化分析,可以根据上皮分化的任何证据来诊断纤维瘤样MeCa(见下文)。由于预后较好,应区分更常见的高级别梭形细胞MeCa。
梭形细胞癌
特征是非典型梭形细胞排列成多种结构模式,从鱼骨形或交织模式的长束状到席纹状(车辐状)模式的短束状。最常见的是不同模式的混合。胞质从细长到丰满梭形不等,中-高度核多形性。部分病例中发现炎性浸润,通常伴有淋巴细胞和树突状细胞渗透穿过肿瘤主体。可以发现肿瘤细胞形成具有更明显上皮样形态或鳞状分化的小簇区域。应该指出,这组肿瘤包括多种病变,形成形态学谱系,一端可能是梭形鳞状细胞癌,另一端可能是恶性肌上皮瘤/肌上皮癌。目前,没有明确的标准来区分这两种病变,也没有数据提示这些病变表现出不同的临床行为。化生性梭形细胞癌应始终作为乳腺非典型/恶性梭形细胞病变的主要鉴别诊断。通过组织病理学和/或免疫组化分析,可以根据上皮分化的任何证据来诊断化生性梭形细胞癌(见下文)。
鳞状细胞癌
纯化生性鳞状细胞癌通常表现为囊性病变,其中空腔内衬鳞状细胞,具有不同程度的核异型性和多形性。肿瘤细胞以片状、索状和巢状的形式浸润邻近的间质,具有不同程度的鳞状分化,它们通常会引起明显的间质反应和明显的炎症浸润。可以观察到几种模式。鳞状细胞癌的棘层松解模式,其特征是形成由衬覆典型鳞状细胞的不规则腔隙,导致假腺或假血管肉瘤样外观,应作为血管肉瘤的潜在鉴别诊断。化生性鳞状细胞癌可能是纯型,也可能与其他类型的化生性癌混合,通常是梭形细胞癌模式或IBC-NST(腺鳞癌模式)。为了诊断乳腺原发性鳞状细胞癌,其他部位的原发性皮肤鳞癌或转移性鳞癌(如肺和宫颈)必需排除。
具有异源间叶性分化的化生性癌
具有间叶性成分的化生性乳腺癌通常由间叶性组分(包括软骨样、骨样、横纹肌样甚至神经胶质分化)与癌区(可以是腺分化、小管、实性簇和/或鳞状分化灶)混合而成。间叶性成分的范围可以从显示分化的轻微异型性到显著的恶性特征,就像真正软组织肉瘤中的模式。历史上,“产生基质的癌”一词适用于具有间叶性成分的MeCa亚组,其中发现了从上皮到间叶性成分的突然转变,两种成分之间没有梭形细胞。然而,有些病例显示出梭形细胞的局灶性存在,这一特征不排除该诊断。肿瘤中存在真正的软骨样或骨样分化伴软骨样或骨样基质是至关重要的。在绝大多数病例中,很容易发现上皮分化区域,但部分病例中,需要广泛取材来才能发现癌区域,并将这些肿瘤与骨或软组织肉瘤区分开来。重要的是,免疫染色显示上皮标记物的表达,通常是高分子量CK。
混合性MeCa
广泛取材后,很多化生乳腺癌显示不同化生成分的混合,以及化生和传统型腺癌成分的混合。这些病例应报告为MeCa,最终报告应记录这些不同的成分。
细胞学
乳腺细针穿刺活检中存在双相肿瘤细胞,包括非典型梭形细胞、鳞状细胞癌细胞、破骨细胞样巨细胞和/或伴或不伴腺癌细胞成分的间质,可能为MeCa的诊断提供线索。产生基质的MeCa的细胞学显示丰富的黏液样间质以及由单一细胞群组成的细胞簇,与PA的细胞学重叠。由于对各种病理因素的选择性取样,可能无法在所有情况下对MeCa进行细胞学诊断。
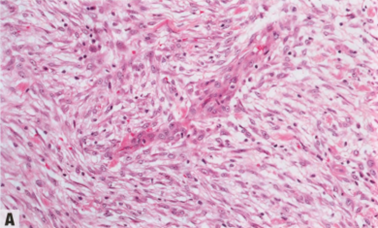
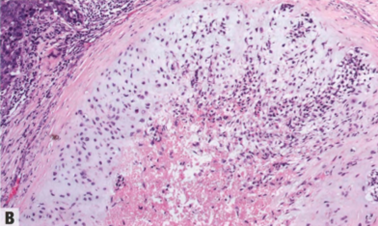
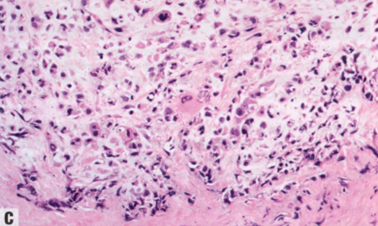
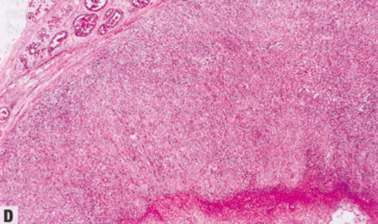
图2.135 MeCa。A 局灶性上皮分化为纤维瘤样MeCa的诊断线索。B 一例软骨黏液样形态(异源间叶性分化)。C 一例产生基质的MeCa,呈高级别核特征、软骨样基质中的失粘附细胞。肿瘤中异型程度可能各不相同。尽管软骨样基质的存在是这些肿瘤的特征,但其数量和分布可能不均匀。D 高级别梭形细胞MeCa伴高级别筛状非梭形细胞型DCIS,支持浸润性梭形细胞成分的性质为癌。诊断分子病理学
绝大多数(>90%)的MeCa缺乏ER、PR和HER2的表达。大多数表达高分子量CK(CK5/6和CK14)、p63和EGFR(HER1);事实上,一组EGFR(HER1)阳性MeCa显示EGFR基因扩增。然而,在这些肿瘤中,激活EGFR的体细胞突变似乎极为罕见。在化生乳腺癌中识别上皮分化需要使用一组免疫组化标记物。常见的标记物是角蛋白,特别是AE1/AE3和MNF116(75-85%的病例呈阳性);34β12、CK5/6和CK14(70-75%);p63(77%)。低分子量CK如CK8/18、CK7和CK19在较低比例的病例中呈阳性(36-61%)。肌上皮标记物,包括SMA、CD10和maspin,也经常呈阳性(在50-70%的病例中)。MeCa呈CD34阴性(100%的病例),通常缺乏结蛋白(18%)和SMMHC(11%)的表达。E-cadherin可能在鳞状细胞病灶内异常表达;β-catenin也可能异常表达。应注意LGASC模式的MeCa具有双相组成:腺样结构中的上皮层对管腔CK呈阳性,偶尔对基底CK也呈阳性,肌上皮/基底细胞显示基底样CK和p63的不同表达水平,染色范围从完全到不完全再到缺失。
从转录组学角度来看,这些肿瘤使用内在基因分类归入基底样或claudin低亚型,使用Lehmann等人提出的分类被分为基底样和间叶性样。对MeCa的全外显子组和靶向测序分析提示,这些肿瘤具有复杂的基因拷贝数改变和基因库。体细胞突变,包括累及TP53、RB1和染色质重塑基因(即ARID1A和KMT2C)的突变,以及与PI3K途径相关的基因(即PIK3CA、PIK3R1和PTEN),MAPK通路(即NF1、KRAS和NRAS)和WNT通路(即FAT1和CCN6[WISP3])。有趣的是,有证据提示,与其他形式的MeCa和LGASC相比,梭形细胞癌中TP53突变的频率可能较低。与其他形式的三阴性乳腺癌相比,MeCa比基底样癌更频繁地表现出涉及PI3K通路相关基因的突变,但其频率与管腔AR三阴性疾病中发现的频率相似。与PT类似,在一项研究中,有25%的病例报道MeCa携带TERT基因启动子突变,但在其他研究中没有检测到这些突变;需要进一步分析以确定化生乳腺癌中TERT启动子突变的频率。
诊断标准
必要标准:具有非典型鳞状细胞、梭形细胞和/或间叶性/产生基质的IBC;在缺乏DCIS或传统型乳腺癌成分的MeCa中,基于(高分子量)CK和/或p63的明确表达,通过免疫组化直接证明上皮分化。
分期
MeCa的分期与其他类型的IBC相似(见“2.8.1 概述”,第82页)。
预后和预测
在化生乳腺癌中发现淋巴结转移的频率明显低于大小和级别相似的IBC-NST。正如其他三阴性乳腺癌,在没有淋巴结转移的情况下,可以发现MeCa有远处转移(优先累及脑和肺)。对于MeCa患者,没有1级证据支持的预后标记物或治疗反应的预测标记物。回顾性分析提示,特定亚型可能有特别的临床结局。尽管存在三阴性表型,但纤维瘤病样癌和LGASC与其他类型的IBC相比具有更惰性的行为。在MeCa的类型中,高级别梭形细胞癌、鳞状细胞癌和高级别腺鳞状细胞癌的预后最差,而产生基质的癌的预后较好。混合性MeCa中形态数量越多,预后越差。组织学分级在化生乳腺癌中的预后价值尚不确定。乳腺癌化生的3年、5年和10年总生存率分别为77%、62%和53%。激素阳性和激素阴性MeCa的5年生存率没有差异。有证据提示,罕见的HER2阳性MeCa可能比三阴性MeCa的预后更好。放射治疗具有生存获益。据报道,与其他形式的三阴性乳腺癌相比,化生乳腺癌对常规辅助化疗的反应率较低,化疗后的临床结果较差。
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论