往期回顾
乳腺肿瘤WHO分类学习笔记(连载1)
乳腺肿瘤WHO分类学习笔记(连载2)
乳腺肿瘤WHO分类学习笔记(连载3)
乳腺肿瘤WHO分类学习笔记(连载4)
乳腺肿瘤WHO分类学习笔记(连载5)
乳腺肿瘤WHO分类学习笔记(连载6)
乳腺肿瘤WHO分类学习笔记(连载7)
乳腺肿瘤WHO分类学习笔记(连载8)
乳腺肿瘤WHO分类学习笔记(连载9)
2.9罕见涎腺型肿瘤
简介:正常乳腺和涎腺具有相似的结构(均为管腺泡状腺)和相似的细胞组成(均由肌上皮细胞包围管腔上皮细胞)。此外,乳腺可以包含显示纯腺泡分化的小叶,类似于涎腺中看到的浆液性腺泡细胞。两个腺体的管腔上皮细胞具有相似的免疫特征,表达低分子量的CK、ER、PR和AR。这些结构上的相似性导致了相似的肿瘤发生。
乳腺可以生涎腺中遇到的所有肿瘤类型。这些涎腺型乳腺肿瘤具有相同的形态特征,并且常有涎腺对应物中发现的分子改变,但它们的临床行为往往不同。涎腺型乳腺肿瘤通常为三阴性,缺乏ER/PR表达和HER2扩增,显示出低或中等浸润潜能。因此,了解其特定部位的行为对于正确管理和避免过度治疗非常重要。
Acinic cell carcinoma
2.9.1 腺泡细胞癌(ACCa)
定义
ACCa是一种由透明和颗粒性上皮细胞组成的恶性上皮性肿瘤,部分细胞含有胞质内酶原颗粒,排列成微腺体和实性形态。
ICD-11编码
8550/3 ACCa
ICD-11编码
2C60&XH3PG9特殊型乳腺癌&腺泡细胞腺癌
相关命名
没有
亚型
没有
部位
ACCa可以累及任何乳腺象限,没有部位偏好。
临床特征
乳腺ACCa通常累及成年女性(20-80岁)。一例累及男性乳房。临床表现与IBC-NST相似。
流行病学
乳腺ACCa是一种罕见的IBC亚型。Roncaroli等人于1996年首先描述,随后Damiani等人于2000年进一步完善。此后,文献中描述的病例不到50例。
病因
未知
发病机制
乳腺可以显示腺泡样分化,这可以解释ACCa的发生。一例发生在BRCA1突变患者。乳腺ACCa的DNA拷贝数和突变情况类似于传统组织学诊断的三阴性乳腺癌或伴有MA,携带TP53、PIK3CA、KMT2D、ERBB4、ERBB3、NEB、BRCA1、MTOR、CTNNB1、INPP4B和FGFR2突变。值得注意的是,乳腺ACCa的突变特征不同于涎腺腺泡细胞瘤,提示它们不是相关实体,这与大多数乳腺涎腺样肿瘤样反。
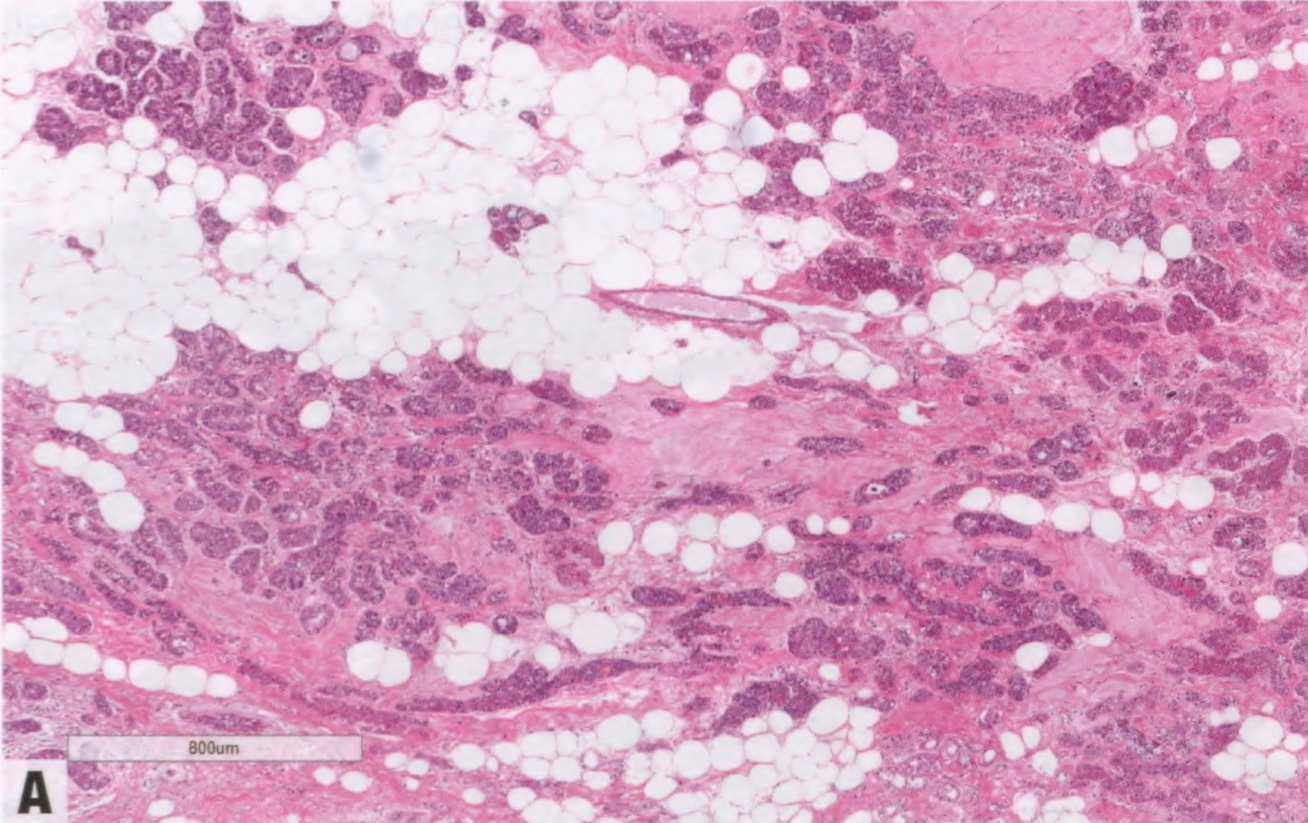
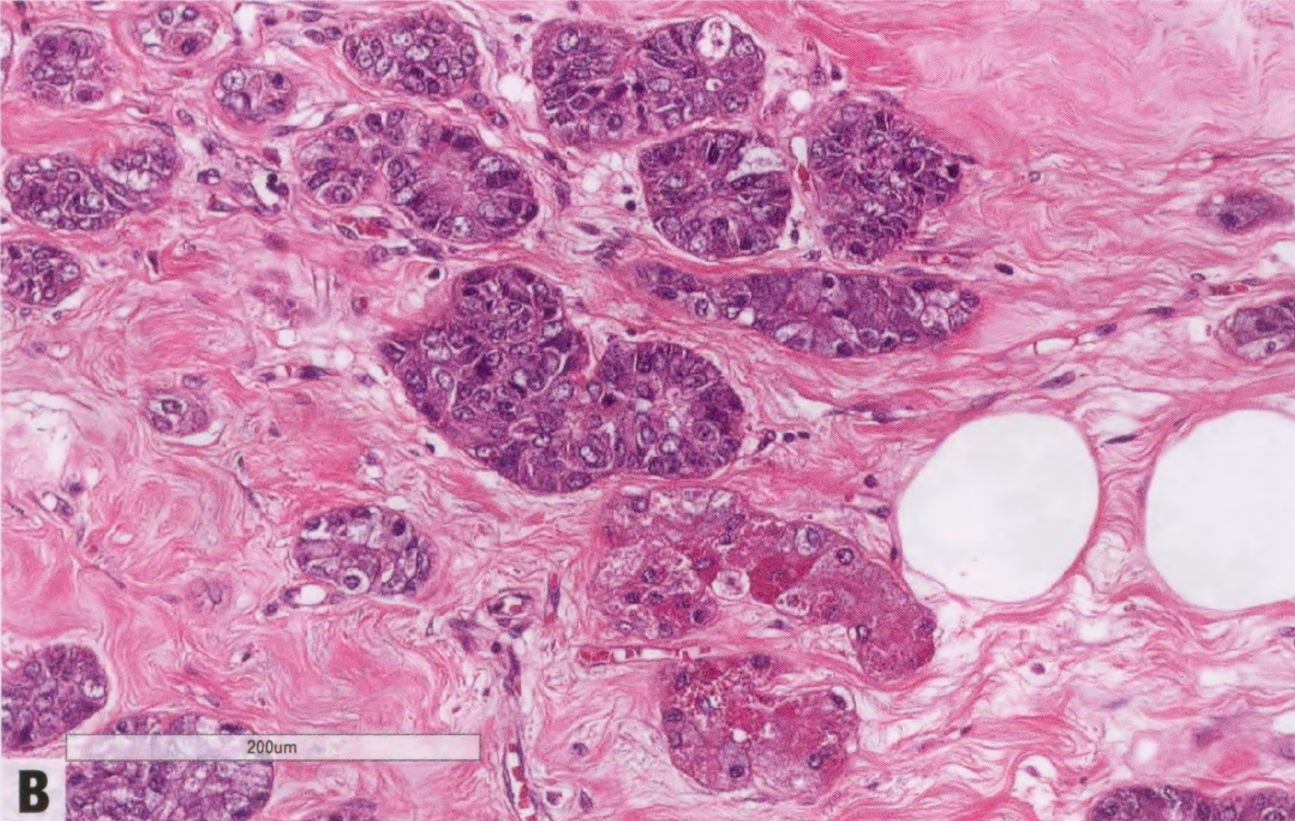 图2.136 ACCa。A ACCa伴微腺体增殖,由小腺体组成。小腺体不规则,衬复层细胞。B 肿瘤细胞具有异型性和颗粒性胞质。部分细胞可见粗糙的嗜酸性颗粒。
图2.136 ACCa。A ACCa伴微腺体增殖,由小腺体组成。小腺体不规则,衬复层细胞。B 肿瘤细胞具有异型性和颗粒性胞质。部分细胞可见粗糙的嗜酸性颗粒。
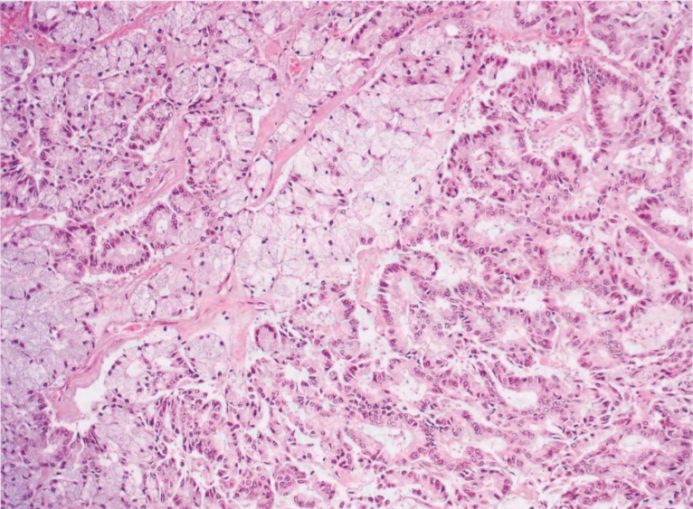
图2.137 ACCa。肿瘤细胞显示透明胞质。
大体表现
ACCa的大体表现与IBC-NST相同,其特征是浸润性结节,质硬,大小11-50mm。一例发生在FA内。
组织病理学
低倍镜下,ACCa可以显示出各种各样的结构模式,从微腺体增殖到常有中心坏死的实性区域。这两种结构模式经常融合。由于结构多变,诊断基于对细胞学特征的识别。肿瘤细胞具有丰富的、不同程度的嗜酸性和嗜碱性颗粒性胞质,呈现杂色外观。PASD染色显示细胞内大而粗糙的嗜酸性颗粒。电镜检查,胞质内颗粒更明显。胞质有时是透明的。核居中,有明显核仁。肿瘤细胞显示不同程度的异型性。异型性和核分裂象在实性区域更明显。可能存在高核级别DCIS。
肿瘤细胞表达浆液性腺泡分化的标记物,如溶菌酶和a1抗糜蛋白酶。此外,S100、EMA和低分子量CK总是阳性。GCDFP-15局灶性阳性。
需鉴别多种乳腺肿瘤,包括高级别浸润性癌和SeCa。鉴别诊断基于细胞特征,特别是胞质内颗粒和浆液性腺泡分化标记物的存在。核形态温和的ACCa可能貌似乳腺SeCa,但ACCa缺乏SeCa中常见的t(12;15)ETV6-NTRK3易位。
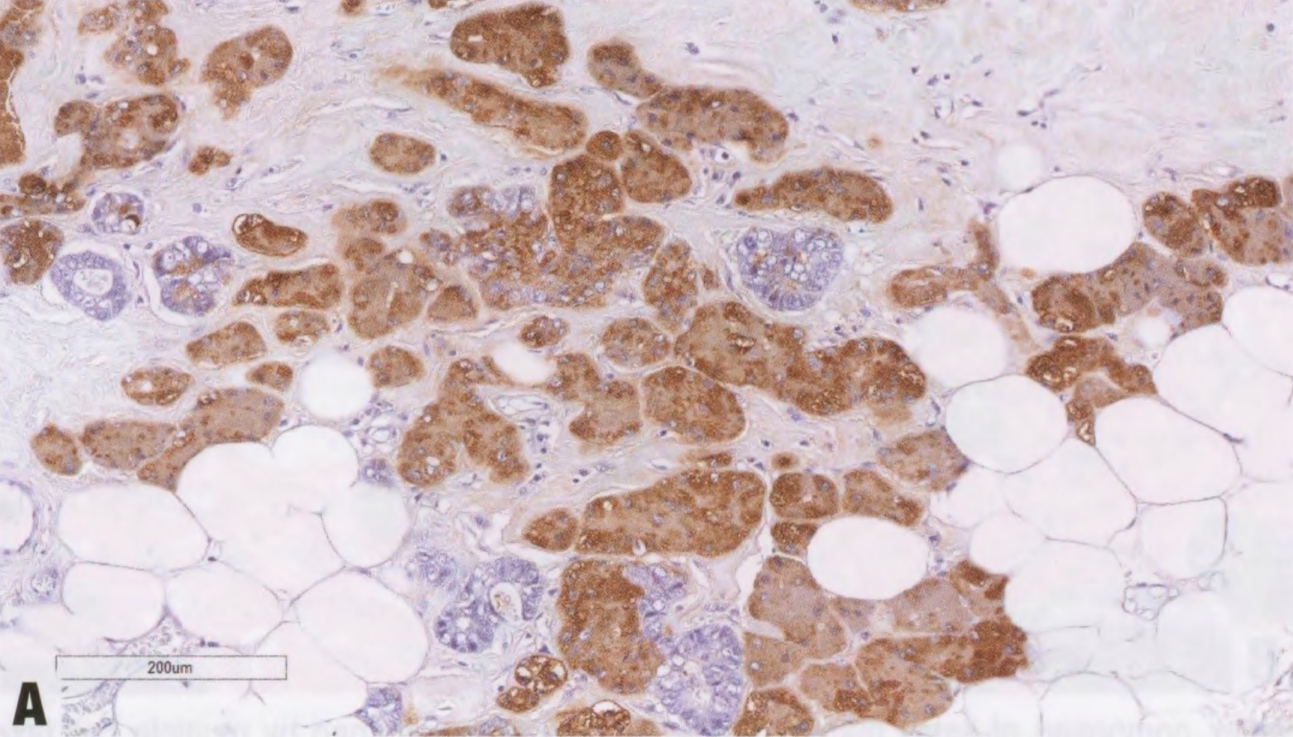
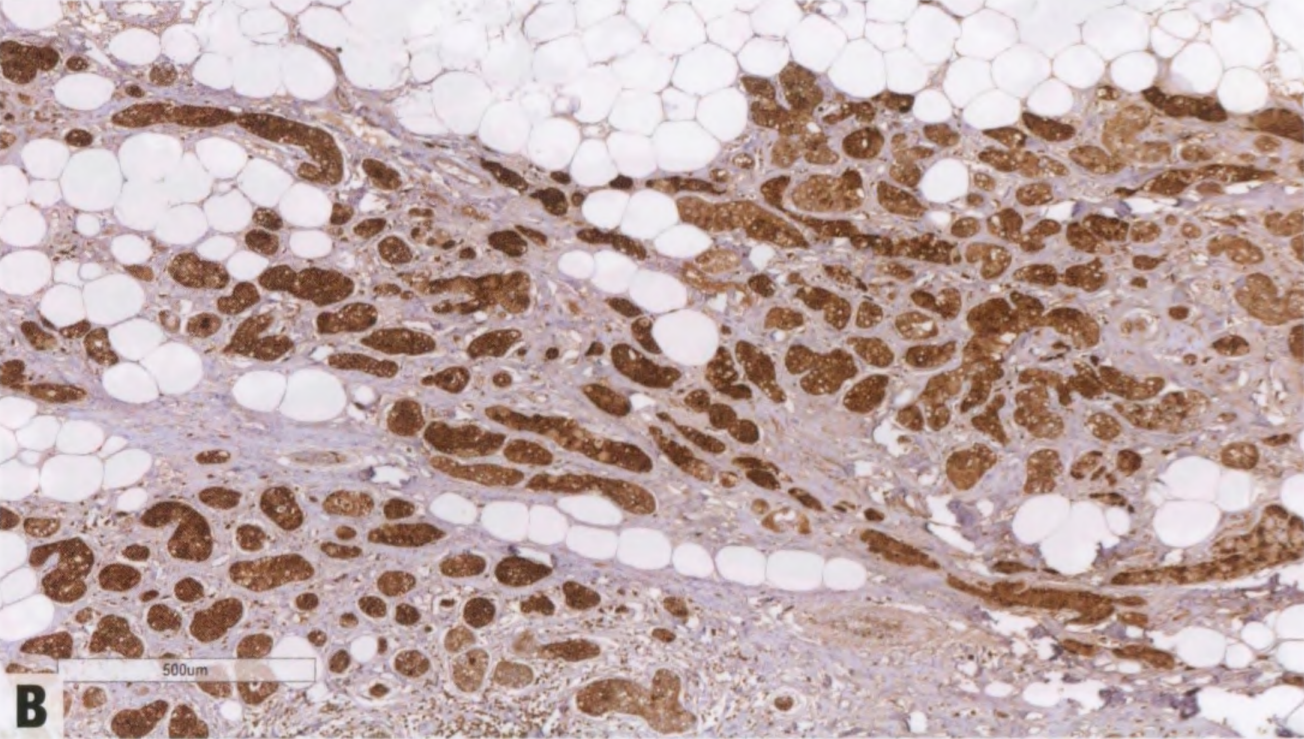 图2.138 ACCa。A 肿瘤细胞呈EMA强阳性。B 浆液性腺泡分化的标记物,如溶菌酶,呈强阳性。
图2.138 ACCa。A 肿瘤细胞呈EMA强阳性。B 浆液性腺泡分化的标记物,如溶菌酶,呈强阳性。
细胞学
有一例乳腺ACCa的FNA报道。涂片中细胞丰富,如IBC-NST中所见。胞质内粗颗粒有助于正确诊断。
细胞学
乳腺ACCa可包括在乳腺癌三阴性组中,因为它对ER和PR始终呈阴性,并且HER2扩增尚未得到证实。AR免疫反应性已被记录。
诊断标准
必要标准:肿瘤细胞具有嗜酸性和嗜碱性颗粒性胞质和PASD阳性胞质内颗粒;免疫组化,EMA和浆液性腺泡分化标记物阳性。
分期
ACCa根据其他类型乳腺癌采用的标准进行分期。
预后和预测
由于随访信息报道的病例数量有限,对ACCa预后的了解仍然有限。现有数据提示,ACCa是一种三阴性癌,具有中度浸润潜能。30例患者中有9例出现腋窝淋巴结转移,3例患者发生肝、骨和肺转移,导致2例死亡。然而,大多数报道的患者在诊断后6-184个月(平均42个月)仍然存活,没有复发的证据。大多数报道的患者除了手术外还接受了化疗和放疗。现有的分子证据支持ACCa可能是侵袭性更强的三阴性乳腺癌的前驱病变。
Adenoid cystic carcinoma
2.9.2 腺样囊性癌(AdCC)
定义
AdCC是一种浸润性癌,由上皮和肌上皮肿瘤细胞组成,排列成管状、筛状和实性模式,伴有嗜碱性间质和重叠的基底膜物质,常有MYB-NFIB融合。
ICD-11编码
8200/3 AdCC
ICD-11编码
2C60&XH4302特殊型乳腺癌&AdCC
相关命名
不推荐:腺囊性基底细胞癌;圆柱瘤样癌。
亚型
经典型AdCC;实性基底样AdCC;AdCC伴高级别转化
部位
AdCC可出现在乳房的任何象限,乳晕后区是最常见的受累部位。
临床特征
AdCC通常累及老年妇女;男性和青少年中有单例病例报道。大多数报道的病例表现为可触及的肿块(主要在老年患者中),但AdCC在年轻患者和参加乳腺筛查计划的人群中可能表现为小结节。AdCC通常是单灶性的,但有多灶性病例的报道。
流行病学
乳腺AdCC相对罕见,占所有乳腺肿瘤的0.1-3.5%。
病因
未知
发病机制
迄今为止,大多数研究的AdCC通过FISH或PCR分析都含有MYB-NFIB融合基因,这与涎腺相似。在实性基底样亚型中也检测到这种融合基因。缺乏MYB-NFIB融合基因的AdCC可能表现出MYBL1重排或MYB扩增。突变状态主要在经典亚型中进行了研究。最常见的突变基因包括MYB、BRAF、FBXW7、SMARCA5、SF3B1和FGFR2。偶有RAS通路基因的激活突变。高级别转化的AdCC在EP300、NOTCH1、HER2和FGFR1中存在突变(除了MYB-NFIB融合基因),并且它们似乎缺乏累及常见类型三阴性乳腺癌的突变(例如TP53突变)。
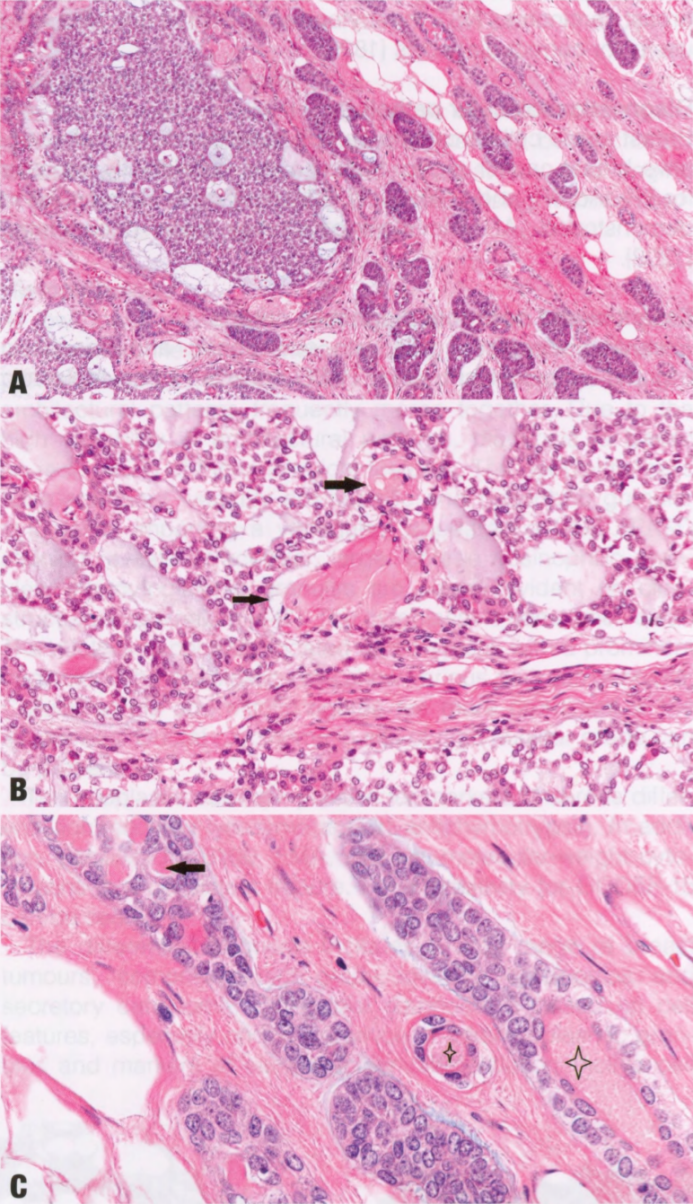
图2.139AdCC。A 一例显示筛状和管状结构。B 筛状亚型:腺体结构含有黏液物质。此外,假腺腔含有基底膜(箭头)。C 管状结构:高倍镜下,显示与具有筛状结构AdCC相同的细胞成分。存在充满黏液的腺腔(星形)和充满基膜的假腺腔(箭头)。
最近热衷于研究涎腺、泪腺和乳腺中AdCC的microRNA表达谱。在涎腺和泪腺中,正常组织和AdCC肿瘤组织的microRNA表达谱不同。相比之下,正常乳腺组织和AdCC肿瘤组织具有相同的microRNA表达谱。此外,乳腺AdCC显示与涎腺和泪腺对应肿瘤存在microRNA谱的差异。这些差异可能有助于我们更好地理解不同起源部位的不同临床行为。
大体表现
AdCC表现为边界清晰的结节,边缘呈推挤状,大小从几毫米至12cm。
组织病理学
乳腺AdCC与涎腺AdCC具有相同的形态谱。根据结构和细胞学特征,定义了三种亚型:经典型AdCC、实性基底样AdCC(SB-AdCC)和AdCC伴高级别转化。
经典型AdCC:低倍镜下,中心为筛状区域,周围以管状结构为主。这两个区域显示出相同的细胞组成,即上皮细胞和肌上皮细胞。两个区域的腺腔都衬覆上皮型细胞并产生黏液,阿尔新蓝(pH 2.5)染色阳性。周围的间质浸润到肌上皮细胞之间的肿瘤巢中,形成不规则空间,称为假腺腔。假管腔充满间质物质,包括间质细胞和基底膜,通常含有小毛细血管和纤维母细胞。罕见病例可出现皮脂腺或鳞状分化。经典型AdCC缺乏明显的核异型性和坏死,核分裂象很少。偶见神经周围侵犯。罕见原位成分。尽管大体检查这些肿瘤通常边界清楚,但肿瘤周围可能具有高度侵袭性,因此难以评估切缘。
免疫组化有助于确认不同的细胞类型。上皮细胞总是表达低分子量CK(CK7和CK8),EMA始终阳性。部分病例中,管腔细胞呈CK5/6阳性。肌上皮细胞表达CK14、CK5/6和p63。其他肌上皮细胞标记物(重链肌球蛋白、calponin、S100和CD10)也可能阳性。AdCC的管腔成分通常呈CD117强阳性,有时区分AdCC与其他乳腺肿瘤;然而,重要的是要记住,局灶性CD117阳性可能存在于许多其他乳腺肿瘤中,包括AME。基底膜抗原(胶原蛋白IV和层粘连蛋白)染色可显示假腺腔。
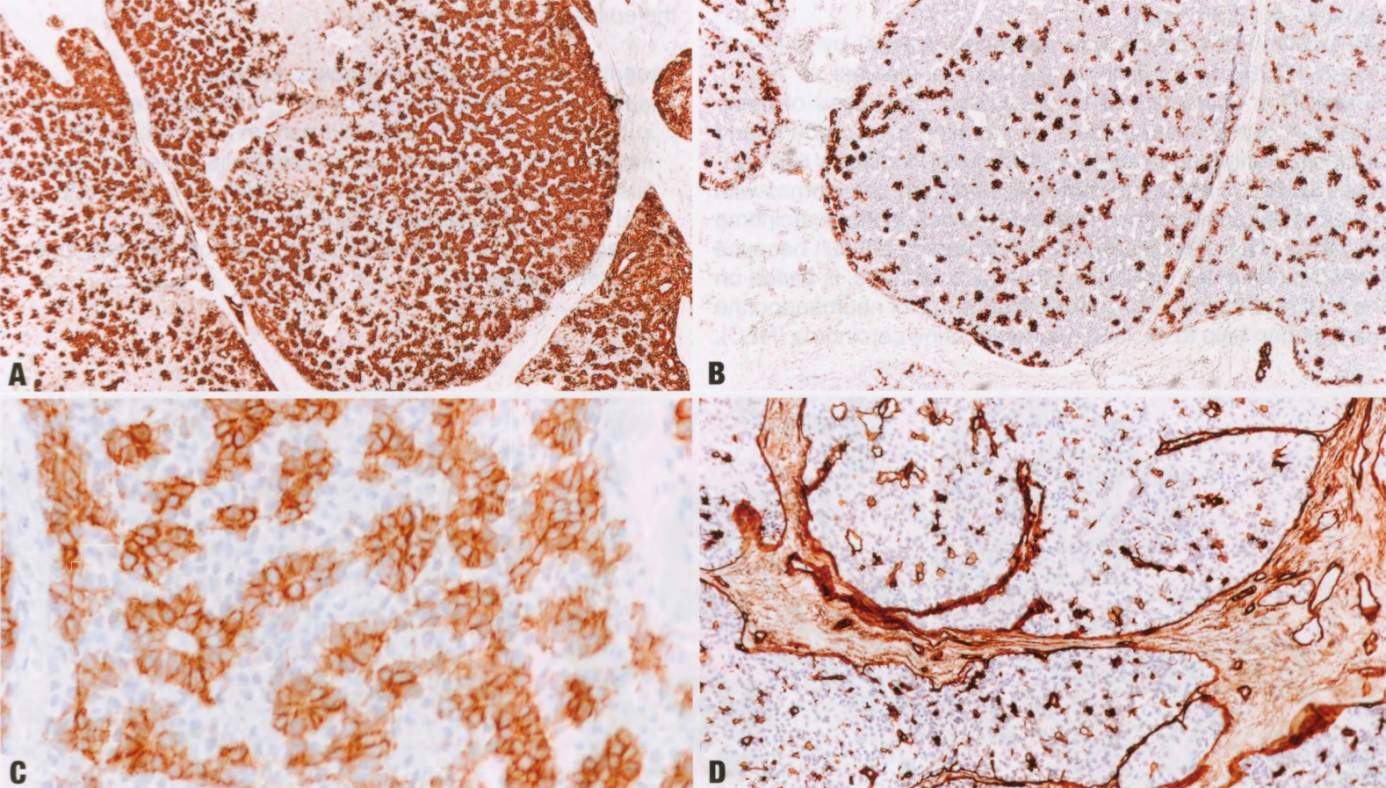 图2.140 AdCC。A CK7显示上皮成分。B CK14显示肌上皮细胞,排列在假腺结构中。C 较高倍,CD117主要表达于上皮细胞。D IV型胶原染色明显肿瘤巢内的假管腔。
图2.140 AdCC。A CK7显示上皮成分。B CK14显示肌上皮细胞,排列在假腺结构中。C 较高倍,CD117主要表达于上皮细胞。D IV型胶原染色明显肿瘤巢内的假管腔。
经典型AdCC的管状成分应鉴别MA和TC。与MA和TC相比,AdCC由不同类型的细胞(上皮细胞和肌上皮细胞)组成。此外,小管含有黏液和基底膜物质。TC显示ER和PR强阳性。同样,AdCC的筛状区域可能需要鉴别浸润性ICC,但根据AdCC由多谱系细胞组成以及ER和PR阴性,而ICC中ER和PR弥漫强阳性,可以排除ICC。AdCC也应鉴别胶原小球病,后者很少形成肿块,其特征是良性导管内增生(如UDH)中基底膜物质填充的空间,CD117和MYB免疫染色通常为阴性或弱阳性。
SB AdCC:由Shin和Rosen在2002年首次描述。除了AdCC的经典特征外,SB AdCC的特征是由基底样细胞组成的实性巢,具有明显的核异型性、高核分裂象计数和坏死。常见神经周围浸润。SB AdCC应鉴别基底样形态的癌和小细胞NEC(SCNEC)。鉴别诊断可能很困难,因为这些病变具有相似的形态特征,而鉴别诊断是基于对典型AdCC区域的发现。神经内分泌标记物的阴性有助于排除NEC。
AdCC伴高级别转化:这种亚型在涎腺中已有详细描述。在乳腺中,AdCC病例伴高级别癌的罕见病例也有报道。这些病例有多种分化区域,包括小细胞癌、IDC和恶性AME。在伴有IDC(即IBC-NST)的AdCC病例中,这两种成分具有相似的分子改变;此外,线粒体DNA分析提示这两种成分之间存在克隆关系,提示AdCC肿瘤细胞可以获得侵袭潜能。
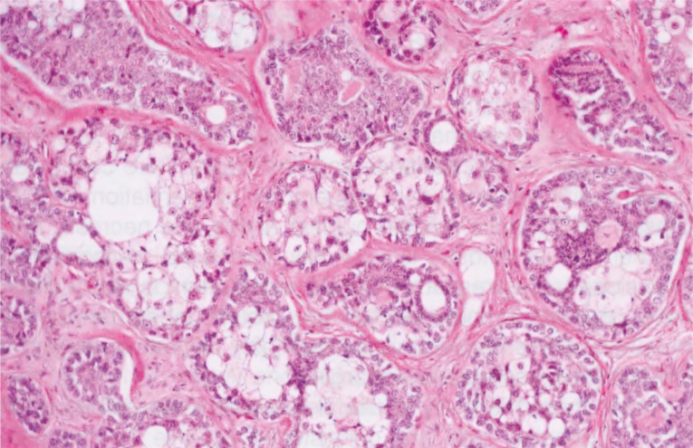
图2.141 AdCC。一例皮脂腺分化。
细胞学
术前FNA诊断可能困难。涂片呈中度至高度细胞丰富;应识别不同的细胞类型(即基底样细胞、肌上皮细胞和上皮细胞)。此外,还存在透明圆柱体,这些圆柱体比来自CSL和胶原球样病变的FNA标本中看到的透明物质更大、更圆。与胶原球样变的鉴别诊断可能很困难。细胞块免疫组化CD117染色可用于避免误诊。
诊断分子病理学
乳腺AdCC通常缺乏ER和PR阳性以及HER2扩增;因此,它被列入低恶性潜能的三阴性肿瘤组。在少数典型的AdCC病例中可以看到局灶性ER和PR阳性。阳性最有可能位于上皮细胞成分中。
诊断标准
必要标准:浸润性癌,肿瘤细胞排列成管状、筛状和实性,由不同类型的细胞(上皮细胞和肌上皮细胞)组成;腺腔充满上皮性黏液,假腔充满间质基质、基底膜和纤维母细胞。
理想标准:免疫组化确认不同细胞类型。
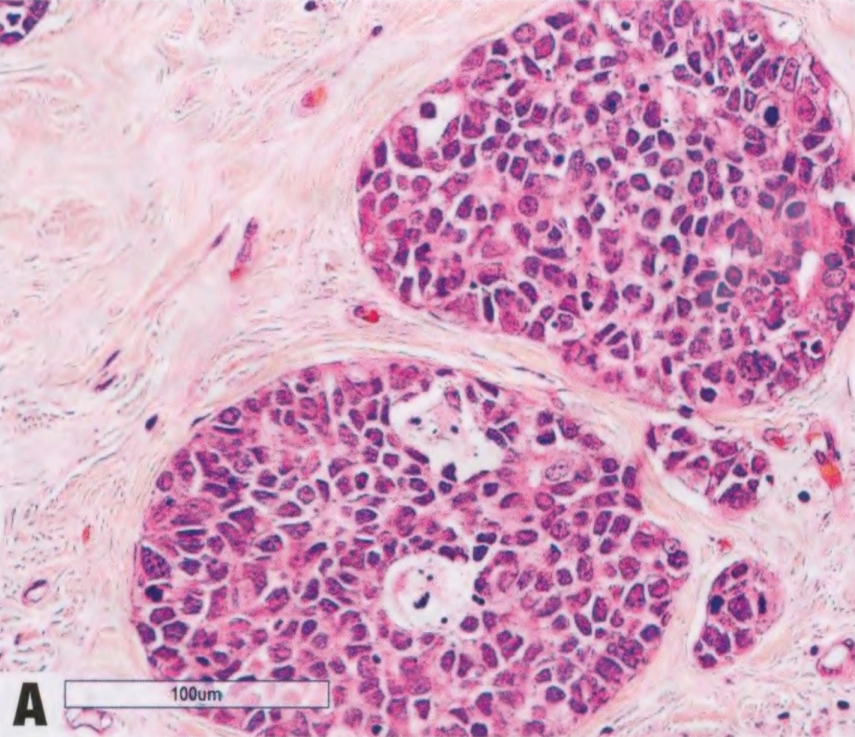
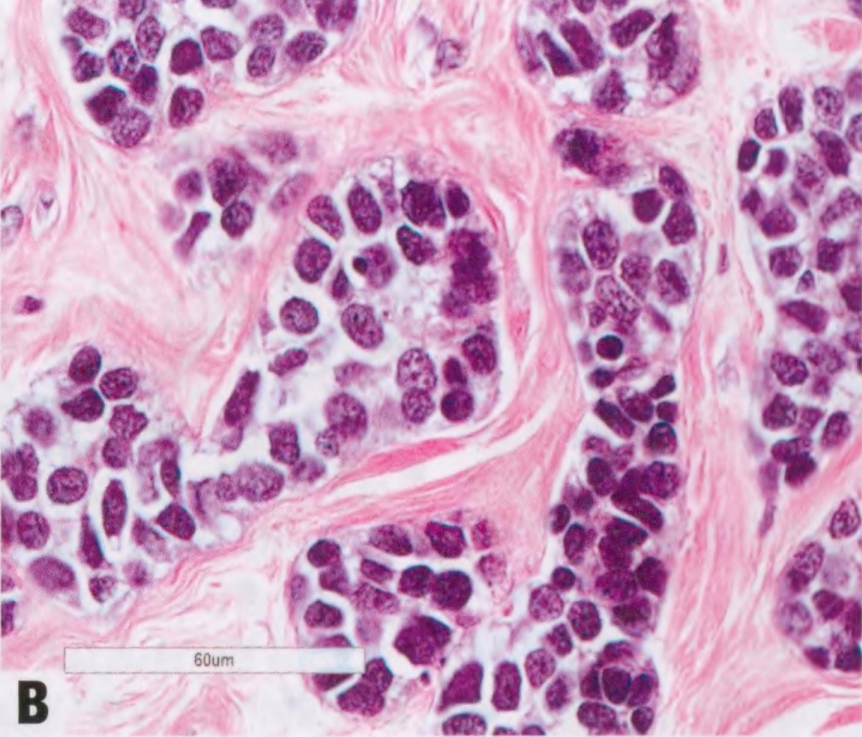
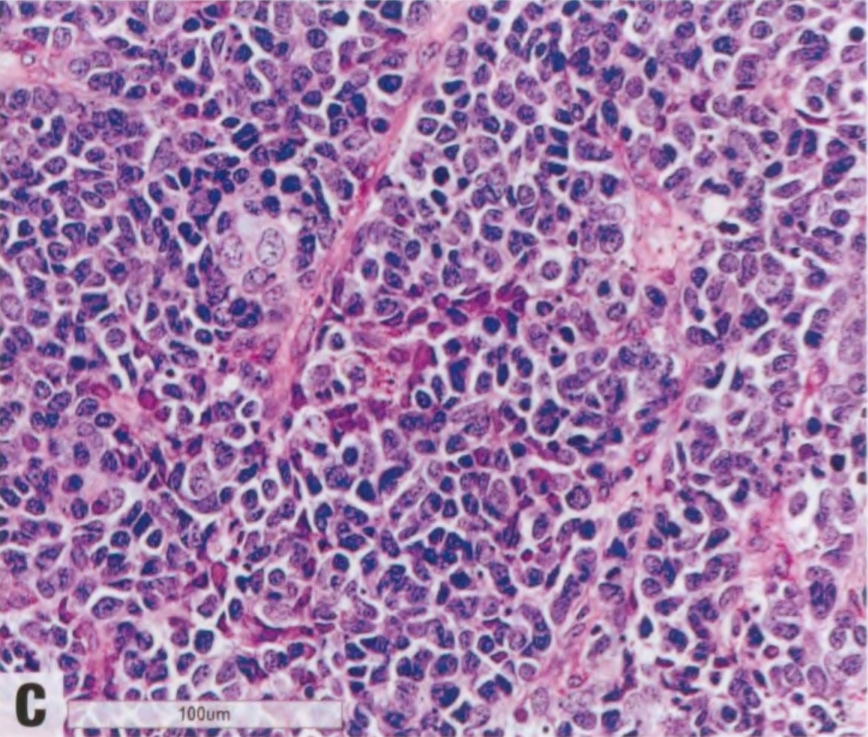 图2.142 AdCC,实性基底样亚型。A 具有AdCC的局灶性特征,但肿瘤细胞呈基底样,核异型性明显。B 更高倍。C 基底样细胞组成的实巢,有明显的核异型性。
图2.142 AdCC,实性基底样亚型。A 具有AdCC的局灶性特征,但肿瘤细胞呈基底样,核异型性明显。B 更高倍。C 基底样细胞组成的实巢,有明显的核异型性。
分期
AdCC根据其他类型IBC采用的标准进行分期。
预后和预测
乳腺AdCC组织学分级对预后的影响一直存在争议,文献中的结果相互矛盾。组织学亚型应被视为预后指标。
经典型AdCC:尽管三阴性表型,但经典亚型通常表现出良好的生物学行为。局部和远处转移罕见,根治性手术切除通常治愈性。罕见病例中,ER和PR局灶性阳性,但治疗意义尚不清楚。经典AdCC占乳腺AdCC的绝大多数,并被纳入大型患者队列。它通常出现在早期,腋窝受累率低。长期随访显示,除一项研究外,所有研究的生存率均高于IBC-NST。因此,大多数经典型AdCC可以仅通过根治性手术治愈。
SB AdCC:常见腋窝淋巴结转移和神经侵犯。在有长期随访信息的病例中,患者出现了局部复发和肺、骨和皮肤的远处转移。尽管存在肺转移,但具有基底样亚型的患者可能存活较长时间。SB AdCC治疗的数据罕见。在最后一次随访中,接受辅助化疗的复发病例患者存活且无肿瘤。
AdCC伴高级别转化:这些是非常罕见的病例,其中大多数会导致患者死亡。由于报道的病例数量较少,在高级别成分中观察到的特征种类繁多,因此无法得出最佳治疗策略的结论。
Secretory carcinoma
2.9.3 分泌性癌(SeCa)
定义
SeCa是一种浸润性癌,肿瘤性上皮细胞具有胞质内分泌空泡和细胞外嗜酸性泡沫状分泌物,排列成多种结构,常有ETV6-NTRK3融合。
ICD-11编码
8502/3 SeCa
ICD-11编码
2C60&XH44J4乳腺癌、特殊型乳腺癌&乳腺SeCa
相关命名
不推荐:幼年性乳腺癌。
亚型
没有
部位
女性大多数SeCa发生在乳头附近或外上象限,但乳腺的任何区域都可能受累,包括异位乳腺组织。男性和儿童大多数SeCa发生在乳晕下区域。
临床特征
SeCa通常表现为生长缓慢、质硬、无痛、可移动的肿块,有时伴有乳头溢液。放射学特征表现为边界清楚的分叶状肿块,可能与FA等良性病变相似。
流行病学
SeCa在所有IBC中占比<0.05%,主要发生在女性。尽管最初描述为儿童患者,但SeCa大多发生在成人,平均患者年龄为53岁;大多数病例出现在40到70岁之间(范围:3-87岁)。
病因
未知
发病机制
SeCa的特征是t(12;15)(p13;q25)易位,导致ETV6-NTRK3融合基因。融合基因存在于原位和浸润性成分中,提示这是肿瘤发生的早期事件。在乳腺癌中,ETV6-NTRK3是SeCa特有的。ETV6-NTRK3最初在先天性纤维肉瘤和细胞中胚层肾瘤中发现,编码一种组成型激活的嵌合酪氨酸激酶,通过RAS-MAPK和PI3K途径发出信号,驱动细胞转化和肿瘤发生。ETV6-NTRK3也在其他部位(如涎腺、甲状腺和皮肤)发生的类似乳腺SeCa中被发现。乳腺SeCa与其他部位类似肿瘤的共同形态、免疫表型和遗传学特征提示,无论这些病变位于何处,都有共同的病因。值得注意的是,ETV6-NTRK3在其他肿瘤类型中的表达也有记录,包括甲状腺乳头状癌、白血病、神经胶质瘤和其他癌症。因此,这种融合在跨多个细胞谱系的肿瘤中表达是独一无二的。除了这种改变,这些肿瘤在基因组上相对静止,突变负荷很低,只有偶尔的染色体增减。
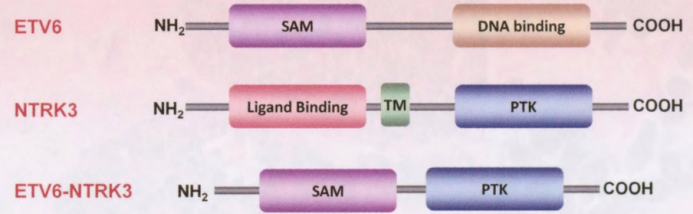
图2.143 SeCa的ETV6-NTRK3嵌合酪氨酸激酶。这种融合将ETV6 DNA结合结构域的无义α基序二聚化结构域(SAM)与跨膜(TM)NTRK3酪氨酸激酶的蛋白酪氨酸激酶结构域(PTK)结合,产生配体非依赖性组成型活性嵌合酪氨酸激酶。
大体表现
SeCa通常是孤立、质硬、边界清晰的肿块,切面呈灰白色或黄褐色。多灶性肿瘤已有描述。平均肿瘤大小约为2cm,范围为0.5-16cm。
组织病理学
SeCa由多边形肿瘤细胞组成,嗜酸性颗粒性或空泡状胞质,圆形至卵圆形核,排列成微囊/蜂窝状、实性、管状或乳头状生长模式。微囊区域可能貌似甲状腺滤泡,并可能合并形成小的实性片段。大多数肿瘤显示混合模式。胞质内和细胞外嗜酸性或嗜两性分泌物持续存在,PAS、黏液卡红和AB染色呈阳性。核多形性几乎总是轻或中度,核分裂象活性低。因此,根据改良的诺丁汉分级,绝大多数SeCa为1级或2级,高级别肿瘤极为罕见。肿瘤间质通常硬化。可能存在原位成分;它通常是筛状或实性,核级别低或中等,可用肌上皮染色进行识别。
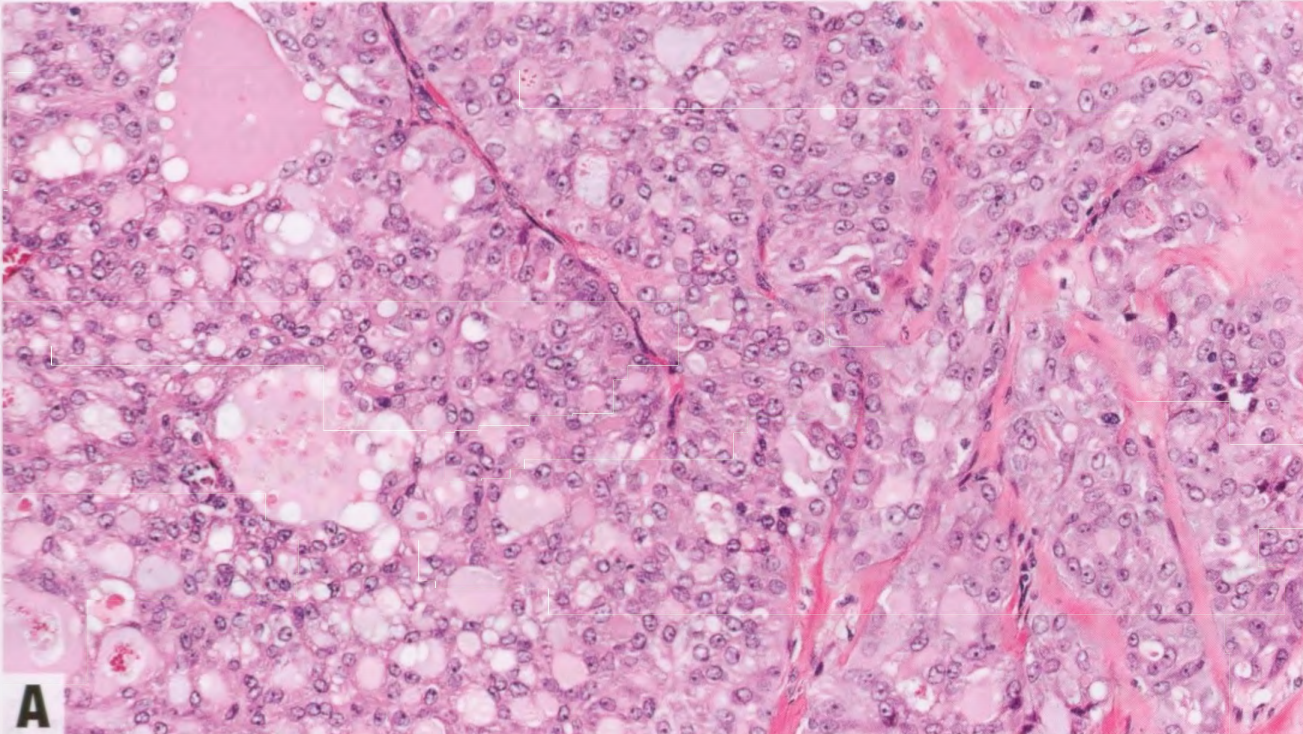 图2.144 SeCa。A、B 微囊生长模式,可能貌似甲状腺滤泡。C 管状生长模式。D 乳头状生长模式。
图2.144 SeCa。A、B 微囊生长模式,可能貌似甲状腺滤泡。C 管状生长模式。D 乳头状生长模式。
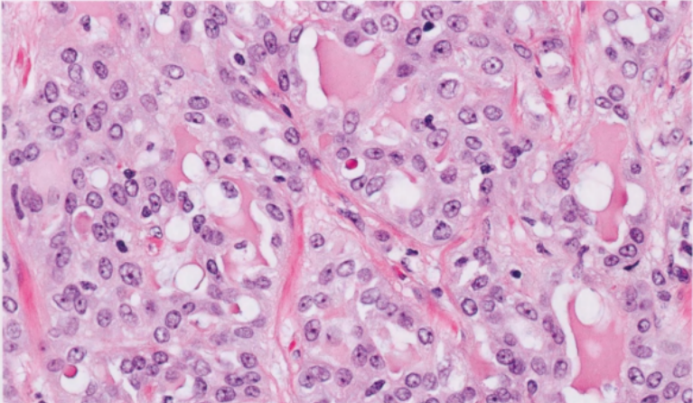
图2.145 SeCa。肿瘤细胞具有丰富的颗粒性嗜酸性或空泡状胞质和轻至中度核异型性。存在细胞外分泌物。
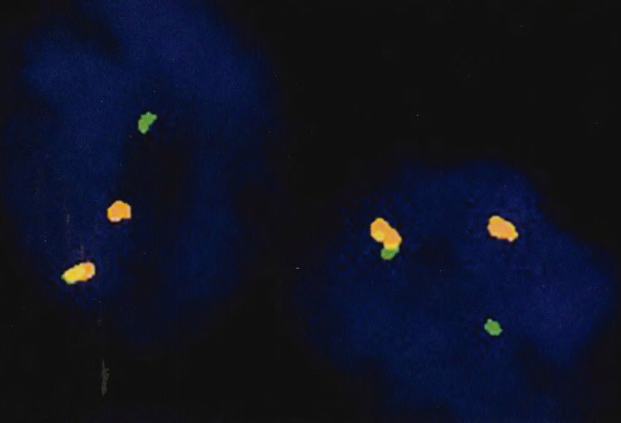
图2.146 SeCa。ETV6重排可以通过使用ETV6断裂探针的FISH来确认。橙色:5'ETV6探针(端粒);绿色:3'ETV6探针(着丝粒);黄色:融合探针(正常)。
免疫组化,肿瘤细胞通常表达CEA(多克隆)、S100、mammaglobin、SOX10和MUC4,通常呈弥漫强阳性。大多数肿瘤表达基底样标记物CK5/6和/或EGFR(HER1),可能呈局灶性表达。GATA3、CK8/18、CD117和vimentin也可能呈阳性。大多数病例的ER、PR和HER2呈三阴性,但ER/PR弱表达并不罕见。Ki-67增殖指数可变,通常<20%。
鉴别诊断可能包括CaAD(通常为AR阳性)、ACCa、囊性高分泌性原位癌和TCCRP,尤其是有限的活检材料。必要时检测ETV6-NTRK3融合,可用于支持SeCa的诊断。
细胞学
FNA标本通常细胞丰富,由粘附性片状或均匀的肿瘤细胞团组成,具有颗粒性或空泡状胞质,核圆形,具有均匀的染色质,罕见核分裂象。含有蛋白性物质的胞质内大空泡有特征性,在背景中可以看到类似的物质。可能存在印戒样细胞。
诊断分子病理学
SeCa特征是ETV6-NTRK3基因融合。最近开发了靶向NTRK3和其他NTRK家族成员的小分子抑制剂(larotrectinib和entrectinib),对TRK融合癌患者(包括分泌性乳腺癌)有良好疗效。因此强调对ETV6-NTRK3的快速和可靠的分子确认,包括福尔马林固定、石蜡包埋组织,以及使用ETV6分解探针或5'ETV6和3'NTRK3会聚探针的FISH。一项研究使用泛TRK单克隆抗体进行免疫组化识别了21例中的20例NTRK(NTRK1、NTRK2或NTRK3)融合,但在第二项研究中检测涉及NTRK3的融合效果较差,这提示需要更可靠的NTRK抗体才能将免疫组化作为分泌性乳腺癌中NTRK3抑制剂的生物标记物。二代测序方法,包括基于杂交的多特异性融合捕获、基于RNA的缺乏内含子的特异性表达转录物的组合测序,以及将RNA测序与全基因组或全外显子组测序相结合的方法,可能与免疫组化相结合,用于ETV6-NTRK3的常规检测,以进行诊断和治疗分配。
诊断标准
必要标准:上文所述的形态学和免疫表型特征,特别是胞质内和细胞外分泌物以及三阴性或弱ER/PR阳性。
理想标准:FISH显示ETV6重排或二代测序鉴定ETV6-NTRK3。
分期
SeCa根据乳腺浸润性癌的指南进行分期。大多数SeCa表现为pT1或pT2肿瘤。腋窝转移的报道约为20-35%,通常累及不超过三个淋巴结。远处转移非常罕见。
预后和预测
SeCa常有惰性临床病程,特别是儿童和年轻人,即使有腋窝淋巴结转移的患者也是如此。老年人的一些肿瘤可能侵袭性更强,并伴有晚期复发。只有罕见的死亡报道。在一项基于人群的研究中,5年和10年的病因特异性生存率分别为94%和91%。
Mucoepidermoid carcinoma
2.9.4 黏液表皮样癌(MEC)
定义
MEC是一种浸润性癌,由肿瘤性黏液细胞、中间(过渡)细胞和鳞状细胞混合而成,排列成囊实性模式。
ICD-11编码
8430/3 MEC
ICD-11编码
2C60&XH1J36特殊型乳腺癌&MEC
相关命名
没有
临床特征
乳腺MEC通常发生在29-80岁的成年女性。一例为淋巴瘤患者的第二肿瘤。
流行病学
MEC在涎腺中常见,但及乳腺罕见,迄今报道<40例。
病因
未知
发病机制
未知
亚型
没有
部位
MEC可以累及任何乳房象限;当出现在乳晕后区域时,会导致乳头溢液。
大体表现
MEC可表现为实性结节或囊性病变。报道的大小范围为0.6-11cm。
组织病理学
与涎腺相似,乳腺MEC具有广泛的组织学特征,从低级别到高级别病变。适用于涎腺或乳房分级系统结果相似。低级别MEC更常显示囊性成分。囊腔衬覆黏液细胞并混杂嗜酸性细胞。实性区域显示肿瘤细胞巢,周围有一层基底样细胞,逐渐融合成表皮样细胞和黏液细胞。高级别MEC更常见实性,细胞组成与低级MEC相同。高级别MEC存在细胞异型性,核分裂象多,并可能出现坏死。中间级别乳腺MEC偶见报道。可能存在导管内成分。形成角化珠的真正角化不是低或高级别MEC的特征。
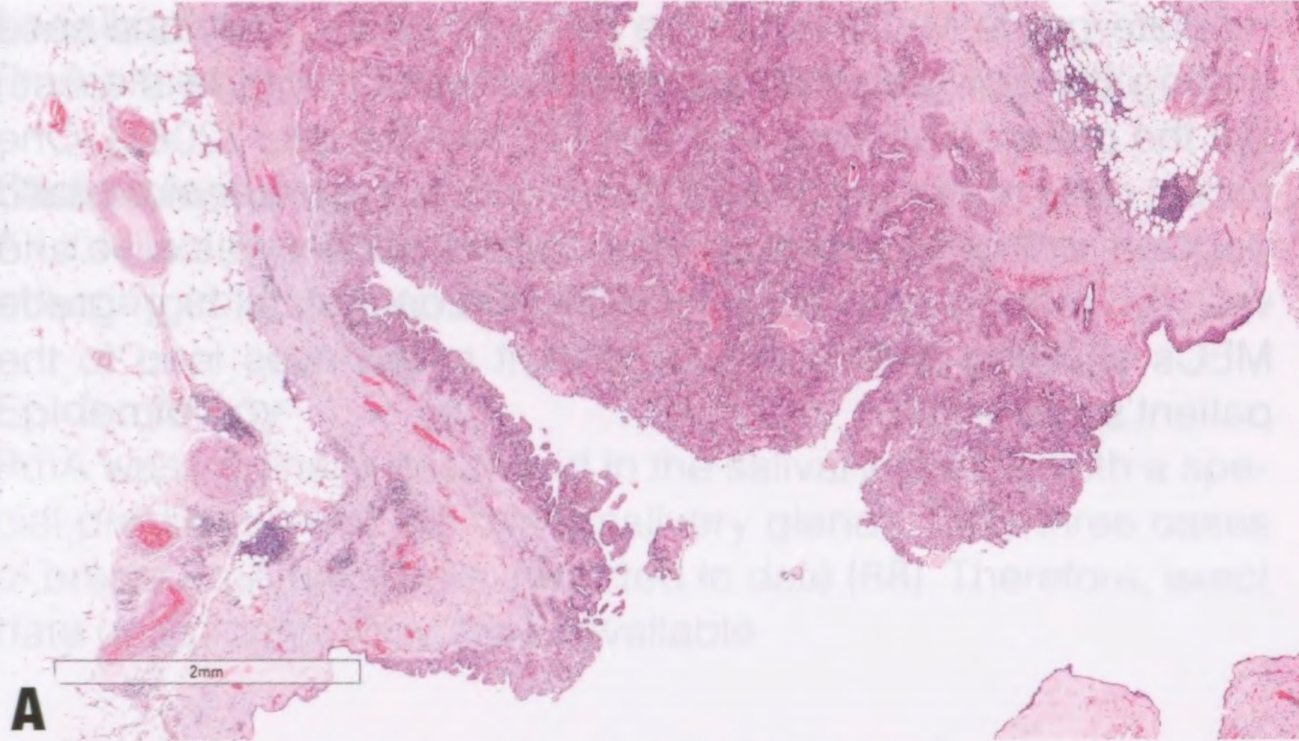
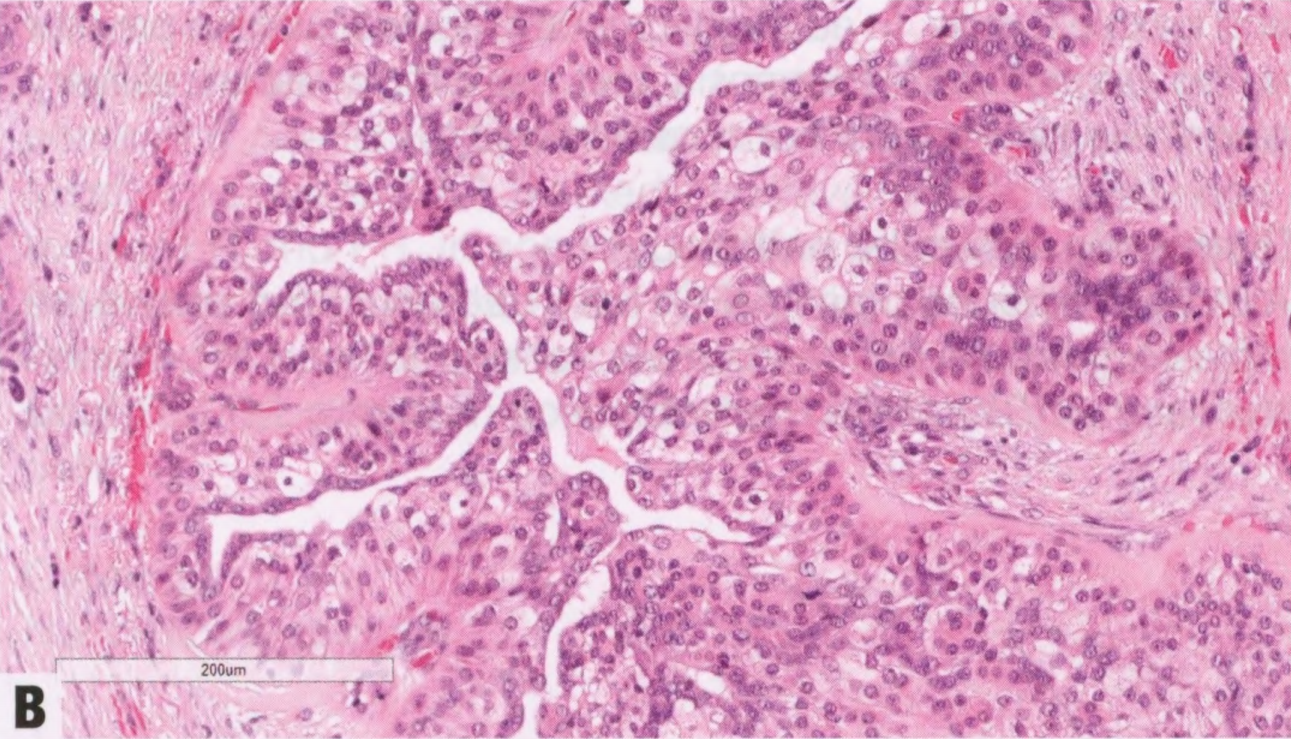
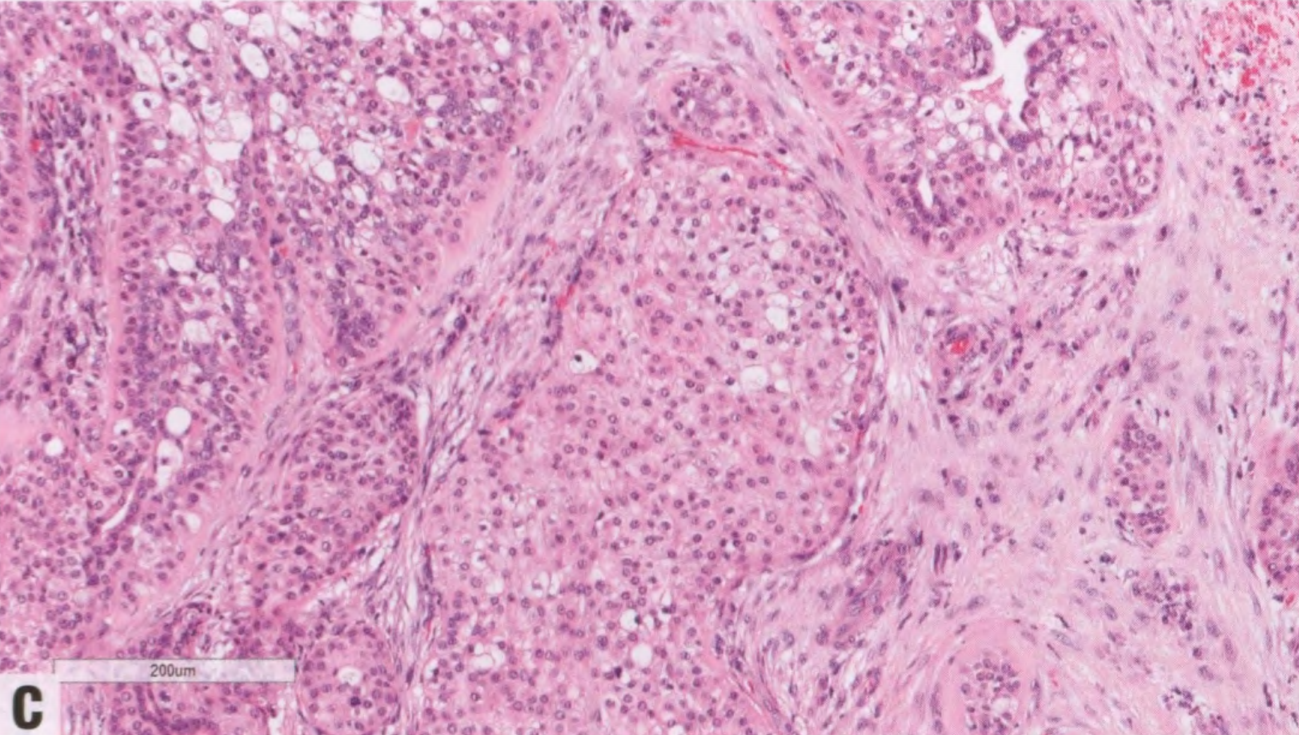
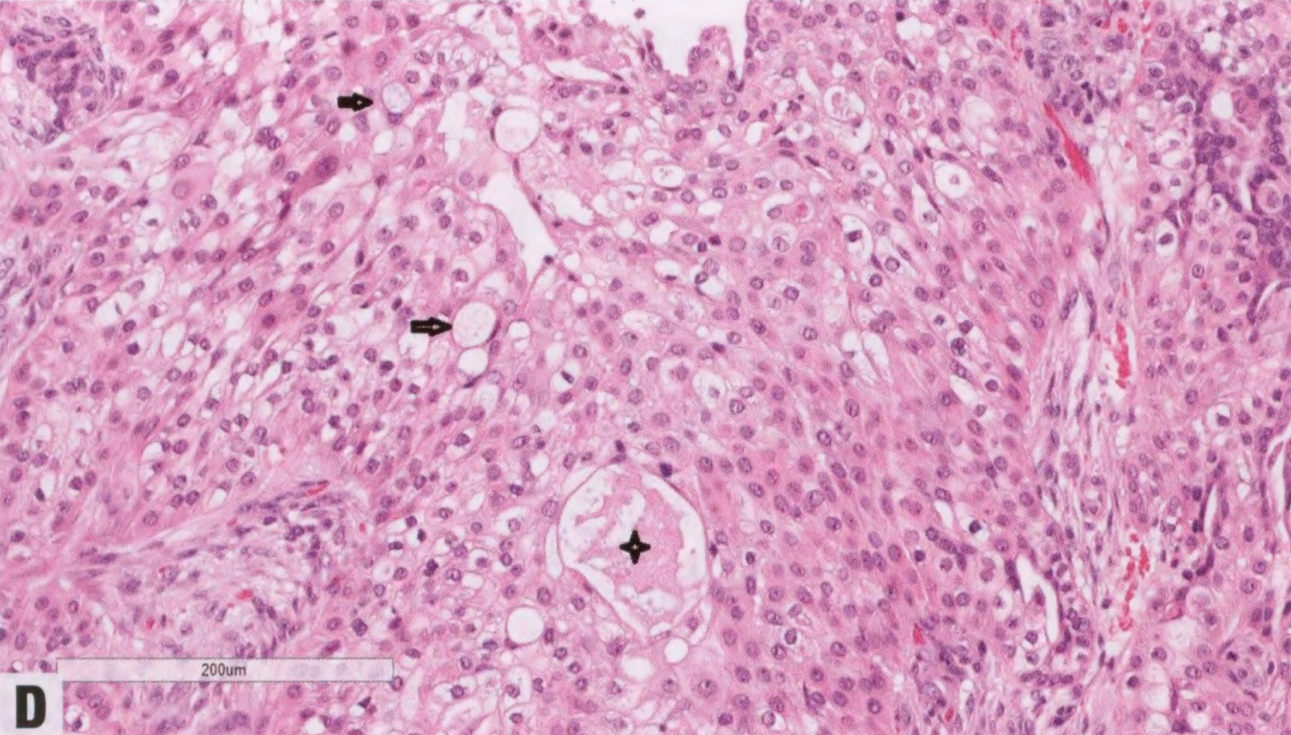 图2.147MEC。A 低级别MEC,息肉样和实性生长。B 较高倍,可见不同的细胞类型。注意没有真正角化。C、D MEC由表皮样嗜酸性细胞(没有真正角化)和黏液细胞(箭头)组成;星形表示充满黏液的腺体结构。
图2.147MEC。A 低级别MEC,息肉样和实性生长。B 较高倍,可见不同的细胞类型。注意没有真正角化。C、D MEC由表皮样嗜酸性细胞(没有真正角化)和黏液细胞(箭头)组成;星形表示充满黏液的腺体结构。
免疫组化有助于识别不同的细胞类型。高分子量CK(如CK14)和p63染基底样细胞和表皮细胞,而低分子量CK(如CK7)染黏液细胞。形成特殊的阳性分区模式,类似于涎腺MEC中观察到的模式。乳腺MEC保留了其他乳腺肿瘤中观察到的GATA3和mammaglobin阳性。
细胞学
细胞学特征罕见报道,似乎类似于涎腺相应病变;FNA标本显示大量嗜酸性胞质与黏液和基底样细胞混合的细胞。此外,背景中可能存在黏液物质。如果不考虑涎腺样肿瘤,诊断可能很困难。
诊断分子病理学
几乎所有报道的乳腺MEC都被纳入三阴性乳腺癌,缺乏ER和PR表达以及HER2扩增。最近,在中低级别乳腺MEC的肿瘤细胞亚群中描述了ER、PR和AR阳性。关于乳腺MEC分子特征的报道很少。t(11;19)(q21;p13)易位导致CRTC1(MECT1)和MAML2融合,视为低级别涎腺MEC的典型表现,已在两例乳腺MEC中进行了研究,这两例分别存在11q21(MAML2)和CRTC1-MAML2融合的部分缺失。
诊断标准
必要标准:存在基底样、表皮样和黏液细胞;缺乏真正的角化。
分期
MEC根据其他类型乳腺癌采用的标准进行分期。
预后和预测
分级是乳腺MEC最重要的组织病理学预后因素。分级可以使用通常适用于乳腺癌的标准以及涎腺MEC的标准;这两种分级系统都基于结构、细胞异型性和核分裂象计数。与涎腺相似,乳腺的高级别MEC显示实性结构、核多形性和高核分裂象计数,常有坏死和淋巴管血管浸润。有26例随访数据的综述,低或中级MEC均未导致患者死亡。在低级别MEC中,只有一例复发为高级别疾病,但患者在156个月后仍然健在。据报道,最近一例低级别MEC病例显示,18个腋窝淋巴结中有3个有转移性灶,但患者在手术后156个月仍然存活。相比之下,所有显示腋窝和/或远处转移的高级MEC都会导致患者死亡。
Polymorphous adenocarcinoma
2.9.5 多形态腺癌(PmA)
定义
PmA是一种浸润性恶性上皮肿瘤,其组织学特征与涎腺的PmA相似,由表现出结构多样性的单调肿瘤细胞增殖组成,排列成各种模式,包括被绳索和单行线包围的大巢(单细胞浸润)。
注:Polymorphous 传统译为多形性,实际意思是结构多样性,没有细胞多形性。个人认为,翻译成多种形态的、多形态或多态性皆可,但不宜译为多形性。除乳腺、涎腺外,淋巴造血病变也有多形态炎症细胞浸润的说法。
比较:Pleomorphic carcinoma 多形性癌(特指肿瘤细胞的多形性)
ICD-11编码
8525/3 PmA
ICD-11编码
2C60&XH5SD5特殊型乳腺癌&多形性低级别腺癌
相关命名
不推荐:多形态低级别腺癌。
亚型
未知
部位
PmA出现在乳腺实质中,没有部位偏好。
临床特征
所有三例报道的病例均表现为可触及的结节,累及37-74岁的成年女性。
流行病学
PmA最初在涎腺中描述,对小涎腺有特殊的偏好。迄今为止,仅报道了三例乳腺PmA病例。因此,我们无法获得流行病学的确切数据。
病因
未知
发病机制
未知
大体表现
大小在1.5-4cm的实质结节。
组织病理学
低倍,PmA常有分区,中央区为大的、实性区域,周围区是细条状和筛状的肿瘤细胞巢。肿瘤细胞均匀,小而圆,核仁居中,核仁不明显,有一圈薄薄的淡染嗜酸性胞质。可见非典型核分裂象,未见凝固性坏死。
免疫组化,肿瘤细胞表达BCL2。CK7局灶阳性,E-cadherin细胞膜周围呈部分弱阳性。ER、PR和HER2呈阴性,没有HER2扩增。PmA应区分ILC和AdCC。与ILC相比,PmA对CK7呈局灶弱阳性,对BCL2呈强阳性,对ER和PR呈阴性。PmA通常不具有AdCC中检测到的典型双相细胞模式。PmA由单一细胞类型组成,没有肌上皮细胞和基底细胞。
细胞学
与临床无关
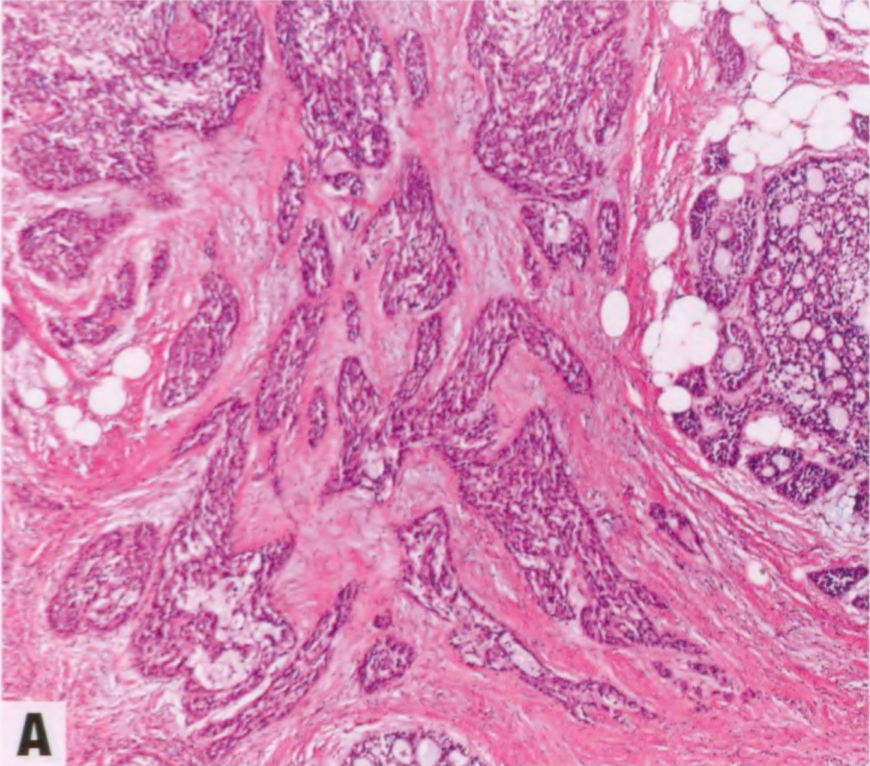
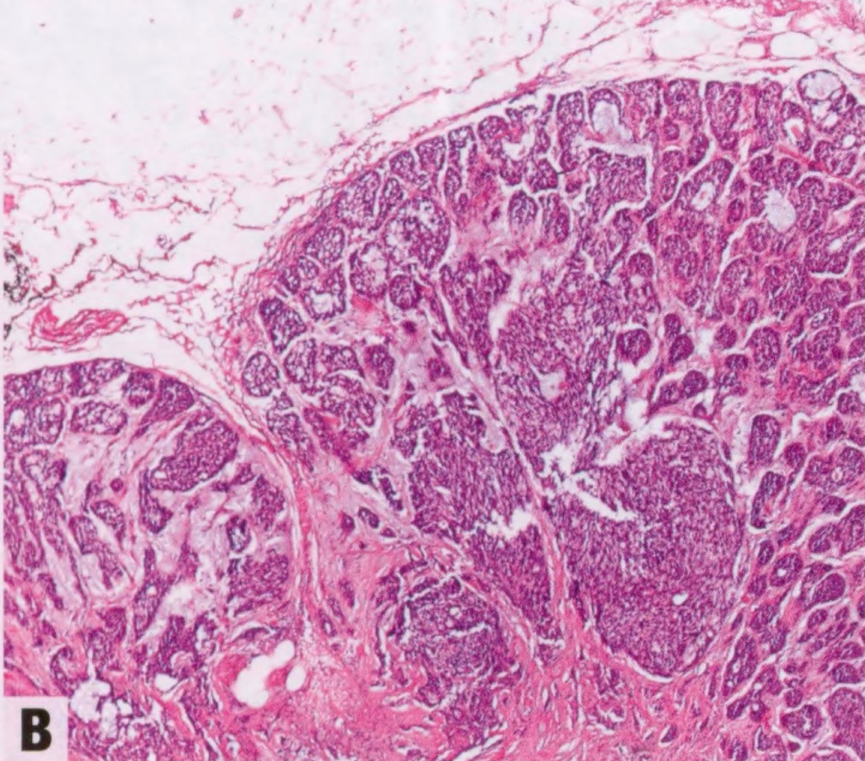
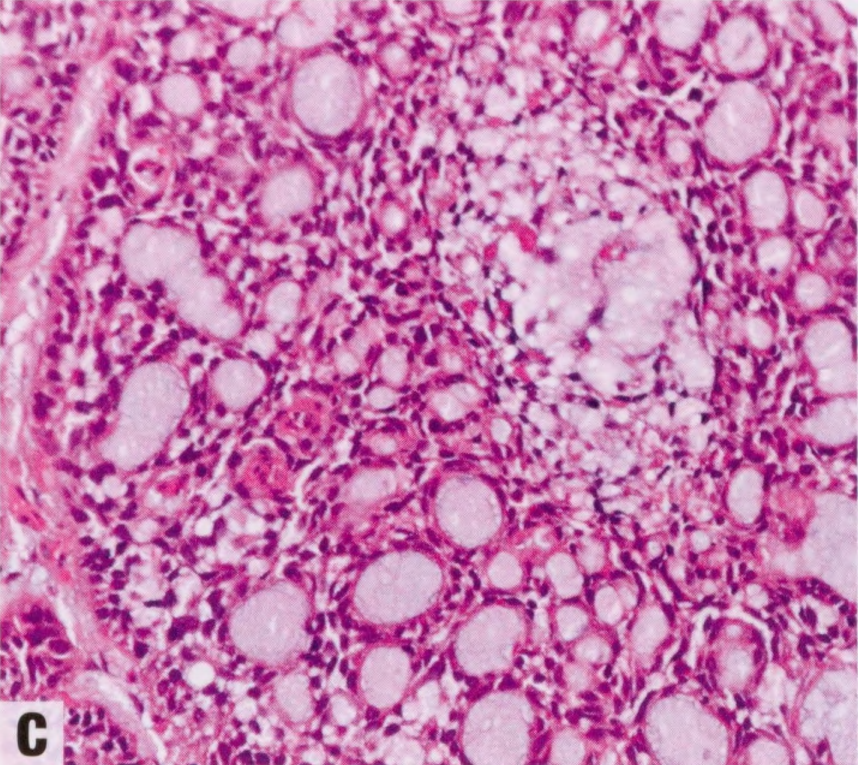 图2.148 PmA。A 低倍,PmA由实细胞巢组成。B 肿瘤中央更多实性区域。C 该区域类似AdCC;然而,PmA只有一种细胞类型。
图2.148 PmA。A 低倍,PmA由实细胞巢组成。B 肿瘤中央更多实性区域。C 该区域类似AdCC;然而,PmA只有一种细胞类型。
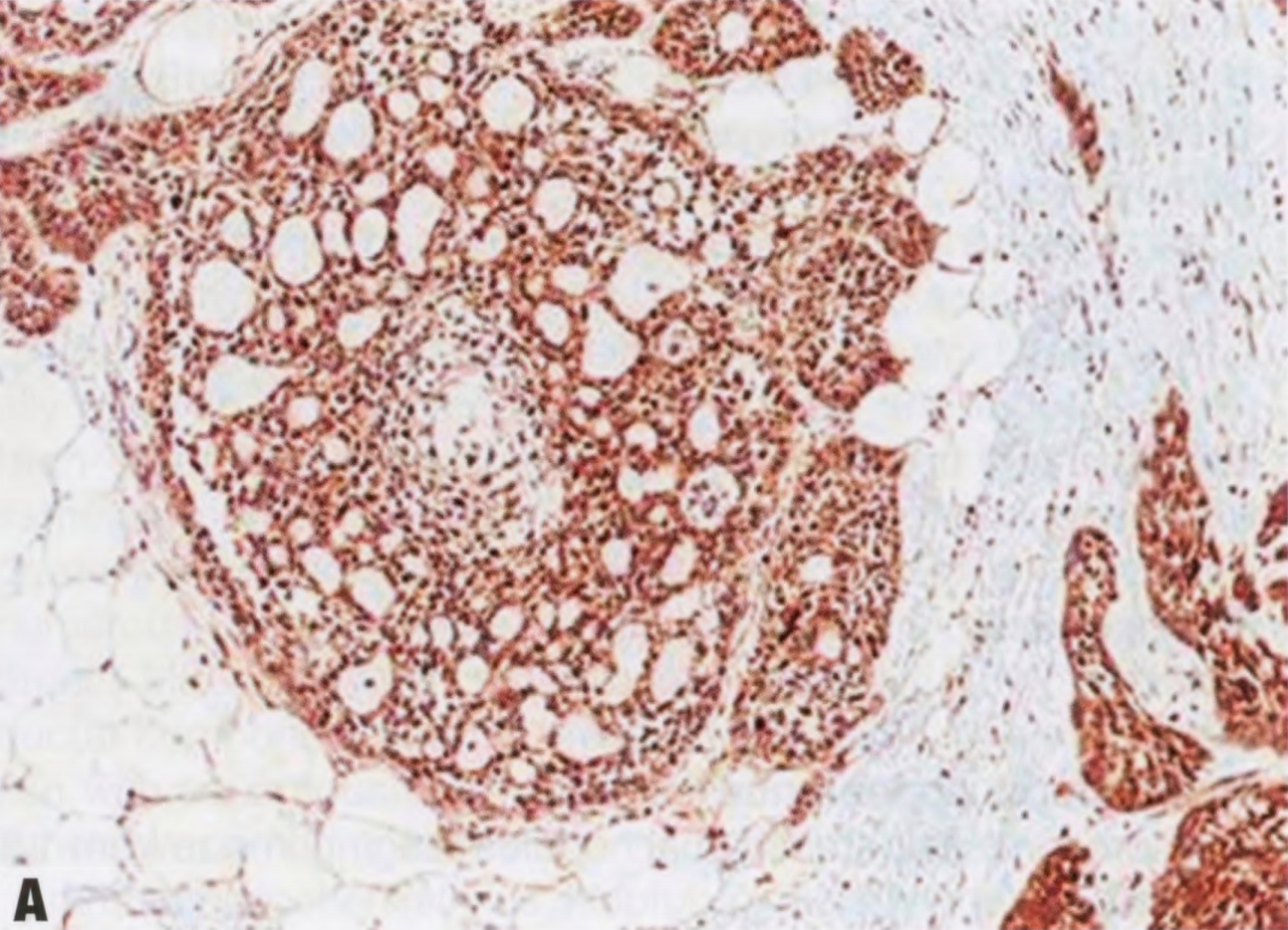
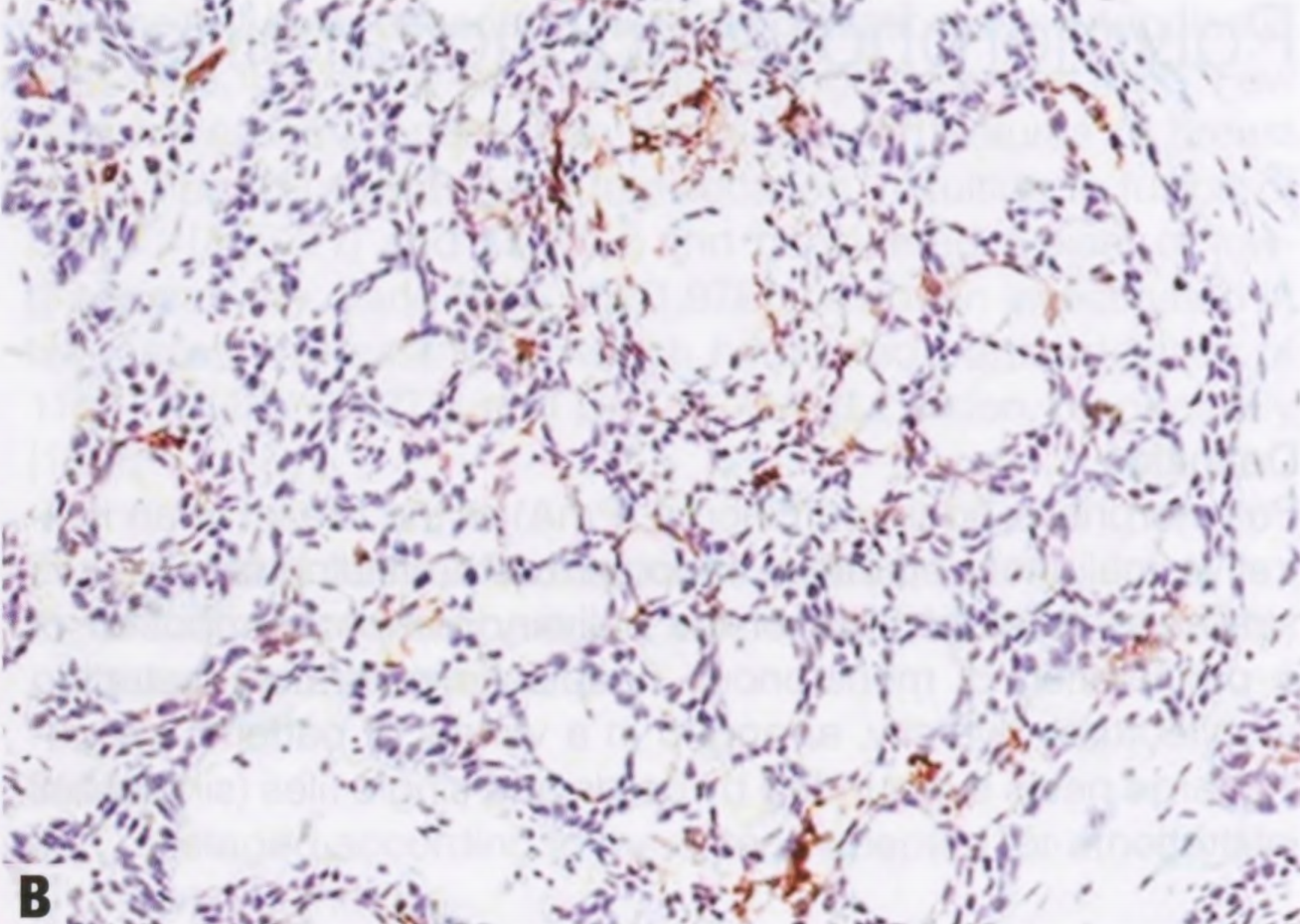 图2.149 PmA。A BCL2呈弥漫性阳性。B CK7仅局灶弱阳性。
图2.149 PmA。A BCL2呈弥漫性阳性。B CK7仅局灶弱阳性。
诊断分子病理学
PmA对ER、PR和HER2呈阴性,没有HER2扩增。
诊断标准
必要标准:典型的结构模式,中央的大面积实性区域,周围的均匀一致的肿瘤细胞条。
理想标准:CK7和E-cadherin局灶弱阳性;ER、PR和HER2阴性。
分期
根据其他类型IBC采用的标准对PmA进行分期。
预后和预测
迄今为止报道的数据不足以支持关于这种肿瘤的明确结论,3例病例中有1例存在广泛转移,诊断后3年死亡。因此,正如涎腺中出现的类似肿瘤所报道的那样,“低级别”一词不应用于这种乳腺肿瘤。
Tall cell carcinoma with reversed polarity
2.9.6 高细胞癌伴极性反转(TCCRP)
定义
TCCRP是一种罕见的IBC亚型,其特征是具有核极性反转的高柱状细胞,排列成实性和实性乳头状模式,最常见伴有IDH2 p.Arg172热点突变。
ICD-11编码
8509/3 TCCRP
ICD-11编码
2C6Y乳腺其他特定恶性肿瘤
相关命名
不推荐:SPC伴极性反转;类似甲状腺乳头状癌高细胞变异型的乳腺肿瘤;类似甲状腺乳头状癌高细胞变异型的SPC。
亚型
没有
部位
对乳房部位没有特别的偏好。
临床特征
肿瘤表现为乳房X线发现的或可触及的肿块。超声检查显示低回声肿块,伴或不伴后部阴影。3名患者报道了腋窝淋巴结转移。
流行病学
目前没有具体的流行病学数据。所有报道的患者都是女性,平均年龄为64岁(范围:39-89岁)。
病因
未知
发病机制
TCCRP特征是IDH2 p.Arg172热点突变,据报道约84%(38例中的32例)有这种突变。累及IDH2的热点突见于胶质瘤、急性髓系白血病、软骨肉瘤和胆管癌,但在TCCRP以外的乳腺癌中罕见。在这些肿瘤中,约68%(38个中的26个)发现PIK3CA错义突变,但累及PI3K通路相关基因的突变在乳腺癌中常见。在伴或不伴IDH2突变的病例中,PIK3CA突变的频率没有差异。BRAF突变和RET/PTC重排是甲状腺乳头状癌的分子特征,在TCCRP病例中均为阴性。
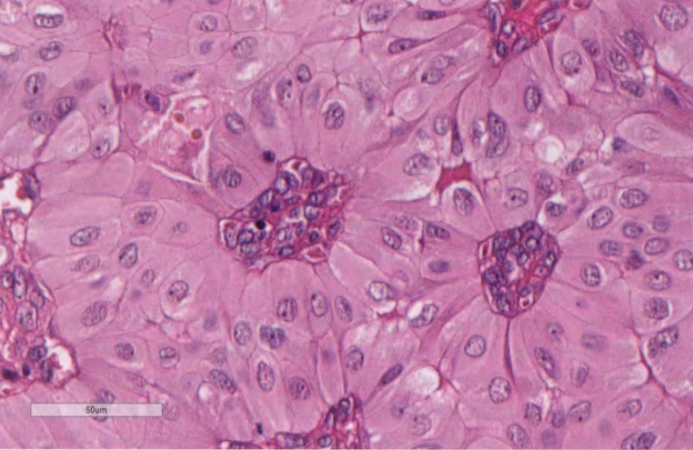
图2.150TCCRP。高倍显示典型高细胞伴特征核。
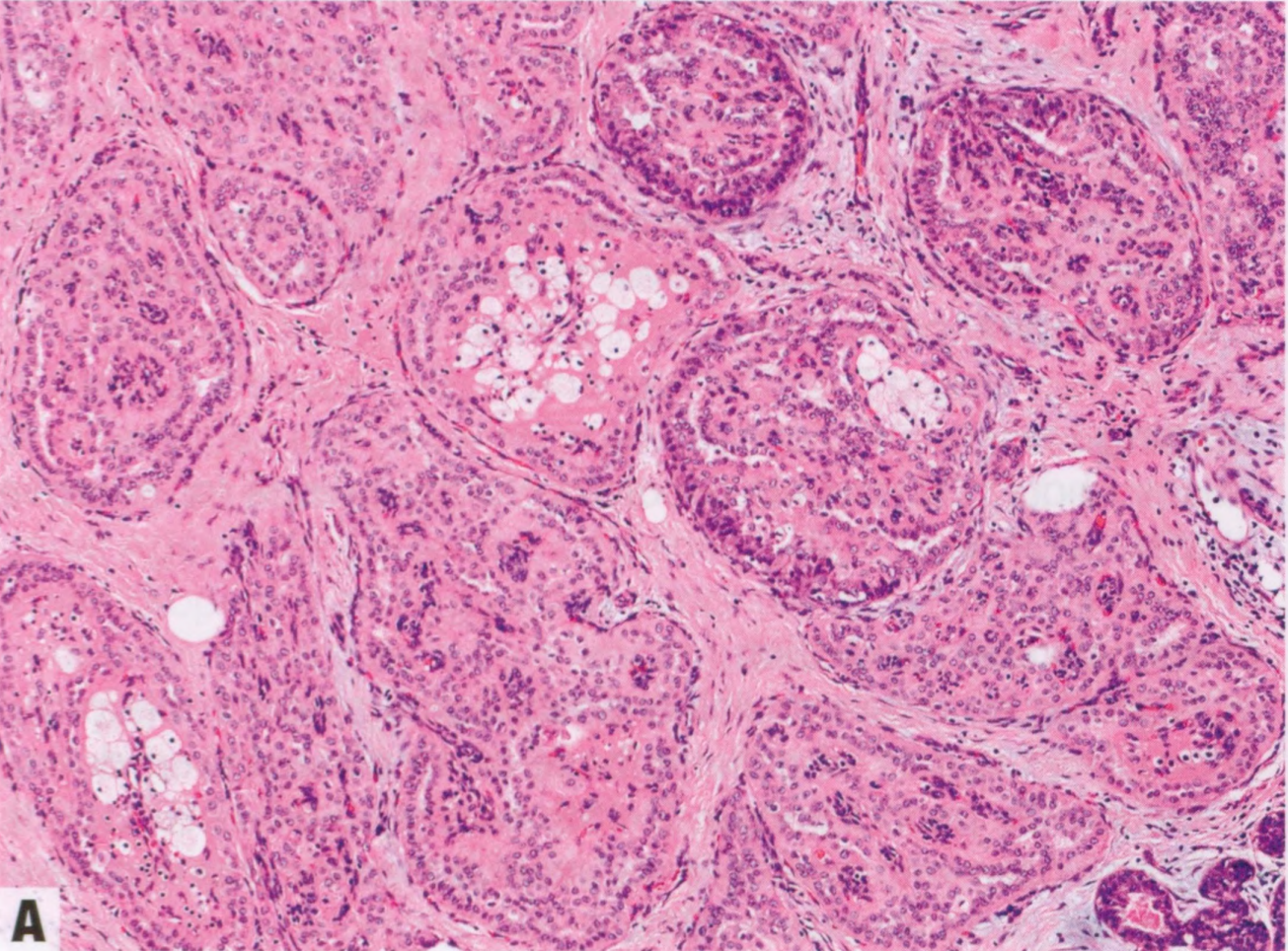 图2.151 TCCRP。A 具有中央纤维血管轴心和泡沫状组织细胞的实性巢。B核极性反转,核位于细胞的顶端。
图2.151 TCCRP。A 具有中央纤维血管轴心和泡沫状组织细胞的实性巢。B核极性反转,核位于细胞的顶端。
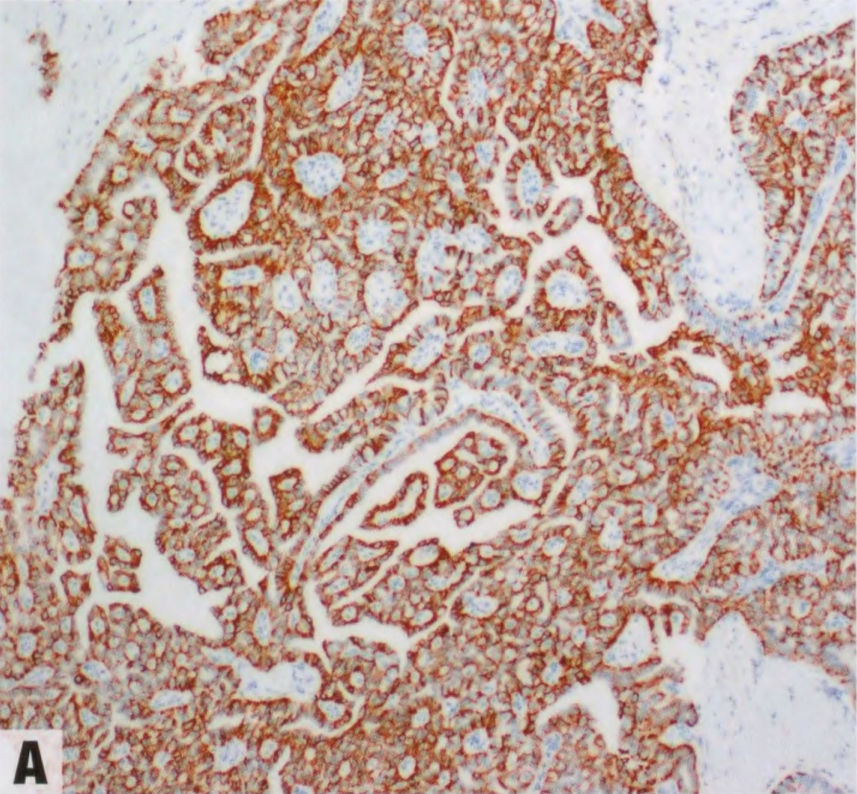
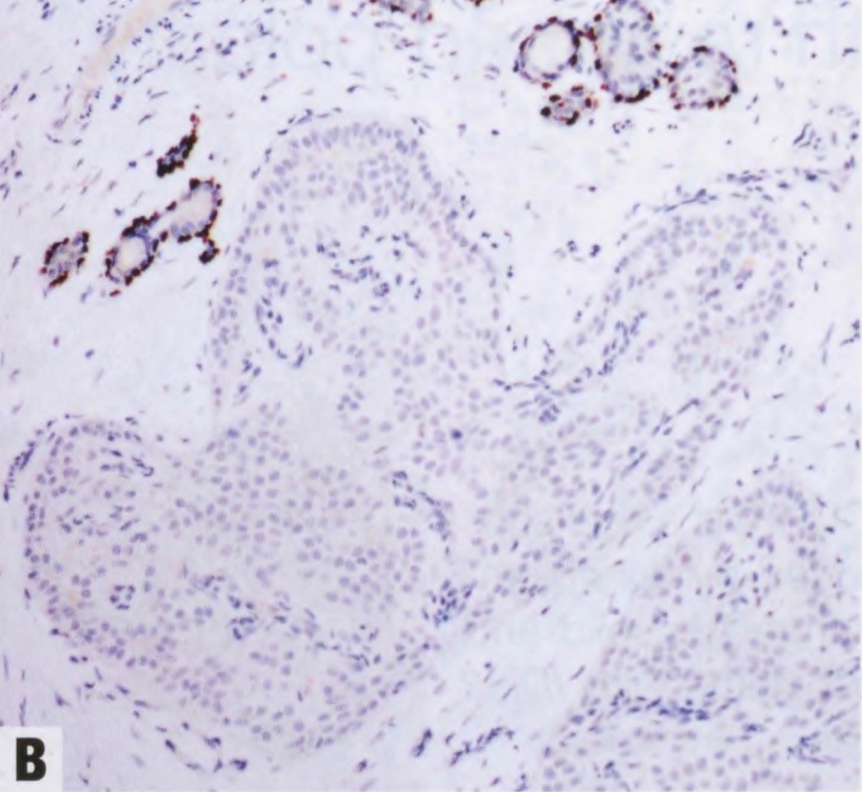
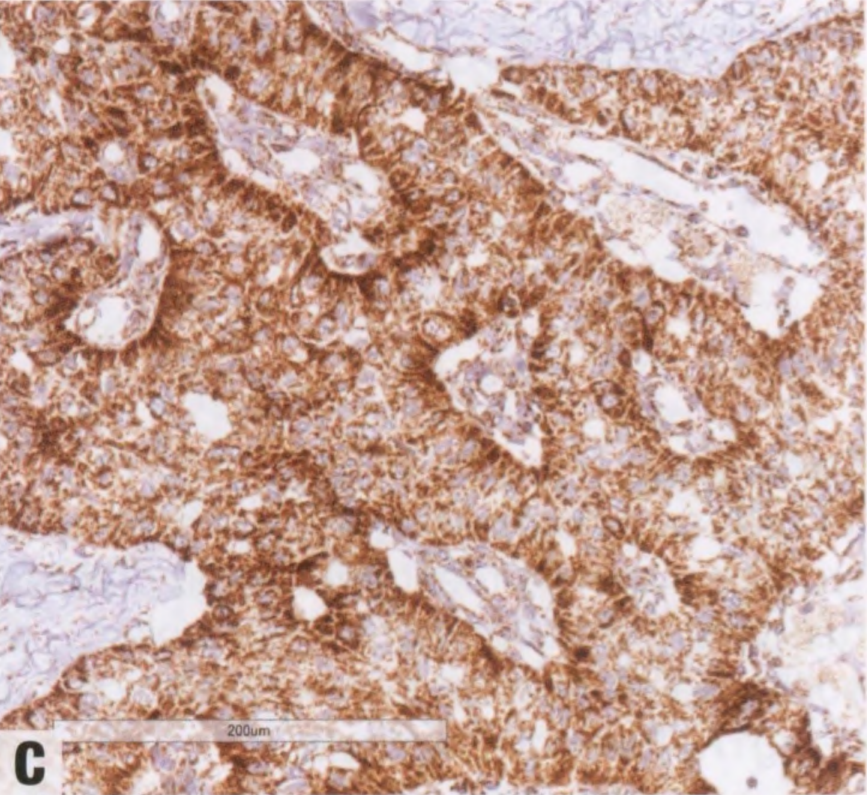 图2.152 TCCRP。A 肿瘤细胞呈CK5/6阳性。B p63染色显示实性巢周围没有肌上皮细胞。C抗线粒体抗原的免疫染色显示线粒体在细胞基底极聚集。
图2.152 TCCRP。A 肿瘤细胞呈CK5/6阳性。B p63染色显示实性巢周围没有肌上皮细胞。C抗线粒体抗原的免疫染色显示线粒体在细胞基底极聚集。
大体表现
TCCRP通常表现为边界清晰、质硬、白色至灰色的肿块。肿瘤大小0.6-5cm,中位大小1.5cm。
组织病理学
TCCRP由边界清楚的上皮细胞巢组成,最常见分布于致密的纤维间质中。许多巢具有纤细的纤维血管轴心,呈现实性乳头状模式。轴心常有泡沫状组织细胞。部分病例中,可以观察到含有胶样物质的真乳头和囊性结构。肿瘤巢周围有一圈薄薄的毛细血管。肿瘤细胞呈高柱状,富含嗜酸性胞质。大多数病例显示形态温和、圆形至卵圆形核,核沟和核内胞质包含体的存在各不相同。TCCRP最显著的组织学特征是核位于柱状上皮细胞的顶端而不是基底。核分裂象罕见。尽管TCCRP与甲状腺乳头状癌高细胞变异型在组织学上有一些相似之处,但免疫组化和分子研究证实了这种肿瘤为乳腺起源。
大多数TCCRP具有三阴性表型,其余病例显示弱或局灶性激素受体表达。几乎所有报道的病例都是HER2阴性。Ki-67增殖指数通常较低(<20%)。这些病变特征性地表达低分子量和高分子量的CK,分别如CK7和CK5/6。CgA和Syn始终呈阴性。肿瘤细胞巢周围无肌上皮细胞。在一项对9例的研究中,所有病例均显示calretinin阳性(弥漫强阳性或局灶染色)。GCDFP-15、GATA3和mammaglobin的可变染色,NKX2-1(甲状腺转录因子1)和甲状腺球蛋白不染色,支持乳腺起源。抗线粒体抗原免疫染色,线粒体在细胞的基底聚集。
细胞学
与临床无关
诊断分子病理学
TCCRP经常携带IDH2 p.Arg172突变。
诊断标准
必要标准:IBC,肿瘤细胞巢主要排列成实性乳头状模式,由柱状上皮细胞组成,核极性反转;肿瘤巢周围没有肌上皮细胞。
理想标准:同时表达低分子量和高分子量CK;三阴性或弱激素受体阳性。
分期
病例应根据IBC的标准进行分期。
预后和预测
TCCRP呈惰性临床病程,预后良好。大多数患者在随访期间(范围:3-132个月)无病生存。仅报道了一例具有侵袭性临床行为(骨转移)的病例。
未完待续......










































共0条评论