病例7 子宫内膜浆液性癌
(endometrial serous carcinoma,ESC)
【病例介绍】
患者,女,66岁;绝经16年,阴道不规则出血12天,宫颈TCT示HSIL,行宫颈管诊刮;后行子宫双附件及淋巴结清扫术。
【病理变化】
1、宫颈TCT:血性背景中散在的正常鳞状上皮细胞、聚集成团的异型细胞;异型细胞胞浆较少,嗜伊红或嗜双色;细胞核呈圆形、卵圆形,增大,深染,染色质较细腻、均匀一致,部分细胞核隐约可见核仁,核浆比较高。
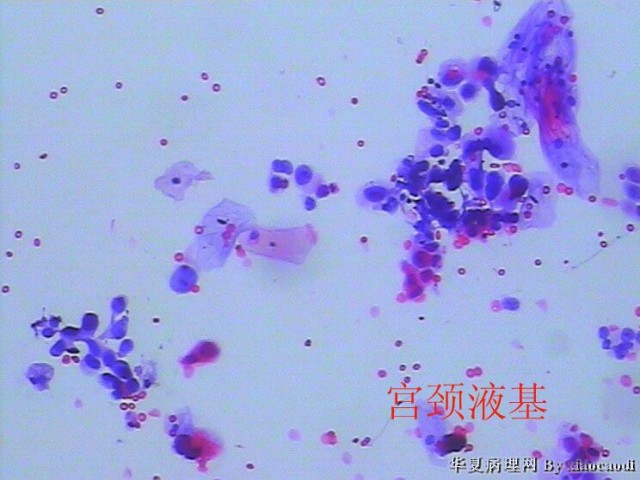
图1 HSIL。散在及聚集成团的异型细胞。
2、子宫颈管分段诊刮组织:
(1)巨检 灰红色组织4枚,直径0.5cm~0.8cm。
(2)镜检 低倍镜示血性背景中实性肿瘤组织及散在的肿瘤细胞(图2-A)。图2-B、C为图2-A不同区域的放大图像,示肿瘤细胞排列成不规则腺样、乳头状或实性片状,部分区域肿瘤细胞松散,可见鞋钉样细胞。高倍镜示肿瘤细胞大小不一,胞浆嗜酸红染;细胞核大小不一、形状不规则,核膜增厚,染色质深染或呈粗颗粒状,可见明显的较大的核仁;可见核分裂象(图2-D、E、F)。
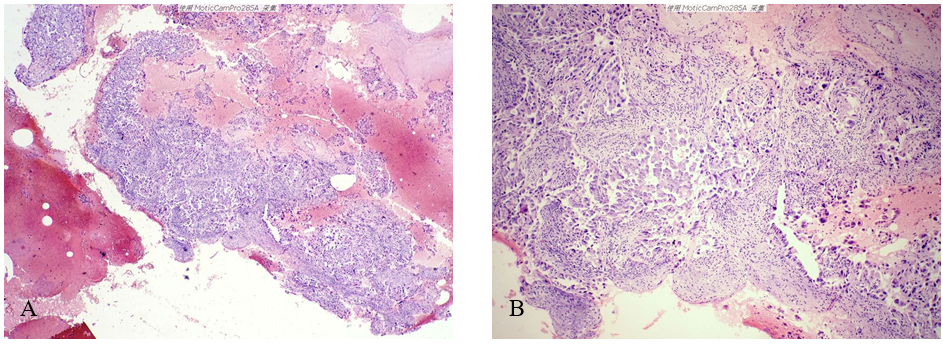
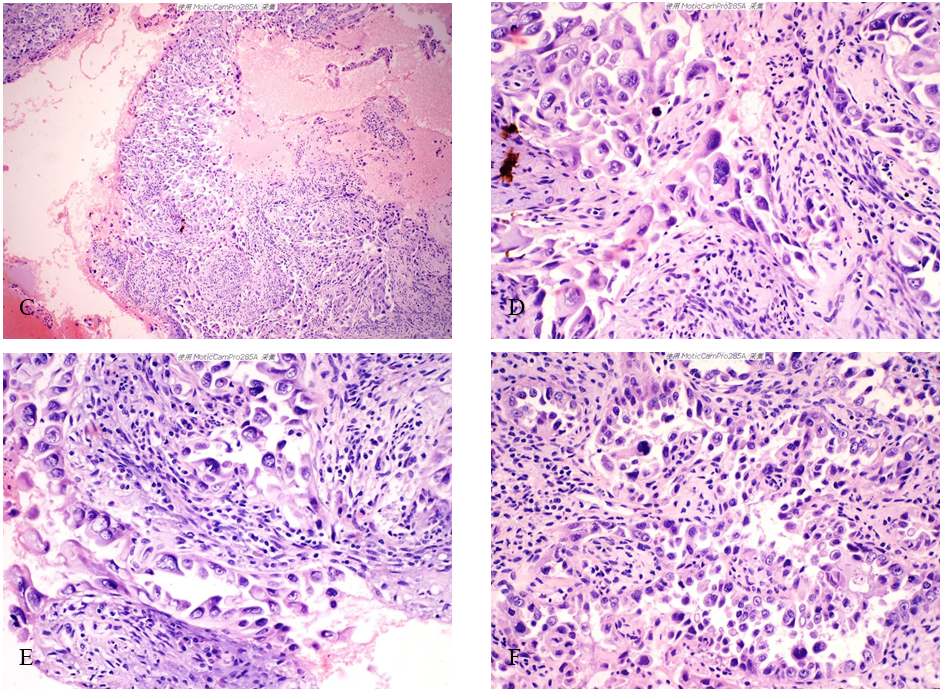 图2 子宫内膜浆液性癌累及宫颈。A示血性背景中的肿瘤组织;B、C示肿瘤组织的内部结构特征;D、E、F示肿瘤细胞异型明显,可见核分裂象。
图2 子宫内膜浆液性癌累及宫颈。A示血性背景中的肿瘤组织;B、C示肿瘤组织的内部结构特征;D、E、F示肿瘤细胞异型明显,可见核分裂象。
(3)免疫组化 CK7(+),Vimentin(部分+),P16(+),PR(+),ER(-),P53(100%+),CD10(-),WT-1(-),Ki-67(?)。
3、子宫双附件及淋巴结清扫:
(1)巨检 全切子宫,9*6*3.5cm,宫颈长2.5cm,宫颈口3*2.5cm,上附阴道壁6.5*2cm,切开子宫,内膜厚0.7cm,一侧卵巢3*1.5*1cm,输卵管包裹于卵巢中,另一侧卵巢3*1.3*1cm,输卵管扭曲,直径1.0cm。左侧盆腔淋巴结18枚,直径0.5-2.0cm,右侧盆腔淋巴结20枚,直径0.3-2.5cm,骶前淋巴结1枚,直径0.8cm。
(2)镜检 子宫间质内肿瘤组织浸润(图3-A),呈不规则腺样,肿瘤细胞呈鞋钉样,异型明显(同宫颈分段诊刮肿瘤细胞),可见淋巴结转移(图3-B)。
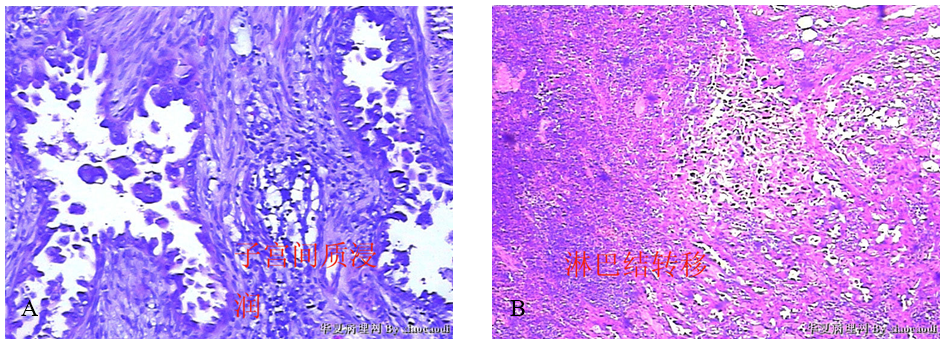 图3 子宫内膜浆液性癌间质浸润及淋巴结转移。
图3 子宫内膜浆液性癌间质浸润及淋巴结转移。
(3)免疫组化 CA125(+),CEA(-),CK20(-),CK7(+),CK8/18(+),EMA(+),ER(-),Ki67(约40%+),P53(约100%+),PR(-),Vimentin(+),WT-1(-),P16(+)。
(4)特殊染色 PAS染色(-)。
【讨论】
子宫内膜癌(endometrial carcinoma)为女性生殖系统最常见的恶性肿瘤之一,是由子宫内膜发生的原发上皮性恶性肿瘤,通常伴有腺体分化、具有浸润子宫肌壁及远处扩散的潜能。根据其起源、临床病理表现和遗传学特征可将其分为I型、II型及Lynch综合症(遗传性非息肉病性结直肠癌,HNPCC)相关内膜癌,其中I型子宫内膜癌包括经典的子宫内膜样癌、子宫内膜样癌的变异类型及黏液性腺癌,其与雌激素的持续性刺激有关,该型临床进展缓慢,预后较好;II型子宫内膜癌包括浆液性癌、透明细胞癌、癌肉瘤及未分化癌,与雌激素无关,临床表现为侵袭性强,预后差; Lynch综合症是家族性子宫内膜癌最常见的原因,为遗传性非息肉结肠直肠癌综合征常见的肠外表现,主要是由于存在DNA错配修复基因缺陷的胚系传递所导致的一种常染色体显性遗传。
子宫内膜浆液性癌(endometrial serous carcinoma,ESC)以往被称为管状形内膜癌、乳头状浆液性腺癌,但是乳头状结构并非是子宫内膜浆液性癌的特异性特征,而ESC所强调的是细胞显著异型性。2014年WHO女性生殖器官肿瘤分类将其定义为“浆液性癌具有复杂的乳头和/或腺样结构特征,并且伴弥漫的、显著的核异型性”,将其分为浆液性子宫内膜上皮内癌和浆液性癌,其ICO-D编码分别为8441/2、8441/3[1]。
ESC患者一般为多产、吸烟、输卵管结扎及有乳腺癌病史和/或使用他莫昔芬的妇女[1]。发病年龄为39~93岁,但通常为绝经后妇女,比子宫内膜样腺癌患者的年龄更大。ESC与雌激素刺激、肥胖、子宫内膜增生没有明确关系。子宫颈细胞学检查发现异常的可能性大(正如本例)。
ESC的大体特征可与子宫内膜样癌相似,肿瘤一般呈外生性生长并有乳头状结构,肿瘤坏死与深肌层浸润更为多见,但很难评估其浸润深度。典型的病例常为宫腔内体积巨大的坏死性肿物,若肿瘤为局限型,周围残存的内膜大多菲薄。肿瘤也可微小,肉眼见不到明显肿物[6]。
ESC的镜下组织学特征以乳头状结构为主,但是也可存在腺样结构和实性结构;乳头状结构较复杂,乳头和腺体衬覆的细胞形成细胞簇多数脱落漂浮于腔隙内。细胞学特征主要是显著细胞异型性,胞质丰富、嗜酸或透明,细胞核多形性、核深染、巨大核仁,大量核分裂象。1/3的病例可见到砂粒体。肿瘤的浸润成分可表现为与肿瘤主体相连的连续向下延伸、乳头状突起、实性肿块或腺体结构,后者常有肿瘤周围裂隙。血管腔内常见肿瘤细胞巢[7]。
免疫组织化学,与子宫内膜癌一样,表达广谱CK、EMA、CA-125等,通常不表达CK20,缺乏弥漫性、强阳性的CEA胞质表达;75%的ESC显示p53过表达(>75%的肿瘤细胞核强阳性);Ki-67增值指数非常高(>75%的肿瘤细胞核表达);ESC缺乏弥漫性ER、PE表达;p16弥漫强阳性;44%的肿瘤显示WT-1表达[8]。
ESC的鉴别诊断主要包括:
(1)绒毛腺管状癌:以细长乳头为主,不出现乳头状细胞簇,缺乏高级别核异型性;
(2)子宫内膜样癌:主要根据核形态学特征进行区分,另外免疫组织化学(p53、ER、PR、Ki-67等)可帮助鉴别诊断;
(3)透明细胞癌:详见专家点评;另外浆液性癌不会显示透明细胞癌中所见的管状囊性或实性结构、透亮胞质和透明变性的间质;
(4)转移性卵巢浆液性癌。
ESC恶性程度高,早期即可发生深肌层浸润、淋巴结转移和宫外扩散,预后很差,5年生存率仅为25%~36%。目前ESC的治疗方法主要是子宫+双侧附件切除术,同时应包括网膜切除术及腹腔细胞学检查、盆腔和主动脉旁淋巴结清扫。最近一项研究报道显示,手术后卡铂-紫杉醇(C/T)化疗联合高剂量率(HDR)的阴道内近距离放射疗法(IVB)值得去使用[2]。通过免疫组织化学(IHC)和荧光原位杂交(FISH)技术检测显示超过35%的ESC表皮生长因子(HER2/neu)过表达,而Neratinib、Afatinib以及Dacomitinib对于化学治疗抵抗而HER2/neu基因扩增的ESC患者可能具有显著的作用[3][4][5]。
【回帖精选】
1、雅马哈(1楼)回复:
诊 断:伴有鳞状上皮分化/桑葚化生的子宫内膜样腺癌
诊断依据:
1)、患者老年女性,绝经后阴道不规则出血;
2)、低倍镜下组织破碎,瘤组织呈裂隙样及不规则的腺管状、乳头状排列,乳头呈不规则的分支状,瘤细胞排列松散。部分区域瘤细胞排列紧密;
3)、部分区域瘤细胞呈片状生长,细胞界限清晰,核浆比增大,可见高级别的核。
免疫组化:ER、PR、P53、P63、CK7、CK高、CK20、HMB45、Vimentin、Ki-67。
鉴别诊断:
1)、子宫内膜浆液性腺癌:一般是以形成宽纤维血管轴心的2-3级乳头为特征。IHC一般P53阳性,PR阴性不难做出鉴别;
2)、子宫内膜鳞状细胞癌:比较罕见,形态同宫颈的鳞状细胞癌;
3)、宫颈鳞状细胞癌扩散到宫腔:结合临床不难做出鉴别。
2、xinzhu1492(8楼)回复:
诊 断:子宫浆液性乳头状腺癌。
诊断依据:
老年,腺体结构不规则,有乳头形成,鞋钉样细胞,细胞异型性明显,有巨大细胞核,核仁明显。
鉴别诊断:透明细胞癌。
3、tianhui77(26楼)回复:
诊 断:(子宫内膜)透明细胞癌。
诊断依据:
1)、患者老年女性,绝经后阴道不规则出血;
2)、低倍镜下组织破碎,瘤组织呈裂隙样及不规则的腺管状、乳头状排列,细胞体积较大,界限清楚,胞浆透明,细胞异型性较大,“鞋钉样”细胞形成片状、管状、迷宫样和乳头状形态。
3)、部分区域瘤细胞呈片状生长,细胞界限清晰,核浆比增大,可见高级别的核。
4)、周围可见正常宫颈管腺体,所以不考虑来源宫颈管。
免疫组化:ER、PR、P53、P63、CK7、CK高、CK20、HMB45、Vimentin、Ki-67。
鉴别诊断:
1)、浆液性腺癌:和透明细胞癌形态有重叠,明显透明细胞和突出的“鞋钉样”排列,提示透明细胞癌;
2)、子宫内膜样腺癌:ER、PR、vim可以鉴别;
3)、宫颈腺鳞癌:有明显鳞癌成分,此例未见到。
【提供者单位及姓名】安徽省宣城市人民医院病理科 陈海玲(xiaocaodi)
【专家点评-喻明芙老师】
出片单位诊断(87楼):
(宫颈管)浆液性腺癌,可能来源于子宫内膜。
1、癌组织呈不规则腺样或宽大乳头排列,癌细胞明显异型,核大,染色质粗,核仁突出,核形怪异,呈鞋钉样排列,胞浆嗜酸红染。
免疫组化标记结果:CK7(+),Vimentin(部分+),P16(+),PR(+),ER(-),P53(100%+),CD10(-),WT-1(-)。
2、手术切除标本:子宫内膜浆液性腺癌,癌组织浸润肌层>1/2,累及子宫峡部、宫颈管、整个宫颈,两侧输卵管及一侧卵巢,“左侧”盆腔淋巴结见癌组织转移(1/18),“右侧”盆腔淋巴结见癌组织转移(3/20),骶前淋巴结未见癌组织转移(0/1),双侧宫旁见癌组织累及,阴道壁阴性。
注:免疫组化标记肿瘤细胞示CA125(+),CEA(-),CK20(-),CK7(+),CK8/18(+),EMA(+),ER(-),Ki67(约40%+),P53(约100%+),PR(-),Vimentin(+),WT-1(-),P16(+);
特染:PAS染色(-)
鉴别诊断:
1、透明细胞癌:与子宫内膜浆液性腺癌同属II型子宫膜癌,恶性程度高,形态上可见透明细胞、鞋钉样细胞和嗜酸性细胞。本例透明细胞有,但较少,而且子宫浆液性腺癌常与透明细胞癌混在,刮宫检材中很难鉴别,两者的治疗原则和预后无大区别,免疫组化标记:CD15在浆液性腺癌阳性,有助于鉴别。
2、中肾管腺癌:部位较深,位于宫颈两侧,CD10+,而本例CD10-,WT-1-,PR+不支持。
3、子宫内膜腺癌:ER+、PR+、Vimentin+可供鉴别。
子宫内膜浆液性腺癌(serous adenocarcinoma,SA)是子宫内膜的一种少见病理类型。患者绝大多数为绝经后的老年妇女,发病年龄在65~72岁,极少见于年轻妇女。发病与高雌激素状态无关,不表达雌、孕激素受体(ER,PR),确诊时常已晚期。早期常发生子宫深肌层学好润,淋巴和(或)脉管浸润及上腹部转移;正常细胞一旦恶变,即出现浸润,不存在非典型增生、原位癌等中间过渡阶段。恶性程度高,预后差。所以术前临床分期常不能正确反映真实情况,多数低估了其病变范围,而子宫内膜浆液生腺癌确切的临床病理分期与患者的预后密切相关。
喻明芙老师跟帖点评:
(84楼)我认为ECC可以诊断高级别侵润性腺癌,浆液性。(High grade) invasive adenocarcinoma, serous type,很可能来源于子宫内膜。EMC/EMB 应该看到同样的癌症。High Grade 加括号是因为浆液性腺癌by definition 是高级别的,可以不写高级别,写上只是万一有临床医生不是很明白。
在这儿像这样的癌症我们可能啥免疫组化都不做,直接诊断就可以了。P53 在浆液癌大多数是阳性(80,90%),也有阴性的。但同时高度内膜样癌(Endometrioid adenocarcinoma, FIGO grade 3, nuclear grade 3), 也有不少阳性的(约15%)。
有很纯很纯的病理人(很喜欢这样的标志)质疑活检要不要报明确。我的观点是越明确越好:浆液癌做全切加淋巴结,即使高级别的内膜样癌,如果冰冻切片没有肌层侵润,可以不做这么大的手术。再说报准确和不报准确并没有时间差异,如不做IHCs,我们都是第2天出报告。
(89楼)关于透明细胞癌:我觉得不像,这例的胞浆不是透明的,是嗜伊红的(实际上浆乳癌很少胞浆,我在工作中看到的浆乳癌基本没啥胞浆,我觉得这例的较容易看到的胞浆可能有固定假象),透明细胞癌胞浆中有小的伊红小体,这例图中没看到,透明细胞癌一般是片状细胞,不成乳头样结构。正如楼上说讲,别的类型也可能有透明细胞,必须透明细胞达到一定的比例(90%?)才能诊断透明细胞癌。我最近有一例,等找到传给大家看。
这例图上也看不到内膜样癌的结构,而是典型的乳头状结构。即使高级别内膜样癌,细胞也有比浆乳癌多的胞浆。
(116楼)ECC和切除样本诊断同意出片老师Xiaocaodi意见和点评, 请见87楼。图片上可能鉴别高度内膜样癌,透明细胞癌和浆乳癌不是很容易,我给出以下几点意见供参考:
1. 都是高级别腺癌,有时是混合存在,成分要达到一定比例(~10%)才需要在诊断中提出。
2. 即使是活检或诊刮,尽量给出明确诊断,基本靠形态学,不靠IHCs,不要退缩。
3. 即使是高度内膜样癌(endometrioid type, nuclear grade 3, FIGO grade 3), 其预后和对治疗的反应也比TypeII (浆乳癌,透明细胞癌)要稍微好些。
4. 美国所有癌症切除样本CAP建议用标准格式(Synoptic Report),需要给AJCC Stage, 这些资料对肿瘤医生的治疗方案和病人的预后非常重要。我根据Xiaocaodi老师的报告,给出CAP (College of Amerian Pathologists) 建议的报告如下:
子宫全切,双侧卵巢及输卵管切除,双侧盆腔淋巴结和髂前淋巴结清扫:
子宫内膜腺癌,浆液性(高度)。
Synoptic Report
Carcinoma Of Endometrium (我试着翻译成中文)
样本:子宫体,双侧卵巢,双侧输卵管,阴道
手术:Radical子宫切除,双侧附件
淋巴结样本:盆腔和髂前淋巴结
样本完整性:完整
肿瘤位置:前后宫腔
其他:宫颈管,双侧输卵管,一侧卵巢
肿瘤大小:XXXX CM
组织学Type: 浆液性
组织学Grade: G3: Poorly Differentiated
Myometrial Invasion: 》=50% Myometrial Invasion
涉及宫颈:涉及
肿瘤侵及其他脏器: 双侧卵巢。。。。。。
腹腔液体细胞学:
切缘(Margins)。。。。。
血管淋巴管Invasion:
Pathologic Staging (pTNM):
pT3a: 肿瘤侵及Serosa或附件
pN1 或 pN2: 转移到盆腔或主动脉前淋巴结
检查淋巴结总数: 39
有转移淋巴结数:4
还有些可报可不报的就免了。
对不起,太长了,但我们就是这样报的,像这么大的样本,病理报告都是几页。
感谢安徽省宣城市人民医院病理科陈海玲老师提供病例,个人查阅文献整理相关内容,仅供参考学习!不当之处敬请批评指正!
【参考文献】
[1]Robert J. Kurma, Maria Luisa Carcangiu, C. Simon Herrington, et al. WHO Classification of Tumours of Female Reproductive Organs [M]. Lyon: IARCC, 2014: 129-130.
[2]Damast S, Higgins SA, Ratner E, et al. High-dose-rate vaginal brachytherapy with chemotherapy for surgically staged localized uterine serous carcinoma [J]. J Contemp Brachytherapy, 2015, 7(1):35-40.
[3]Zhu L, Lopez S, Bellone S, et al. Dacomitinib (PF-00299804), a second -generation irreversible pan-erbB receptor tyrosine kinase inhibitor, demonstrates remarkable activity against HER2-amplified uterine serous endometrial cancer in vitro [J]. Tumour Biol, 2015, 11.
[4]Schwab CL, Bellone S, English DP, et al. Afatinib demonstrates remarkable activity against HER2-amplified uterine serous endometrial cancer in vitro and in vivo [J]. Br J Cancer, 2014, 111(9):1750-1756.
[5]Schwab CL, English DP, Roque DM1, et al. Neratinib shows efficacy in the treatment of HER2/neu amplified uterine serous carcinoma in vitro and in vivo [J]. Gynecol Oncol, 2014, 135(1):142-8.
[6]郑文新, 沈丹华, 郭东辉. 妇产科病理学. 北京: 科学出版社, 2013年: 326-333.
[7]薛德彬译. Blaustein女性生殖道病理学[M]. 北京:北京科学技术出版社, 2014: 402-407.
[8]Hedley C, Sriraksa R, Showeil R, et al. The frequency and significance of WT-1 expression in serous endometrial carcinoma [J]. Hum Pathol. 2014, 45(9): 1879 -1884.







 图2 子宫内膜浆液性癌累及宫颈。A示血性背景中的肿瘤组织;B、C示肿瘤组织的内部结构特征;D、E、F示肿瘤细胞异型明显,可见核分裂象。
图2 子宫内膜浆液性癌累及宫颈。A示血性背景中的肿瘤组织;B、C示肿瘤组织的内部结构特征;D、E、F示肿瘤细胞异型明显,可见核分裂象。 图3 子宫内膜浆液性癌间质浸润及淋巴结转移。
图3 子宫内膜浆液性癌间质浸润及淋巴结转移。







共0条评论