往期回顾:
2.3腺瘤
简介:“腺瘤”是良性腺上皮肿瘤的通用术语。在乳腺中,腺瘤来源于TDLU细胞的增殖,形成独立的肿块,对应于临床和影像学检出的边界清晰的肿块。归类为“腺瘤”的良性乳腺病变包含不同比例的腺体、纤维和脂肪组织。应用于具体病例的术语取决于主要的增殖细胞类型及其与其他细胞类型的比例。例如,FA(最常见的腺瘤类型)是一种纤维上皮病变,伴有间质和腺体的混合,而TA中的主要细胞是密集的导管和肌上皮细胞,很少或没有背景间质。LA是妊娠或哺乳期出现的肿瘤。有人认为DA相当于硬化性IPa。所有这些腺瘤的恶性转化风险可以忽略不计。
Tubular adenoma
管状腺瘤(TA)
定义
TA是一种良性、边界清晰的肿瘤,由密集增殖的紧密接近的圆形和卵圆形管状结构组成,由双层导管和肌上皮细胞组成,背景间质很少。
ICD-11编码
8211/0 TA-NOS
ICD-11编码
2F30.0&XFI7SY6乳腺TA&TA-NOS
相关命名
不推荐:FA,管周型(伴明显的上皮增殖)。
亚型
没有
部位
TA出现在乳房的外上象限。
临床特征
TA是一种生长缓慢的肿瘤,可能在发病后2-12个月查出。体检可能表现为可触及的、孤立的、无痛的、可推动的、轮廓分明的肿块。影像学通常表现为边界清晰的肿块。超声表现为低回声,并有轻微的后回声。两份病例报道描述了快速增大:一例是孕妇,另一例是绝经后妇女。罕见情况下,TA可能表现出提示恶性肿瘤的临床特征,包括患者年龄较大(>48岁)、质硬、活动受限、边缘不清、体积大、皮肤溃疡、快速增大(2个月)和影像学可疑结果(BI-RADS 4)。较少见的是,在绝经后妇女中,它们可能表现为聚集的高密度可疑钙化,需要进行粗针活检,并且可能伴有管腔内分泌物。只有一份病例报道描述了绝经后妇女乳头溢液的表现。FA和TA在临床、放射学、细胞学和免疫组化方面有相似的发现;因此,TA在术前可能被误认为是FA,但可以通过组织病理学进行区分。
流行病学
TA的发病率在0.13%-2.9%之间。这些肿瘤通常发生在育龄妇女(15-49岁),90%的病例发生在40岁以下的女性。TA罕见于月经初潮前或绝经后。
病因
TA起源于TDLU。确切的病因尚不清楚,但考虑到育龄妇女的发病率,它很可能与生殖激素有关。这一假设也得到了TA与FA的密切相似性和关系的支持,FA在生殖期也受到激素的累及。然而,没有描述与妊娠或口服避孕药使用有关。
发病机制
TA和FA在临床病理特征上的重叠、它们偶尔的共存以及它们在腺瘤中的组合特征提示,它们具有共同的组织发生机制,FA中间质成分占主导地位,TA中上皮和肌上皮细胞占主导地位。使用二代测序研究的少数TA病例显示MET和FGFR3突变。尽管FA和TA之间存在相似性,但这些研究未能显示MED12外显子2突变的存在,这是FA中常见的突变。这种差异最好的解释是,TA与FA管周型非常相似,已知MED12外显子2突变的发生率低于管内型FA。鉴于TA和FA在临床、放射学、细胞学和免疫组化发现上的相似性,以及它们偶尔的混合和关联,尽管罕见病例在分子病理学上表现出差异,但它们可能在组织遗传学上相关。
大体表现
肿瘤大小一般为1-7.5cm(平均3.0cm),文献中报道了一些巨大的肿瘤(大至15cm)。与FA一样,TA通常是光滑的圆形、无包膜、质硬的肿瘤,具有实性均匀或微结节橡胶状的切面。然而,它们往往比FA更柔软,颜色从黄色到黄褐色,而不是像FA那样的白色。
组织病理学
低倍观,规则的均匀的圆形小管形成边界清晰的致密增殖。高倍,小管衬双层细胞,内层为导管腔面细胞,外层为变薄的基底部肌上皮细胞,类似于正常的静止期乳腺上皮。核仁、异型性和核分裂象都罕见。管腔通常中空,偶尔含有黏液或PAS阳性嗜酸性蛋白物质,α-乳清蛋白免疫染色阴性。与FA不同,间质稀疏,主要由纤细的纤维血管网组成,可能含有少量散在的淋巴细胞。因此,没有明显的纤维化挤压小管。罕见梗死(2.4%的病例)。FA和TA只有在组织病理学上才能明确区分,其关键特征是TA有明显的旺炽性腺病样上皮增殖和很少间质。

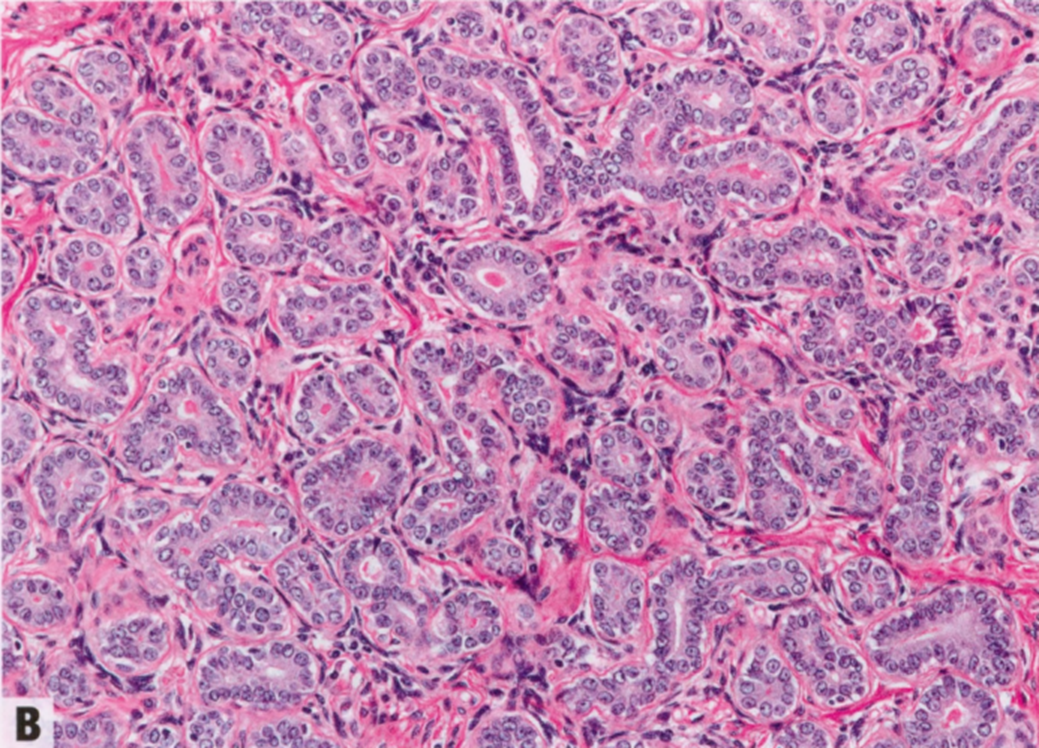 图2.24 TA。A 由密集排列的圆形小管组成的边界清晰的肿瘤。B 小管由内层导管腔面细胞和外层变薄的基底部肌上皮细胞组成,间质很少。
图2.24 TA。A 由密集排列的圆形小管组成的边界清晰的肿瘤。B 小管由内层导管腔面细胞和外层变薄的基底部肌上皮细胞组成,间质很少。
细胞学
仅有少数细胞学描述,中-高度细胞丰富,有许多由形态温和的导管细胞组成的紧密3D球状簇,可能形成腺泡。导管细胞偶尔也可能呈乳头状或鹿角状排列。背景中含有肌上皮细胞,呈裸核状,几乎没有间质碎片。这些发现也可能出现在FA中,因此TA很容易被误认为是FA。当存在过多的管状碎片时,应考虑TA的诊断,但准确的术前诊断很少。最近文献中有一例误认为非典型病例,原因是标本细胞密度高、病变面积大(>8.5 cm)和伴有钙化。鉴于细胞学难以识别TA,组织病理学仍然是确诊的金标准。
诊断分子病理学
与临床无关
诊断标准
必要标准:边界清晰的肿瘤,由圆形和卵圆形管状结构形成密集的增殖,背景间质稀少;双层上皮(腺和肌上皮)。
理想标准:如果需要,免疫染色标记肌上皮(p63、p40、SMA、calponin)和腺上皮(EMA、CK19、CK8/18),证实双细胞群。
分期
与临床无关
预后和预测
TA是良性、惰性肿瘤,不增加恶性肿瘤风险。然而,文献中有些病例报道描述了它们伴有DCIS和浸润性导管癌。其中一例,两个实体在组织学上截然不同,最可能是碰撞肿瘤。另一例,两个实体混合,提示恶性转化的可能性。经过短期随访(18个月),少数完全切除的病例没有复发。与FA一样,对无症状TA进行观察、年度临床乳腺检查和影像学检查就足够了。对于临床特征令人担忧的病例,出于美容原因或明确诊断,可能需要手术切除。
Lactating adenoma
泌乳性腺瘤(LA)
定义
LA是一种良性乳腺结节,在妊娠或哺乳期发现,由显示泌乳改变的腺体聚集而成。
ICD-11编码
8204/0 LA
ICD-11编码
2F30.1&XH0W31乳腺LA&LA
相关命名
不推荐:妊娠期肿瘤;结节性泌乳增生。
亚型
没有
部位
LA主要发生在乳房(有时为双侧和多发性),罕见沿着从腋窝到腹股沟的乳线发生。
临床特征
LA通常表现为柔软、无痛、可触及、质硬、可移动、离散的肿块,没有乳头或皮肤改变。由于生理需求增加导致的血供不足,多达5%的病例可能发生梗死,进而导致增大、疼痛、压痛和可疑的影像学表现。LA通常<5cm,但有快速生长和增大的潜能(可达25cm)。终止母乳喂养通常会导致1-5个月内自然消退,但有人描述了罕见的产前和产后肿大。乳房X线通常显示边界清晰的肿瘤,但LA很少表现为部分模糊或不对称的肿块。超声特征包括平滑均匀的低回声实性圆形至卵圆形肿块,长轴(如果有的话)平行于胸壁(横向)。此外,还可以看到微小叶边界、血管增生、后回声增强和回声假包膜。或者,由于乳脂存在,LA可能出现高回声或透亮。可见明显的中线管状结构,代表扩张的导管。由于妊娠/哺乳期乳房的生理密度增加,可能干扰乳房X线和MRI的解读,超声检查是首选的诊断方式。此外,在妊娠期间,乳房X线和MRI造影剂的使用也不受欢迎。尽管超声检查在诊断LA方面可能是可靠的,但与FA的明确区分可能具有挑战性。如果肿块迅速增大并出现令人担忧的超声表现,如后部阴影、边缘不规则和异质性,则应通过活检/切除进行确认性组织诊断。
流行病学
尽管称为“泌乳性”,但LA在妊娠晚期比分娩后更常见(罕见于第一或第二孕期),而且几乎从不发生在妊娠期以外,约占该人群所有粗针活检的70%。然而,并非所有LA都采用了活检,因此,真正的发病率尚不清楚。LA通常累及19-34岁的女性,大多数病例发生在20多岁。
病因
未知
发病机制
目前尚不清楚LA是新发肿瘤、增生性病变,还是原先的FA伴叠加的诱导生理改变。LA和TA视为一个谱系的两端,因为两者都有旺炽性上皮增殖和很少间质。事实上,泌乳期腺瘤在妊娠早期和中期的组织学和超微结构改变与TA相似。使用二代测序研究,少数LA病例未能显示任何突变,包括FA中常见的MED12外显子2突变。
大体表现
LA是一种边界清晰、无包膜、分叶状的实性肿块,切面质硬(但比FA或TA软)至橡胶状灰褐色至黄色。梗死肿瘤可能出现坏死。
组织病理学
LA是由密集的、增生性分泌小叶形成的边界清晰的增殖,由稀疏的纤细的结缔组织分隔,可能水肿。妊娠早期和中期的LA类似于TA,因为它们由圆形到不规则的卵圆形腺泡结构组成,但腺体的大小和形状存在差异。中期妊娠后,肿瘤成熟,由上皮细胞形成大小不一的腺泡腔。导管腺泡网衬覆立方形或鞋钉状细胞组成,含有颗粒状或空泡状透明胞质,以及管腔嗜酸性分泌物(乳汁),两者都是油红O阳性,含有α-乳清蛋白。小圆核,无异型性,偶见核分裂象。周围乳腺组织可见相同的细胞学和超微结构改变。FA也可能表现出分泌活性,但它与LA的区别在于其保留的纤维上皮结构、明显的间质和具有分泌活性的细胞的局灶性而非密集增殖。

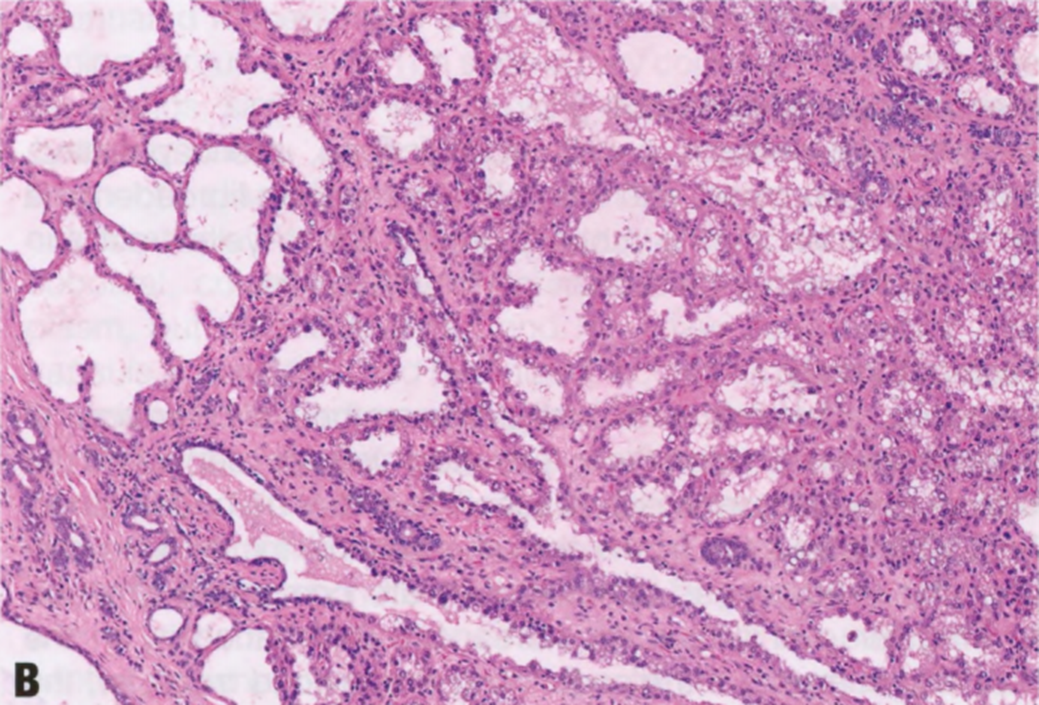 图2.25 LA。低倍显示由密集、扩张的小管形成边界清楚的结节。B 较高倍,小管内衬单层立方上皮细胞,胞质空泡化,偶尔有鞋钉样核,肌上皮变薄。一些扩张的小管含有管腔内粉红色的絮状分泌物。
图2.25 LA。低倍显示由密集、扩张的小管形成边界清楚的结节。B 较高倍,小管内衬单层立方上皮细胞,胞质空泡化,偶尔有鞋钉样核,肌上皮变薄。一些扩张的小管含有管腔内粉红色的絮状分泌物。
细胞学
低倍显示中等量细胞,具有丰富的分泌蛋白质背景,含有单一的裸核非粘附性附单一细胞群,以及大的3D腺泡细胞聚集。高倍,腺泡细胞聚集体具有空泡状和细长的胞质,以及轮廓平滑的核,核内含有细小的核染色质,核仁明显但均匀。在缺乏有关妊娠和哺乳的信息的情况下,生理性增殖细胞学特征很容易被过度诊断为异型性。细胞学发现包括非典型非粘附性附细胞,在颗粒状花边背景中含有明显的大核仁。然而,由于非典型性被哺乳期的改变所掩盖,可能出现假阴性。因此,组织病理学是确诊的金标准。
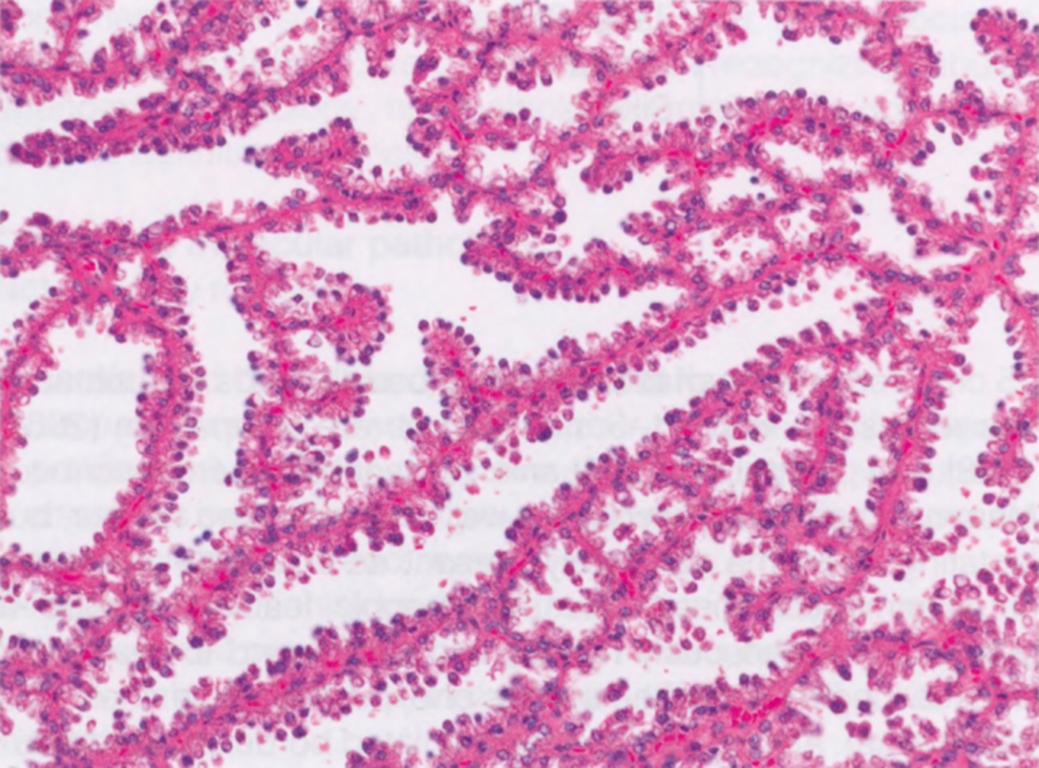 图2.26 LA。高倍显示上皮细胞排列成导管腺泡网,鞋钉状细胞,含有颗粒状或空泡状透明胞质。
图2.26 LA。高倍显示上皮细胞排列成导管腺泡网,鞋钉状细胞,含有颗粒状或空泡状透明胞质。
诊断分子病理学
与临床无关
诊断标准
必要标准:由密集的、增生性分泌小叶形成边界清晰的增殖,由稀疏的纤细的结缔组织分隔;形态温和的衬覆上皮细胞,含有空泡状或颗粒状胞质和小核,核仁小而均匀。
分期
与临床无关
预后和预测
肿瘤呈惰性、缓慢生长和自发消退,管理方式是观察和要随访,并排除恶性肿瘤。由于令人担忧的特征,可能需要肿块挖除术,术后恢复母乳喂养。溴隐亭通过抑制催乳素导致复旧,但也会导致停止母乳喂养。随访6个月至14年(平均3.4年),没有进展为癌,但部分病例中,有同时发生的癌。一例浸润性癌发生在先前切除的LA部位。一项发现了从LA到癌的转变。重要的是,在妊娠期间促进乳房发育的激素,如雌激素、黄体酮和催乳素(尤其是黄体酮和催乳素),也在癌症发生中发挥作用。因此,目前尚不清楚LA是否能够恶性转化,是危险因素,还是恰好发生在恶性肿瘤附近。
Ductal adenoma
导管腺瘤(DA)
定义
DA是一种良性肿瘤,由硬化间质中扭曲的腺体组成,周围有纤维包膜。
ICD-11编码
8503/0 DA
ICD-11编码
2F30.2&XH4LZ4乳腺IPa&IPa
相关命名
不推荐:硬化性乳头状瘤。
亚型
没有
部位
DA发生在周围乳腺的中小导管中。
临床特征
DA通常表现为可触及的孤立性肿块,但多灶性肿瘤可能出现不规则外观。通常来自中小型导管。罕见情况下,可能累及较大的导管,并伴有乳头溢液,类似于IPa。乳房X线显示独立的肿块、边界不清、毛刺状、多个小叶和/或形状不规则的钙化。超声显示边界清楚的圆形低回声结节,伴有阴影和后部增强。妊娠期和哺乳期发生的伴有梗死的罕见病例已有报道。
流行病学
DA是一种罕见的肿瘤,发生在50多岁。据报道,4例为双侧性伴Carney综合征。
病因
DA主要起源于周围乳腺的中小型导管腔,罕见于较大的导管。相比之下,IPa也起源于中小型外周导管,更主要起源于较大的乳晕下导管。
发病机制
有人认为DA很可能是起源于中小型导管中的IPa。由于间质修复,IPa发生硬化,肌纤维母细胞增殖和纤维连接蛋白和间质胶原的沉积,导致树枝状乳头结构的消失。由于DA中的RS视为乳头状病变谱系之一,因此也可见RS的叠加特征(如中央弹性组织增生)。有人认为,DA中普遍存在的SA等增生病变可能通过直接扩张并进入中小导管内或进入共存的IPa,从而导致DA。使用二代测序研究的少数DA病例显示PIK3CA、GNAS和AKT1突变。在IPa中也检测到AKT1突变,支持与DA密切相关(或起源相似)。
大体表现
DA大小0.5-5.0cm(平均0.85cm),表现为孤立的白色实性结节。切面呈分叶状和颗粒状,中心呈灰色软化。钙化区域显得质硬、沙砾感和假浸润。偶尔可见局部附着于囊肿或扩张的导管。罕见情况下,肿瘤可能边界不清,与周围的乳腺间质牢固粘连,令人怀疑浸润性癌。此外,由于同一导管系统的近端或远端部分都受累,DA可能形多结节。
组织病理学
DA通常是孤立的实性腺瘤样增殖,周围围绕着致密增厚的同心圆状纤维弹性管壁(包膜),但有时可能是多结节。腺瘤部分的腺体排列成有序的平行模式,从中心向外围呈放射状分布。腺体呈圆形到卵圆形,细长到分枝,有双层细胞(腺腔面导管上皮和变薄的肌上皮细胞),有少量的纤维间质。间质可能挤压并堵塞腺体,类似于SA。腺体可能出现囊性扩张、管腔折叠、含有PAS阳性嗜酸性分泌物和/或伴有层状钙化(沙砾体)。高倍,导管细胞呈立方形、柱状和/或梭形,胞质嗜酸性,无非典型性,罕见核分裂象。包膜呈层状并透明变性,含有营养不良钙化。管壁(包膜)内可有陷入的腺体,或明显延伸到周围组织中,似有推挤性或假浸润性边界。除了钙化外,硬化管壁还可能出现慢性炎症、出血、黏液样变以及鳞化和软骨样化生。周围或中心可见伴或不伴钙化的退行性改变;中心的退行性改变可能与RS的组织学特征相似并重叠。周围的乳房可能显示SA、大汗腺化生或囊性导管扩张。无分支乳头(如IPa)或肌上皮增生(如AME)。DA显示p53和Ki-67的低标记。

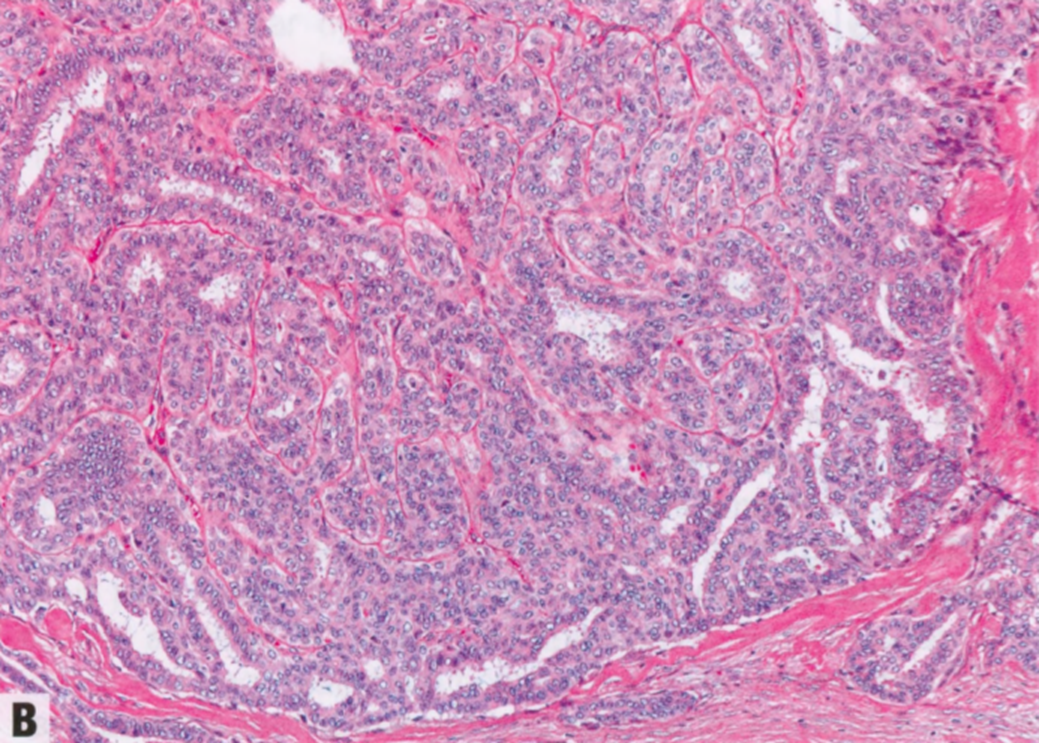 图2.27 DA。低倍显示孤立的实性腺瘤增殖,周围环绕着厚的同心硬化管壁(包膜),其中有陷入的腺体,导致推挤性或假浸润性边界。B 较高倍显示圆形至卵圆形、细长至分支的腺体,有双层细胞(导管上皮和变薄的肌上皮细胞),局部呈假浸润性。
图2.27 DA。低倍显示孤立的实性腺瘤增殖,周围环绕着厚的同心硬化管壁(包膜),其中有陷入的腺体,导致推挤性或假浸润性边界。B 较高倍显示圆形至卵圆形、细长至分支的腺体,有双层细胞(导管上皮和变薄的肌上皮细胞),局部呈假浸润性。
细胞学
涂片高度细胞丰富,含有大量分支的单层的规则排列的粘附性上皮细胞,均匀的核、核仁、染色质,凿孔样胞质空泡。背景由双极和卵圆形裸核、组织细胞和大汗腺细胞组成。其独特特征是存在异染性或嗜酸性间质,夹杂指状透明突起或小卵圆形边界清晰的小球。这些小球可能貌似胶原小球病的一些特征,但缺乏其他特征。高度细胞丰富可能需鉴别恶性肿瘤(特别是AdCC),若能辨认上皮细胞的良性细胞学细节,则很容易排除所有恶性肿瘤。FA有富细胞性间质,可以因此区分。
诊断分子病理学
与临床无关
诊断标准
必要标准:边界清晰的肿瘤,由腺瘤样增殖组成,围绕着层状同心圆纤维硬化管壁;圆形到卵圆形、细长到分支的腺体,双层细胞(管腔面导管上皮和变薄的肌上皮细胞),有少量的纤维性间质;立方、柱状和/或梭形导管细胞,嗜酸性胞质,缺乏异型性,罕见核分裂象。
分期
与临床无关
预后和预测
DA是一种良性、稳定的肿瘤,完全切除后复发或恶性风险不会增加,低p53和Ki-67支持上述生物学行为。由于组织学和放射学貌似癌,通常建议切除,特别是在临床检查、影像学和粗针活检中。文献中少数病例伴有DCIS和LCIS,可能是共存而不是恶性转化。
未完待续......




















共0条评论