介绍
细胞学标本获得高度准确性IHC非常重要,因为高达40%的肺癌诊断来自细胞学标本。细胞学对非小细胞癌(NSCC)分型的效能相当于组织学,不仅如此,细胞学用微创方法收集肿瘤材料,可用于复发或转移性疾病的重复生物标记物分析。经支气管内镜超声引导细针穿刺(EBUS-FNA)是最有效的细胞学技术。然而其他方式也很重要,如经胸FNA、支气管分泌物或刷取,支气管肺泡灌洗液和胸水,或远处转移部位FNA。与组织学相比,主要区别和挑战是细胞学标本在分析前因素存在更大的变数,并缺乏组织学背景。对于NSCC预测生物标记物,IHC可以作为一种快速、经济的替代方式,用于荧光原位杂交(FISH)和分子检测的筛选。细胞学IHC检测的现状和挑战已有数优秀综述。肺癌细胞学标本必须进行IHC检测,这是无可争议的。
哪些细胞学标本最适合免疫染色:细胞蜡块?风干或乙醇固定涂片?
细胞蜡块标本
细胞学标本的制备分为细胞蜡块和非细胞蜡块。细胞蜡块最容易获得,其处理方式等同于福尔马林固定石蜡包埋(FFPE)组织学标本,其免疫染色方案得到优化(图12-1A和B)。细胞蜡块和组织学标本之间的IHC结果具有高度一致性。然而,预固定方法和制备方案尚无国际标准,仍然是细胞蜡块的主要问题。目前使用的细胞蜡块制备方法超过10种,美国最常见方法包括:血浆凝血酶、组织凝胶(Thermo)、细胞自动细胞蜡块系统(Cellient Hologic)以及这些方法的改良。几乎所有的制备方法都分享了固定颗粒的最后一步:10%中性缓冲福尔马林固定并制备成FFPE蜡块。细胞标本的固定方式五花八门:10%缓冲福尔马林,在福尔马林固定前用乙醇或甲醇溶液预固定,甚至单纯用95%乙醇固定。
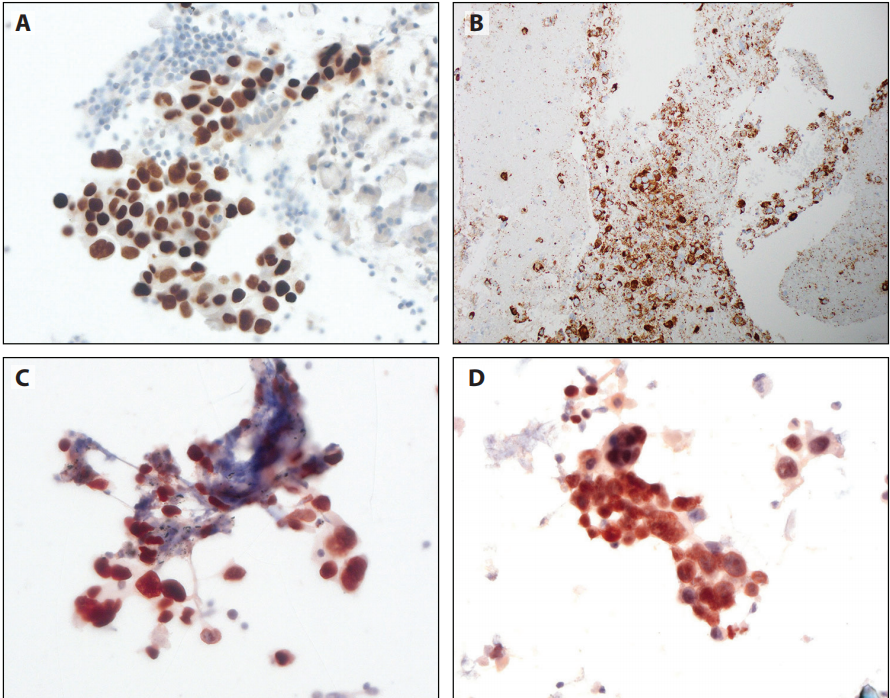
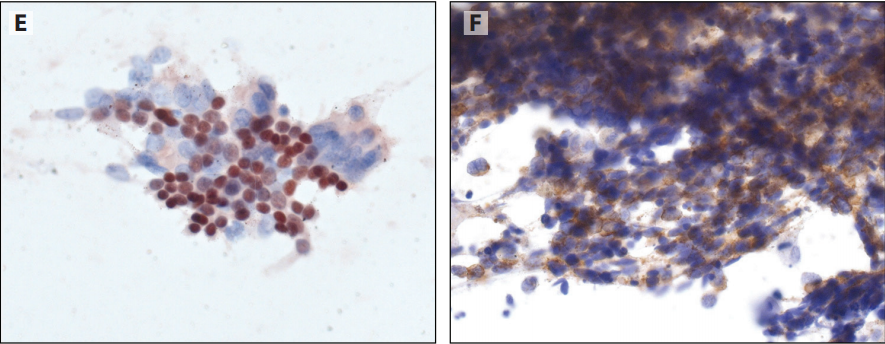
图12-1 A:NSCC细胞蜡块呈TTF1阳性,内镜超声引导(EBUS)经支气管针穿刺(TBNA),DAB显色。B:NSCC细胞蜡块呈Napsin A阳性, EBUS-TBNA,DAB显色。(C-F)乙醇固定和巴氏染色的涂片上进行IHC,3-氨基-9-乙基咔唑(AEC)显色。C:NSCC涂片呈TTF1阳性,EBUS-TBNA。D:鳞癌涂片呈p40阳性,刷取细胞学。E:纤毛呼吸细胞下方的p40阳性良性基底细胞。F:小细胞癌呈CD56阳性,膜染色为主,TBNA。
以前一项调查认为,多种运输介质、预固定剂和细胞蜡块制备方法似乎不会导致免疫染色的系统性问题,但最近发现了细胞蜡块的分析前因素相关的特定挑战,特别是乙醇或甲醇预固定。用CytoLyt固定剂,TTF1的表达缺失或接近缺失外。细胞蜡块系统(Cellient)上测试的抗体,30种抗体中近一半(43%)不能在BenchMark XT自动IHC/ISH染色仪器上验证。此外,在评估诊断性IHC时,了解抗体克隆号和预固定条件的影响可以防止出现重大问题。图12-2强调了基于酒精的固定对常用的Ki-67克隆号的影响。
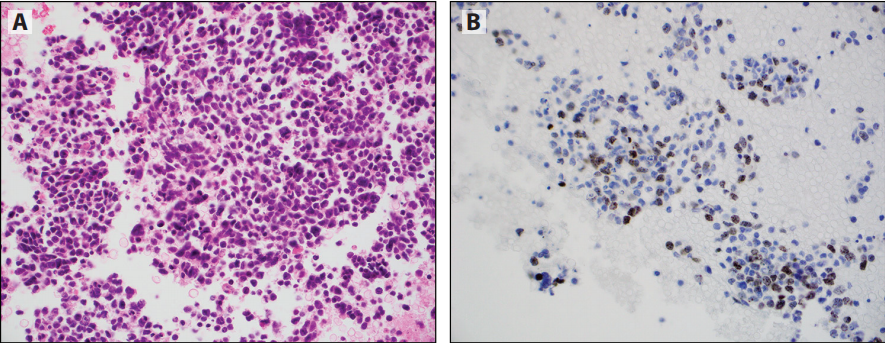
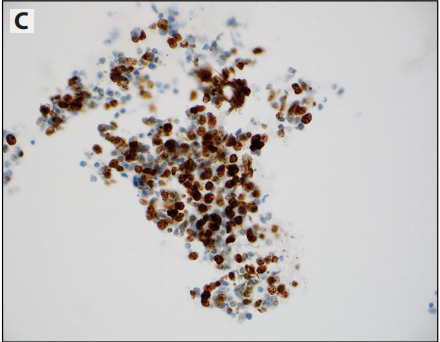
图12-2 NE肿瘤细胞蜡块,CgA和Syn呈阳性。B:乙醇固定,Ki-67(克隆号MIB-1)染色呈低阳性,提示低级别类癌。C:福尔马林固定,Ki-67(克隆号309)染色,阳性细胞>50%,提示高级别NE肿瘤。
尽管FFPE细胞蜡块已经成为IHC分析的主要细胞学制备类型,但它们有一些限制。细胞蜡块制备比非细胞蜡块更耗时、更昂贵,技术更难,而且它们并非在每个患者和所有实验室都统一可用。
非细胞蜡块标本
非细胞蜡块细胞学标本包括多种制备方法,包括风干和酒精固定涂片、细胞离心(Cytospin)、ThinPrep(Hologic)或SurePath (Becton)液基制备方法。大量的分析前因素和制备方法使非细胞蜡块标本的免疫染色标准化比细胞蜡块更难。非细胞蜡块最广泛使用的固定剂包括:基于乙醇的Saccomanno(50%乙醇和2%聚乙二醇)、Delaunay(等量的乙醇和丙酮混合05的ML1M三氯乙酸)和商业喷雾固定剂,而基于甲醇的CytoLyt或PreservCyt溶液(后者被优化用于液基制片)(Hologic)用作防腐剂和运输介质。基于乙醇的CytoRich Red收集液(Thermo)也含有福尔马林。所有这些固定剂和运输介质都可能存在免疫染色问题,一些抗体经常获得与组织学不一致的结果。
然而,英国国家外部质量评估服务(UK NEQAS)发现,几乎所有非福尔马林固定剂与单用福尔马林获得了相似的免疫染色质量。因此,实验室可以使用适合自己的固定剂,唯一警告是需要严格重新验证其IHC程序。事实上,有充分的证据表明,通过对分析因素进行适当的改进,非细胞蜡块可以获得相当于FFPE组织或细胞蜡块切片上的IHC。例如,使用诊断性巴氏染色涂片(图12-1C-F)。
之前的巴氏染色,不会干扰免疫染色反应,可以筛选合适的涂片用于免疫染色,并标记特殊兴趣的区域。风干直接涂片和离心标本获得的一些结果并不一致,有的报道完全缺乏染色,而其他报道用福尔马林和/或甲醛/或酒精/甲醇丙酮后固定并成功染色。巴氏染色通常在内源性过氧化物酶阻断和/或抗原修复之前即已褪色。
答:所有细胞学制备,包括细胞蜡块、乙醇固定和风干玻片,原则上都可以用于免疫染色。福尔马林固定、制备细胞蜡块是最简单和最常用的。免疫染色细胞学标本中需要严格的流程优化、验证和质量控制,特别是在非细胞蜡块。
在肺癌细胞学标本中,预测性IHC生物标记物检测有多可靠?
临床实践中越来越多地使用细胞学标本检测IHC 预后标记物,如PD-L1、ALK,等。如上文所述,分析前因素是细胞学标本标准化IHC细胞学的主要挑战。
PD-L1
细胞蜡块检测PD-Ll已成为常见的诊断实践,为组织学特性开发的检测方法和方案,同样适用于细胞蜡块(图12-3)。已证实其高成功率并与组织学结果高度一致。相反,非细胞蜡块的研究数据只是刚刚出现,但也表明是成功的。非细胞蜡块标本,膜染色不太清楚,就像胞质染色(图12-4)。
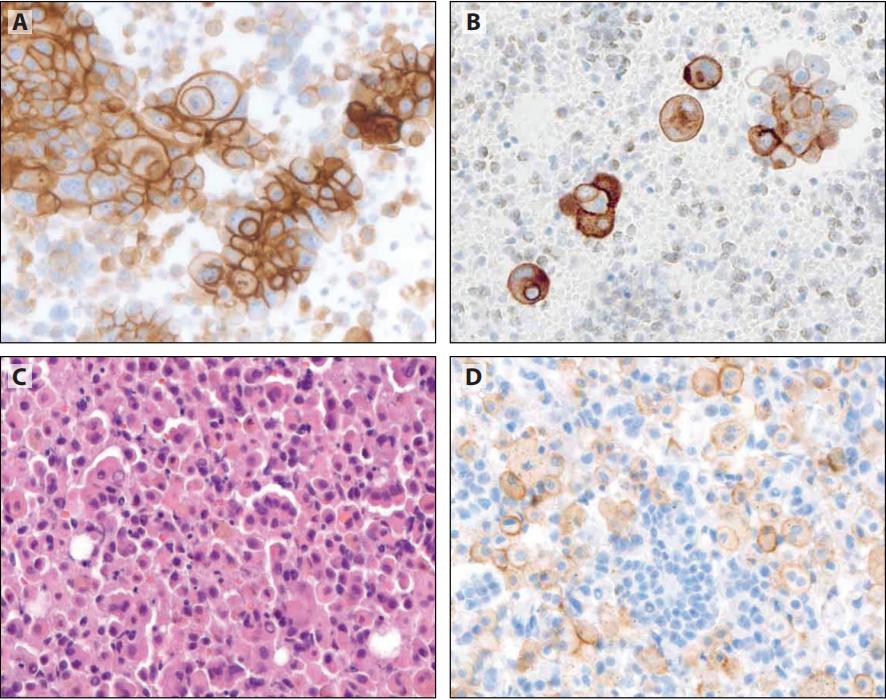
图12-3 NSCC细胞蜡块检测PD-L1(SP263)。一例恶性胸水中,所有肿瘤细胞(A)或大多数肿瘤细胞(B)呈明显的膜阳性。另一例肺腺癌FNA(C),腺癌细胞呈PD-L1阴性,背景中组织细胞大部分呈弱阳性(D)。
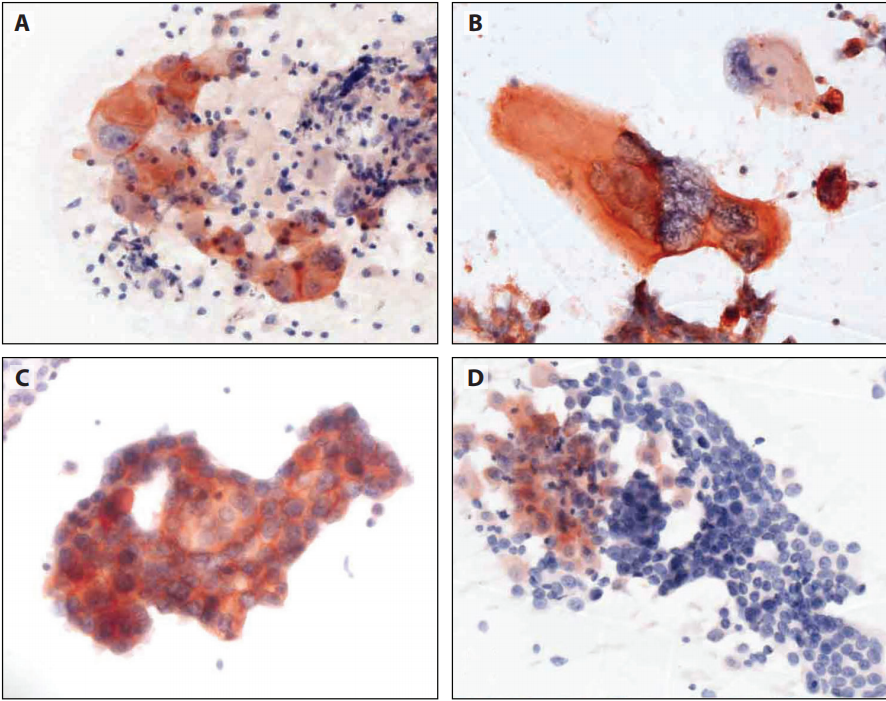
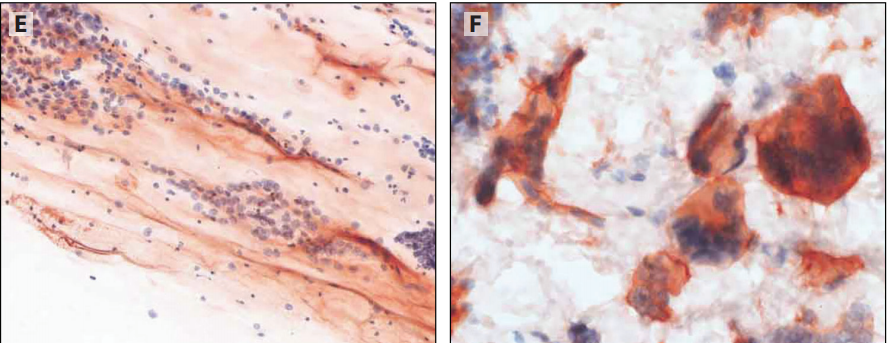
图12-4 乙醇固定和巴氏染色的NSCC细胞学标本,实验室自研系统(LDT)检测PD-L1。A:PD-L1(SP263)。B:PD-L1(SP142)。C:肿瘤细胞呈胞质样染色且局灶膜染色增强(Lica73-10)。D:巨噬细胞作为阳性内对照。E:粘液和肿瘤细胞的非特异性弱染色判读为PD-L1阴性。F:胎盘滋养细胞作为阳性外对照。
ALK、ROS1和pan-TRKIHC
组织学标本上IHC检测ALK或ROS1的过表达是一种成熟方法,用于筛选NSCC的后续FISH或进一步评估不确定的FISH结果(详见第19章)。与组织学标本一样,ALK IHC同样适用于细胞学标本(图12-5)。大多数研究使用了FFPE细胞蜡块,使用5A4或D5F3克隆号,没有修改IHC程序,在各种自动染色平台上检测。这些研究一致证明了100%敏感性,但有不同的特异性(83%~100%)。乙醇固定非细胞蜡块也有研究,结果不一致。
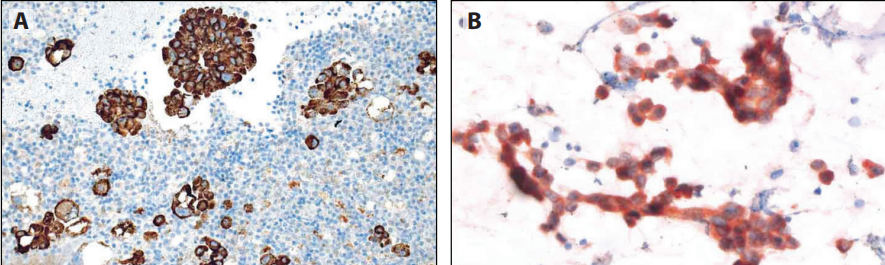
图12-5 肺腺癌,ALK重排。实验室自研IHC,5A4抗体。A:恶性胸水细胞蜡块。B:以前乙醇固定巴氏染色涂片,TBNA标本。
ROS1 IHC也适用细胞学标本(图12-6),阳性结果需要FISH或二代测序的证实。
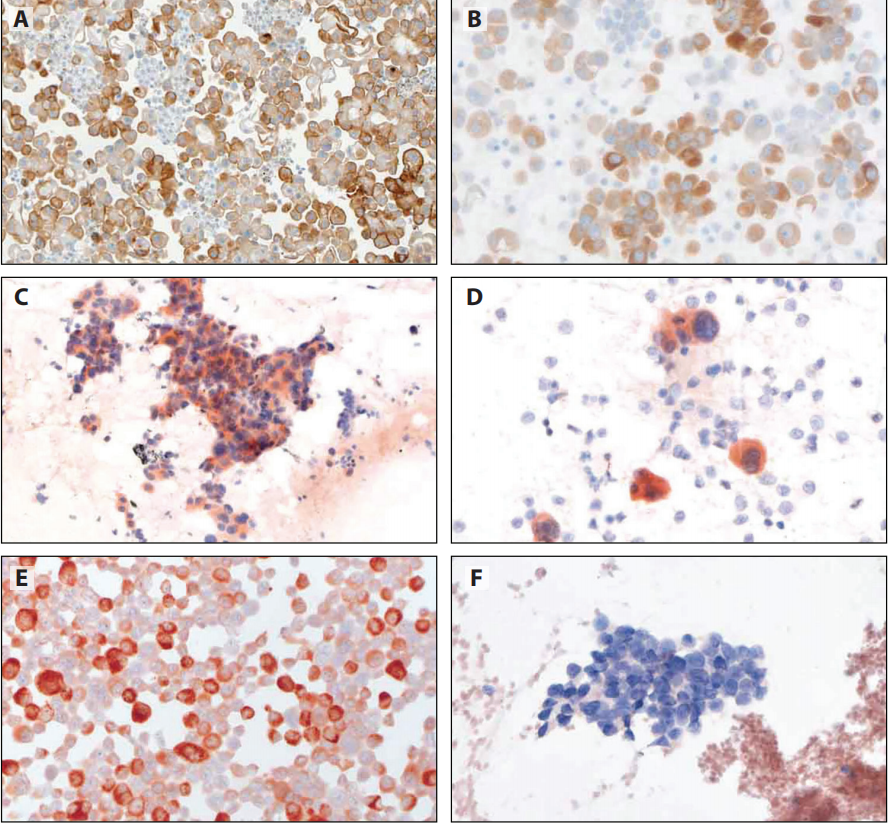
图12-6 ROS1 IHC。A-B:细胞蜡块(Optiview DAB IHC检测试剂盒,BenchMark ULTRA)。C-F:之前乙醇固定的巴氏染色涂片(D4D6抗体,Leica Bond)。
NTRK1-3重排用于筛选适用NTRK抑制剂治疗的患者,组织学标本中已证明其敏感性和特异性。可以预见,pan-TRK也将用于细胞学标本,但尚无研究数据(图12-7)。
答:细胞学标本可用于预测性PD-L1、ALK和ROS1 IHC,细胞蜡块是目前推荐的制备方法。非细胞蜡块很有前景,但需要进一步证实。
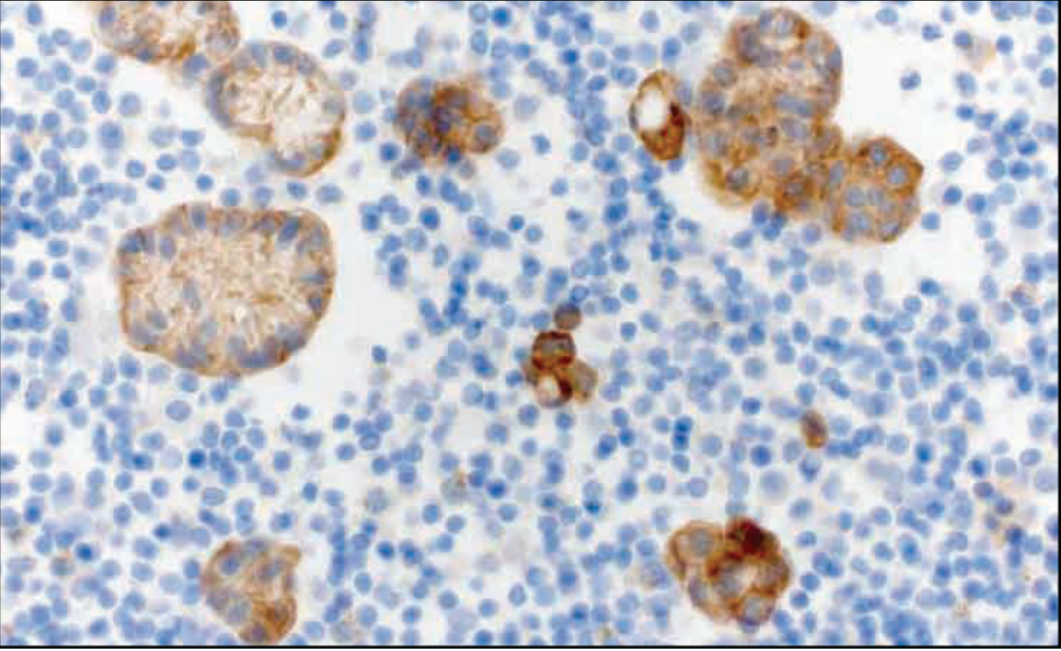
图12-7 已证实CLIP1-NTRK1基因融合的肺腺癌,细胞学标本使用Abcam pan-TRK抗体EPR17341获得阳性结果。
结论
毫无疑问,细胞标本作为有用的、不可或缺的资源,有助于肺癌的诊断性和预测性检测,包括IHC。FFPE细胞蜡块是首选和最常用的方法,有经验的实验室也使用非细胞蜡块。
往期回顾:
国际肺癌研究协会免疫组化诊断图谱(IASLC ATLAS of DIAGNOSTIC IMMUNOHISTOCHEMISTRY 2020.9)
国际肺癌研究协会免疫组化诊断图谱——5小活检
国际肺癌研究协会免疫组化诊断图谱——6肺癌切除大标本
国际肺癌研究协会免疫组化诊断图谱——7甲状腺转录因子-1
国际肺癌研究协会免疫组化诊断图谱——8.p40和p63
国际肺癌研究协会免疫组化诊断图谱——9细胞角蛋白标记物
国际肺癌研究协会免疫组化诊断图谱——10神经内分泌标记物
国际肺癌研究协会免疫组化诊断图谱——11增殖标记物























共0条评论