介绍
在大约60%的活检和80的%切除标本中,定义性形态学模式和特征足以诊断大多数类型的非小细胞癌(NSCC)。腺癌模式包括贴壁、腺泡、乳头状、微乳头状、筛状结构和/或粘液产生,如印戒样形态。鳞癌模式包括角化、角化珠和细胞间桥。缺乏这些特征和粘液染色阴性的情况下,应当使用IHC染色进一步分型。2015年WHO分类建议,根据IHC表达谱对未分化肿瘤分型。在小活检和细胞学标本中,用于诊断或预测标记物检测的染色数量应保持在最低限度,以保存尽可能多的组织用于分子分析(如第5章所述),切除标本也限于精确分类所需的最低限度。
在日常实践中,鉴别腺癌和鳞癌的最佳标记物组合是什么?
在切除标本中,没有NE形态的形态学未分化的非小细胞癌(图6-1A和B),最有用和最常用的足以鉴别腺癌和鳞癌的组合包括由TTF1(克隆号8G7G3/1)和p40。至于排除转移性疾病的问题,TTF1表达是肺腺癌的特征,而不是其他主要类型的非鳞癌(图6-1C和D)。TTF1是一种核标记物,非粘液性原发性肺腺癌表达率为75%到80%以上,取决于克隆号。与克隆号SPT24相比,克隆号8G7G3/1具有较高的特异性和较低的敏感性。局灶TTF1(克隆号8G7G3/1)阳性,足以认为肿瘤呈TTF1阳性,并且可能呈弱阳性(详见第7章)。p40(△Np63)是鳞状分化的核标记物。TTF1阳性肿瘤可以观察到p40局灶或弱阳性;这些病例仍应归入腺癌。
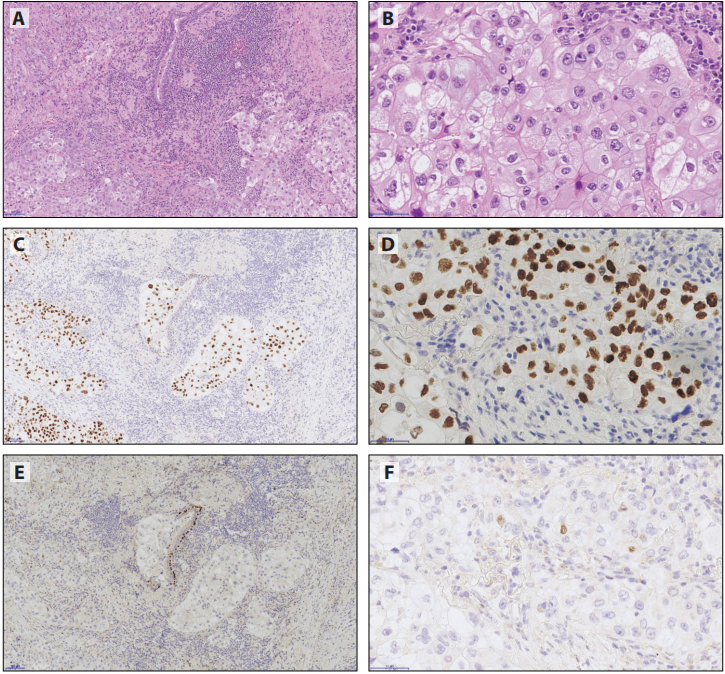
图6-1使用TTF1和p40分类肺癌切除标本中的低分化癌。这例实性腺癌呈TTF1阳性和p40阴性。TTF1阳性肿瘤中p40弱染色不提示腺鳞癌组织学。A和B:HE,C和D:TTF1,E和F:p40。
在FFT1阴性原发性肺肿瘤病例中,Napsin A可能有助于诊断腺癌,因为持续报道鳞癌呈Napsin A阴性。Napsin A(单克隆)显示颗粒状、细胞质染色模式(图6-2)。它表达于II型肺细胞、肺泡巨噬细胞、肾小管、外分泌腺和胰管。单抗优于多克隆抗体(太敏感)。但如果TTF1阳性则不推荐Napsin A,因为大多数肺腺癌共同表达TTF1和Napsin A。
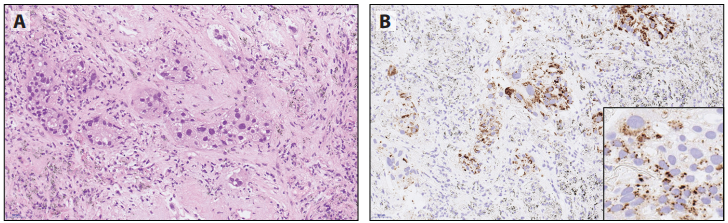
图6-2 Napsin A可能是将TTF1阴性原发性肺肿瘤病例诊断为腺癌的有价值的标记物。Napsin A(单克隆)显示颗粒状、细胞质染色模式。A:HE,B:Napsin A。
对于形态学未分化的非小细胞癌,在相同的肿瘤细胞中共同表达TTF1和p40的情况下,即使TTF1呈弱阳性也足以将肿瘤划分为腺癌。
鳞癌中超过50%的肿瘤细胞强表达p40且必须是TTF1阴性(图6-3)p63与p40的敏感性相似,但特异性较差,如有p40则不用p63。CK5/6也可作为鳞状细胞分化的附加标志物,但单独使用CK5/6时不能区分腺癌和鳞癌。

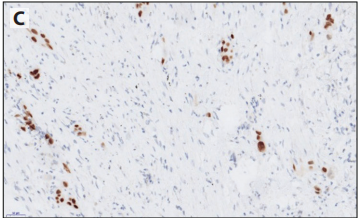
图6-3高度侵袭性、形态学未分化的肿瘤。无角化(A)或TTF1阴性(B)且p40强阳性(C),则可分类为鳞癌。
棘层松解性鳞癌可能与腺癌混淆,有时可能与上皮样血管肉瘤混淆。在这些病例中,TTF1和p40组合对于确认鳞癌非常有用(图6-4),如果两者都为阴性,则使用更多抗体组合。
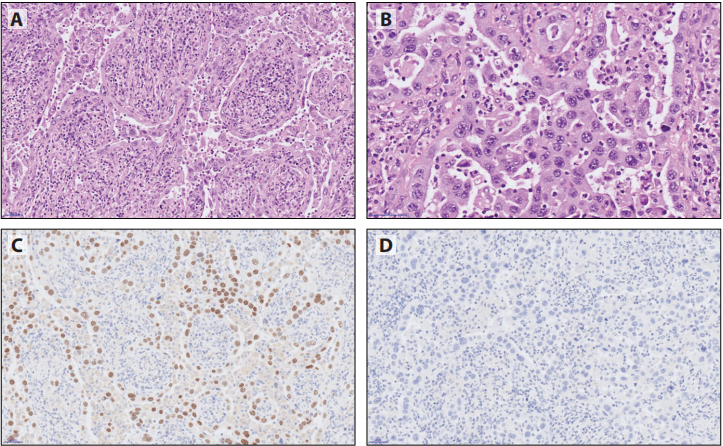
图6-4由于治疗结果,在不确定病例中应用IHC验证非小细胞癌(NSCC)亚型时,应该接受低阈值。(A和B)该肿瘤呈棘层松解模式,像是腺癌,然而p40强阳性(C)而TTF1阴性(D),证实为鳞癌。
由于特异性低,CK7阳性不能用于区分腺癌和鳞状分化(图6-5)。虽然肺腺癌中CK7阳性率高达91%~100%,但鳞癌也可CK7弥漫强阳性(5%~7%的病例)。第9章深入讨论CK的使用。
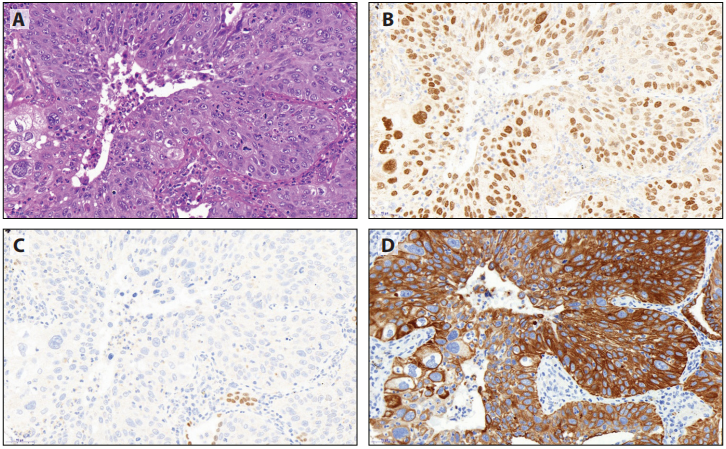
图6-5 非角化性鳞癌表达p40(B),不表达TTF1(C),均质性强表达CK7(D)。加做其他免疫组化并结合病史排除了尿路上皮癌的转移。
呈p40强表达或角化、证实鳞状分化的原发性肺癌并非都是鳞癌。有些p40强表达、形态学未分化的肿瘤可能代表睾丸核蛋白(NUT)相关癌。在切除标本中可能仅有典型的局灶角化(图6-6)(见第14章)。肺内胸腺瘤也可呈p40弥漫强阳性。
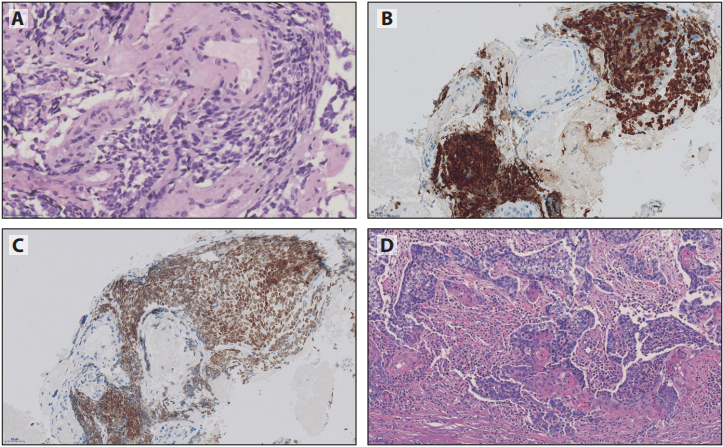
图6-6 NUT癌中定义为NUT基因重排,可用单克隆NUT抗体检测,呈斑点状核阳性,角化可能只是局灶性的。B:p40。C:NUT。
在形态学未分化肿瘤中,局灶性(少于10%的肿瘤细胞)或弱表达p40不应判读为鳞状分化。这种病例应归入IHC特征不确定的大细胞癌,而不是非角化性鳞癌。
答:在日常实践中,对于没有定义性形态学特征或NE形态学的大多数非小细胞癌,TTF1和p40足以用于分型。当怀疑转移或罕见变异型时,可以增加抗体组合。
免疫标记物在腺鳞癌诊断中的作用是什么?
腺鳞癌的诊断,需要切除标本中每种成分至少占10%。阳性如组织形态学学诊断的腺癌和鳞癌,不需要IHC确认腺鳞癌的不同成分,只要由形态学明确的鳞癌和腺癌成分组成即可。当其中一种或两种成分都是低分化,则需要IHC来支持诊断,以显示二种清晰描述的成分,分别呈TTF1和p40阳性(图6-7)。在相同肿瘤细胞中TTF1和p40共表达时,归类为腺癌。
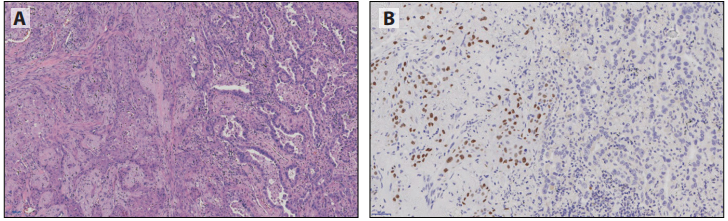
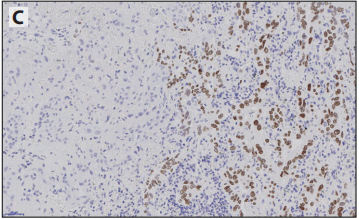
图6-72个肿瘤成分被明确划分,左侧为p40表达/TTF1阴性的鳞癌成分,右侧为×20为p40阴性/TTF1表达的腺癌成分;A: HE、B: p40和C: TTF1。
答:TTF1的IHC1和p40可以帮助腺鳞癌的诊断时,他们突出吗2不同的肿瘤细胞群。
IHC在肉瘤样癌中的作用是什么?
多形性癌的诊断需要识别腺癌、鳞癌或大细胞癌伴梭形细胞癌或巨细胞癌(图6-8A和C)。在此情况下,使用TTF1和p40可能有助于显示癌成分。梭形细胞癌或巨细胞癌成分通常只显示CK阳性,这可能在纯梭形细胞癌或纯巨细胞癌的分类中有用(图6-8B和D)。在这些肿瘤的肉瘤样成分中,锌指E盒结合蛋白1(ZEB1)呈核阳性已有报道,但其在诊断中的作用仍不确定(图6-8E)。在某些病例中,可能需要多种CK而不是单一CK来确认肿瘤的上皮来源。
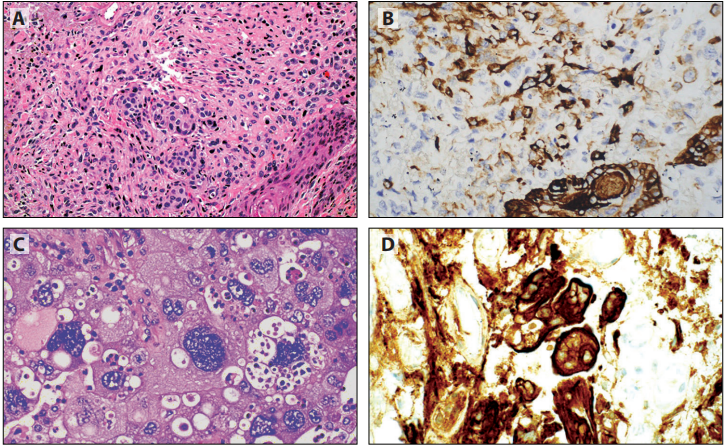

图6-8肉瘤样癌IHC。A:多形性癌显示CK阳性的鳞状细胞成分(B)和梭形细胞成分。C:巨细胞癌由CK阳性证实(D)。尽管诊断用途尚不确定,但ZEB1 IHC显示多形性癌的肉瘤样成分呈核阳性(E)。
母细胞瘤的诊断需要胎儿型腺癌和肉瘤样成分的组合,后者通常是恶性的软骨或骨骼肌的异源性成分。因为这是αβ-catenin突变的肿瘤,它显示β-catenin核阳性,正如胎儿型腺癌(见图13-5)。
癌肉瘤的诊断包括癌和异源性肉瘤样成分的组合。在这种情况下,IHC的使用可能仅限于识别或确认异源性成分,如 myogenin或MYOD1确认横纹肌肉瘤成分。
答:CK的阳性有助于支持多形性癌中的恶性梭形细胞癌或巨细胞癌模式。罕见亚型中IHC可以证实异源性成分,或在母细胞瘤中证实胎儿腺癌成分。
IHC在大细胞癌诊断中的作用是什么?
如2015年WHO分类所定义,大细胞癌是一种未分化的非小细胞癌,没有形态学特征(图6-9A)或IHC特征,允许进一步区分亚型。因此,大细胞癌是一种排除性诊断,因此可能只在切除时考虑。除了免疫染色阴性外,粘液染色也要阴性才能进一步排除实体性腺癌。

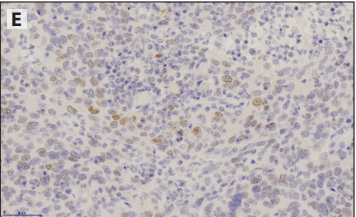
图6-9大细胞癌。A:形态学未分化非小细胞癌。TTF1(B)、Napsin A(B)、p40(D)和p63(E)均为阴性。
在大细胞癌中TTF1和p40必须为阴性。TTF1可能只突出显示先前存在的肺泡壁内的肺细胞(图6-9B)。Napsin A也应阴性(图6-9C),p40显示细支气管基底细胞(如有)可作为阳性内对照(图6-9D)。大细胞癌或腺癌可见淡染和局灶性p63阳性,没有特异性(图6-9E)。特别是不足分型为鳞癌。
该诊断需要切除标本,通过检查HE染色切片,在检查肿瘤的所有切片后,确定可能显示腺癌或鳞癌的最佳蜡块。
如果实体肿瘤对TTF1和p40均为阴性,应加做IHC染色以确认肿瘤是癌(CK染色),而不是黑色素瘤、淋巴瘤或肉瘤,并应根据临床背景和形态学特征来排除转移(见第16章)。
此外,根据组织学特征,非特指(NOS)/大细胞癌可以考虑用SMARCA4染色。SMARCA4-缺陷的肺腺癌显示TTF1阴性(80%病例)。然而,不要与SMARCA4缺陷的胸部肿瘤相混淆(见第15章)。
答:粘液卡红阴性且无TTF1、Napsin A或p40染色的未分化癌,在考虑SMARCA4缺陷癌后,可以诊断为大细胞癌。
结论
在日常实践中,对于缺乏定义性形态学特征或NE形态学的大多数非小细胞癌,TTF1和p40组合足以用于分型。如果怀疑转移或更罕见的变异型,可以增加抗体组合。
往期回顾:
国际肺癌研究协会免疫组化诊断图谱(IASLC ATLAS of DIAGNOSTIC IMMUNOHISTOCHEMISTRY 2020.9)
国际肺癌研究协会免疫组化诊断图谱——5小活检


























共0条评论