介绍
据估计,70%的原发性肺癌是使用小活检和/或细胞学标本进行诊断和分期的。在肺部获取肿瘤组织的技术方法包括经胸穿刺活检和/或细针抽吸(FNA)、支气管内或经支气管活检和/或FNA,以及在恶性渗出的情况下的胸水抽吸。细胞学标本的特殊原则详见第12章。
上述小活检来自微创手术,与手术活检相比,微创手术降低了患者的不适感和风险。然而,小活检对最佳诊断和后续生物标志物检测提出了一些潜在的挑战。首先,因体积小,可能导致诊断时可用于评估的肿瘤细胞数量不足,以及后续分子检测时核酸数量不足。其次,肺原发部位活检可能被良性细胞严重污染,如正常肺实质、支气管上皮或胸膜组织,这对诊断和分子检测灵敏度都有影响。第三,小活检通常会受到挤压假象和组织变形的影响,这是获得组织过程的固有缺陷。最后,这些标本只占整个肿瘤的一小部分,可能无法体现肿瘤异质性的程度。
本章重点介绍小活检处理的方法,重点介绍IHC(IHC)在诊断和治疗预测中的作用,以及在实践中优化IHC。
应该在所有的小活检中都进行IHC吗?
分子检测的本质是选择晚期非小细胞癌(NSCC)患者进行靶向治疗,病理学家必须认识到保存肿瘤组织进行生物标志物检测的必要性,同时仍能产生最准确和最特异的诊断。2011年最初提出的诊断策略已成为当前命名的基础,并强调在疑似NSCC患者中明智使用IHC(图5-1)。
答:简言之,病理学家的形态学印象应该推动最初的诊断方法:如果活检显示明确的鳞癌(即,角化)或腺癌(即,腺体形成)的形态学分化,则鼓励病理学家做出相应的诊断,不必应用证实性IHC。当然,这是假设临床背景支持原发性癌的诊断,并且在适当的时候考虑了潜在的假冒疾病(转移性疾病、间皮瘤)。
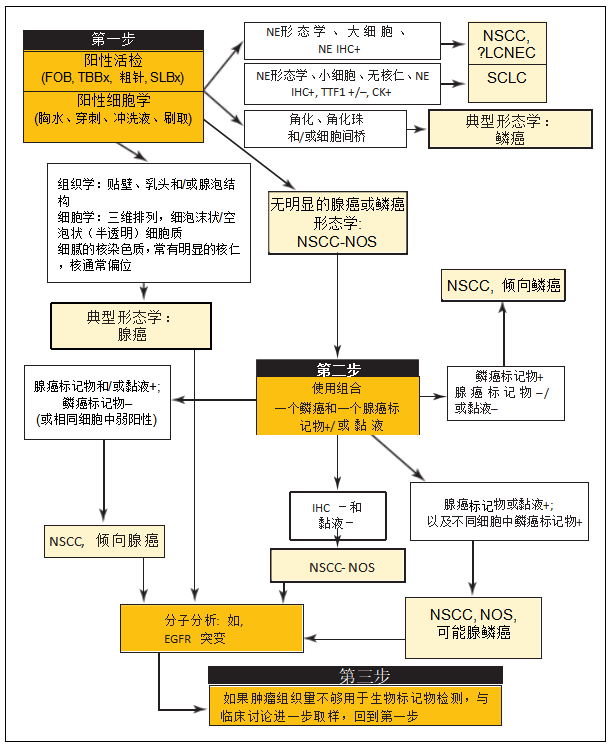
图5-1癌症小活检和/或细胞学样本的诊断流程。
具有腺癌或鳞癌经典形态的样本不必进行IHC。如有神经内分泌(NE)形态学,可根据标准进行分类。对于没有明确腺癌、鳞癌或NE形态学的病例,应进行IHC。
FOB=柔性纤维支气管镜检查;LCNEC=大细胞神经内分泌癌;NSCC=非小细胞癌;SCLC=小细胞肺癌;SLBx=手术肺活检;TBBx=经支气管活检。
什么时候应该做IHC来对NSCC进行分类?
小活检中的低分化癌(没有腺癌或鳞癌的形态学证据)很难做出可靠的形态学诊断。在这种情况下,至少假设形态学能排除小细胞癌,病理学家只好诊断为NSCC,非特指(NOS)。此时,应该利用IHC来澄清它更可能代表腺癌或鳞癌(或其他),IHC显著降低NSCC-NOS诊断频率,临床医师更有信心地选择治疗性和/或预测性生物标志物测试。
答:低分化癌(通常为实体生长模式)应进行IHC。这种模式可见于腺癌和非角化性鳞癌。
分类NSCC最佳一线标记物是什么?
合理选择某些抗体和克隆号,详见本书其他章节。简言之,用于NSCC诊断的最佳一线IHC组合仅包括甲状腺转录因子-1(TTF1)和p40。表5-1提供了基于阳性程度的判读指南。形态未分化肿瘤进一步以IHC为特征的分类,如图5-2和图5-3。
答:将NSCC分为腺癌和鳞状细胞癌,p40和TTFl组合具有最佳的敏感性和特异性。
表5-1小活检或细胞学标本中非小细胞癌(NSCC)诊断的初步IHC组合
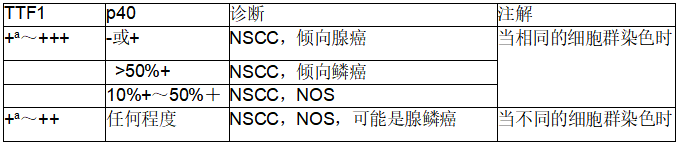
a局灶性肿瘤细胞染色
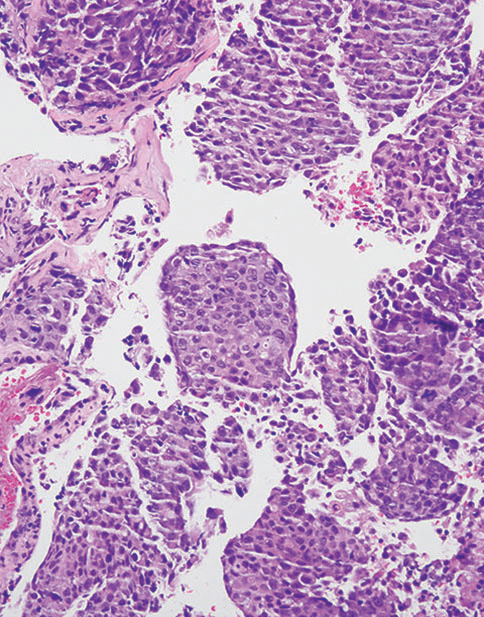
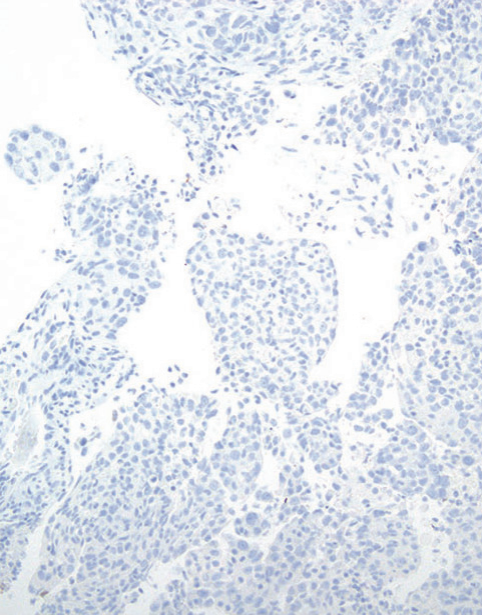
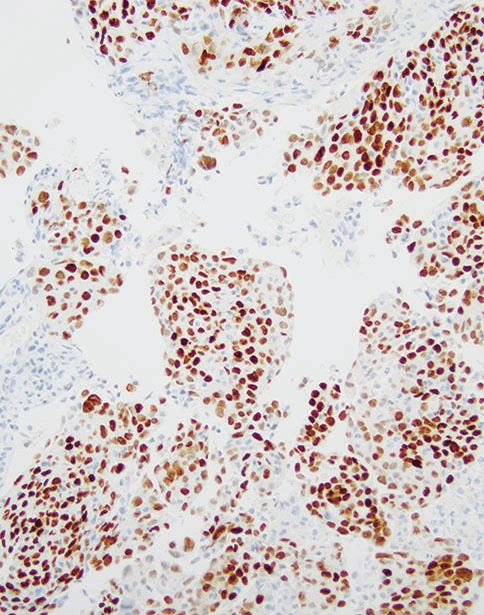
图5-2非小细胞癌(NSCC),倾向腺癌。(上)注意低分化癌呈实体生长模式,在常规HE切片中没有腺、鳞或NE分化的形态学证据。癌细胞呈p40阴性(中)和TTF1弥漫阳性(下)。
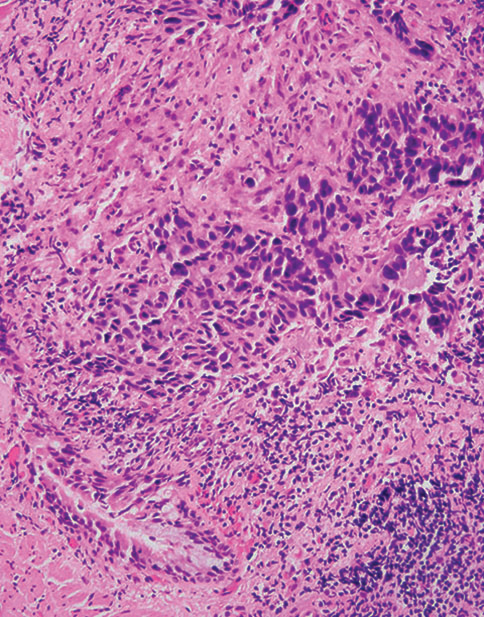
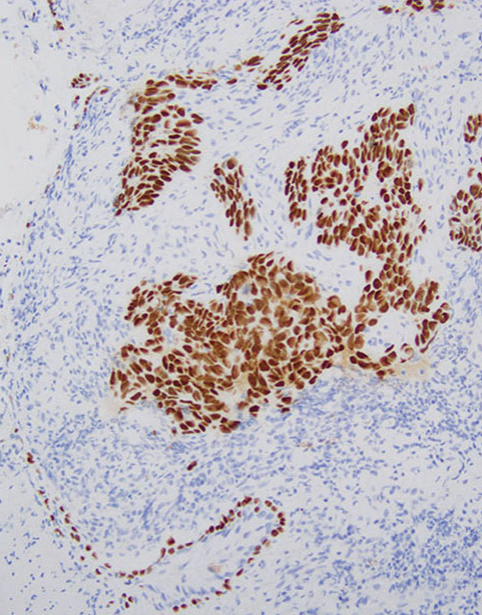
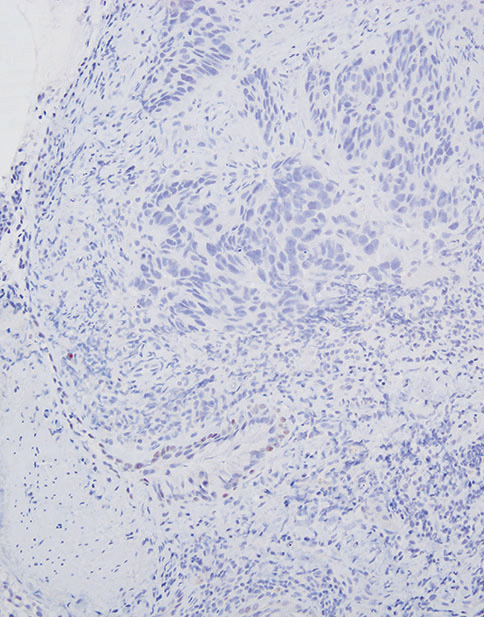
图5-3非小细胞癌(NSCC),倾向鳞癌。(上)注意低分化癌呈实体生长模式和广泛坏死。癌细胞呈p40弥漫性阳性(中)和TTF1阴性(下)。
还有哪些肿瘤标志物有助于NSCC的分类?
在腺癌的鉴定中Napsin A与TTF1的价值差不多。作为胞质标记物,Napsin A可与核染色的p40进行复染,因此IHC分析只需要单张切片。然而,由于napsin A染色难以判读,通常不建议一线使用。如果TTF1和p40染色没有结果或模棱两可,则包括napsin A和CK5/6在内的有限的二线IHC标记物可能偶尔会提示诊断。细胞角蛋白7对肺腺癌和鳞状细胞癌的鉴别能力较差,不建议用于此目的。因为不能排除腺癌的诊断,应考虑对NSCC-NOS进行分子研究。对于未显示TTF1或p40染色的NSCC-NOS,应添加广谱角蛋白染色。
答:Napsin A和CK5/6可以改善某些NSCC-NOS的分类。如果是TTF1、p40、CK5/6和Napsin A全阴性的低分化癌,则应添加广谱角蛋白。
NE肿瘤的最佳标志物是什么?
神经内分泌肿瘤,特别是类癌家族肿瘤和小细胞癌,通常起源于中央气道,适用于支气管内或经支气管活检方法。肿瘤细胞质脆,在取样过程中容易产生挤压伤。此外,小细胞癌、类癌、良性结构(如淋巴组织)和其他小圆蓝细胞肿瘤(基底样鳞癌、淋巴瘤、肉瘤)的形态可有显著重叠。因此,需要鉴别这些情况时,IHC对自信的诊断至关重要。详见本书后续章节,这里仅介绍一些基本考虑因素。
如果细胞类似淋巴细胞,并且怀疑支气管相关淋巴组织(BALT),只用CD45染色就能足以证实(图5-4)。BALT组织在成人肺中很常见,并且可能在气道分支点更明显。
CK染色可用于确认上皮性肿瘤的诊断;然而,小细胞癌可能偶尔阴性或只是非常局限的阳性。神经内分泌标志物染色,包括Syn、CgA、CD56和/或INSM1(胰岛素瘤相关蛋白1),可用于确认神经内分泌分化,但在高达10%的病例中为阴性(图5-5)。
类癌肿瘤缺乏小细胞癌特有的恶性特征(异型性、频繁核分裂象、成片坏死)。在有限且保存不良的样本上,Ki-67 IHC可能有助于证实类癌的低增殖指数,或小细胞癌的极高增殖指数(关于神经内分泌标志物,见第10章)。
在与其他原发性肺癌的区别中,小细胞癌在形态上可能类似于基底样鳞癌;p40阳性表达将支持后一诊断。
答:应添加一组神经内分泌标记物(Syn、CgA、CD56和/或INSM1)来确认神经内分泌表型。此外,增殖标记物有助于具有明显挤压假象的小活组织检查。广谱CK可以区分神经内分泌肿瘤和淋巴瘤。p40可以避免将基底样鳞癌误认为高级神经内分泌癌。
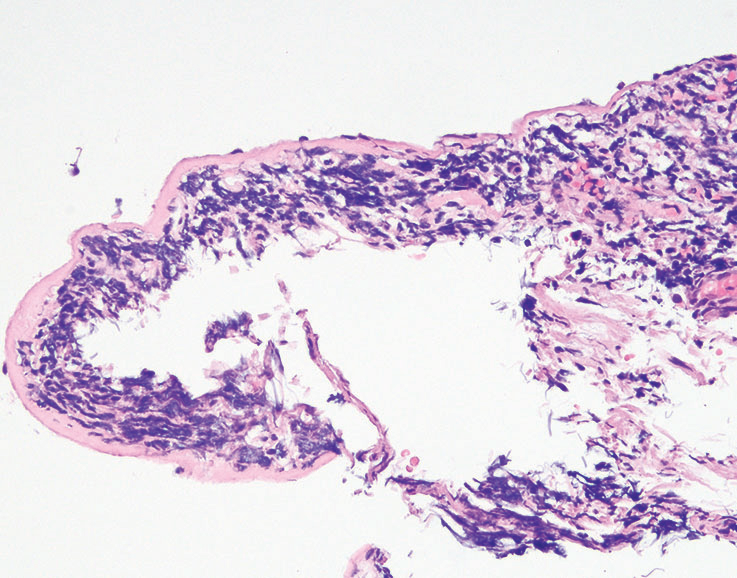
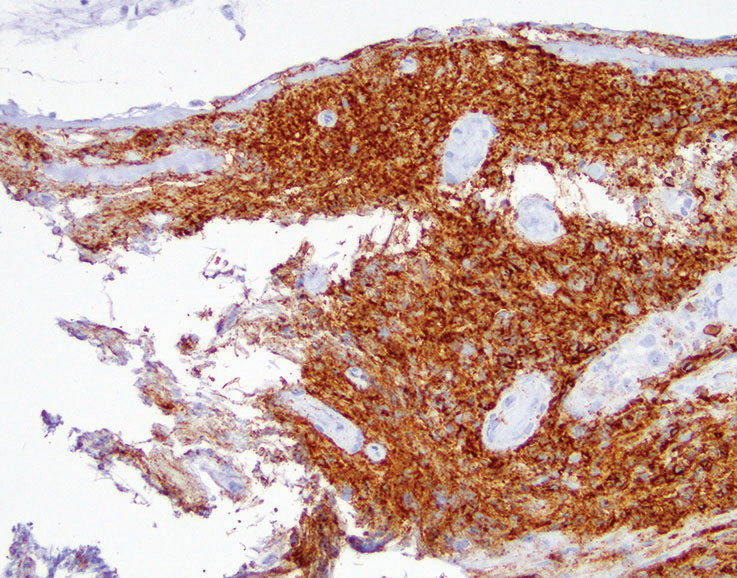 图5-4(上)在常规H&E切片上,小活检含有有挤压和剥脱的气道和保存不良的小蓝细胞。(下)CD45弥漫阳性证实了支气管相关淋巴组织(BALT)的形态学印象。
图5-4(上)在常规H&E切片上,小活检含有有挤压和剥脱的气道和保存不良的小蓝细胞。(下)CD45弥漫阳性证实了支气管相关淋巴组织(BALT)的形态学印象。
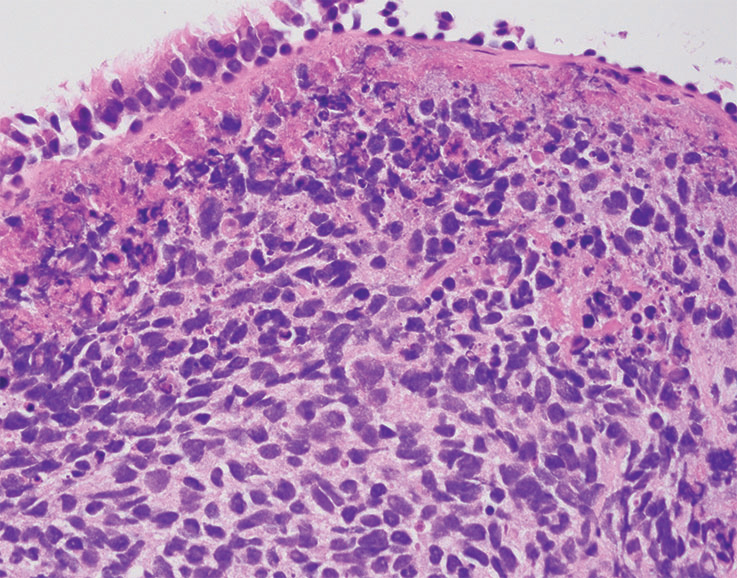
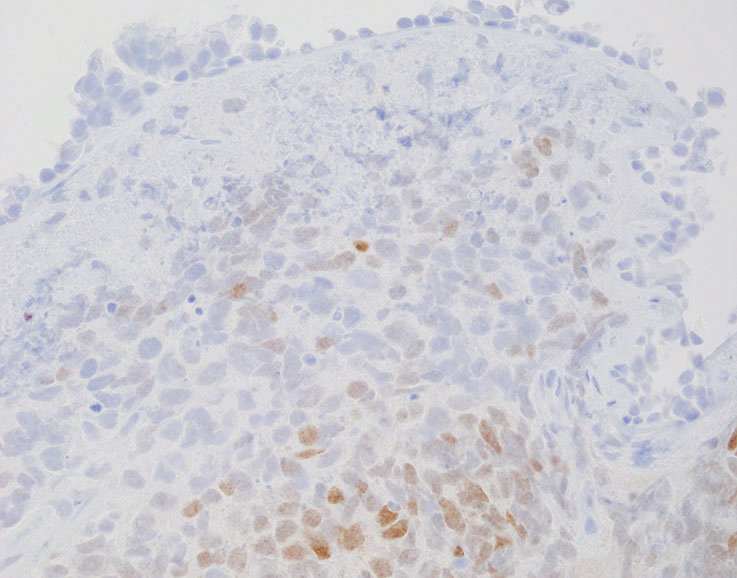 图5-5(上)HE切片上,支气管内活检含有小细胞癌。(下)胰岛素瘤相关蛋白1(INSM1)多灶阳性核染色。
图5-5(上)HE切片上,支气管内活检含有小细胞癌。(下)胰岛素瘤相关蛋白1(INSM1)多灶阳性核染色。
在小活检中,具有挑战性的诊断情形是什么?
与小活检相关的假象,包括细胞保存不良、挤压假象和扭曲,很可能混淆良性结构的解释,就像掩盖肿瘤细胞的形态学特征一样。在某些情况下,IHC可能有助于突出显示良性或恶性细胞群。在其他情况下,病理学家必须完全依靠形态学线索和背景。在支气管内活检中,区分保存不良的粘膜下腺体或反应性内皮和浸润性腺癌可能具有挑战性。TTF1染色突出显示浸润性腺癌,但当使用高特异性克隆(8G7G3/1)时,良性气道壁成分应为阴性(图5-6)。
相反,病理学家不应过度解读,将残留的或邻近的TTF1阳性反应性肺细胞误认为腺癌诊断的指标(图5-7)。在连续切片中仔细地交叉参考HE染色切片,确保对适当的细胞群进行免疫反应性评估。
答:小心地结合组织学和免疫组织化学染色,避免活检假象对后者的误判。
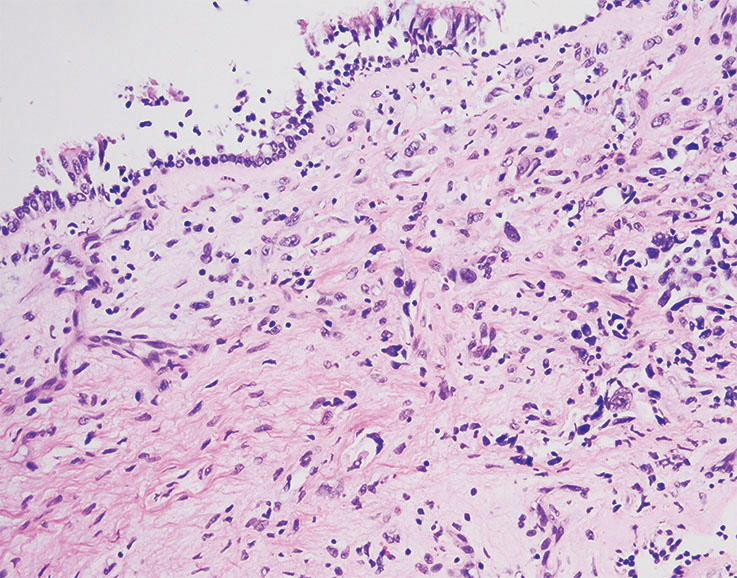
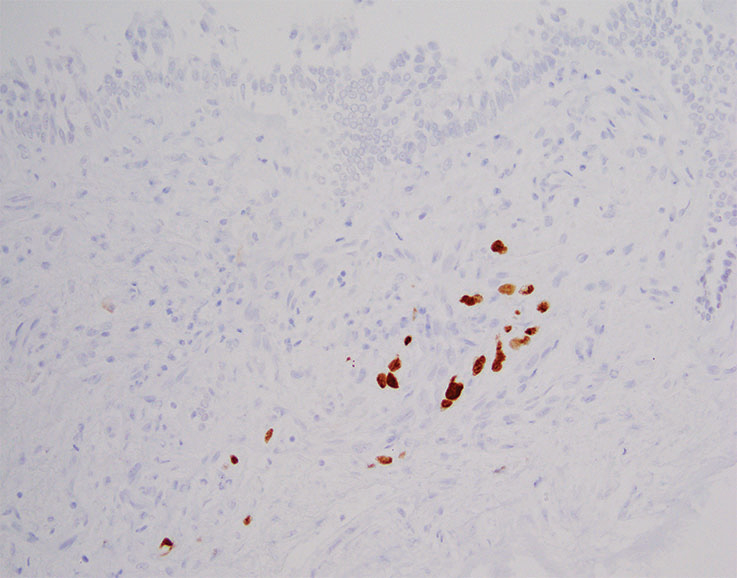
图5-6(上) 气道壁有极少数高度异型细胞,与慢性炎症混合;(下) TTF1染色突出显示了浸润性肿瘤细胞。
应该如何处理活检标本以优化预测性生物标志物检测结果?
分子检测的准确性在很大程度上取决于受试样本的质量。样本质量,例如蛋白质和核酸的保存和数量,既取决于肿瘤的固有属性(大小、浸润性质、炎症浸润程度、肿瘤坏死等),也取决于更可控的变量,如活检操作和病理实验室的样本处理。

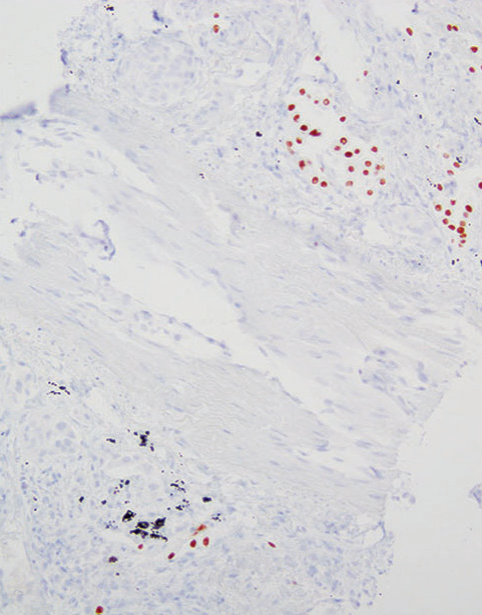
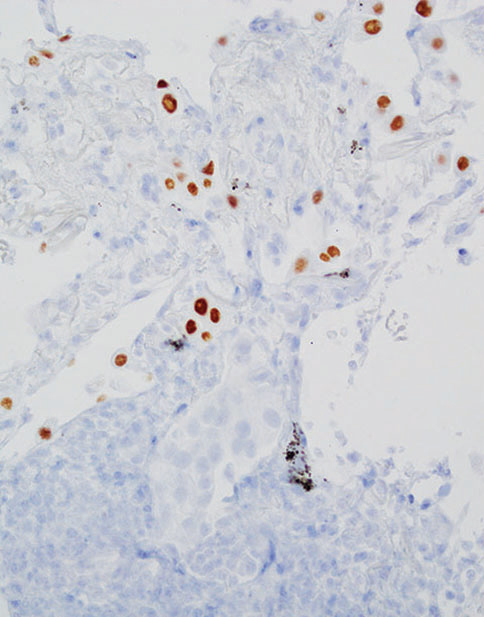
图5-7(上) 非小细胞肺癌NOS,广泛存在于淋巴管内(箭头);(中) TTF1)色突出显示了相邻的反应性肺细胞。(下) 注意淋巴管内的阴性细胞(箭头)。广谱CK染色突出显示了肿瘤细胞(未提供图片)。
在疑似非小细胞肺癌的检查中,病理学家应考虑后续预测性生物标志物测试的潜在需求,包括PD-L1 IHC、ALK、ROS1 FISH或IHC,以及EGFR和BRAF分子检测,以及一系列其他潜在的治疗靶点检测。因此,明智地使用诊断性IHC是至关重要的。实验室工作流程应适用于大量和多样性临床检测的小样本。
答:小活检在患者管理中起着至关重要的作用。因此,每个实验室都要建立详细的组织利用方案,用于预测标志物的管理。充分理解每种生物标志物的局限性、陷阱和检测要求,有助于建立有效的工作流程。
结论
免疫组织化学染色是对低分化癌进行分类的有力工具,尤其是在小活检标本,操作和采样产生的假象可能会影响诊断。
病理学家应采用推荐的免疫组化组合和检测流程,对预测性标志物进行分类和检测,以提高小活检的利用率,从而实现准确的诊断和预测性生物标志物的识别。
往期回顾:
国际肺癌研究协会免疫组化诊断图谱(IASLC ATLAS of DIAGNOSTIC IMMUNOHISTOCHEMISTRY 2020.9)





























共0条评论