[导读] 编译整理:张仁亚,王强
呈双相型特点的肿瘤
PTC伴韧带样纤维瘤病
伴纤维瘤病/筋膜炎样间质的甲状腺乳头状癌(PTC)目前被归为PTC伴韧带样纤维瘤病。这是一种双相型肿瘤,具体为富于细胞的甲状腺乳头状癌成分、混有伴良性间质的梭形细胞,后者类似结节性筋膜炎或韧带样纤维瘤病。该肿瘤中的间质成分免疫组化β-catenin细胞核阳性,胞质表达SMA,不表达CK和TTF1;如果细胞核β-catenin阳性不明确的病例,也可以通过SOX11细胞核阳性来做出诊断。该肿瘤要注意鉴别甲状腺间变性癌。
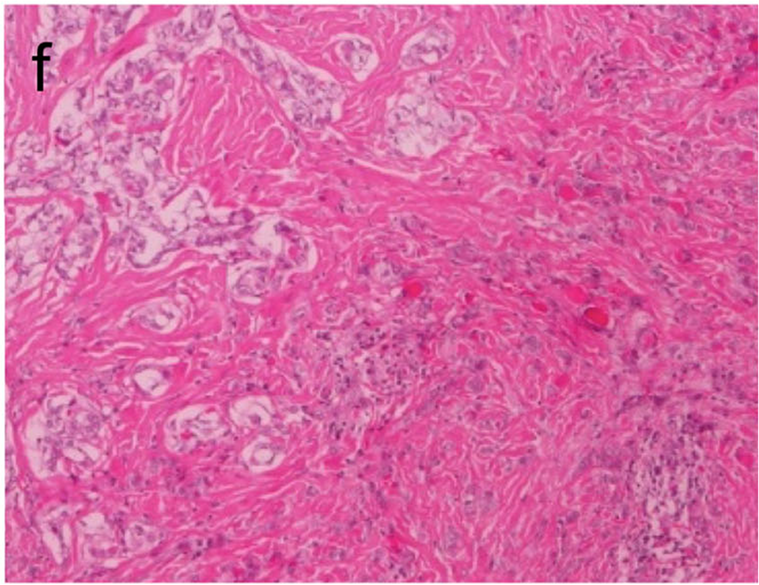 图29.甲状腺乳头状癌伴韧带样纤维瘤病,可见间质成分及甲状腺乳头状癌成分。
图29.甲状腺乳头状癌伴韧带样纤维瘤病,可见间质成分及甲状腺乳头状癌成分。
甲状腺癌伴Ewing家族肿瘤成分
甲状腺癌伴Ewing家族肿瘤成分(carcinoma of the thyroid with Ewing family tumor element,CEFTE)也被称为造釉细胞瘤(ademantinomatous)样Ewing肿瘤,是一种类似软组织Ewing肉瘤的甲状腺原发侵袭性肿瘤。该肿瘤一般较大,发生于年轻人,预后好。形态学方面,该肿瘤为小细胞构成,免疫组化p63、CD99和CK弥漫强阳性,TTF1、Tg、降钙素一般为阴性。
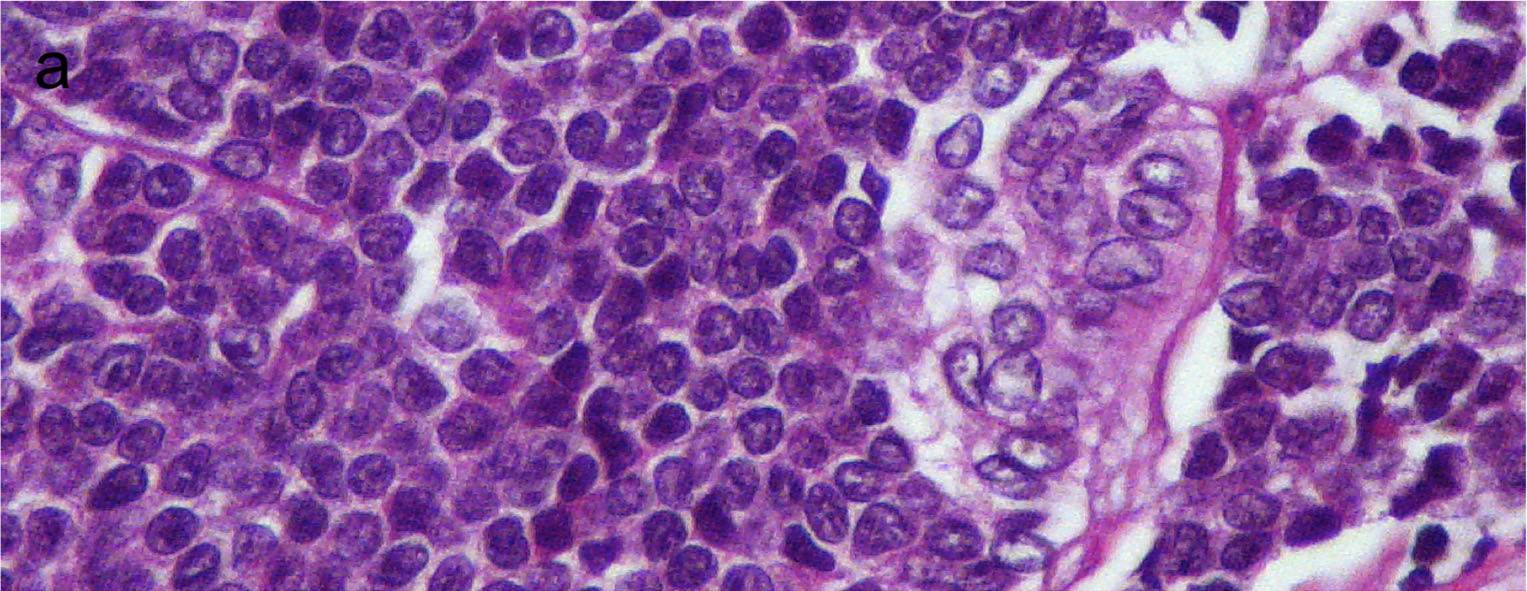 图30.甲状腺癌伴Ewing家族肿瘤成分。形态学为呈实性巢状的小细胞,细胞核圆形、不规则,局灶可见巢状的甲状腺乳头状癌。
图30.甲状腺癌伴Ewing家族肿瘤成分。形态学为呈实性巢状的小细胞,细胞核圆形、不规则,局灶可见巢状的甲状腺乳头状癌。
分子层面上,该肿瘤的致病性遗传学改变是EWSR1/FLI1重排,所有报道的CEFTE病例中都可以检出这一异常。甲状腺乳头状癌中伴有EWSR1重排,也支持CEFTE可能是甲状腺乳头状癌“反式去分化”(trans-dedifferentiation)现象的观点。
CEFTE需要和小细胞亚型的髓样癌、甲状腺低分化癌鉴别。不表达p63和CD99,则不太可能是CEFTE。不过,CEFTE和典型Ewing肿瘤的鉴别的确很有难度;Vimentin阴性、且存在上皮分化、同时有甲状腺乳头状癌成分,支持CEFTE的诊断。CEFTE的预后好也是一个重要特征。
此外,伴体细胞性恶性成分的畸胎瘤可能也需要鉴别。与CEFTE不同,甲状腺恶性畸胎瘤是生物学行为上极具侵袭性的小细胞肿瘤,免疫组化表达SALL4和Glypican 3,不表达p63。与CEFTE不同,这一具有侵袭性的原始表现、多表型恶性肿瘤具有器官样表现,且常有DICER1改变,最近有文献提出将其称为“甲状腺母细胞瘤”。
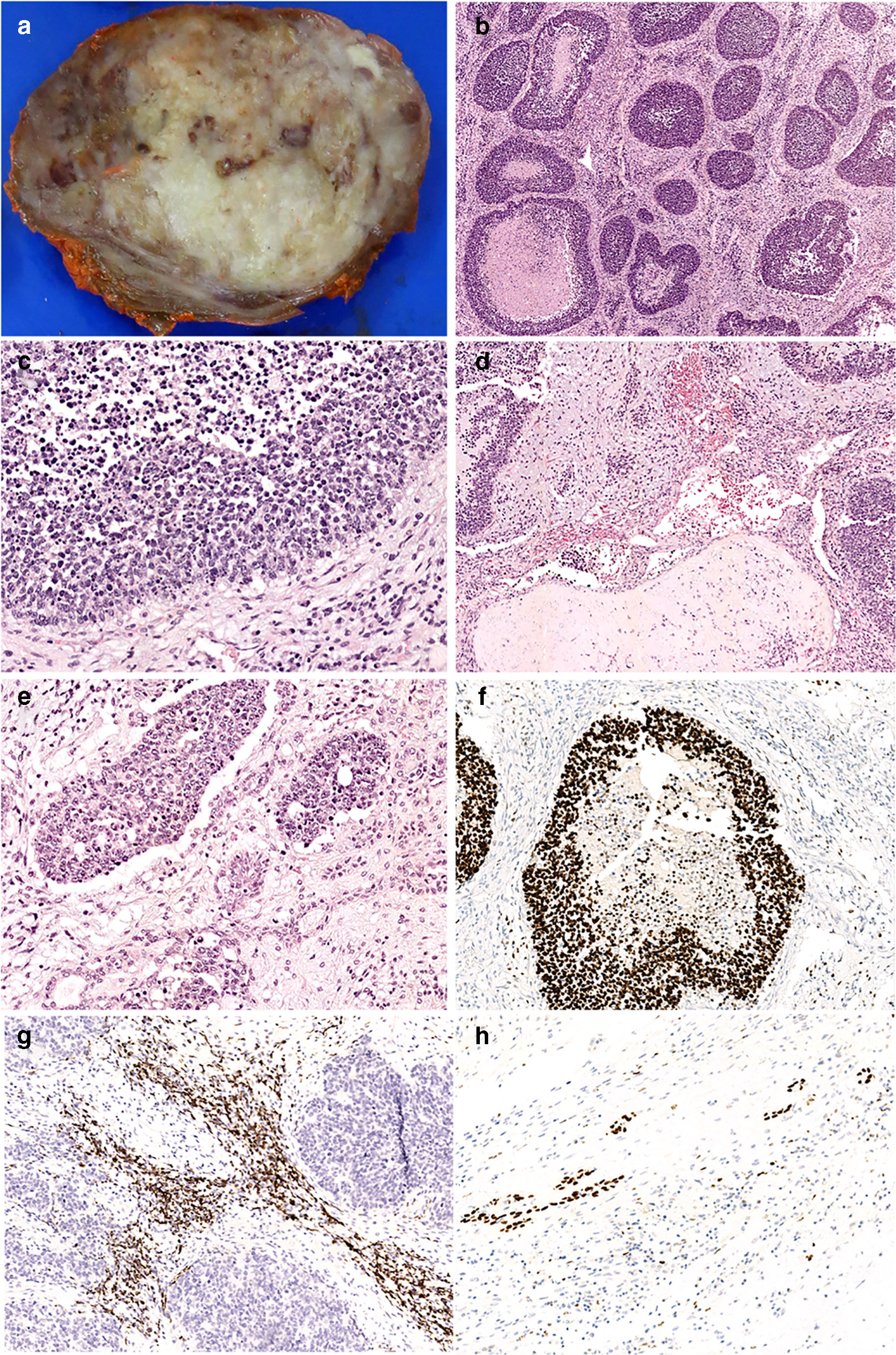 图31.本例为17岁女性,甲状腺恶性畸胎瘤累及双侧甲状腺。组织学上,肿瘤呈巢状,伴坏死,并有显著间质成分;瘤细胞小,伴凋亡及显著核分裂;图中可见软骨样基质及细胞性间质。除小细胞外,还有上皮性管状成分。免疫组化小细胞成分表达SALL4,间质成分表达desmin,同时上皮成分表达p63。
图31.本例为17岁女性,甲状腺恶性畸胎瘤累及双侧甲状腺。组织学上,肿瘤呈巢状,伴坏死,并有显著间质成分;瘤细胞小,伴凋亡及显著核分裂;图中可见软骨样基质及细胞性间质。除小细胞外,还有上皮性管状成分。免疫组化小细胞成分表达SALL4,间质成分表达desmin,同时上皮成分表达p63。
混合性髓样癌及甲状腺滤泡癌
混合性髓样癌及甲状腺滤泡癌(mixed medullary and follicular thyroid carcinoma,MMFTC)也是甲状腺原发的罕见肿瘤,具体为同一病变由两种类型的肿瘤成分构成,且各自的形态学和免疫组化都呈现出C细胞和滤泡细胞特征。两种成分的各自比例并不一致,目前尚无公认的阈值。个别病例报道于多发性神经内分泌肿瘤2型情况下。同时存在甲状腺髓样癌和滤泡细胞来源的癌、二者紧密相邻但并不混杂在一起的情况,被称为“碰撞瘤”,不要诊断为MMFTC。
MMFTC中的甲状腺髓样癌成分在组织学上和常规的甲状腺髓样癌并无区别;其中的滤泡细胞成分一般为滤泡亚型甲状腺乳头状癌。不过,也有经典型甲状腺乳头状癌、甲状腺滤泡癌、嗜酸细胞性或低分化癌的罕见病例,未分化甲状腺癌的情况也有过报道。这两种成分都可能出现转移,这也支持混合性肿瘤的诊断;不过也可以仅表现为一种成分的转移。
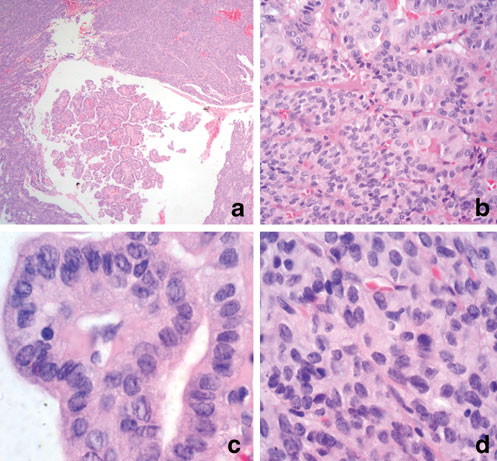
图32.(a)低倍镜下,肿瘤有两种成分,即乳头状结构和实性及梁状结构;(b)图示中倍镜下的混杂区域;(c)乳头状区域的高倍,细胞大,细胞核不规则、空泡状、有核沟;(d)假梁状区域,细胞核卵圆形,不规则、中等大小,染色质呈胡椒盐样,胞质轻度嗜酸性。
MMFTC的诊断需要免疫组化证实有两种成分:降钙素、降钙素基因相关肽、单克隆CEA阳性而单克隆PAX8阴性的C细胞来源成分,Tg和单克隆PAX8阳性的滤泡细胞来源成分。这两种成分都是TTF1阳性。甲状腺髓样癌中PAX8的表达取决于所用抗体。尽管降钙素和Tg一般不会在同类细胞出现同时表达,但也有两种标记物双表达的罕见报道。这种双分化的表现也可表现在mRNA水平和超微结构水平。
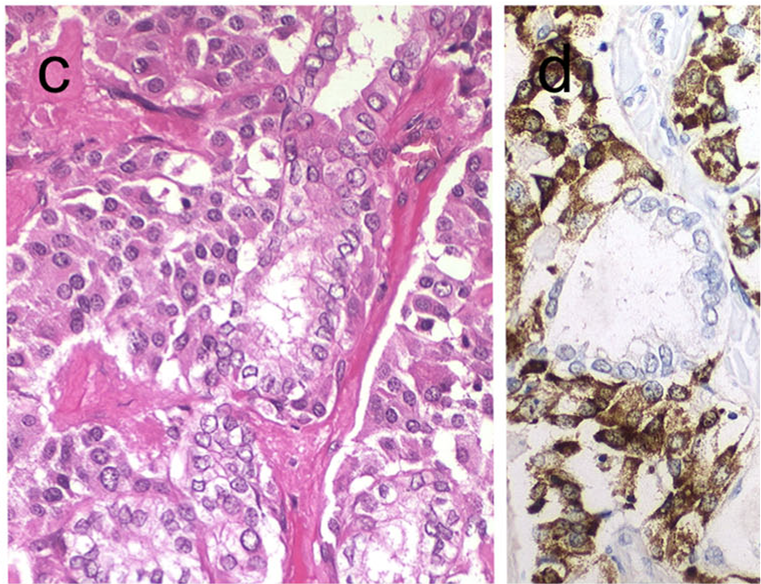 图33.混合性髓样癌及甲状腺滤泡癌,降钙素在髓样癌成分阳性而乳头状癌成分(滤泡亚型)阴性。
图33.混合性髓样癌及甲状腺滤泡癌,降钙素在髓样癌成分阳性而乳头状癌成分(滤泡亚型)阴性。
部分MMFTC中,滤泡成分为寡克隆或多克隆,因此可能是增生性病变而非肿瘤性病变。滤泡细胞也可在获得某些分子改变后生长进入甲状腺髓样癌中,成为真正的肿瘤性甲状腺髓样癌成分内的“客居”成分。体细胞性RET突变仅在MMFTC中的甲状腺髓样癌成分内检出。
甲状腺内胸腺癌
甲状腺内胸腺癌是伴胸腺上皮分化的甲状腺罕见恶性肿瘤。甲状腺内胸腺癌也称为甲状腺内具有胸腺样成分的癌(carcinoma showing thymus-like elements,CASTLE),其实对应的是甲状腺内异位胸腺的恶性病变。也有人提出甲状腺内胸腺癌是发生于异位胸腺、或仍有胸腺分化能力的鳃囊残余。
甲状腺内胸腺癌有三种组织学亚型,分别为角化型鳞状细胞癌型、非角化型基底细胞癌型(淋巴上皮瘤样型)、类似纵隔胸腺癌的神经内分泌癌型。大部分甲状腺内胸腺癌都表现为有纤维性间质分隔的分叶状鳞状细胞癌,纤维间质内伴致密淋巴细胞和浆细胞浸润;瘤细胞多边形,细胞分界不清,有显著核仁。可偶见单细胞角化或呈分层状表现的角化瘤细胞,但细胞核非典型为轻度,核分裂少见。肿瘤周边可能会有胸腺小体。
免疫组化方面,瘤细胞表达CD5、p63、CD117、多克隆PAX8、高分子量CK、广谱CK、CEA、GLUT-1、EGFR、calretinin、p53、BCL-2、MCL-1,不表达Tg、TTF1(克隆号SPT24者可有散在阳性)、降钙素、LCA。与胸腺瘤类似,也会有散在的S100A阳性细胞。未见与EBV相关。与正常位置的胸腺癌不同,甲状腺内胸腺癌有部分发现具有TERT启动子的突变。
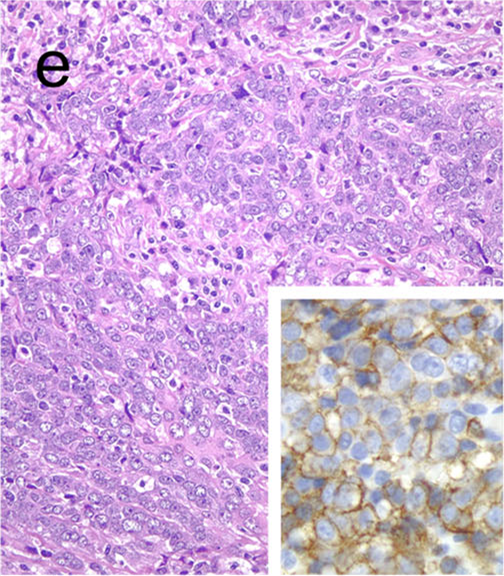
图34.胸腺内甲状腺癌,也称为甲状腺内具有胸腺样成分的癌,免疫组化CD5阳性。
甲状腺内胸腺癌的细胞学特征非常类似转移性鼻咽癌。不过,与鼻咽癌相比,甲状腺内胸腺癌相对为低级别肿瘤,Ki-67增殖指数约10-30%,且弥漫阳性表达CD5;而原发的鳞癌角化更为显著,组织学级别更高,Ki-67增殖指数超过50%,且不表达CD5和S100A。甲状腺间变性癌(包括伴鳞状分化的病例在内)会有显著多形性、非典型核分裂、肿瘤性坏死,且免疫组化CD5阴性。部分甲状腺内胸腺癌病例中报道有神经内分泌分化(Syn和CgA阳性),同时会有CD5阳性、降钙素阴性。
梭形上皮性肿瘤伴胸腺样分化
伴胸腺样分化的梭形上皮性肿瘤(spindle epithelial tumor with thymus-like differentiation,SETTLE)是发生于年轻患者及儿童的甲状腺恶性肿瘤,其来源是鳃裂囊肿或甲状腺内胸腺残余。
组织学上,SETTLE呈分叶状,一般有伴纤维间隔的包膜。瘤细胞形态温和,梭形及上皮样,后者可形成伴黏液囊肿的管状、小乳头、梁状、鳞状细胞巢等结构。免疫组化方面,梭形细胞成分表达低分子量CK、高分子量CK、p63、vimentin、CD99;两种成分一般都不表达Tg、降钙素、TTF1。
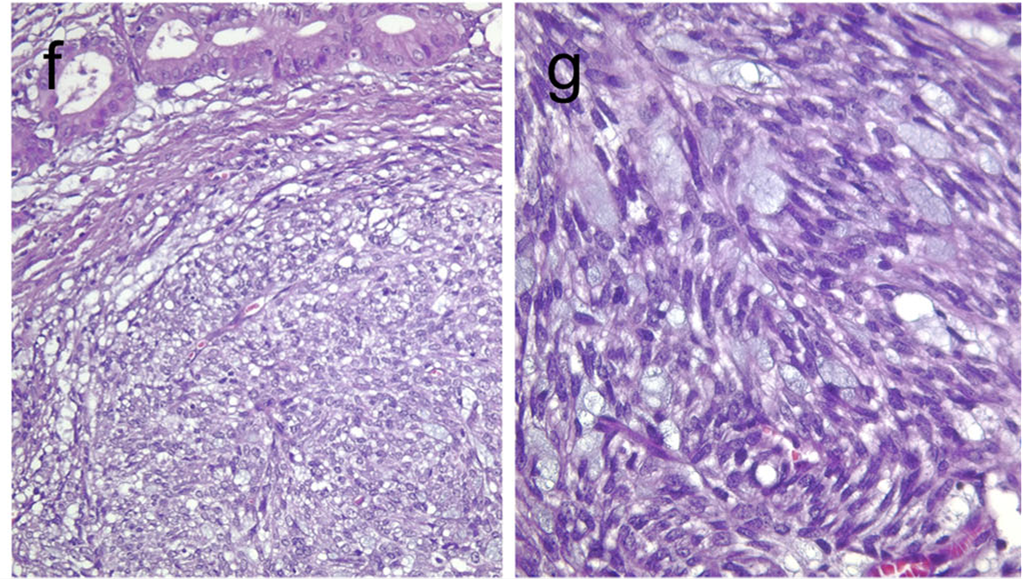
图35.伴胸腺样分化的梭形上皮性肿瘤,组织学呈分叶状,瘤细胞为梭形及上皮样细胞成分,伴腺体结构、黏液囊肿、和/或鳞状细胞巢。
SETTLE要注意鉴别本文前述的梭形细胞肿瘤。SETTLE和滑膜肉瘤的鉴别,只有滑膜肉瘤中特征性的t(X,18)重排这一点可以区分。
——全文完——
往期回顾:
旧文新读-从模式出发学习甲状腺肿瘤诊断(一)
旧文新读-从模式出发学习甲状腺肿瘤诊断(二)
旧文新读-从模式出发学习甲状腺肿瘤诊断(三)
旧文新读-从模式出发学习甲状腺肿瘤诊断(四)
旧文新读-从模式出发学习甲状腺肿瘤诊断(五)
旧文新读-从模式出发学习甲状腺肿瘤诊断(六)




















共0条评论