[导读]
编译整理:强子
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(一)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(二)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(三)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(四)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(六)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(七)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(八)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(九)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(十)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(十一)
实用学文献-妇科病理诊断及鉴别诊断中的免疫组化要点(十二)
四. 子宫上皮性肿瘤
2. 伴梭形细胞成分的子宫内膜癌
子宫伴上皮和梭形细胞形态的低分化恶性肿瘤鉴别诊断需包括:去分化癌、未分化癌、癌肉瘤、子宫的肉瘤以及罕见的转移性恶性黑色素瘤。大部分病例中,根据形态学特点(即低分化成分周围有高分化癌成分的存在)可以作出去分化癌的诊断,但高分化成分不易识别的情况下,免疫组化标记有助于判定。去分化癌、癌肉瘤中分化较好的上皮成分一般表达上皮标记如CK和EMA;未分化癌中CK一般为阴性,但EMA可局灶阳性。相反,极少数标记物有助于癌肉瘤中肉瘤成分的证实,这方面的诊断主要基于形态学、并排除其他可能。
已证实claudin-4表达于子宫癌中分化较好的上皮成分,也见于约50%的去分化癌或未分化癌。其敏感性低限制了常规应用,但如果有该指标的阳性表达,则支持上皮分化可能要超过肉瘤可能。PAX8和ER弥漫阳性,加之SMARCA4、INI1(SMARCB1)阳性,则支持3级子宫内膜癌可能要超过去分化癌、未分化癌可能。相反,约50%的未分化癌、部分子宫肉瘤中并不表达BRG1、INI1,这些肿瘤中PAX8和ER也为阴性。
3. 错配修复蛋白免疫组化检测
Lynch综合征易感者容易出现多个部位的癌,具体如子宫内膜、下生殖道、结肠,其原因为错配修复(mismatch repair,MMR)基因种系突变所致,详见表3。近些年,通过MMR蛋白免疫组化和/或微卫星不稳定检测而进行的筛查已逐渐建议用于子宫内膜恶性肿瘤患者。具体说来,微卫星不稳定检测、联合MMR免疫组化检测是最为敏感和特异的,但仅进行MMR免疫组化费用较低,因此很多单位仅用此作为筛查。与微卫星不稳定检测不同的是,MMR免疫组化可提示后续基因检测结果。
免疫组化MMR检测包括四种蛋白,即MLH1、PMS2、MSH2、MSH6,如四种抗体均为阳性则视为“正常”。由于这些蛋白以异二聚体(heterodimeric pair)的方式发挥作用,因此MLH1与PMS2配对、MSH2与MSH6配对。更具特异性的是,MLH1种系突变会导致MLH1和PMS2的表达缺失,MSH2突变会导致MSH2和MSH6的表达缺失;不过,PMS2或MSH6的缺失则会导致PMS2、MSH6的单独缺失。
目前子宫内膜肿瘤MMR表达的相关建议中表明,肿瘤细胞有任何程度的细胞核着色均提示“完整”表达(即无需一定是细胞核的弥漫阳性)。另外需要注意的是,MLH1和PMS2表达缺失常是由于MLH1启动子甲基化所致,这样的病例在进行遗传学检测之前应进行MLH1启动子甲基化检测。

表3. 错配修复蛋白免疫组化检测及相关要点
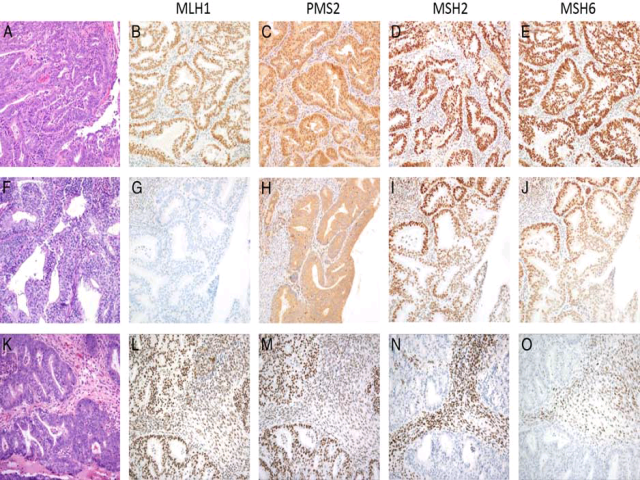
图1. MMR免疫组化检测。第一行为FIGO分级1级的子宫内膜样癌,4种蛋白均完整表达,这种情况下Lynch综合征及微卫星不稳定的可能性很小。相反,第二行也是FIGO分级1级的子宫内膜样癌,但MLH1和PMS2染色缺失(此处PMS2的着色为胞质异常着色),MSH2和MSH6完整表达。这种情况下在建议对MLH进行突变相关检测之前,应先进行MLH1启动子甲基化检测。第三行中,是一例已知有Lynch综合征病史患者的FIGO分级1级子宫内膜样癌,免疫组化MLH1、PMS2完整表达,MSH2和MSH6缺失。如无Lynch综合征病史的情况下呈这样的免疫组化结果,则应建议患者进行遗传学检测。
点击下载英文文献
参考文献
Hirsch MS, Watkins J.A Comprehensive Review of Biomarker Use in the Gynecologic Tract Including Differential Diagnoses and Diagnostic Pitfalls[J].Advances in anatomic pathology,2019,.
DOI:10.1097/PAP.0000000000000238















共0条评论