[导读] 作者: 刘常恩,王春,于骞,马周鹏;来源:肝胆胰外科杂志
胰腺神经内分泌癌(pancreatic neuroendocrine carcinoma,pNEC)极为罕见,仅占胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasm,pNEN)的2%~3%。目前有关pNEC的MRI研究报道较少,笔者对经病理学证实的7例pNEC的MRI及临床资料进行回顾性分析,并复习相关文献,旨在提高临床对该病的诊治水平。
01.资料和方法
1.1 一般资料
7例pNEC为2011年3月至2018年8月经舟山市普陀区人民医院及温州医科大学附属慈溪医院诊治的患者。其中男5例,女2例,年龄26~63岁,中位年龄45岁。主要临床表现为腹痛、上腹部胀痛不适、消瘦及乏力,其中4例可扪及腹部包块。实验室检查5例伴有轻度贫血(HGB 100~114 g/L),3例肝功能轻度受损(ALT 45~57 U/L,ALP 148~162 U/L),其余化验检查包括尿常规、肾功能、电解质、血糖均未见明显异常;肿瘤指标AFP、CEA、CA19-9、CA125均在正常范围。
1.2 MRI检查
采用GE Avanto1.5T磁共振仪行MRI平扫加动态增强检查。扫描范围自肝上缘至双侧髂前上棘水平。平扫T1WI行横断面(TR 112~190 ms,TE 2.46~4.76 ms),T2WI行横断面、矢状面及冠状面(TR 4 000~6 000 ms,TE 70~120 ms),并均行T1WI、T2WI脂肪抑制横断面扫描,横断面背景抑制屏气DWI(b值取0.600)。扫描层厚5 mm,间隔1 mm,矩阵270 mm×360 mm。动态增强采用梯度回波SPGR/FLASH序列,脂肪抑制成像,对比剂为Gd-DTPA(0.1 mmol/kg)。由肘静脉高压注射器团注,动脉期延迟时间为20~30 s,静脉期延迟65~80 s,延迟期延迟300~320 s。
1.3 图像分析
由3名高年资MR医师共同对MRI图像进行回顾性分析。观察内容:(1)病灶部位、形态、界限、大小;(2)病灶MRI平扫信号特点,与相邻正常胰腺组织相比分低、等和高信号3级;动态增强检查的强化特征。强化程度根据强化信号低于、接近或高于正常胰腺分别称为轻度、中度及明显强化;(3)继发改变,如邻近胰腺组织、主胰管、胆总管及胰周血管的变化,邻近及远处转移等。
2.结果
2.1 病灶部位、形态及大小
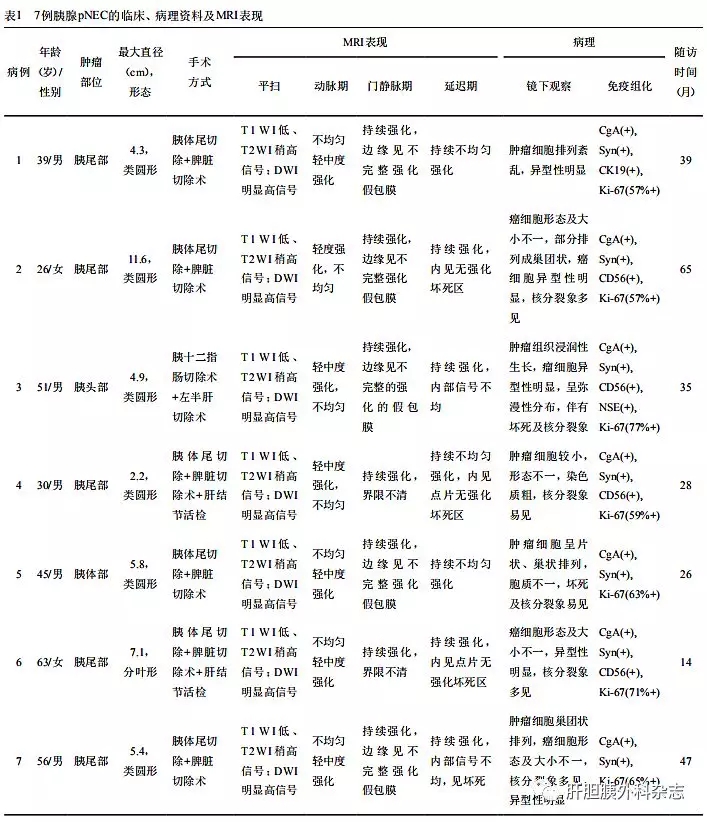
7例均为单发,其中位于胰尾5例(图1),胰体部1例(图2),胰头部1例(图3)。病灶直径约2.2~11.6 cm,平均5.9 cm。6例呈类圆形,1例不规则分叶状,5例边界部分较清楚,2例边界不清。



2.2 MRI平扫及增强表现
平扫7例T1WI上均呈低信号(图3A),T2WI呈稍高信号(图1A),DWI均呈明显高信号(图1B)。7例内部信号不均匀,T2WI上病灶内见斑点、点片状高信号。
增强检查动脉期6 例病灶轻-中度强化,信号强度略低于邻近正常胰腺(图3B),1例轻度强化(图1C);静脉期及延迟期7例均进行性持续强化(图1D,图2,图3C)。7例强化不均匀,内部均见灶性无强化坏死区,其中3例较大病灶内部少许点片状坏死灶与瘤体大小不成比例。5例边缘见不完整的环形强化的假包膜,强化程度高于肿瘤实质,以静脉期显示相对清楚(图1D,图2,图3C)。7例病灶远侧主胰管未见明显扩张,其中4例累犯胰周结构;3例伴发肝脏转移(图3B),其中1例肝脏单发转移,2例三枚以上多发转移灶;7例均未见明显腹部淋巴结转移。
2.3 手术及病理
7例均在MRI检查后1周内行手术治疗。1例胰腺体部及3例胰腺尾部肿瘤术前未发生肝脏转移,行胰体尾切除+脾脏切除术;1例胰头部肿瘤伴肝脏单发转移,行胰十二指肠切除术+左半肝切除术;2例胰尾部肿瘤伴肝脏多发转移者,行胰体尾切除+脾脏切除术+肝结节活检术。术后病理显示7例肿块局部边界尚清,切面呈灰白或灰红色,可见出血、坏死区。镜下见癌细胞形态及大小不一,部分排列成巢团状,癌细胞异型性明显(图3D),核分裂象多见(20~35个/10 HPF)并可见病理性核分裂相,Ki-67阳性指数均大于55%;免疫组织化学检查显示7例CgA阳性表达(图3E),7例Syn阳性表达(图3F),4例CD56阳性表达,最终均确诊为pNEC。
2.4 随访情况
采用门诊和/或电话随访的方式对7例进行随访。按照术后1、3、6、9、12个月各1次,12个月后每6个月1次。7例术后均行全身静脉辅助化疗3周期,其中4例随访时间分别为26、39、47及65个月,至发稿前均存活。1例胰头部肿瘤并肝左叶单发转移者经胰十二指肠联合左半肝切除术,术后随访35个月仍生存;2例胰尾部肿瘤并肝脏多发转移者死亡,其中1例姑息手术者生存14个月,1例术后合并行5-氟尿嘧啶腹腔动脉灌注化疗3次,生存28个月,死亡原因均为肿瘤广泛转移衰竭死亡。详见表1。
3.讨论
3.1 pNEC的临床及病理学特征
pNEC临床罕见,好发于中青年,多属于无功能性肿瘤,2017版WHO对pNEN具体分级诊断标准如下:NETG1(核分裂数<2/10 HPF、Ki-67<3%);NETG2(核分裂数为2~20/10 HPF和/或Ki-67为3%~20%);NETG3(核分裂数>20/10 HPF、Ki-67>20%和低分化神经内分泌癌);混合腺神经内分泌癌(mixed neuroendocrine-non neuroendocrine neoplasm,miNEN),其中pNEC属于G3级,具有分化程度差、恶性程度高的生物学特点。病理组织学上肿瘤细胞排列多呈片块状、巢状,胞质不一,坏死及核分裂象易见;免疫组化表现有特异性,尤其Syn、CgA两者为阳性时,对明确诊断意义重大。pNEC临床上常以腹痛、腹部肿块、消瘦等非特异性症状就诊,本组1例胰头部肿瘤的患者,临床上未见明显梗阻性黄疸,不同于胰腺导管癌;此外7例患者实验室检查CA19-9、CEA、CA125等均未见升高,亦有助于与胰腺导管癌及转移癌的鉴别。
3.2 MRI表现及鉴别诊断
因为罕见,pNEC术前不易诊断,与胰腺导管癌、肿块型胰腺淋巴瘤、实性假乳头状瘤等鉴别较困难,尤其与胰腺导管癌较易混淆。pNEC与胰腺导管癌的手术方式的选择存在一定差异,而且预后多好于胰腺导管癌,因此术前确诊具有重要意义。
总结本组7例并复习有关文献,笔者认为 pNEC的MRI表现具有以下特征:(1)pNEC强化程度低于G1、G2级的pNEN,往往表现为乏血供的实性为主肿块。由于较低表达血管内皮生长因子及血小板源性生长因子,进一步导致其微血管密度减少,可能是其强化不明显的病理学基础。本组病例虽然动脉期强化多不明显,但强化程度仍高于胰腺导管癌,与岳亚丽等报道相符。(2)肿瘤界限部分清楚,有时可见不完整的假包膜。文献报道pNEC具有高侵袭性,包膜多不完整或无明显包膜,不同于G1、G2级的pNEN。本组7例中5例病灶界限部分相对清楚,增强后周边见不完整较明显强化的假包膜,不同于胰腺导管癌和淋巴瘤,后两者因为浸润性生长多边界不清,有时类似于炎性病变。胰腺实性假乳头状瘤可见包膜,但包膜多完整连续,同时结合临床多见于年轻女性、肝脏转移罕见,有助于鉴别。(3)上游主胰管阻塞性改变不明显。胰腺导管癌具有围管浸润的生长特点,易较早出现远侧胰腺实质萎缩、胰管明显扩张等改变。本组1例pNEC位于胰头部,上游主胰管仅轻度扩张,与胰头部肿块大小不成比例。笔者认为此征象可能是pNEC与胰腺导管癌的重要鉴别征象之一,有待于扩大样本数的研究。(4)肝脏转移较多见。有文献研究认为约60%的pNEC在确诊时已经存在肝转移,本组3例初次就诊时发现肝脏转移,其中1 例肝脏转移灶巨大,而胰尾原发灶相对较小。结合术后病理分析,可能与pNEC分化程度较低,类似于小细胞肺癌转移灶大于原发灶的特点有关,可能对本病的诊断有所帮助。
3.3 预后及治疗
pNEC的生物学行为类似小细胞癌,以手术切除辅化疗为主要治疗手段,预后一般好于胰腺导管癌。对于局限于胰腺的肿瘤,胰十二指肠切除术或胰体尾联合脾脏切除术是其标准手术方式,同时进行相应区域的淋巴结清扫。伴发肝转移并不是绝对的手术禁忌证。手术应尽量同时切除原发灶及转移灶,对于无法根治性切除者,可联合采取姑息性减瘤、动脉栓塞化疗、射频消融、生物治疗和分子靶向治疗等治疗方法,也有助于控制病情、改善预后。本组1例胰腺体部及3例胰腺尾部肿瘤术前未发生转移,行胰体尾切除+脾脏切除术,术后随访26~65个月均未见复发或转移;1例胰头部肿瘤并肝左叶单发转移,行胰十二指肠切除+左半肝切除术,术后随访35个月仍生存。
引证本文:
刘常恩, 王春, 于骞等. 胰腺神经内分泌癌的MRI表现及治疗 [J]. 肝胆胰外科杂志, 2019, 31(10): 604-608.

















共0条评论