[导读] 编译整理:强子
胃肠道内镜下切除标本之病理应知应会(一)
胃肠道内镜下切除标本之病理应知应会(二)
胃肠道内镜下切除标本之病理应知应会(三)
胃肠道内镜下切除标本之病理应知应会(四)
胃肠道内镜下切除标本之病理应知应会(六)
胃肠道内镜下切除标本之病理应知应会(七)
六. 具体部位的问题
1. Barrett’s食管
Barrett’s食管及食管早期腺癌内镜下治疗,已经成为了目前的主流方式并逐渐取代了外科手术的地位。队列研究表明,黏膜内癌内镜下治疗在长期疾病特异性生存期方面的结果与手术治疗者近似,但治疗相关并发症及死亡率却要更低。同时这一治疗方案不仅仅可以达到治愈目的,也有助于病变的准确分期,从而对有深部浸润风险、有淋巴结转移风险的患者实施进一步治疗。
长期前瞻性研究也表明,对于伴异型性的Barrett’s食管治疗来说,EMR的治疗效果、安全性及性价比方面均非常好。对于Barrett’s食管基础上的早期肿瘤来说,浸润深度和切除是否完整,决定了内镜下治疗是否成功,同时也可以在此基础上进行准确分期。如果EMR标本确定为浸润性癌,需要注意的其他重要指标有:切缘情况,肿瘤分化程度,有无淋巴管-血管浸润。这些指标决定了下一步的治疗及随访。
对于食管腔内有较大肿物(如直径>20mm)、且黏膜下浸润风险较大的肿瘤来说,可能无法实施“整块”切除。此时需综合考虑EMR、ESD的优缺点。不过,这样的病变仅占食管早期肿瘤的10%以下。鉴于Barrett’s食管基础上发生的黏膜下的癌淋巴结转移风险较高,所以早期的指南建议手术治疗。不过,回顾性研究表明,对淋巴结转移的风险可能高估了。最近的系列研究表明,黏膜下表浅浸润(自黏膜肌底部开始测量,浸润深度≤500μm)且组织学上无其他高危因素时,淋巴结转移的风险较低,为0-2%。
Barrett’s食管相关肿瘤评估时,还有些特殊问题需要注意。由于胃食管交界处黏膜肌排列相对紊乱,因此评估浸润深度的时候会相对复杂。因为浸润深度意义重大,直接决定了分期是否准确、后续是否需要治疗,所以必须仔细判定黏膜肌的结构是否紊乱。
文献报道,高达92%的Barrett’s食管中黏膜肌会出现排列重复、紊乱的表现,因此导致黏膜肌形成内层、外层的表现。这一现象也会导致黏膜肌增厚,并常形成突入上方黏膜的表现。黏膜肌形成的内、外层表现中,外层相对较厚、排列有序,这是固有的黏膜肌层;内层排列相对无序、可能与黏膜层混杂在一起。黏膜肌层之间的分离可能会类似黏膜下层,但仔细评估疏松结缔组织、扩张的薄壁毛细血管等,可以判定不是黏膜下层。相反,黏膜下层的血管不仅有较大、扩张的小血管,同时有特征性的厚壁血管及脂肪组织、黏膜下腺体。

图1. (a)食管,被覆鳞状上皮,黏膜肌层排列有序;(b)Barrett’s食管,黏膜肌排列重复、紊乱(直线所示);图中粗箭头示管腔较大的厚壁血管,为黏膜下血管;三角形示黏膜下脂肪组织;细箭头示黏膜下腺体。
认识到黏膜肌排列紊乱、重复的问题,对于避免误判Barrett’s食管相关腺癌的浸润深度来说至关重要。黏膜肌较厚的时候,可能会误判为固有肌层,则可能会将黏膜内癌(pT1a)误判为固有肌层浸润(pT2)。如果将黏膜肌层之间的裂隙误判为黏膜下层,则会将pT1a期腺癌过诊断为pT1b期。这两种情况都会导致患者实施不必要的手术。深层黏膜肌浸润与黏膜下浸润的区分也很关键,这一点的失误可能会导致pT1a期和pT1b期癌之间的误判。非浸润性肿瘤性腺体之间也可能出现黏膜肌排列紊乱、形成突入上方黏膜的表现,此时如果误判为浸润性肿瘤则可能会将pTis病变或高级别异型增生误判为pT1a期肿瘤。
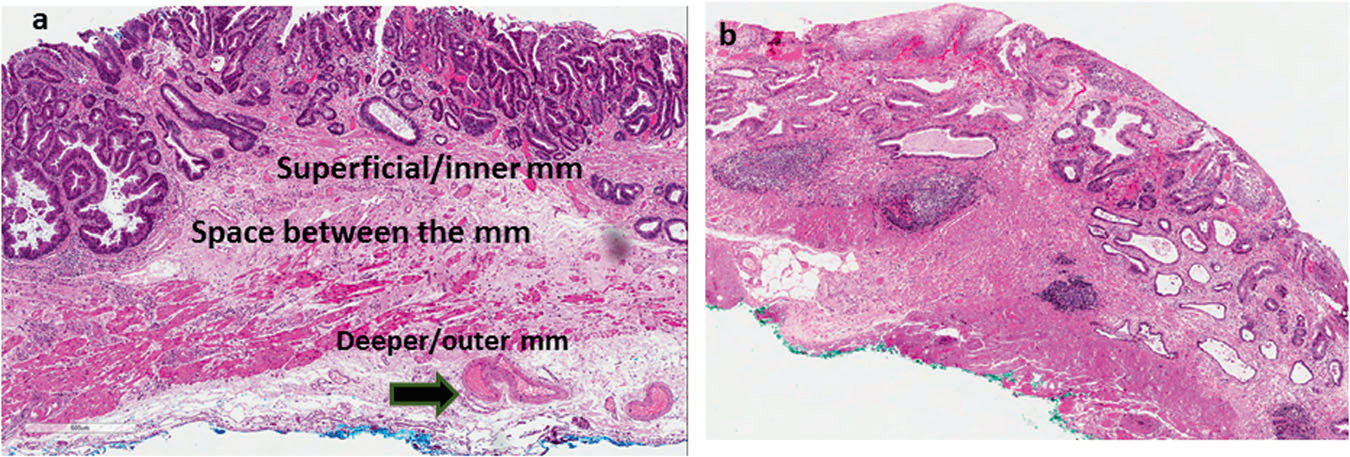
图2. (a)Barrett’s食管有时黏膜肌层排列紊乱、重复,可能在表浅部分和较深部分相互分离形成裂隙,这一裂隙有时会误判为黏膜下层;但左图中箭头示黏膜下层血管。(b)Barrett’s食管中黏膜肌层排列紊乱、重复,T1a期腺癌侵及黏膜肌相互分离的裂隙时,如果将该裂隙误判为黏膜下层,则可能会将病变误判为pT1b期(黏膜下浸润)或pT2期(肌层浸润)。
越来越多的证据表明,肿瘤在黏膜肌层的浸润深度对于pT1a期腺癌的预后也有影响;也有证据表明浸润至两层黏膜肌间的肿瘤淋巴结转移风险低,类似仅浸润黏膜固有层的癌。所以,仅侵及表浅黏膜肌层(及表浅黏膜肌层与深部黏膜肌层之间间隙)的肿瘤,相比侵及深部黏膜肌层的肿瘤来说预后可能不同,但还需要更多证据。
还要注意的是,也正是由于前述黏膜肌排列紊乱、重复,所以内镜下超声检查对于pT1期腺癌来说准确性欠佳;并且已有研究表明对于早期食管腺癌来说,内镜下超声检查对于分期并无作用,因为其结果一般是分期过高。
上述问题也导致对于Barrett’s食管背景中不同浸润深度pT1a期癌侵及黏膜不同层次有两种判读方法。第一种是按照第八版AJCC方案,将其分为三组-m1、m2、m3。该方法一般适用于食管的鳞状细胞癌。第二种方法则更为复杂:将上皮内肿瘤与浸润性癌明确区分开,而pT1a期腺癌分为四组,同时要考虑黏膜肌层的排列紊乱、重复问题,因此该方案更为精准。所以具体报告中还要注意声明所用的具体方案。当然,这两种方法中均将黏膜下层浸润的癌(pT1b)分为sm1、sm2、sm3三组。详见下表及图示。
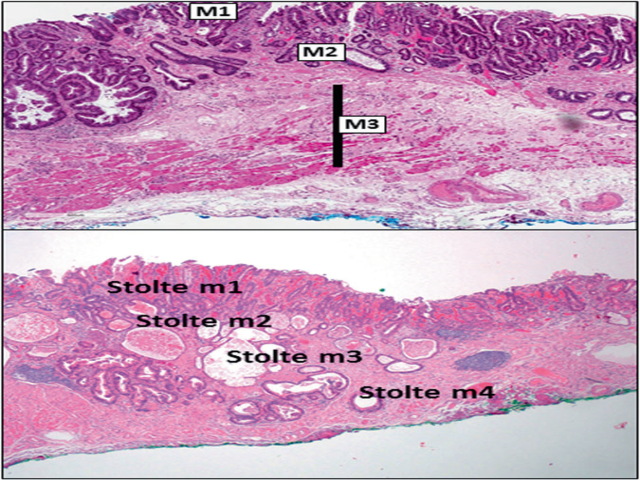
图3. 根据肿瘤浸润深度,对食管T1a期腺癌进一步分组。(a)第八版AJCC方案中,m1是指原位或仅在上皮内的病变,m2是指侵及黏膜固有层,m3是指侵及黏膜肌层;(b)Vieth及Stolte等人提出的方案:m1是指侵及黏膜固有层,m2是指侵入表浅黏膜肌层,m3是指侵入表浅和深部黏膜肌层之间的裂隙,m4是指侵及深层黏膜肌层。
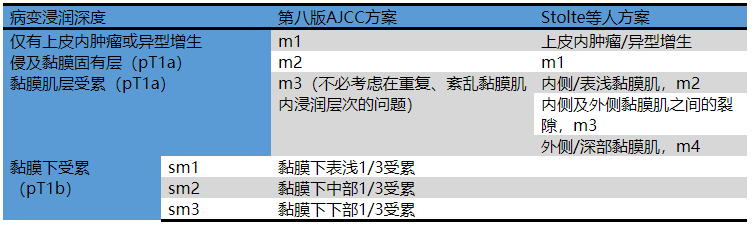
表1. 食管pT1期腺癌黏膜浸润的分组
一般说来,黏膜下浸润可以分为三个层次,详见上表。这一区分可能相对困难,因为标本中所见黏膜下成分不一定是全部;没有固有肌层的情况下更是无法准确判读。因此有些专家或团体推荐直接测量浸润深度至微米并记录。
目前,测量黏膜下浸润至微米的做法可能会有助于预后判定,因为最近有研究表明:低危型黏膜下浸润性癌(指黏膜下浸润深度≤500微米,pT1sm1)如无其他淋巴结转移的组织学危险因素,则可能内镜下治疗后仅密切内镜随访即可。
黏膜下浸润深度的测定,应从黏膜肌层最外侧开始量起。如HE染色切片中判读困难,则可以借助于特殊染色(如Masson三色)或免疫组化(如desmin)来确定黏膜肌层最深处位置。有些浸润性癌的浸润性前缘可能并无明显的黏膜肌,这时候如果肿瘤性腺体并未超出周围完整黏膜肌对应层面的最下方,则最好将其归为黏膜内癌(pT1a)并备注;如果肿瘤性腺体位于管腔较大的黏膜下血管周围,此时即使无法确定黏膜肌的情况,也应归为黏膜下浸润性癌(pT1b)。当然,精确测定需要定位良好的标本,且标本中其他地方应有完好的黏膜肌,如果这些条件达不到,则无法准确测定。
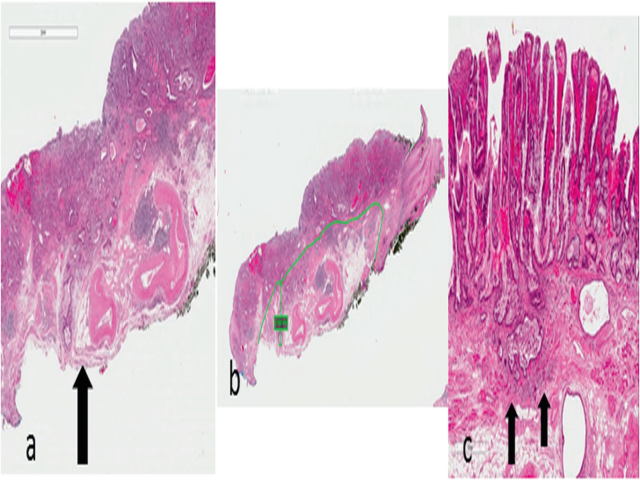
图4. (a)食管黏膜下浸润的腺癌(pT1b)并有舌状浸润切缘的表现(箭头所示)。(b)浸润深度的测定,从黏膜肌层最下端开始量起。(c)本例中,肿瘤性腺体极为接近黏膜下层,但还是有一层属于黏膜肌外层的肌组织分隔(箭头所示),所以应属pT1a,m4。
点击下载英文文献
参考文献
Kumarasinghe MP,Bourke MJ,Brown I,et al.Pathological assessment of endoscopic resections of the gastrointestinal tract: a comprehensive clinicopathologic review[J].Modern pathology : 2020.
DOI:10.1038/s41379-019-0443-1


















共0条评论