往期回顾:
消化系统肿瘤WHO分类第五版学习笔记(一)
消化系统肿瘤WHO分类第五版学习笔记(二)
消化系统肿瘤WHO分类第五版学习笔记(三)
消化系统肿瘤WHO分类第五版学习笔记(四)
5 恶性上皮性肿瘤
01. 胃腺癌
定义
胃腺癌是胃黏膜的恶性上皮性肿瘤,伴腺体分化。
ICD-0编码
8140/3腺癌NOS
ICD-11编码
2B72.0&XH74S1胃腺癌&腺癌NOS
相关术语
无
亚型
管状腺癌(8211/3);壁细胞癌(8214/3);腺癌伴混合亚型(8255/3);乳头状腺癌NOS(8260/3);微乳头状癌NOS(8265/3);黏液表皮样癌(8430/3);黏液腺癌(8480/3);印戒细胞癌(8490/3);低粘附性癌(8490/3);髓样癌伴淋巴样间质(8512/3);肝样腺癌(8576/3);潘氏细胞癌
部位
根据胃癌(GC)的发病率,这些肿瘤的分布在地理上有所不同。在GC发病率高的地区(亚洲、中南美洲和东欧),约80%的病例发生在远端(发生在胃体、胃窦和/或幽门),胃窦-幽门位置相对占主导地位。在北欧(包括英国)和美国,50-60%的GC位于贲门和/或胃底,主要是因为这些地区的远端癌发病率较低。相比之下,在1999-2014年的15年期间,韩国的一项研究中,贲门/胃底病例的比例相对稳定,为5.9-7.1%。在日本,近端胃癌的发病率一直在上升,18-22%的胃癌发生在近端胃。最近在美国和荷兰也观察到胃体GC的增加。
临床特征
GC在早期可能无症状。在疾病晚期,常见症状包括吞咽困难、乏力、消化不良、呕吐、体重减轻、食欲减退和贫血。
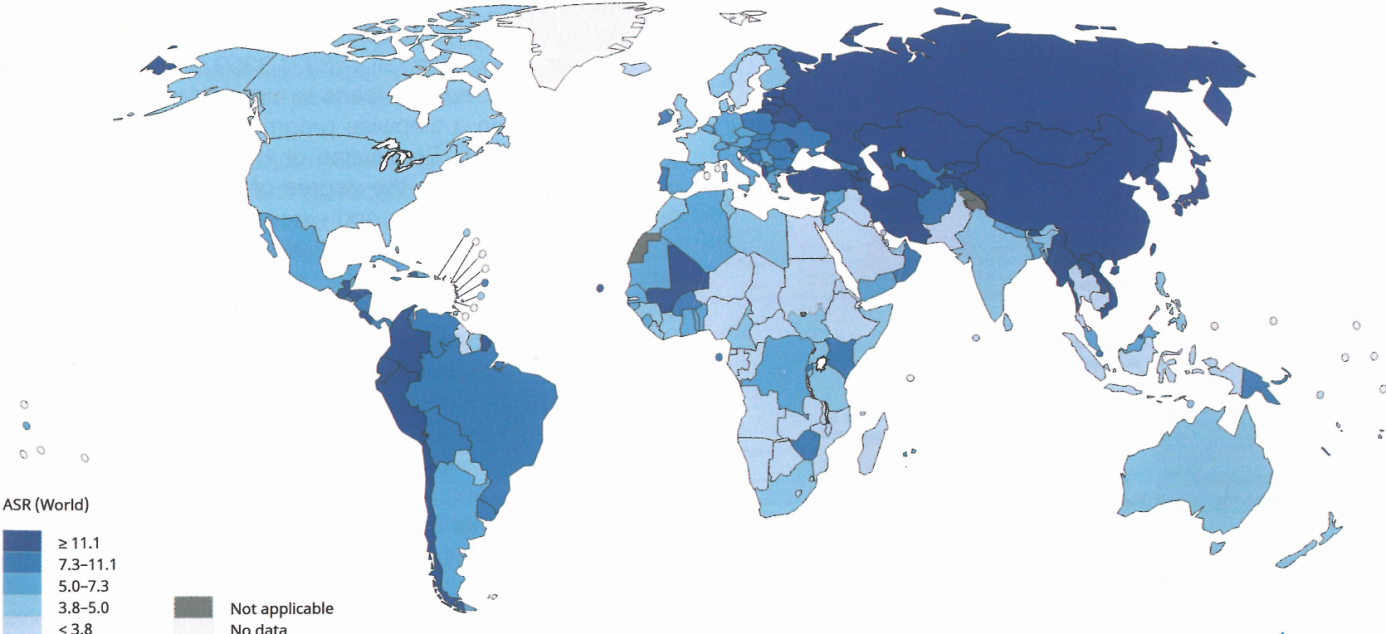
图3.25 2018年胃癌估计全球年龄标准化发病率,每10万人每年。
内镜检查和夹取活检仍然是诊断GC的金标准方法。黏膜表面的细节可以通过窄带成像或彩色内镜结合放大内镜进行评估。如果发现黏膜异常,如深凹陷、不规则结节或无定形表面,则可以怀疑黏膜下浸润。内镜黏膜切除术(resection)和内镜黏膜下剥离术(dissection)用于分期和治疗浅表病变,如异型增生或黏膜内癌。
对于更晚期的癌症,使用EUS、增强CT、MRI或FDG PET-CT进行分期。EUS也可用于识别增大的胃周淋巴结,并在必要时通过FNA确认转移。需要分期腹腔镜检查以排除腹膜疾病。
简表3.02有充分证据(因果关系)和有限证据(正相关)的致胃癌药

简表3.03早期(0型)癌症的亚分类

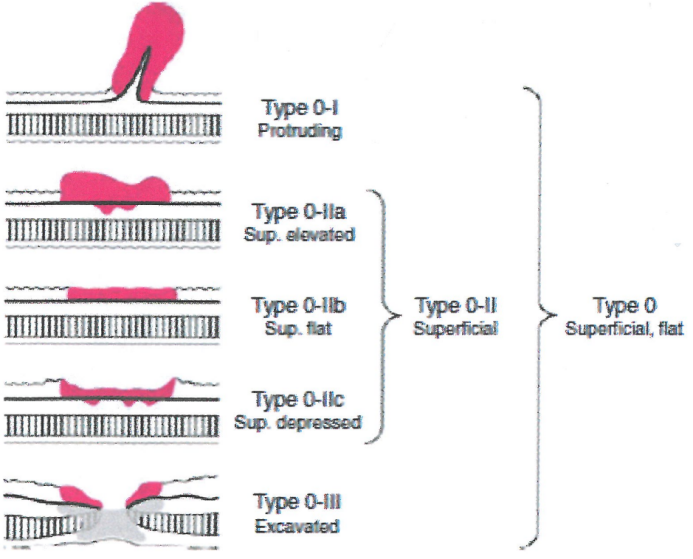
图3.26早期胃癌(0型)的亚分类。具有两种或多种成分的浅表(sup)肿瘤,应按所占表面积的顺序记录所有成分,例如“0-llc III”。详见简表3.03。
图中文字:
0-I型(突起)
0-IIa型(浅表隆起)
0-IIb型(浅表平坦)
0-IIc型(浅表凹陷)
0-III型(挖掘)
0-II型(浅表)
0型(浅表,平坦)
流行病学
在全球范围内,GC是癌症相关死亡的第三大常见原因;尽管发病率下降,但2018年全球估计新增病例超过100万例。发病率在中亚和东亚、东欧和南美最高。在英国的一项研究人群中,每2名GC患者中就有1名出现局部晚期疾病。Lauren分类将GC分为两种主要的组织学类型:肠型和弥漫型。在一些国家,观察到肠型GC的发病率下降,而弥漫型GC的发生率相对增加。
病因
GC是一种多因素疾病;90%的病例是散发性,另外10%发生在家族/遗传学环境。环境因素包括HP感染、EB病毒感染、吸烟和饮食因素(见简表3.02)。
GC的几种亚型与特定的病因和分子机制有关。已识别种系突变和特定类型的GC,如遗传学性弥漫性GC中的CDH1突变(见遗传学性弥漫型癌症,原书第535页)和胃腺癌和胃近端息肉病(GAPPS)中的APC外显子1B突变(见GAPPS和其他胃底腺息肉病,原书第526页)。
发病机制
一般认为HP感染是大多数GC的原因,特别是非贲门GC。胃黏膜的慢性感染导致萎缩性胃炎和肠化生,呈阶梯式进展,称为Correa级联反应。根除HP可降低胃癌的风险。然而,风险降低的程度取决于根除时萎缩性损伤的存在、严重程度和范围。在胃萎缩晚期患者中,根除HP可能不再降低肿瘤进展的风险。慢性HP感染被认为会导致胃上皮细胞的DNA突变和表观遗传学变化(局部癌变)。cagA阳性HP菌株感染是GC发展的最强危险因素。感染毒力最强的vacA s1、ml和i1菌株与胃腺癌风险增加有关,尽管在美国和哥伦比亚观察到的vacA毒力基因型的预测价值在东亚和东南亚的一些研究中尚未得到证实。还涉及遗传学易感性,如炎症相关基因(IL1B、TNF)的SNP。此外,在高收入国家,自身免疫性胃炎被认为是GC的危险因素。
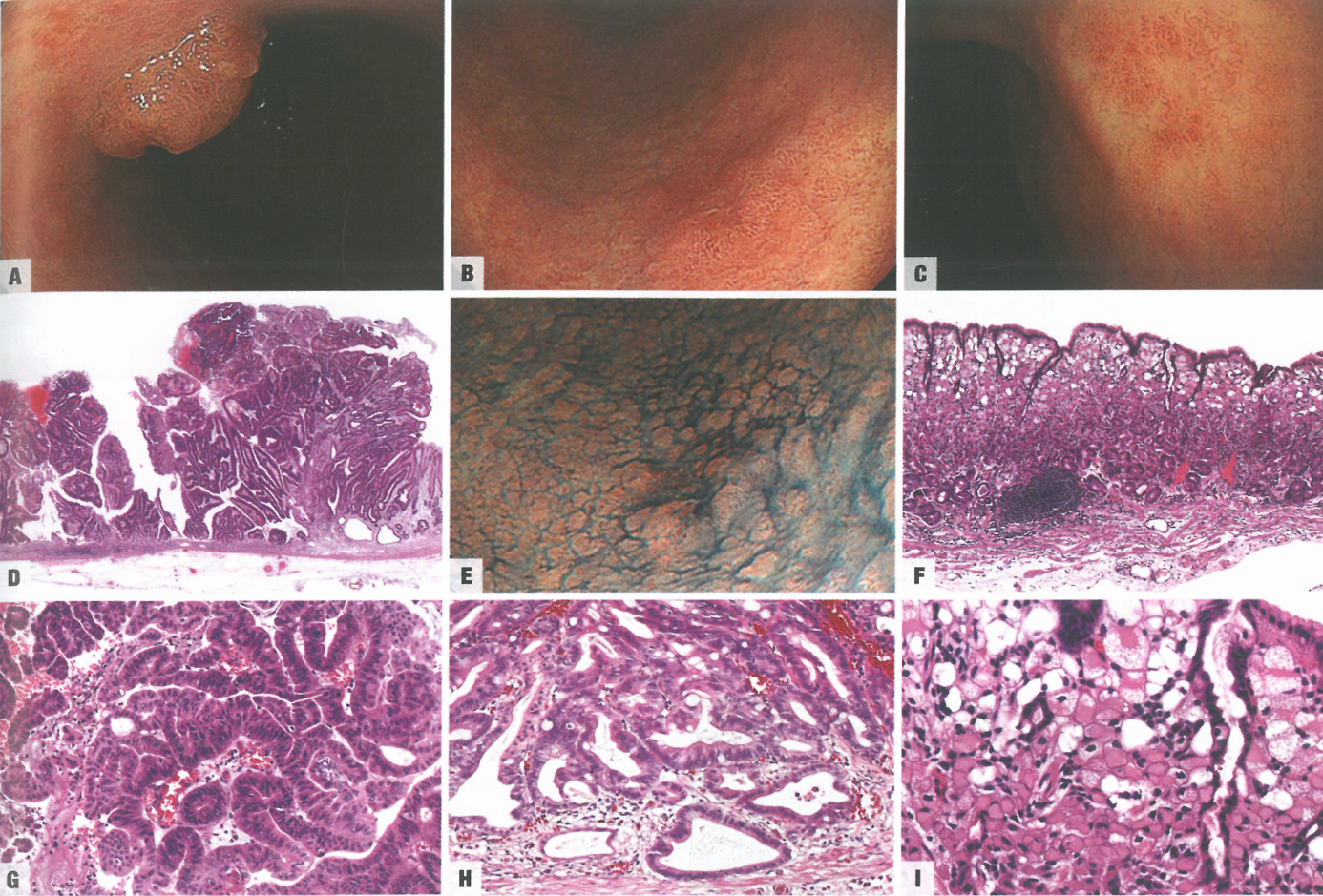
图3.27早期胃癌。A 0-1型,内镜特征。略微红色的突出病变,表面不规则,大小为16mm,位于胃体下部的小弯侧。B 0-llc型,内镜特征。红色凹陷病变,边缘不规则,大小为10mm,位于胃体下部的大弯侧。C 0-llc型,内镜特征。脱色的凹陷病变,边缘不规则,大小为18mm,位于胃角后壁。D 0-I型,组织学(低倍)。肿瘤显示乳头状腺癌的特征。E 0-llc型,内镜特征。图B的同一病变,靛蓝胭脂红染色内镜,表面更不规则,病变边缘更清晰。F 0-llc型,组织学(低倍)。肿瘤呈印戒细胞癌的特征。G 0-I型,组织学(高倍)。H 0-llc型,组织学。肿瘤呈管状腺癌的特征。I 0-llc型,组织学(高倍)。
胃癌发生和进展过程中会发生多种遗传学和表观遗传学改变。这些包括癌基因、肿瘤抑制基因、生长因子、受体酪氨酸激酶、DNA修复基因、间质降解酶、细胞周期调节因子和细胞粘附分子的遗传学不稳定性和异常。遗传学多态性或变异,如MUC1和PSCA的SNP,是易感内源性因素,似乎会改变GC易感性以及疾病进展。DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA的调控是重要的表观遗传学改变。先进的多平台基因组技术最近发现了GC致癌的潜在分子机制。
利用高通量测序技术,包括癌症基因组图谱(TCGA)研究网络和亚洲癌症研究小组(ACRG)在内的几个小组提出了GC的遗传学和表观遗传学分子分类。
TCGA提出了一种分类方法,将GC分为四种分子亚型:EBV阳性、微卫星不稳定(MSI)、基因组稳定和染色体不稳定(见表3.05,原书第94页)。大多数EBV阳性GC组织学上具有淋巴样间质或呈淋巴上皮瘤样,并显示PIK3CA和ARID1A突变、全基因组高甲基化和CD274(PD-L1)基因扩增,CD274(PD-L1)是一种重要的免疫检查点调节因子。MSI GC的特征是错配修复基因的突变或启动子甲基化,如MLH1。与EBV阳性GC一样,MSI GC亚型表现出全局高甲基化。遗传学稳定的GC主要表现为弥漫型组织学,其特征是遗传学畸变频率显著降低。然而,在遗传学稳定的GC亚群中观察到RHOA突变或涉及RHO家族GTP酶激活蛋白的融合。染色体不稳定的GC主要表现为肠型组织学,并伴有广泛的DNA拷贝数异常,包括受体酪氨酸激酶基因的扩增,如ERBB2、EGFR、MET和FGFR2。在常规病理学中,错配修复蛋白(MLH1等)、p53和E-cadherin的免疫组织化学结合EBV编码的小RNA(EBER)的原位杂交可能替代类似于TCGA提出的分类的分子GC亚型。
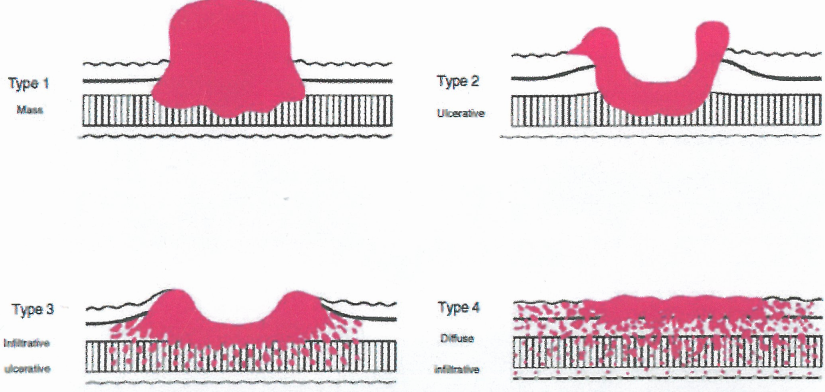
图3.28晚期癌症的大体类型。1型(肿块):息肉样肿瘤,与周围黏膜界限分明。2型(溃疡):溃疡性肿瘤,边缘隆起,周围是增厚的胃壁,边缘清晰。3型(浸润溃疡):溃疡性肿瘤,边缘隆起,周围胃壁增厚,边缘不清。4型(弥漫浸润):无明显溃疡或边缘隆起;胃壁增厚、硬结,边缘不清。
图中文字:
1型肿块
2型溃疡
3型浸润溃疡
4型弥漫浸润
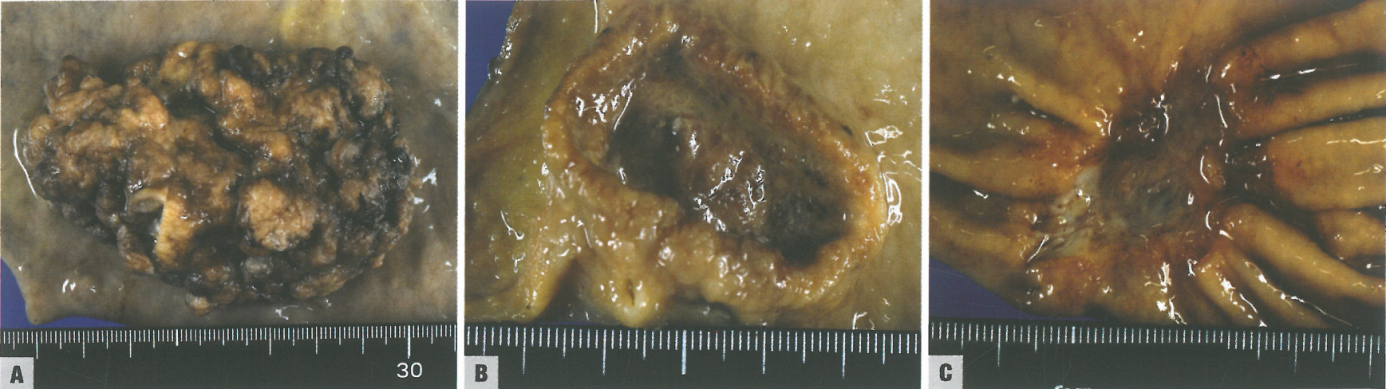
图3.29胃腺癌。A Borrmann I型。巨大息肉样和蕈伞样肿瘤,宽基;表面斑驳状。B Borrmann II型。形成溃疡的肿块,相对于邻近黏膜其底部抬高,表现为溃疡周围的厚壁。C Borrmann III型。大溃疡,周围有浸润区;增厚的胃褶在溃疡边缘融合,提示癌症浸润。
ACRG提出将GC分为四种不同的亚型:1.MSI;2.具有上皮间质转化基因特征的微卫星稳定型(MSS);3.MSS和TP53活性型,4.MSS和失活型。
大体表现
早期胃癌大体上可分为三种主要类型:0-I、0-ll和0-lll(见图3.26和简表3.03,原书第86页)。根据Borrmann分类法,晚期胃癌在宏观上分为局部生长伴蕈样或溃疡外观,或浸润性生长伴或不伴溃疡。当有大量的纤维间质反应导致胃壁增厚和僵硬时,使用“皮革胃”或“硬癌”一词。
组织病理学
GC组织表型可能呈现显著的瘤内和瘤间异质性,这很可能是GC的许多组织病理学分类方案的原因。最常用的分类是日本癌症协会(JGCA)、WHO、Nakamura等人和Lauren发表的分类,表3.03对其进行了比较。Ming、Mulligan和Carneiro等人提出了其他分类方法。胃腺癌有五种主要的组织学亚型:管状、乳头状、低粘附性(包括印戒细胞和其他亚型)、黏液性和混合性腺癌。
表3.03 Lauren、Nakamura、JGCA和WHO胃癌分类的比较
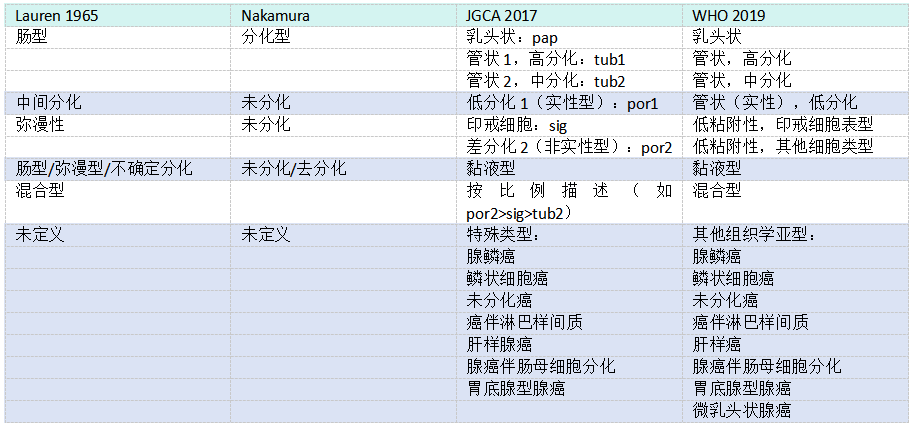
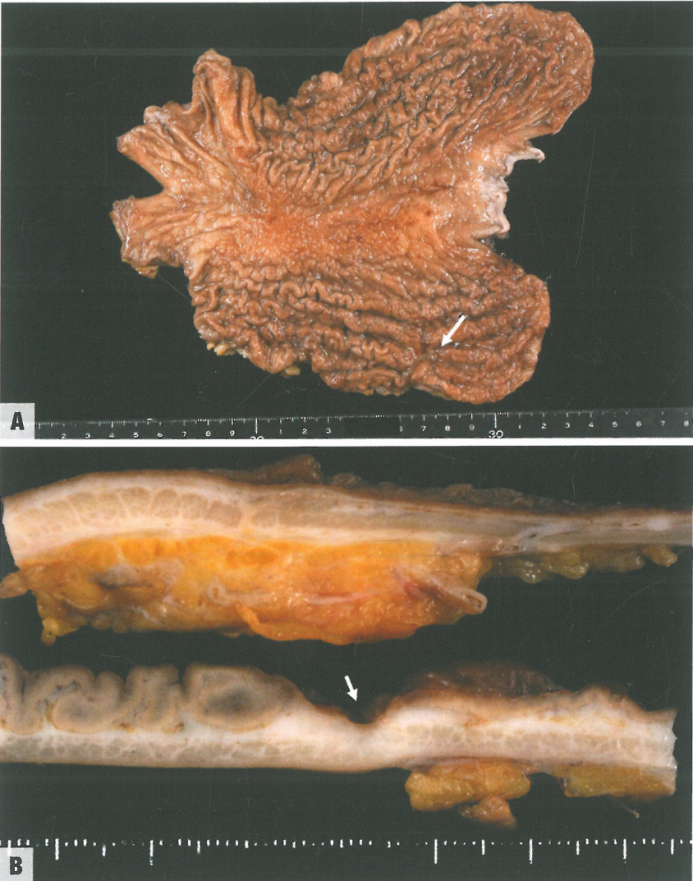
图3.30胃腺癌,Borrmann IV型,一个极端病例(皮革胃)。A 整个胃有显著的胃褶皱,类似于肥大的胃皱襞;褶皱的华夫饼状外观提示因硬癌样浸润而失去延展性;注意后壁大褶皱之间的小溃疡(箭头)。B 切面,弥漫的白色条纹勾勒出黏膜下层、固有肌层和浆膜下层;注意下图切面中心的浅溃疡(箭头;对应于图a的箭头)。
管状腺癌:最常见亚型,相对频率从欧洲的45%到日本全国性研究的64%不等。据报道,日本老年患者的发病率要高得多(72.4%)。该型由不同口径的、扩张的或狭缝状分支小管组成。也可能存在腺泡结构。单个肿瘤细胞可呈柱状、立方形,也可能因显著的腔内黏液或细胞碎屑而挤压变平。已识别一种透明细胞亚型,好发于贲门/食管胃交界区。具有实性结构和几乎无法辨认小管的肿瘤也归入这个类别;称为“管状(实性),低分化“,对应于JGCA分类中的“低分化1(实体型):por1”(见表3.03)。
乳头状腺癌:相对罕见的亚型,占GC的2.7-9.9%。通常显示外生生长模式,在组织学上最常见的是高分化,具有细长的指状突起,在纤维血管结缔组织轴心上被覆柱状或立方形细胞。一些肿瘤还含有小管(管状乳头状)。尽管乳头状腺癌呈高分化,伴推挤性浸润边缘并且常有炎症细胞浸润,但肝转移率高,生存率差。
低粘附性癌(PCC),包括印戒细胞癌及其他亚型:PCC占GC的20-54%,在日本患者中报告的频率更高。肿瘤细胞互相分离或聚集成小团,没有完好的腺体。PCC分为印戒细胞型和非印戒细胞型(PCC-NOS)。印戒细胞型主要或仅由印戒细胞组成,特征是含有居中、透明、球状的细胞质黏液小滴,核偏心。印戒细胞可能形成花边状腺体或精细的微小梁模式(特别是在黏膜中)。其他细胞亚型(非印戒细胞型:PCC-NOS)的肿瘤细胞可能类似组织细胞或淋巴细胞,或呈深嗜酸性胞质,或多形性低粘附性细胞伴奇异形核。可能见到不同细胞类型的混合,包括少量印戒细胞。PCC可能伴有明显的结缔组织增生,特别是在浸润到黏膜下层或更深层浸润时。有初步证据表明印戒细胞癌对化疗(放疗)的敏感性较低。RHOA突变GC的亚组主要或仅由PCC组成,伴有限的管状分化和黏膜边缘的渗透性生长模式。
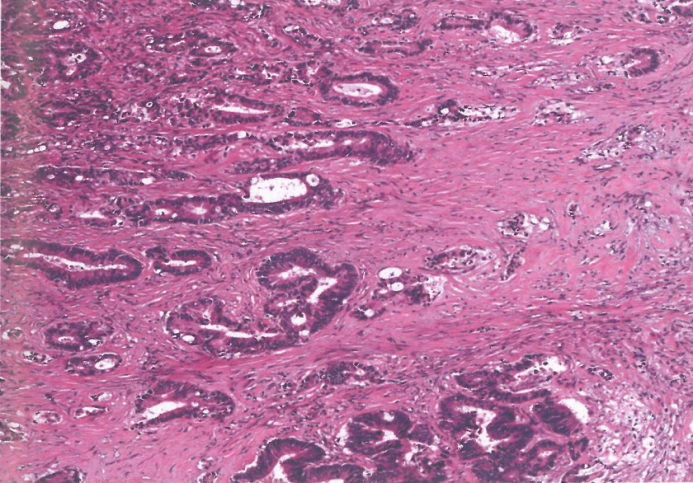
图3.31管状腺癌。肿瘤由浸润肌肉层的扩张小管组成。
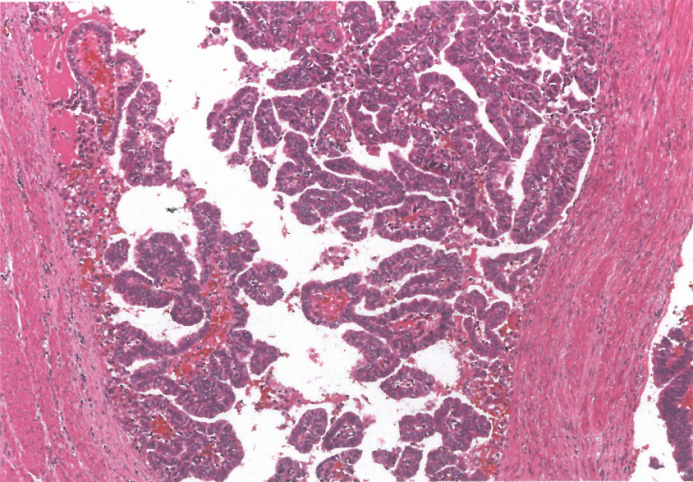
图3.32乳头状癌。肿瘤由细长的指状突起组成,有纤维血管结缔组织轴心,被覆柱状细胞。
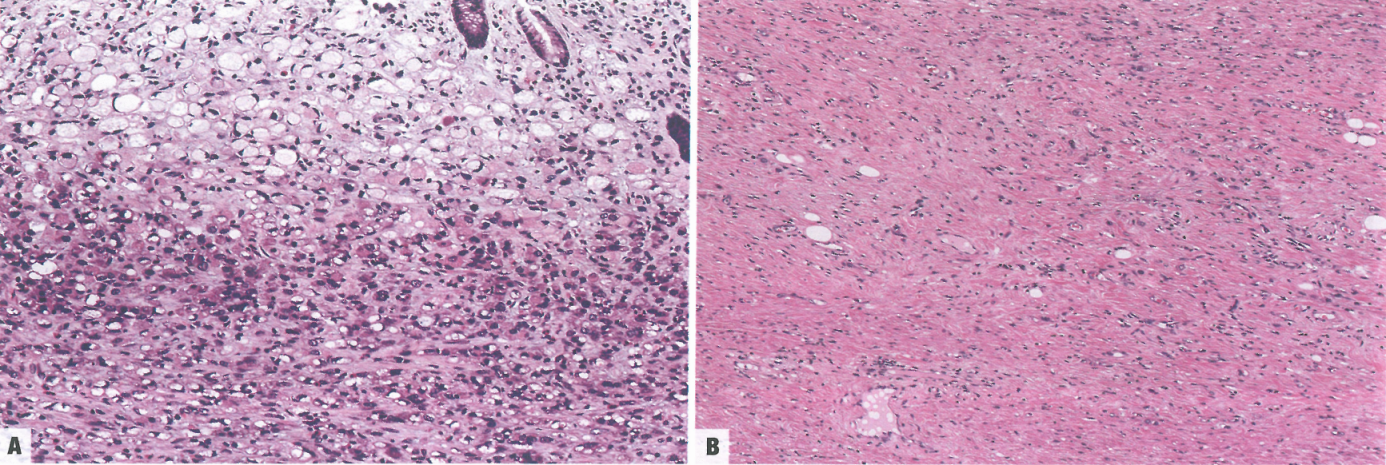
图3.33胃腺癌。A 印戒细胞型低粘附性癌。肿瘤主要由印戒细胞组成;黏膜表层肿瘤细胞较大。B 低粘附性癌NOS(即,非印戒细胞型)。肿瘤由非印戒细胞型的低粘附性细胞组成,这些细胞广泛浸润胃壁,并有明显的促结缔组织增生。
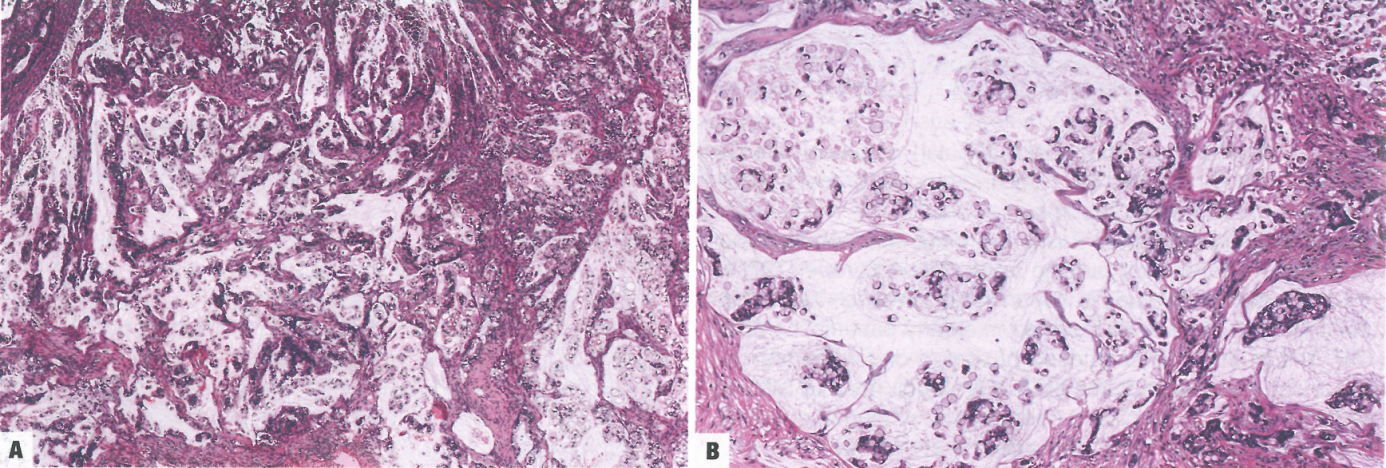
图3.34黏液癌。A 细胞外黏液池中可见恶性腺体。B 存在印戒细胞巢,漂浮在细胞外黏液中。
黏液腺癌:据报道,该亚型占GC的2.1-8.1%。由恶性上皮和细胞外黏液池组成,后者占肿瘤面积的50%以上。可以看到两种主要的生长模式:(1)可识别的腺体结构或小管,衬柱状上皮细胞,伴间质黏液;(2)黏液包围的链状、巢状或单个肿瘤细胞(可以看到印戒细胞)。最近的综合遗传学分析表明,后一种黏液腺癌的突变特征与肠型或弥漫型GC不同。
混合性腺癌:据报道,该亚型的相对频率为6-22%。这些癌显示两种或多种不同的组织学成分:腺体(管状/乳头状)和印戒细胞/低粘附性。应报告任何不同的组织学成分。混合癌似乎是克隆性的,它们的表型多样性归因于编码E-钙黏蛋白(CDH1)的基因中的体细胞突变,该基因仅限于印戒细胞/低粘附性的成分。现有数据表明,混合癌患者的预后比只有一种成分的患者差。
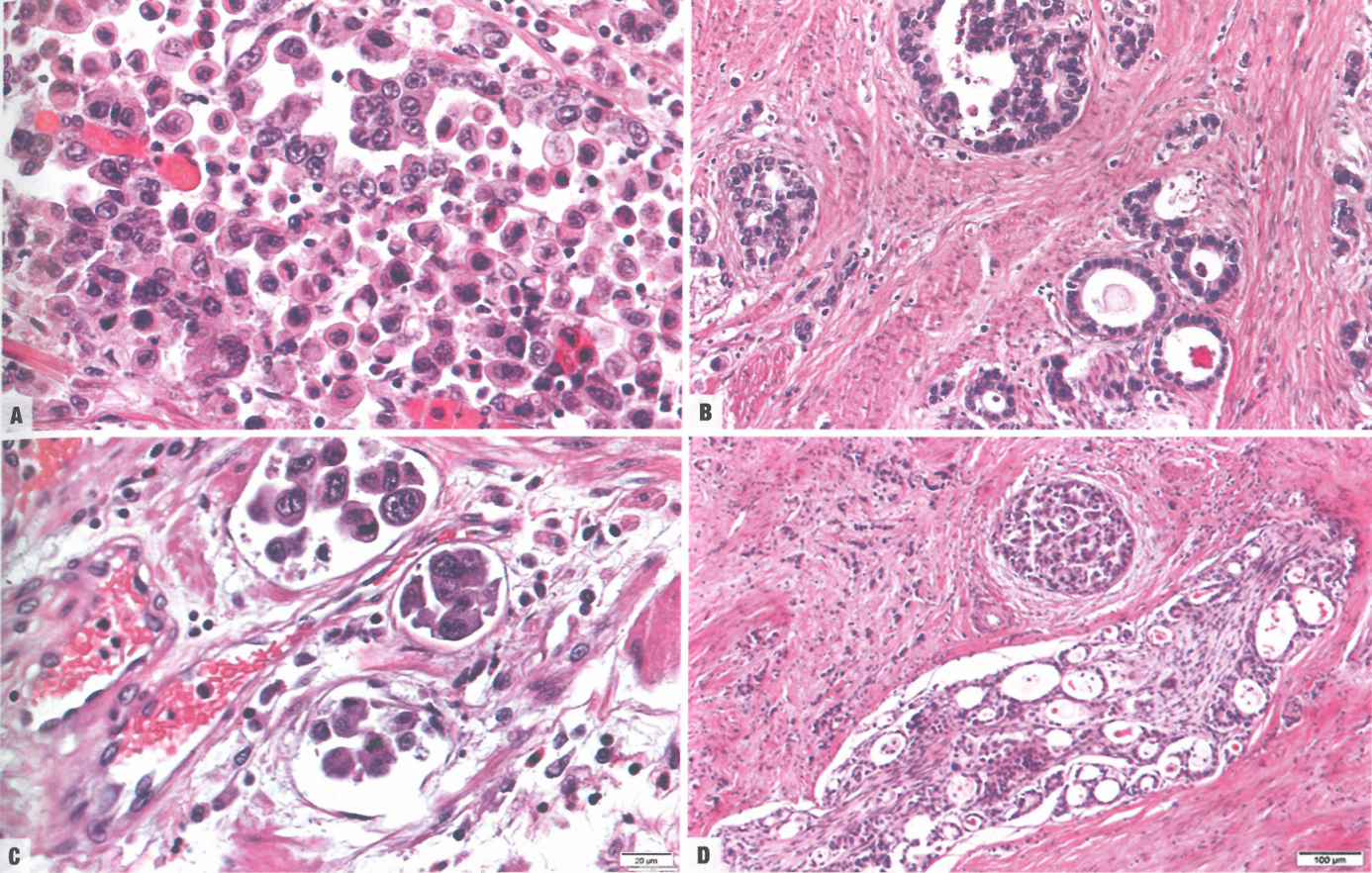
图3.35混合癌。A 低粘附性细胞成分。B 管状成分。C 低粘附性细胞的淋巴管浸润。D 管状成分的血管和神经周围侵犯。
其他和罕见的组织学亚型
胃(腺)癌伴淋巴样间质:据报道,这种亚型占胃癌的1-7%。也称为淋巴上皮瘤样癌和髓样癌。该亚型的特征是不规则的片状、小梁状、界限不清的小管或多边形合胞体细胞,埋陷在明显的浸润性淋巴细胞中,伴上皮内淋巴细胞。早期疾病呈特征性花边状模式伴吻合或分支腺结构。肿瘤通常位于胃近端或残胃,男性更常见。据报道该亚型的EBV感染率从22.5%到100%不等,EBER原位杂交检出率最高(>80%)。携带MSI和/或错配修复缺陷的胃癌亚群具有相似的组织学表型,但转录模式不同。
肝样腺癌和相关实体:肝样腺癌主要由大的多边形嗜酸性肝细胞样肿瘤细胞组成。免疫组化和血清学可检出AFP。可以观察到胆汁和PASD阳性的细胞质内嗜酸性小球。其他产生AFP的癌包括高分化乳头状或管状腺癌伴透明细胞质、腺癌伴肠母细胞分化和卵黄囊瘤样癌。这些组织学类型常有多种共存。据报道,肝样癌和产AFP癌的频率分别为所有GC的0.3-2%和2.6-5.4%。腺癌伴肠母细胞分化是一种显示管状乳头状结构的肿瘤,特征是柱状肿瘤细胞伴透明细胞质,类似于早期胎儿肠上皮。肿瘤可能表达胎儿肠道的标志蛋白,如SALL4、claudin-6和glypican-3(GPC3)。SALL4和claudin-6免疫组织化学在区分肝样腺癌和肝细胞癌方面具有诊断价值。
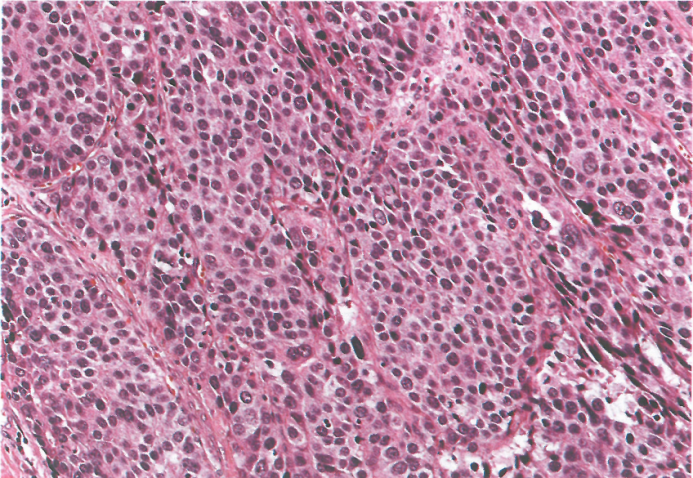
图3.36肝样腺癌。多角形细胞成片和条索,有丰富的嗜酸性细胞质,很像肝细胞癌。
微乳头腺癌:这种亚型的特征是存在小簇肿瘤细胞,没有纤维血管核心突入透明空隙。该成分占整个肿瘤的10%-90%,伴有管状或乳头状GC。据报道,食管胃交界处存在一种纯浸润性微乳头状癌。微乳头亚型预后不良,患者经常有淋巴结转移。
胃底腺型胃腺癌:该亚型可能由泌酸腺腺瘤发展而来,占内镜黏膜下剥离治疗的早期胃癌的1%。根据肿瘤的组成,特征性的泌酸腺分化可分为三种:以主细胞为主(约占报告病例的99%)、以壁细胞为主和混合表型。60%的病例观察到黏膜下浸润。免疫组织化学显示胃蛋白酶原I和MUC6均呈阳性。一些细胞也向壁细胞分化(H+/K+ATP酶阳性)。这种GC亚型生长缓慢,淋巴结转移极为罕见。
罕见亚型:包括黏液表皮样癌、Paneth细胞癌和壁细胞癌。
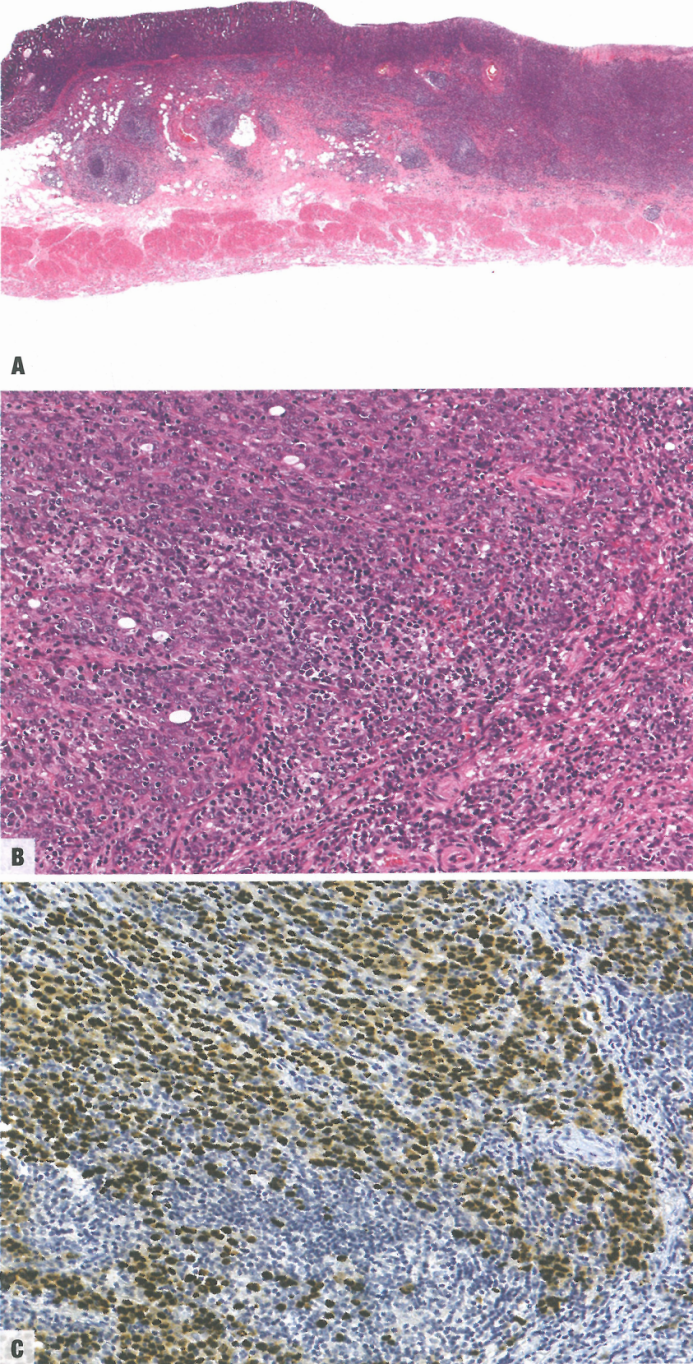
图3.37胃癌伴淋巴样间质(EBV阳性胃癌)。A 低倍,癌灶附近黏膜下层的淋巴滤泡。B 癌细胞形成小巢或融合腺体,伴大量淋巴细胞浸润。C EBER原位杂交,癌细胞核呈阳性。淋巴细胞核呈阴性。
分级
分级主要适用于管状和乳头状癌,不适用于其他GC亚型。因此,高分化腺癌由完好的腺体组成,而低分化腺癌由不完好腺体组成,并可能显示实性区域或单个细胞。分级最好使用两级系统进行:低级别(以前的高分化或中分化)与高级别(以前的低分化)。
肿瘤扩散
GC可以通过直接延伸到邻近器官、通过淋巴和/或血液扩散和/或通过浆膜传播。应系统评估淋巴管血管浸润;它是生物学侵袭性的指标,可能是淋巴结阴性GC的预后因素。管状/乳头状癌很可能通过血行扩散引起肝转移,而PCC更可能累及浆膜。混合性肿瘤表现出两种类型的转移模式。广泛的肿瘤扩散在PCC中尤为常见,PCC经常在浆膜表面显示广泛的扩散,远远超出了肉眼可见的范围。因此,最好对纵向边缘进行冰冻切片检查,特别是在切除范围<4cm的病例,以评估是否完整切除。如果癌细胞穿透浆膜,常发生大量腹膜种植。双侧大面积卵巢受累(Krukenberg肿瘤)可由腹膜或血液传播引起。GC患者很少发生肺的癌性淋巴管炎和肿瘤血栓性微血管病。
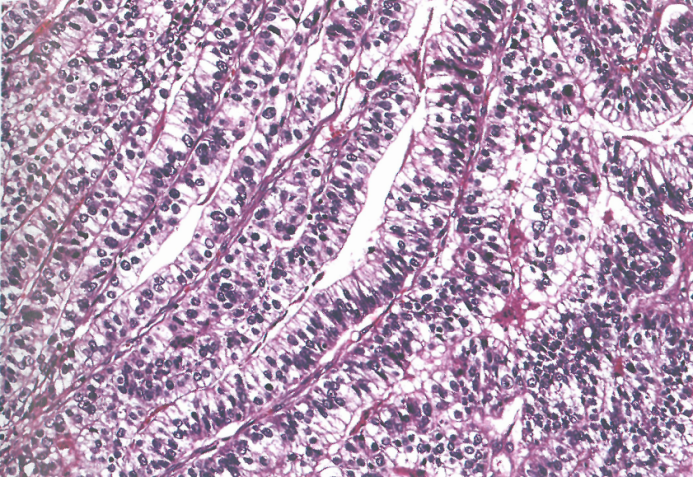
图3.38腺癌伴肠母细胞分化。腺体由柱状肿瘤细胞组成,其特征是富含糖原的透明细胞质,就像胎儿肠道上皮。
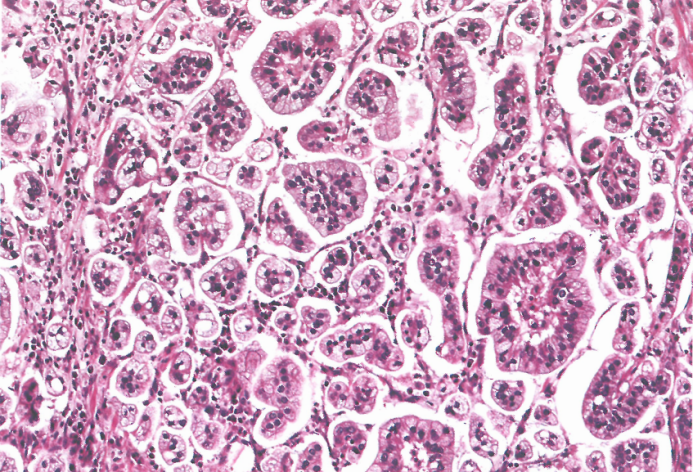
图3.39浸润性微乳头腺癌。肿瘤簇显示“里面朝外”的生长模式,细胞的管腔极位于细胞簇的外表面。
治疗反应
新辅助治疗可能会改变组织病理学外观。肿瘤反应从未见反应到病理完全反应不等,可以通过肿瘤消退等级(TRG)进行评估。已经提出了各种方法,包括Becker和Mandard系统,该用哪种TRG系统,国际上没有共识。
细胞学
腹膜灌洗细胞学已被用于GC分期和监测GC的辅助化疗。细胞学异常包括细胞核形状不规则、核质比高、核深染和核大小不一。据报道,尽管没有肉眼可见的腹膜转移,但腹膜灌洗中存在单个印戒细胞、>5个细胞簇或>50个分离的癌细胞会影响R1切除的临床结局。
诊断分子病理学
目前不建议常规评估MSI和PD-L1,但胃腺癌是靶向PD1/PD-L1轴的免疫治疗的良好潜在候选者,这些生物标记物目前正在临床试验中进行研究。
诊断标准
必要标准:肿瘤性腺细胞浸润固有层或更深层的证据;免疫组织化学检测(可能是验证某些组织亚型以及小活检和转移所必需的)。
理想标准:ERBB2(HER2)免疫组织化学(如果考虑抗ERBB2治疗,则需要)。
分期(TNM)
根据国际癌症控制联盟(UICC)TNM分类的第八版和美国癌症联合委员会(AJCC)癌症分期手册,累及食管胃交界处的肿瘤(肿瘤中心距近端胃<2cm)分期为食管癌;中点位于胃近端2cm以上的肿瘤被分为GC,即使累及食管胃交界处也是如此。胃中所有未穿过食管胃交界处的肿瘤都按GC分期。
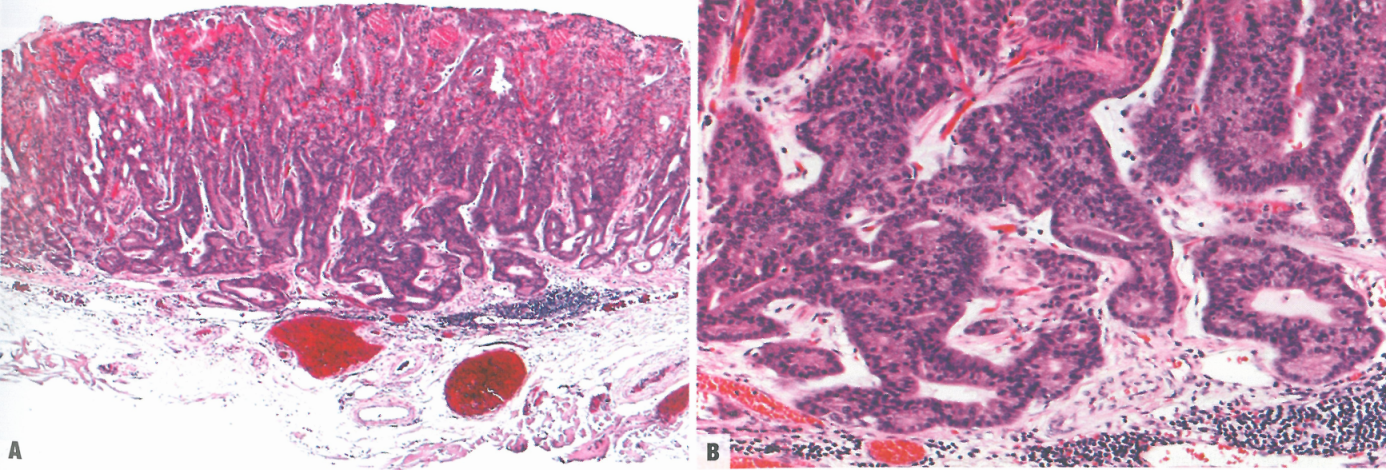
图3.40胃底腺型胃腺癌。A 低倍,注意肿瘤中心部分的黏膜下浸润。B 浸润性癌的高倍,由未成熟的胃底腺型肿瘤细胞组成。
表3.04 JGCA治疗指南,根据内镜切除标本的组织病理学检查,对癌症内镜治疗提出的治疗建议

EMR,内镜黏膜切除术;ESD,内镜黏膜下剥离术。
a 根据Nakamura分类;见表3.03(原书第89页)JGCA和WHO的相应分类。
b 如果水平边缘呈阳性,则需要额外的内镜治疗或手术。
预后和预测
预后因素
分期:pTNM分期系统目前是GC患者预后预测的最重要因素。pT1(肿瘤侵犯固有层、黏膜肌层或黏膜下层)和pNO(无区域淋巴结转移)GC患者的5年生存率>90%。随着pT和pN类别的增加,生存率呈阶梯式下降。pT4b GC患者的5年生存率为30%,pN3b GC患者为20%,IIIC 期GC患者为20%。
组织学:有人认为组织学表型可能影响预后。日本对GC内镜治疗的建议是基于病变的大小和组织病理学特征(见表3.04)。必须对切除的标本进行详细的组织病理学检查,以确定哪怕是微小的黏膜下浸润病灶或其他表明需要进一步治疗的特征。具有丰富纤维间质的PCC患者(皮革胃或硬癌)预后最差,5年生存率<15%。
分子特征:最近发现的分子特征不仅对提高我们对胃癌发生过程中驱动因素变化的理解很重要,而且可能有助于确定临床相关的生物标记物和未来新的潜在治疗靶点。
表3.05 TCGA提出的胃癌的四种分子亚型的关键特征
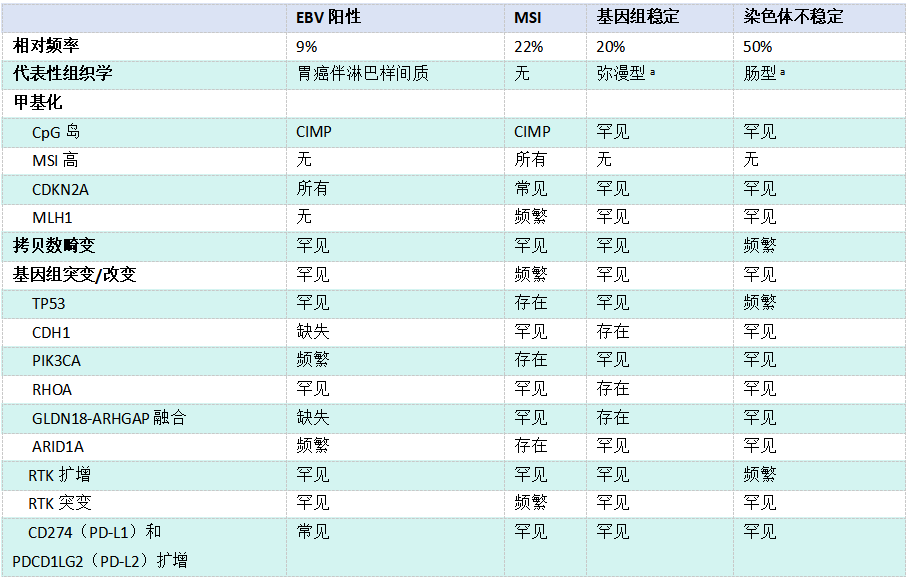 CIMP、CpG岛甲基化子表型;MSI,微卫星不稳定;RTK,受体酪氨酸激酶。
CIMP、CpG岛甲基化子表型;MSI,微卫星不稳定;RTK,受体酪氨酸激酶。
a TCGA使用的Lauren组织学分类;日本癌症协会(JGCA)和WHO的相应分类见表3.03(原书第89页)。
已建立的预测性生物标记物
ERBB2(HER2):抗ERBB2治疗对不可切除或转移/复发ERBB2阳性GC的患者有益,ERBB2检测用于预测潜在的治疗反应。ERBB2状态主要通过免疫组织化学评估;如果发现不明确,建议使用ERBB2原位杂交。ERBB2过表达/ERB2扩增的预后价值在一些研究中得到了证实,但在其他研究中没有得到证实。
部分建立和/或正在研发的预测性生物标记物
受体酪氨酸激酶:EGFR扩增已被认为是II/III期GC的独立预后因素。同样,在接受标准化疗的患者中,c-MET状态被认为是不可切除或复发GC的独立预后因素。
MSI和EBV:EBV阳性或MSI/错配修复缺陷的GC预后优于EBV阴性或MSS/错配修复正常的病例。因此,GC与淋巴样间质的组织学识别、通过EBER检测EBV以及检测MLH1的高甲基化是预后良好的生物标记物。
癌症免疫疗法:已提出肿瘤突变负荷、肿瘤内CD8+T细胞浸润密度和PD-L1表达作为免疫检查点阻断治疗反应的生物标记物。在TCGA提出的四种分子亚型中,具有错配修复基因启动子甲基化的MSI GC的特征是突变频率高,在EBV阳性GC中,PD-L1的扩增和表达升高分别为10-15%和30-50%。因此,这两种分子亚型可能是靶向PD1/PD-L1轴的免疫治疗的良好潜在候选者,目前正在临床试验中进行研究。
其他预测/预后生物标记物:已经发表了大量的单基因标记物研究,包括EGF/TGF-A、VEGF-A、CD44、E-钙黏蛋白、MMP1、MMP7、MMP10、SPC18和原钙黏液B9的研究。已经提出了几种具有预后价值的综合分子图谱。某些microRNA特征与GC的存活率有关。然而,尚未将其引入临床实践。
未完待续......


































共0条评论