往期回顾:
消化系统肿瘤WHO分类第五版学习笔记(一)
消化系统肿瘤WHO分类第五版学习笔记(二)
消化系统肿瘤WHO分类第五版学习笔记(三)
4 良性上皮肿瘤及其前驱病变
01. 胃底腺息肉
定义
胃底腺息肉(FGP)是良性胃上皮病变,成于深层泌酸黏膜上皮成分的增生性扩张。
ICD-0编码
无
ICD-11编码
DA44.1胃的胃底腺息肉
相关术语
可接受:Elster囊肿。
亚型
无
部位
FGP仅在泌酸黏膜中出现。
临床特征
这些息肉通常无症状,在内镜检查时偶然发现。在年轻患者中发现FGP(特别是息肉数量多,例如>20枚),必须考虑息肉综合征。FGP伴发十二指肠腺瘤时,应强烈怀疑家族性息肉综合征,并建议进行结肠镜检查。
流行病学
这些息肉是食管胃十二指肠镜检查中发现的最常见的息肉类型。它们可能发生在任何年龄,并且以女性为主。在美国的一项大型病理学研究中,7.2%接受食管胃十二指肠镜检查的患者被诊断为FGP,占所有提交组织病理学评估的胃息肉的70-90%。患有家族性息肉综合征的患者通常比FGP的患者年轻(平均年龄:40岁)。
病因
它们可能偶尔发生,也可能是几种息肉病综合征的一部分,包括家族性腺瘤性息肉病、胃腺癌和胃近端息肉病(GAPPS)。首次发现时,这些息肉被认为是错构瘤;然而,几项研究证实,它们与质子泵抑制剂的使用有关,这表明散发性环境中的机制可能与质子泵抑制剂抑制酸分泌有关,这是其发病机制的一部分。FGP与HP胃炎呈负相关:200名HP性胃炎患者中有<1名患有FGP。
发病机制
息肉是由泌酸腺增生和扩张引起的。散发性FGP没有APC突变,但可以在CTNNB1(编码β-catenin)中发生突变。涉及CpG岛甲基化的表观遗传学改变在一些具有质子泵抑制剂作用的FGP的发生中发挥作用。CTNNB1突变见于64-91%的无异型增生的散发性FGP。异型增生的FGP可能携带APC突变,通常与野生型CTNNB1一起。家族性腺瘤性息肉病相关的FGP具有双等位基因APC突变和野生型CTNNB1。
大体表现
FGP表现为多个小息肉(通常<5mm)。
组织病理学
FGP通常表现为扩张的泌酸腺、胃小凹发育不全和壁细胞增生。息肉糜烂可以合并再生变化,后者可能被误认为异型增生。
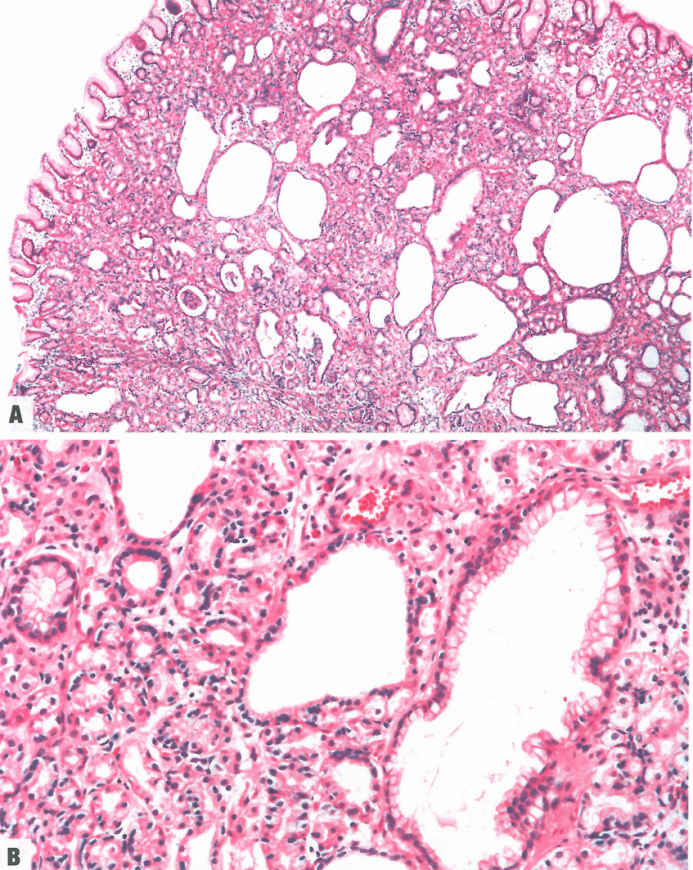
图3.01胃底腺息肉。A 低倍,有许多密集的胃底腺,腺腔扩张。B 高倍,扩张的腺体内衬平坦的泌酸腺细胞或胃小凹上皮。
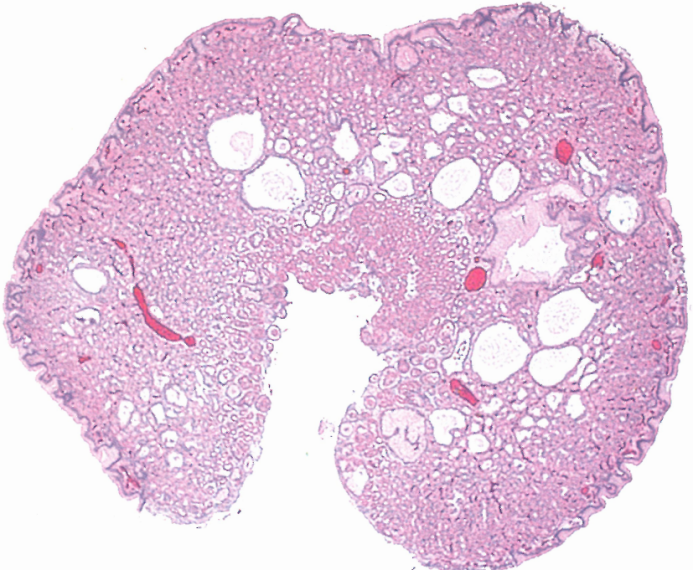
图3.02胃底腺息肉。典型病例的低倍;有许多扩张的泌酸腺,内衬平坦的壁细胞;还有两个扩张的黏液腺,衬小凹细胞。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:深层泌酸黏膜上皮成分的增生性扩张,伴一个或多个泌酸腺扩张;壁细胞增生;小凹发育不全。
分期(TNM)
无临床相关性
预后和预测
当治疗中断时,与质子泵抑制剂治疗相关的偶发性FGP消失。目前还没有关于散发性环境中发生恶性转化的可靠报告。有关遗传学背景的信息,请参阅GAPPS和其他胃底腺息肉(原书第526页)。异型增生在散发性FGP中很少见,但在综合征环境中并不少见(见GAPPS和其他胃底腺息肉,原书第526页)。
02. 胃的增生性息肉
定义
胃增生性息肉是一种良性胃上皮病变,其特征是拉长或扭曲的(增生性)小凹和囊性扩张的腺体与炎症变化共存。
ICD-0编码
无
ICD-11编码
DA44.0胃增生性息肉
相关术语
可接受:炎性息肉。
亚型
息肉样小凹增生;黏膜脱垂息肉;囊性息肉性胃炎(深部)
部位
增生性息肉最常见于胃窦。
临床特征
增生性息肉可能是多发性的,通常无症状。由于表面糜烂而出血可能导致缺铁性贫血。很少情况下,影响幽门转运的大息肉可能会导致梗阻或亚梗阻。
流行病学
增生性息肉没有性别差异。它们通常发生在50-70岁(中位年龄:66岁),大多数发生在长期胃炎的背景下。在一项美国78 909名内镜检查患者的研究中,6.4%的患者患有息肉样病变;在息肉样病变患者中,增生性息肉的患病率为17%。在一项病例对照研究中,对71575例胃息肉患者和741351例无胃息肉对照组受试者进行研究,所有受试者中增生性息肉的总体患病率为1.79%(胃底腺息肉:7.72%,胃腺瘤:0.09%,神经内分泌肿瘤[NET]:0.06%)。随着年龄的增长,所有类型的胃息肉的患病率都明显增加。在一项针对153名至少有一个胃息肉的巴西患者的研究中,增生性息肉约占病例的71%。
病因
具体病因尚不清楚。然而,与慢性胃炎有很强的相关性,包括胃切除术后胃炎和HP胃炎。
发病机制
增生性息肉是对组织损伤的过度增殖反应,在恶性转化灶中检测到TP53突变和p53过表达。
大体表现
胃增生性息肉可表现为小圆顶形息肉,通常大小<1cm,也可表现为分叶状和带蒂的大息肉,伴有糜烂。
组织病理学
典型特征包括细长、扭曲、分支和扩张的增生性小凹,位于水肿、发炎的间质中,富含脉管系统。存在小的、随意分布的平滑肌束。1%至20%的增生性息肉存在异型增生,约2%可能有癌灶,特别是当息肉大小>1cm时。
息肉样小凹增生是一种微小的息肉样病变(<10mm),由细长的小凹组成,没有扩张的特征,固有层正常或仅轻微肿胀。息肉样小凹增生被认为是胃增生性息肉的前驱病变。
胃黏膜脱垂息肉的特征是固有层中存在腺体成分、厚壁血管和有序的粗大树枝状平滑肌束。这些息肉可能发生在胃窦,可能有不同的发病机制。
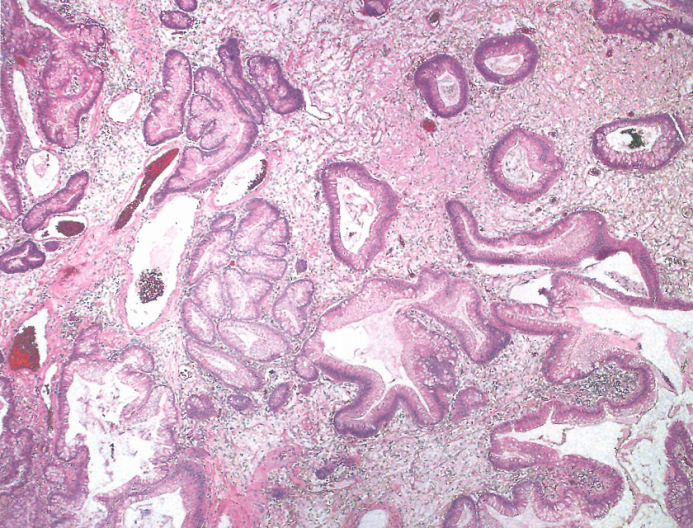
图3.03胃增生性息肉。特征包括在疏松水肿的间质背景,形状不规则、杂乱扩张的小凹,以及数量不等的炎细胞。表面经常糜烂。
囊性息肉性胃炎(深部)是一种良性息肉样增生,腺体囊性扩张经常延伸到黏膜下层。病变大多沿Billroth II吻合口的间质呈线性排列。
胃增生性息肉应与其他散发性息肉(胃底腺息肉、腺瘤性息肉)和胃息肉病表现的息肉(青少年息肉病和Cowden综合征)区分开来。错构瘤性内翻性息肉是一种孤立的息肉样病变,其特征是增生性和囊性腺体成分向下生长到黏膜下层。黏膜肌层与正常层相连,将病变分开。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:由细长和扭曲(增生)的小凹上皮组成的息肉;囊性扩张的腺体混合炎症变化。
理想标准:糜烂、溃疡和(部分病例中广泛的)炎症(息肉的预期特征)。
分期(TNM)
无临床相关性
预后和预测
大小>10mm的增生性息肉中存在异型增生和腺癌病灶已有报道。如果发现异型增生或黏膜内癌,但蒂部未受累,则可以认为病变已完全切除,有可能治愈。
03. 胃的异型增生
定义
胃异型增生由胃上皮的明确肿瘤性变化组成,没有间质浸润的证据。
ICD-0编码
8148/0腺上皮内肿瘤,低级别
8148/2腺上皮内肿瘤,高级别
ICD-11编码
2E92.1&XH6AF9胃良性肿瘤&腺上皮内肿瘤,低级别
2E60.2&XH28N7胃原位癌&腺上皮内肿瘤,高级别
相关术语
可接受:上皮内肿瘤。
亚型
锯齿状异型增生,低级别(8213/0);锯齿状异型增生,高级别(8213/2);肠型异型增生;小凹型(胃型)异型增生;胃小凹/隐窝异型增生
部位
异型增生最常见于胃窦。然而,在广泛的化生萎缩中,任何胃分区都可能出现异型增生病变。异型增生的部位分布符合早期分化型胃腺癌的部位分布(在胃的下、中、上三分之一分别为51%、40%和8%)。
临床特征
异型增生大多无症状;症状通常与患者的潜在疾病有关。出血、贫血或消化不良可能是由大病灶或溃疡性病变引起。
内镜下,胃异型增生表现为平坦、凹陷或隆起(息肉样)病变,伴有糜烂/溃疡和色调变化。显示这些内镜异常的黏膜靶向活检可以考虑异型增生。在随后切除的标本中,大多数明确的异型增生病变,特别是那些在常规内镜下表现为凹陷和红斑的病变,被证明是高级别异型增生(HGD)/黏膜内腺癌。通过窄带成像放大内镜可以大大改善内镜评估,能够更准确地检测异型增生病变,并能同时注意到表面上皮和上皮下血管的结构。
息肉样、隆起甚至平坦的异型增生也被称为腺瘤(肠型和小凹型;请参阅相应章节)。
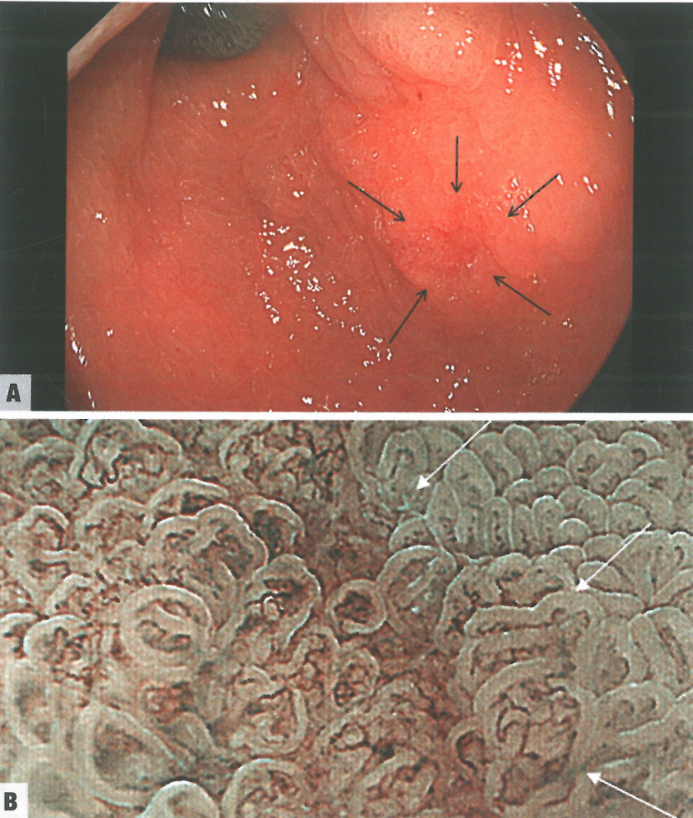
图3.04胃异型增生。A 通过传统白光内镜在胃窦内发现一个轻微凹陷和微红的区域(箭头),大小为4 x 3mm。B 高级别异型增生的窄带成像(放大内镜);注意具有不规则微血管和微表面结构的界限分明的区域(箭头)。
流行病学
胃异型增生的患病率反映了癌症(GC)的患病率,并且在大多数系列中类似地显示出男性占主导地位。它也显示出同样的地理差异,亚洲部分地区发病率很高,北美和欧洲部分地区的风险要低得多。在发病率高的地区,内镜筛查发现10-15%的参与者胃黏膜异常。夹取活检显示,在这些病变中,1-2%为低级别异型增生(LGD),4-6%为HGD和腺癌(分别占所有参与者的0.1-0.2%和0.4-0.5%)。在韩国,报告了类似的发病率,在7年的时间里,40821名参与者中,腺瘤、早期胃癌和晚期胃癌的发病率分别为0.43%、0.21%和0.09%。
病因
胃异型增生的致病危险因素与胃腺癌相似。
表3.02胃癌发生过程中涉及的组织学表型分类,每种表型按恶性肿瘤风险增加的顺序列出类别
发病机制
胃异型增生病变的分子谱可能因异型增生表型组织学评估中应用的不同标准而出现部分偏倚(见表3.02)。在浸润性胃癌(尤其是肠型胃癌)中观察到的许多分子改变也可能在胃异型增生中检测到。这些异常包括染色体不稳定、微卫星不稳定(MSI)和CpG岛甲基化。
TP53的功能丧失是胃癌发生的主要驱动因素。根据最近的数据,TP53突变和p53过表达分别在HGD(均为40%)和黏膜内癌(分别为60%和73%)中检测到。APC突变在LGD和HGD中存在的频率很高(约70%),但在黏膜内癌中的发生率低(4-20%)。
MSI是由DNA错配修复系统的异常引起的,包括MLH1启动子的CpG岛甲基化。MSI高表型的异型增生显示基因突变数量增加(富含indel型)。其中,RNF43异常与HGD和黏膜内癌有关。
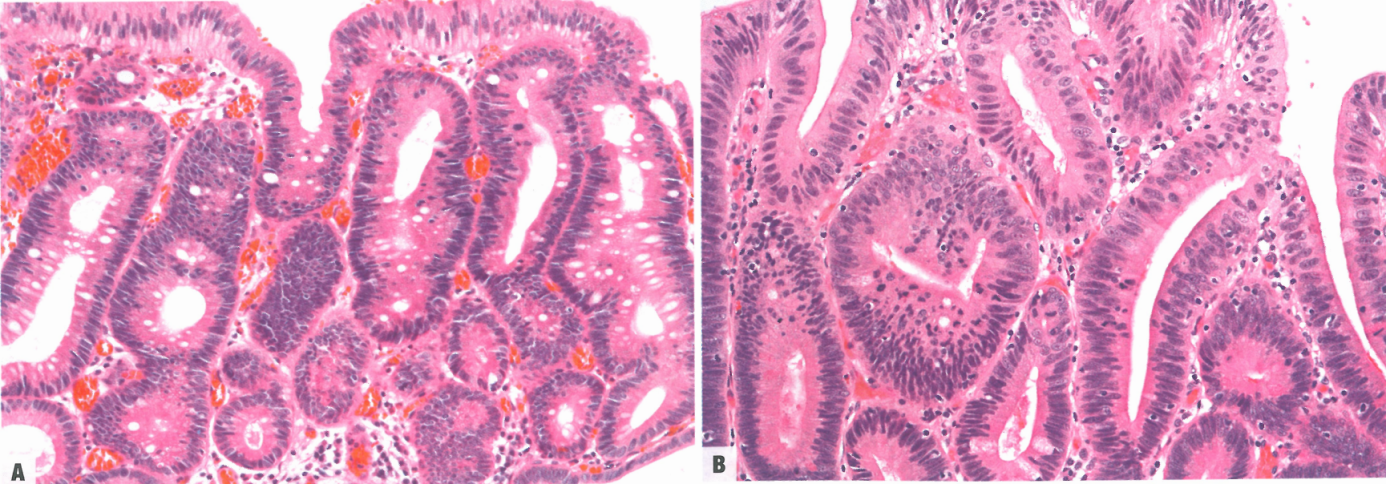
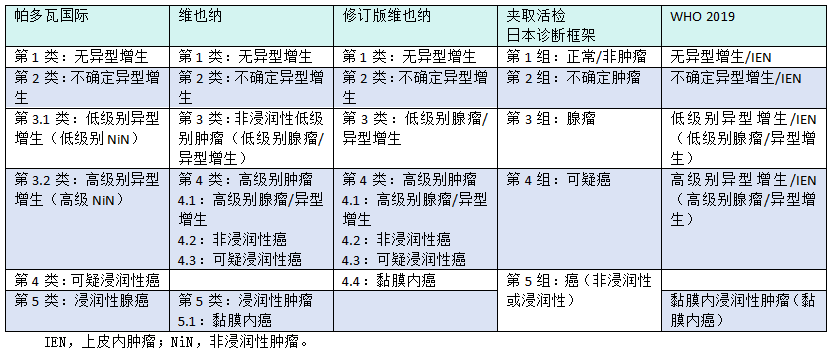
图3.05胃的肠型异型增生。A 低级别异型增生;注意高柱状细胞分化为肠型细胞,其核拉长,位于基底。B 高级别异型增生;注意高柱状细胞分化为肠型细胞,核方向紊乱。
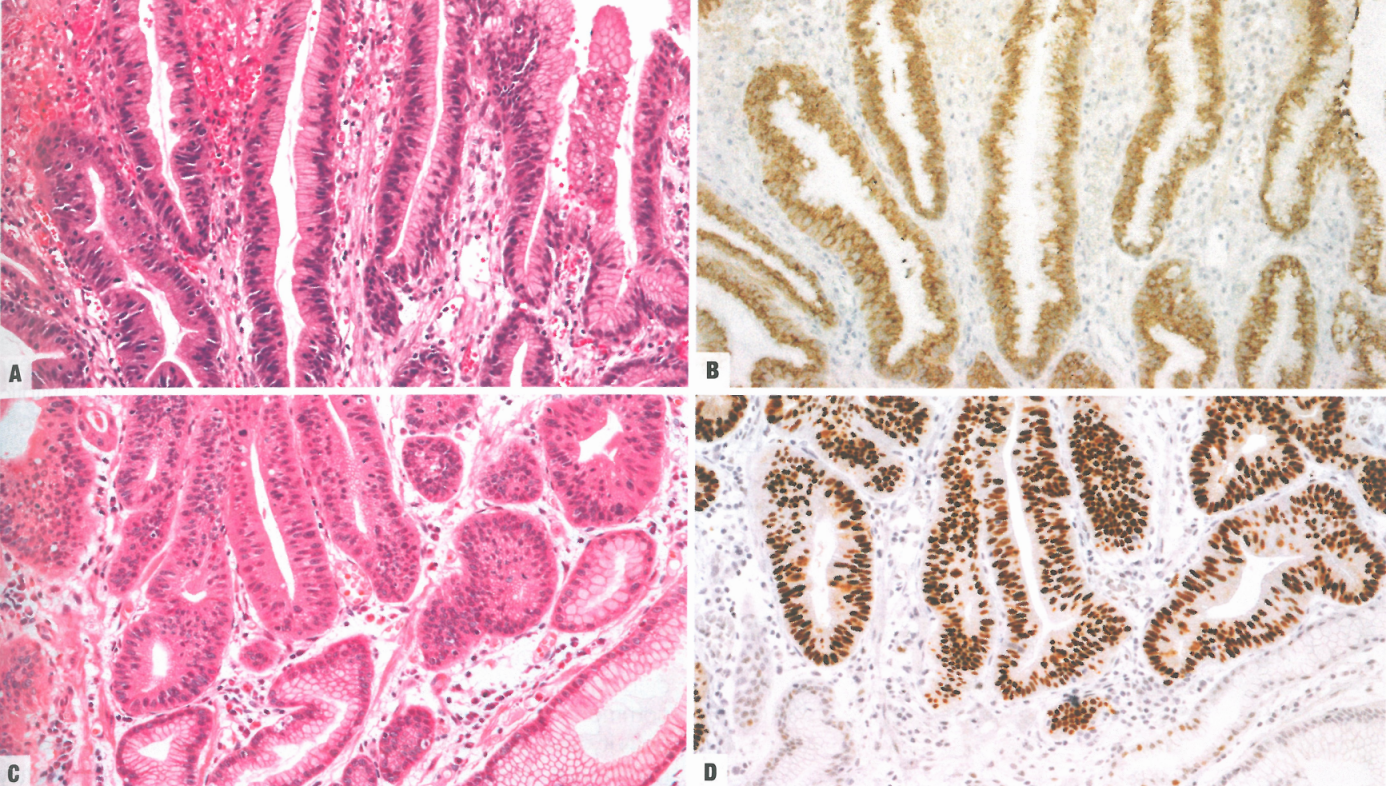
图3.06胃小凹型胃异型增生。A 低级别异型增生;高柱状细胞分化为小凹细胞;核细长、位于基底。B 异型增生细胞呈MUC5AC阳性。C 高级别异型增生;高柱状细胞核的方向紊乱。D 高级别异型增生;p53过表达。
大体表现
胃异型增生表现为平坦、凹陷或隆起(息肉样)病变。
组织病理学
胃异型增生具有异时性或同步性胃腺癌的患癌风险。胃异型增生的分级基于帕多瓦国际(Padova International)和维也纳(Vienna)系统,使用二级系统(LGD 与 HGD),已证明该系统具有相对的可重复性和临床相关性。对于胃癌发生过程中出现的组织学表型,已经提出了各种分类(见表3.02)。每种分类都反映了其特定的疾病导向(生物、临床或治疗)。当临床考虑手术治疗时,大多数国际指南建议获得治疗前的第二诊断意见。
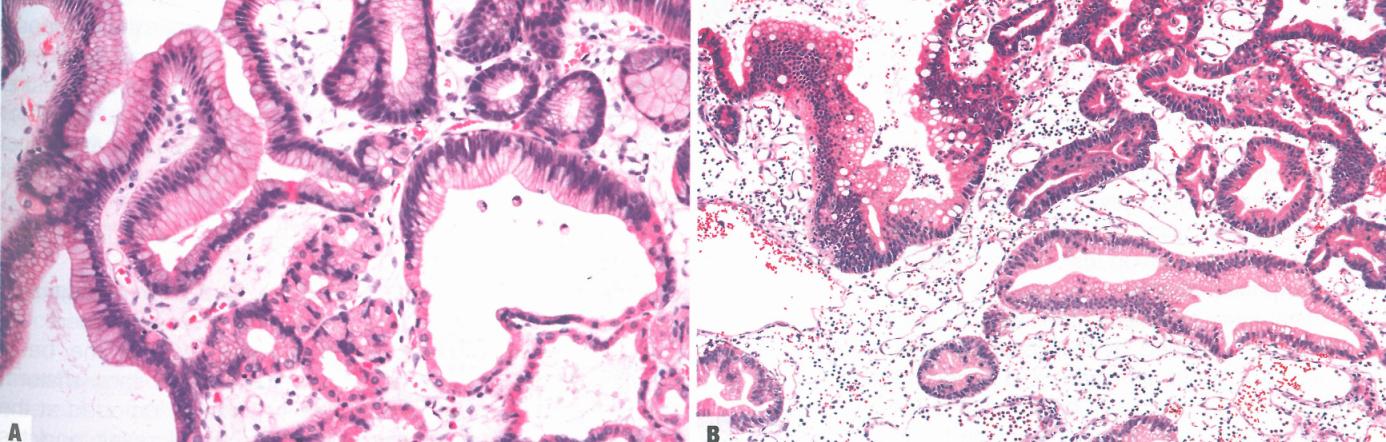
图3.07息肉中的胃小凹型胃异型增生。A 胃底腺息肉表面的低级别异型增生。B 高级别异型增生和黏膜内腺癌起源于增生性息肉;小凹型和杯状细胞的混合。
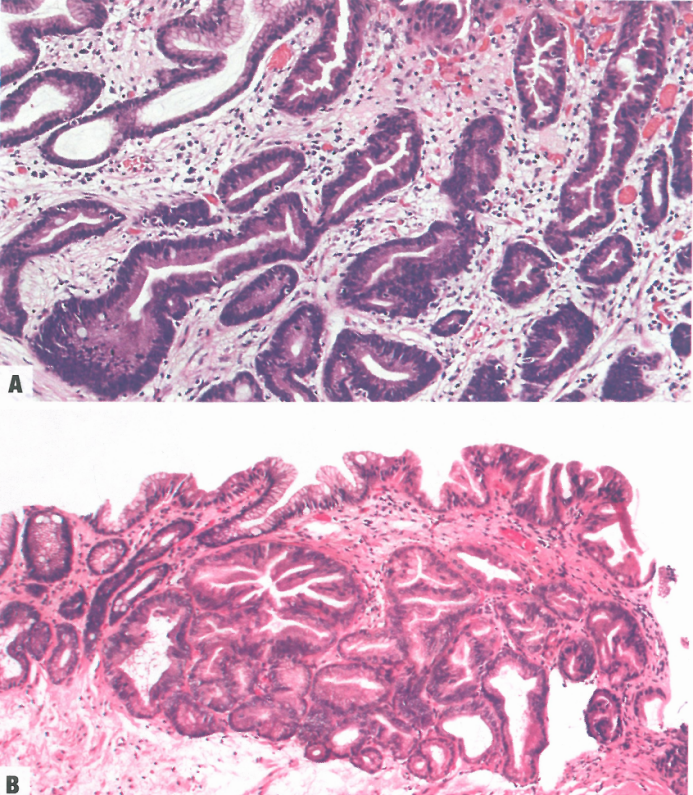
图3.08异型增生的亚型。A 隐窝型/小凹异型增生;异型增生核变化仅限于胃小凹,表面成熟呈锯齿状。B 锯齿状异型增生。
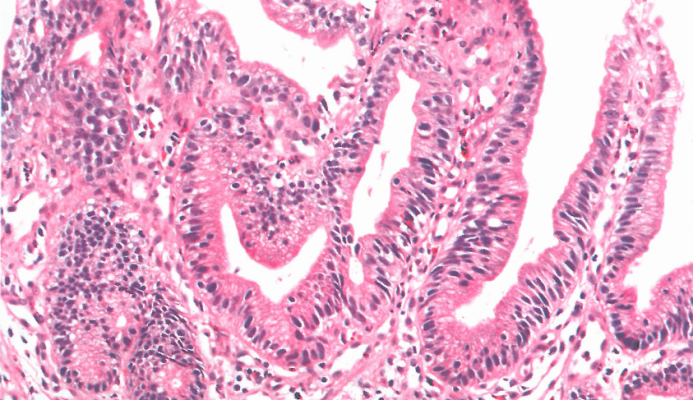
图3.09再生性非典型。注意上皮细胞的表面成熟伴炎症背景。
分型
胃异型增生的两大类是肠型和胃小凹型。然而,许多病例是混合的。异型增生可从头发生,也可发生于先前存在的良性病变,如胃底腺息肉和增生性息肉。
肠型异型增生由管状、管状绒毛或绒毛状病变组成,内衬高柱状细胞。细胞核增大、拉长、分层和深染。细胞质不同程度地嗜酸性。常见向吸收型细胞、杯状细胞、内分泌细胞甚至Paneth细胞的终末分化。免疫组化,肠型异型增生表达MUC2、CD10和CDX2。
胃小凹型异型增生的特征通常为管状绒毛状乳头结构和/或锯齿状腺体结构,内衬类似于胃小凹细胞的立方形至低柱状细胞。核呈圆形至椭圆形,有不同程度的明显核仁。因胞质顶端存在中性黏液,细胞呈现淡嗜酸性,表达MUC5AC。很少观察到MUC2阳性杯状细胞,MUC6阳性细胞可能出现在腺体底部。
分级
根据核异型性(即拥挤、增生和分层)、核分裂活性、细胞质分化和结构扭曲的程度,将异型增生分为低级别或高级别,不管形态类型如何。在LGD中,明确的肿瘤细胞显示出轻微的结构紊乱,只有轻中度细胞学异型性。核深染,在肠型异型增生中呈细长形(雪茄形),在小凹型呈圆形至椭圆形。在这两种类型中,核都保持极性,并且位于基底部。轻中度核分裂活性。腺体结构的相对保存是LGD的特征。
HGD显示立方至柱状细胞,具有明显的细胞学异型性,核增大,核质比高,常有显著的双染性核仁。常见核极性丧失和非典型核延伸到管腔表面。经常检测到核分裂象(包括非典型核分裂象)。腺体结构通常复杂,明显扭曲,包括背靠背的腺体。然而,明显的腺体拥挤、出芽和筛状结构应提示黏膜内腺癌的诊断。即使观察到轻微的细胞学异型性,具有明显结构异型性(例如大小和形状各异的腺体)的病例也应诊断为HGD。HGD还包括原位癌。在这些病变中经常观察到p53的过表达。
关于胃异型增生和腺癌的诊断标准,尤其是日本与北美、欧洲和韩国的病理学家之间的共识有限。日本病理学家根据细胞结构异型性确定腺癌的诊断,而不考虑间质浸润的证据。在北美、欧洲和韩国,病理学家的诊断主要基于基底膜的破坏以及癌细胞向固有层的扩散。在日本,具有高级别细胞和/或结构异型性的胃非浸润性肿瘤病变被诊断为非浸润性癌,而其他国家的大多数病理学家将相同病变归类为HGD。
亚型
已识别胃异型增生的几种亚型,但其临床意义尚不完全清楚。
胃小凹/隐窝异型增生显示胃小凹基底部异型增生。腺体结构显示为表面上皮细胞的成熟。据报道,在49-72%的病例中,它位于传统肿瘤的边缘,一般认为是癌症进展的独立预测因素。
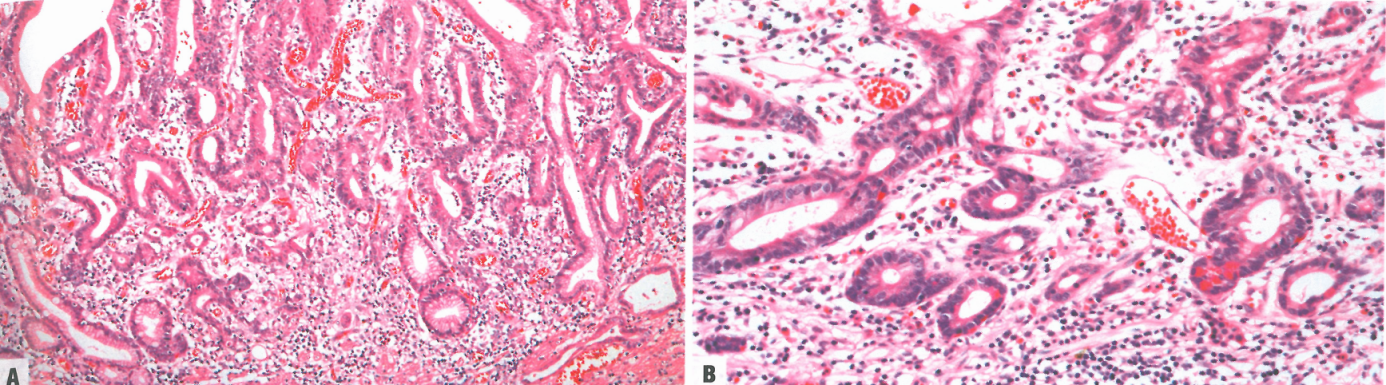
图3.10黏膜内浸润性肿瘤/黏膜内腺癌。A 不规则腺体,貌似异型增生或肠化生,在深层黏膜中显示过度分支、出芽和单细胞浸润;所谓的分化非常好的肠型腺癌。B 肠型小管显示不规则(爬行)融合。
锯齿状异型增生的特征是其独特的位置(小凹区);它常有微乳头状模式,延伸到黏膜表面并表达MUC5AC。这种表型也被报道为锯齿状腺瘤,经常与腺癌共存。
鉴别诊断
“不确定异型增生”这个术语并不能确定一个生物实体;它主要代表了一种诊断标签,适用于缺乏可靠区分肿瘤/异型增生表型与非肿瘤表型(即反应性或再生性变化)所需组织学特征的可疑病例。当处理具有重度炎症的小活检标本时,通常会使用“不确定异型增生”的标签。这种难题可以通过评估连续的组织切片和/或在清除黏膜炎症后获得更可靠的活检标本来解决。由于其细胞异型性和(甚至非典型)核分裂象,再生异型性可能被误认为异型增生;然而,在非异型增生的改变中,细胞结构改变很少累及黏膜表面。
术语“黏膜内浸润性肿瘤/黏膜内腺癌”是指肿瘤侵犯固有层或黏膜肌层。它与HGD的区别在于不同的结构异常,如腺体拥挤、过度分枝和出芽,无论是否存在促纤维增生反应。单细胞浸润、小梁状生长、腺体内坏死碎片、不规则(爬行)融合或退变的小腺体可能是有帮助的发现。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:明确的上皮内肿瘤性病变(非息肉或息肉样);没有浸润的证据;低级别到高级别的细胞学和结构变化;肠和/或胃表型。
分期(TNM)
HGD和黏膜内浸润性肿瘤/黏膜内腺癌分别对应于pTis和pT1a。
预后和预测
胃异型增生具有进展为浸润性腺癌的风险。在一项仅涉及内镜检查随访>12个月的患者的前瞻性集中研究中,LGD的总体进展率为15%(进展为癌症:9%)。69%的HGD病例进展为浸润性GC。不确定的异型增生病变仅进展为LGD(11%的病例)。在最近的一项回顾性多中心研究中,只有4.3%的LGD病例进展为浸润性癌(中位随访时间:2.6年)。在59%的HGD患者中,初次诊断后12个月内组织学诊断了GC,但HGD的自然病史仍未确定。在1年内未发生腺癌的16名患者中,11名接受了内镜切除术,2名进展为GC。
重新分级:一些研究明确表明,基于活检的异型增生组织学诊断,在随后的切除标本中可能升级。在一系列78例活检评估的HGD病例中,随后的内镜黏膜下剥离标本分别显示3.8%和1.3%的病例存在黏膜下浸润和/或静脉浸润。在293例LGD患者中,18.7%的内镜黏膜切除标本表现为HGD或GC。
风险分层:组织学分级(低级别vs高级别)与胃异型增生的预后密切相关。辅助标记物的临床实用性仍在研究中。DNA含量异常(非整倍体或4N分数升高,通过流式细胞术评估)在统计学上与异型增生分级增加甚至与癌症进展显著相关。其他预测性生物标记物包括p53的免疫组织化学;TP53、ARID1A、APC、ARID2和RNF43的靶向测序;MSI;p16的启动子甲基化,但这些都没有在临床上使用。
04. 肠型胃腺瘤
定义
肠型胃腺瘤(IGA)是一种局限性息肉样病变,由异型增生的肠化上皮组成。
ICD-0编码
8144/0肠型腺瘤,低级别
8144/2肠型腺瘤,高级别
ICD-11编码
2E92.1&XH3DV3胃良性肿瘤&腺瘤NOS
相关术语
无
亚型
散发性肠型胃腺瘤;综合征性肠型胃腺瘤
部位
它们在肠上皮化生普遍存在的胃分区中占主导地位(60%在胃远端,包括角切迹)。
临床特征
患者通常年龄超过60岁,无症状。常共存广泛性化生萎缩性胃炎。大腺瘤的反复出血可能导致贫血和/或便血。
流行病学
腺瘤(主要是肠型腺瘤)是继增生性和胃底腺息肉之后第三常见的胃息肉。在内镜系列中,IGA的患病率与癌症的患病率基本相似(中国:3-10%,美国:<1%)。
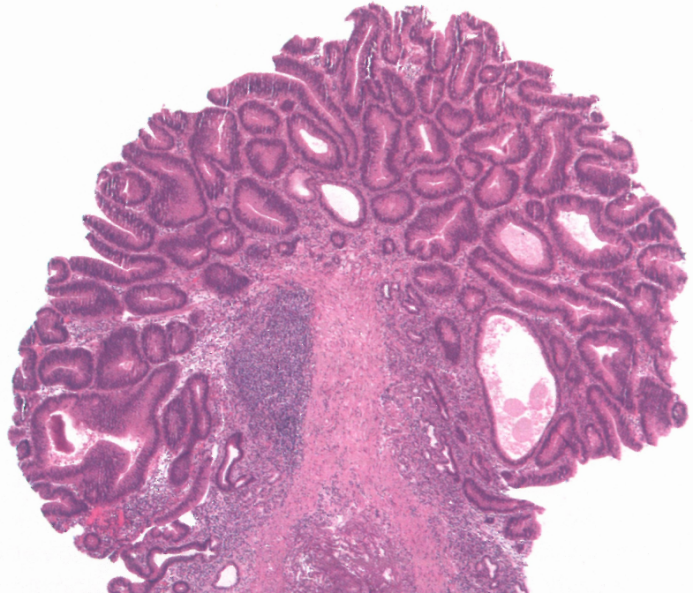
图3.11肠型腺瘤。该病变类似于结直肠管状腺瘤;注意邻近的胃黏膜显示慢性胃炎。
病因
胃黏膜肠化的任何原因都是一个危险因素。病因包括环境因素(HP)、宿主相关因素(自身免疫性胃炎)、遗传学综合征(APC基因突变)和表观遗传学失调。
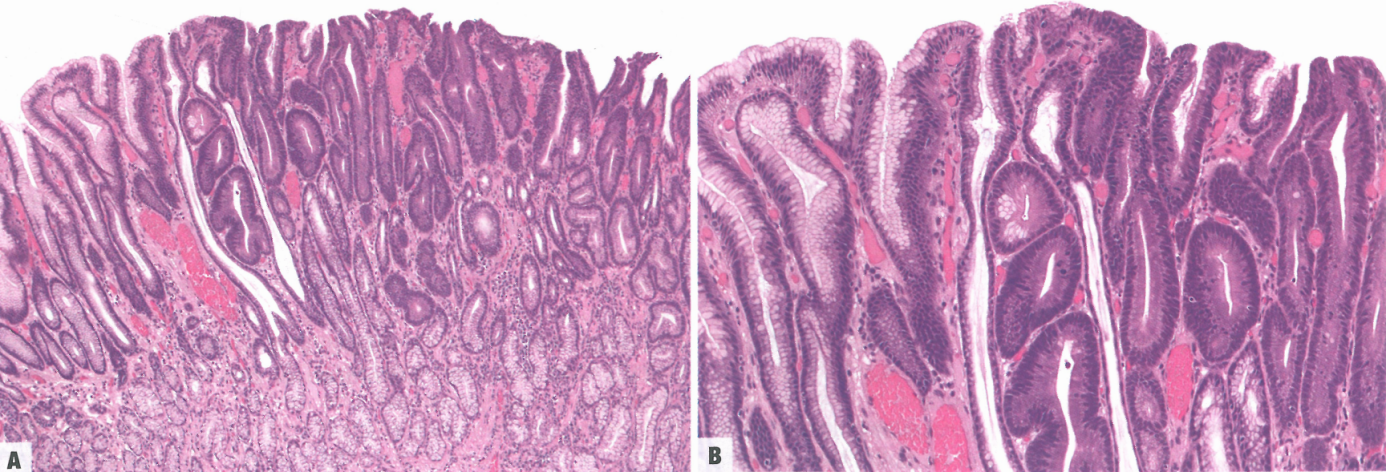
图3.12肠型腺瘤。A 这例胃窦病变类似于结直肠腺瘤伴低级别异型增生;注意左侧正常的胃窦黏膜。B 核细长,类似于肠的管状腺瘤;病变右侧杯状细胞很少。
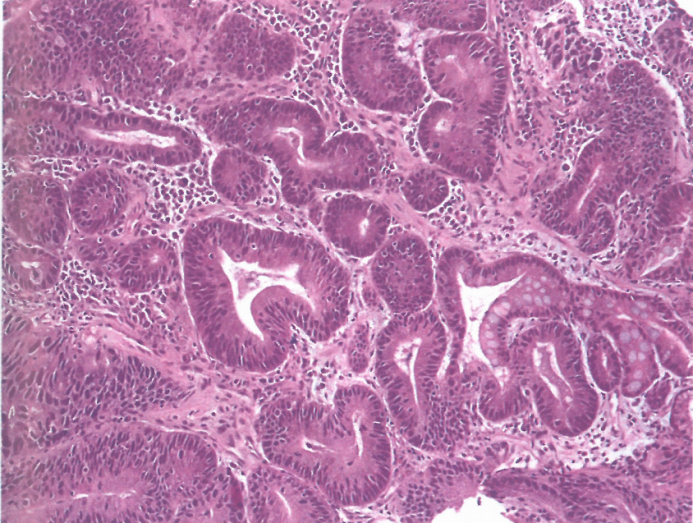
图3.13肠型腺瘤。腺瘤右侧伴有肠化生,并有明显的肿瘤浸润性淋巴细胞;这种腺瘤有些是微卫星不稳定。
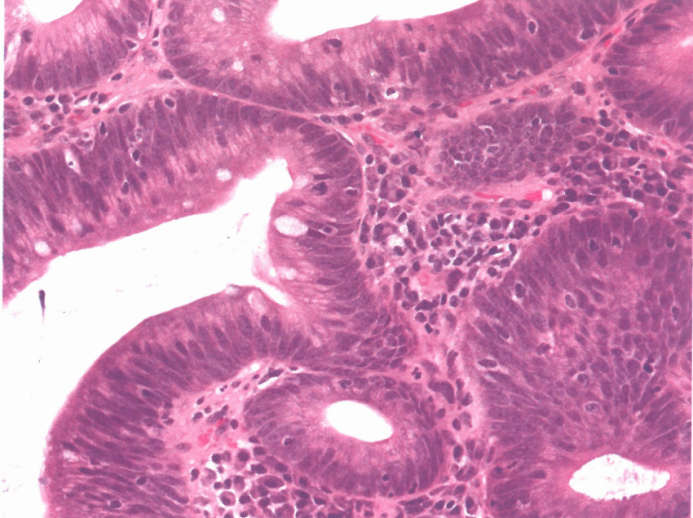
图3.14肠型腺瘤。注意核特征;视野中央有一个杯状细胞。
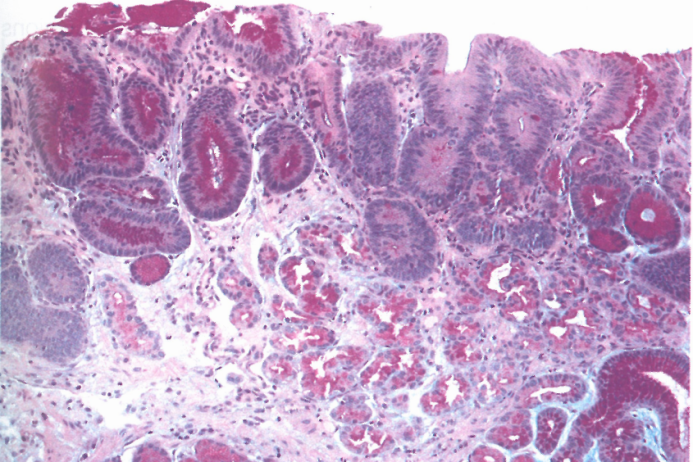
图3.15肠型腺瘤。家族性腺瘤性息肉病患者,胃窦腺瘤的PAS/AB染色;左侧胃窦黏膜未见肠化生,但腺瘤中有少量杯状细胞。
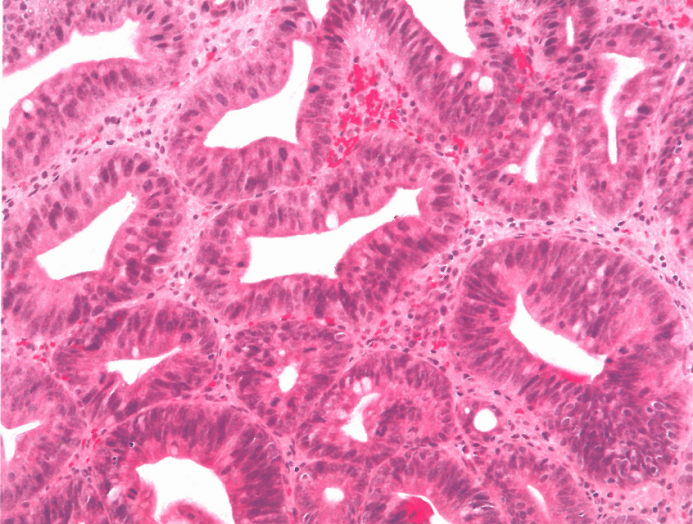
图3.16肠型腺瘤。家族性腺瘤性息肉病患者,胃窦病例;注意病变中的高级别异型增生和大量杯状细胞。
发病机制
发病机制涉及促进肠化的遗传学和/或表观遗传学失调。分子发现与结直肠腺瘤的发现有些相似。病变在APC、KRAS、ERBB2和ARID2中存在突变,但在CTNNB1中没有改变,有些病例(可能20-30%)是微卫星不稳定。综合征病例通常是家族性腺瘤性息肉病的一部分。
大体表现
IGA通常是孤立的,最大直径<2cm。
组织病理学
IGA起源于息肉内异型增生的小管。平坦黏膜中的相同外观称为异型增生(上皮内肿瘤)。小管内衬肠化的柱状上皮,肠化表现为核细长伴杯状细胞,就像结直肠腺瘤,并有多少不等的Paneth细胞。背景黏膜常表现为肠化和平坦异型增生。在北美和欧洲的家族性腺瘤性息肉病患者中,平坦的黏膜通常是正常的,而亚洲患者的周围黏膜通常是肠化的。异型增生分级与任何其他异型增生病变的分级一致。
在一些IGA中(主要发生在化生萎缩性胃炎),肠型和胃型分化确实共存;这些混合性病变的癌症风险高于仅有肠化的IGA。混合表型也称为小凹异型增生(fovelar dysplasia);请注意这与其他地方所述的小凹型腺瘤之间的差异(原书第79页)。
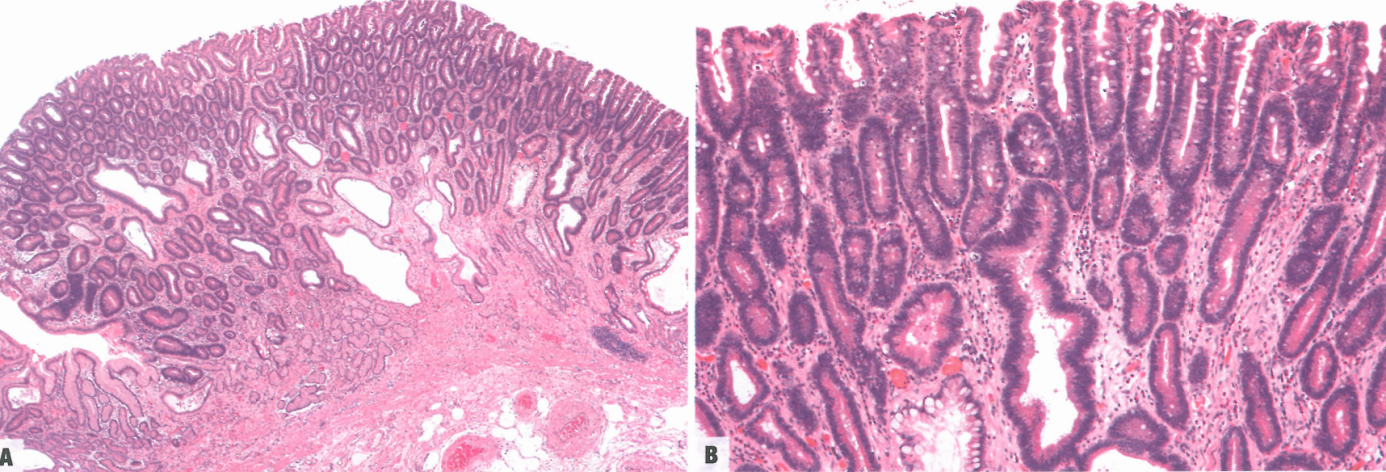
图3.17肠型腺瘤。A 由异型增生小管的增殖组成的隆起性病变,下方伴有扩张的非肿瘤腺体。B 小管内衬异型增生的柱状细胞,分化为杯状细胞、吸收细胞和Paneth细胞;左下可见肠化生。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:明确的肿瘤性改变,位于由胃的肠化腺体组成的息肉样病变中;没有浸润的证据。
分期(TNM)
如果存在高级别异型增生,则分为pTis。
预后和预测
IGA比小凹型病变更容易进展。癌症进展最常见于兼有肠型和胃型分化的腺瘤(混合型)。北美和欧洲患者患家族性腺瘤性息肉病腺瘤的癌症风险低于亚洲患者,这可能是因为HP感染的患病率不同。治疗方法为内镜切除。
05. 胃小凹型腺瘤
定义
胃小凹型腺瘤是由肿瘤性胃小凹上皮组成的息肉状病变。
ICD-0编码
8210/0腺瘤性息肉,低级别异型增生
8210/2腺瘤性息肉,高级别异型增生
ICD-11编码
2E92.1&XH3DV3胃良性肿瘤&腺瘤NOS
相关术语
可接受:小凹型胃腺瘤。
亚型
无
部位
胃小凹型腺瘤大多发生在胃的泌酸腺部分(胃体/胃底)。
临床特征
胃小凹型腺瘤通常发生在健康的胃黏膜中(没有炎症或萎缩/化生)。散发性病例极罕见,从未报告过进展为胃癌。(更常见的)综合征性小凹型腺瘤可能发生在家族性腺瘤性息肉病(FAP)和胃腺癌及胃近端息肉病(GAPPS)中;在这两种综合征中,小凹型腺瘤可能与胃底腺息肉病共存,且其癌症进展率始终较低。
流行病学
散发性小凹型腺瘤极罕见。在美国研究的人群中,散发性小凹型腺瘤与肠型腺瘤的比例<0.25:1。
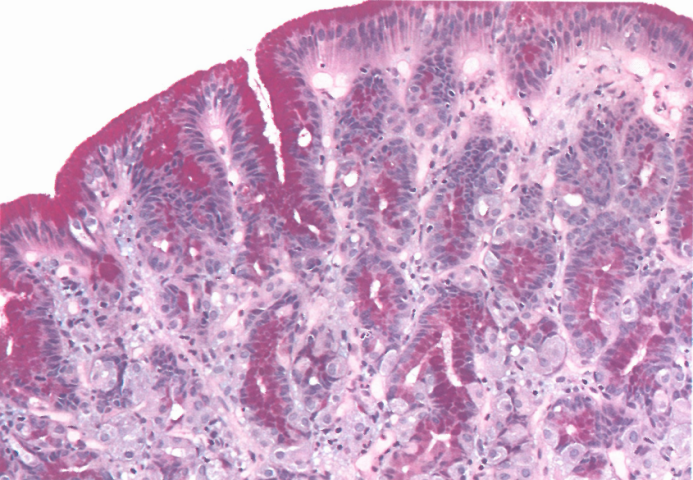
图3.18胃小凹型腺瘤,PAS/AB染色。背景没有胃炎或肠化生的嗜酸性黏膜;胞质顶端的黏液帽,由胃型中性黏液组成。
病因
散发性病变的病因尚不清楚。有关综合征性小凹型腺瘤的更多信息,请参阅相关的遗传学性疾病(例如家族性腺瘤性息肉病1,原书第522页,以及GAPPS和其他胃底腺息肉病,原书第526页)。
发病机制
通过双等位基因APC失活,胃小凹型腺瘤在FAP中占主导地位。关于分子基础的数据有限。散发性腺瘤很少携带APC和KRAS突变:CTNNB1(编码β-catenin)突变尚无报道。错配修复状态的报道不一致。FAP相关病变显示体细胞性和种系APC突变。
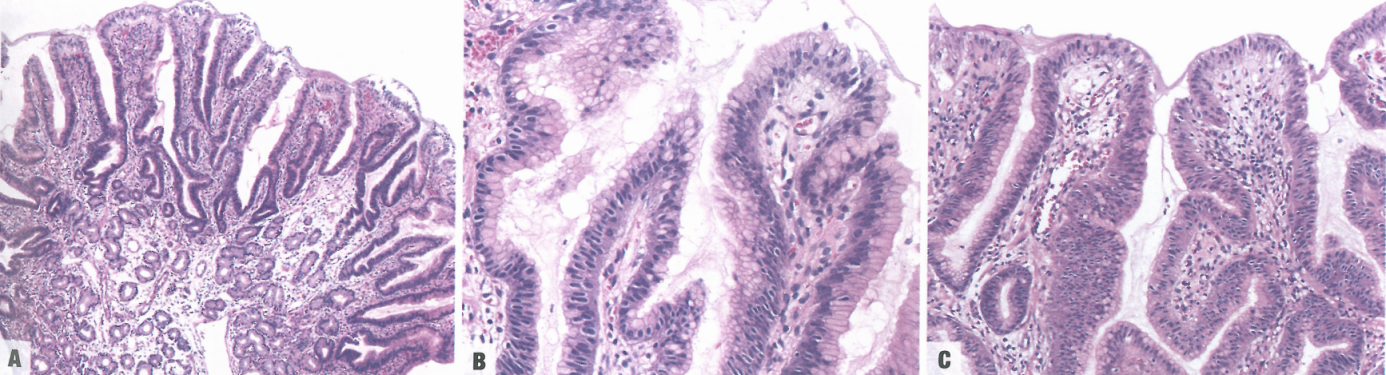
图3.19胃小凹型腺瘤。A 发生在胃底黏膜的病例。B 柱状肿瘤细胞具有胞质顶端黏液帽和基底核。C 在这个区域,顶端黏液帽不太显著,但仍然存在。
大体表现
散发性小凹型腺瘤是小而孤立的息肉。在FAP患者中,小凹型腺瘤通常与多发性胃底腺息肉共存。
组织病理学
散发性和综合征性小凹型腺瘤均由异型增生的柱状(小凹型)上皮细胞组成,核细长,复层化。胞质顶端有独特的中性(PAS阳性)黏液,可以区分幽门腺腺瘤。大多数病变表现为低级别异型性。应将高级别腺瘤与浸润性癌区分开来(癌的特征是更显著的表面乳头状结构和更严重的腺体紊乱)。免疫组化,肿瘤细胞特征性强/弥漫性表达MUC5AC,弱/局灶性表达MUC6,无MUC2或CDX2表达。然而,组织学诊断主要依赖于HE/PAS特征,而不是免疫表型。综合征性小凹型腺瘤(特别是FAP)通常与胃底腺息肉和幽门腺腺瘤并存。胃小凹型腺瘤可能同时表现出肠型和胃型分化;这种杂交表型具有更高的癌症进展风险。
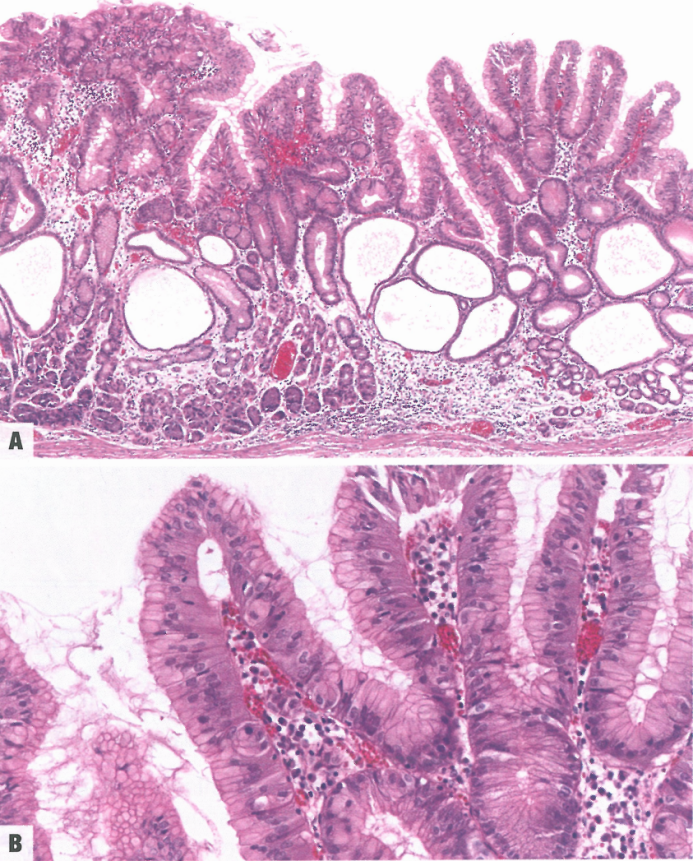
图3.20 胃小凹型腺瘤。A 家族性腺瘤性息肉病患者;病变主要累及胃底腺黏膜的表层。B 乳头状突起被覆轻度异型增生的小凹型上皮细胞,轻度核复层化。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
基本标准:息肉样生长,异型增生柱状上皮,小凹细胞表型,独特的胞质顶端中性黏液帽。
分期(TNM)
如果存在高级别异型增生,则分期为pTis。
预后和预测
散发性小凹型腺瘤通常是孤立的、低级别,很少与长期胃炎共存。其恶性进展或同步或异时发生胃癌的风险可以忽略不计。综合征(FAP-相关)小凹型腺瘤具有进展为浸润性癌的低风险。
06. 胃幽门腺腺瘤
定义
胃幽门腺腺瘤(PGA)是一种胃的上皮性息肉,成于肿瘤性幽门型腺体。
ICD-0编码
8210/0腺瘤性息肉,低级别异型增生
8210/2腺瘤性息肉,高级别异型增生
ICD-11编码
2E92.1&XH3DV3胃良性肿瘤&腺瘤NOS
相关术语
可接受:幽门腺管状腺瘤;幽门腺囊内乳头状肿瘤。
亚型
无
部位
PGA出现在胃体或胃底。
临床特征
大多数PGA发生在60-70岁的患者,并与自身免疫性和/或HP胃炎引起的泌酸黏膜萎缩/化生变化共存。女性占主导地位反映了她们与自身免疫性胃炎的关系。综合征(家族性腺瘤性息肉病相关)PGA发生在比散发性PGA更年轻的患者。与散发性PGA不同,综合征性PGA与任何炎症背景无关,它们可能与胃底腺息肉共存。
流行病学
PGA占胃上皮性息肉(不包括胃底腺息肉)的比例不超过3%。
病因
散发性病例与萎缩性(主要是自身免疫性)胃炎密切相关。PGA可能与整个胃肠道的柱状上皮异型增生有关,也可能出现在息肉样综合征中,包括家族性腺瘤性息肉病、胃腺癌和胃近端息肉病(GAPPS)、McCune-Albright综合征、青少年息肉病和Lynch综合征。
发病机制
幽门腺化生(无论发生在何处,即胃肠道和肝胆道)是PGA的假定前驱病变。散发性和家族性腺瘤性息肉病相关的PGA均具有激活GNAS和/或KRAS突变和灭活APC突变的特征。
大体表现
PGA是息肉样病变或肿块,平均大小为2cm(范围:0.3-10cm)。
组织病理学
PGA由紧密排列的幽门型腺体组成,内衬立方形/低柱状上皮细胞。大的病变可有腺体扩张。肿瘤细胞特征是明确的磨砂玻璃外观,细胞质透明或轻度嗜酸性。缺乏明确的胞质顶端黏液帽将PGA与小凹型腺瘤区分开来。核圆形至卵圆形,位于基底部,核仁不明显。高级PGA始终表现出结构紊乱、核拥挤和核极性丧失。在40-50%的病例中观察到高级别异型增生,其高增殖指数很容易识别。几乎一半的病例中观察到腺癌(甚至局灶性);然而,黏膜下浸润不超过10%。
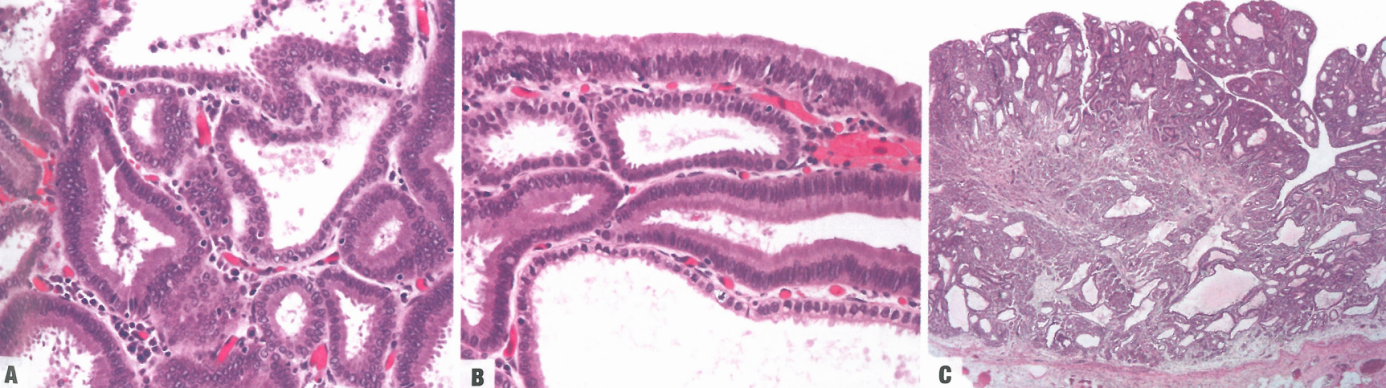
图3.21胃幽门腺腺瘤。A和B 高倍。C 低倍。
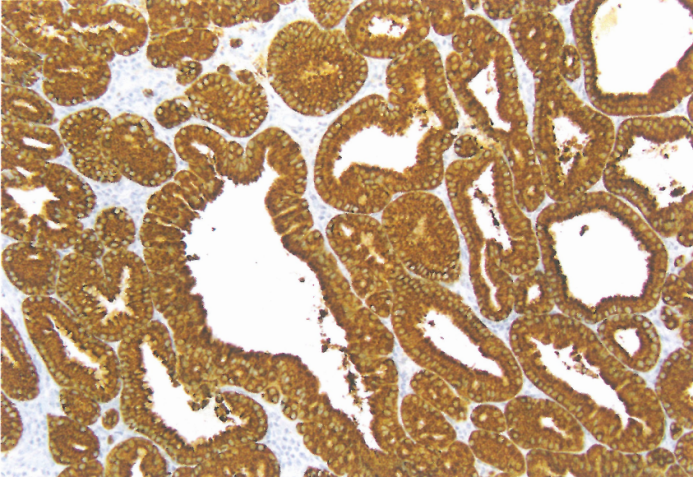
图3.22胃幽门腺腺瘤。MUC6呈胞质强阳性。
免疫组化,与幽门型组织学表型一致,PGA表达(程度不一)MUC6。MUC5AC表达可能累及整个病变(不限于表面上皮)。低级别PGA主要表现为弥漫性MUC6表达,表面覆盖MUC5AC。多达10%的PGA表现出MUC2和/或CDX2的局灶性表达。也有报道称核β-catenin偶尔表达。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:幽门型腺体的息肉样增生,由立方/柱状细胞组成,细胞质呈泡沫状、磨玻璃状;没有完好的胞质顶端黏液帽。
分期(TNM)
如果存在高级别异型增生,则分期为pTis。
预后和预测
由于高级别异型增生/癌症的风险相对较高,因此必须进行完全切除。自身免疫性胃炎患者进展为高级别异型增生/癌症更常见。肿瘤风险随着息肉大小、管状绒毛结构和混合免疫表型的增加而增加。预后取决于任何癌成分;然而,内镜或手术切除后,整体局部复发率<10%。
07. 泌酸腺腺瘤
定义
泌酸腺腺瘤(OGA)是一种良性上皮性肿瘤,由主细胞和/或壁细胞分化的柱状细胞组成,腺癌(黏膜下浸润)的进展率高。
ICD-0编码
8210/2腺瘤性息肉,高级别异型增生
8210/0腺瘤性息肉,低级别异型增生
ICD-11编码
2E92.1&XH3DV3胃良性肿瘤&腺瘤NOS
相关术语
可接受:主细胞为主型胃异型增生;主细胞为主的胃息肉;泌酸腺息肉/腺瘤。
亚型
无
部位
OGA主要发生在胃的上三分之一(80%),主要发生在非萎缩性泌酸黏膜中,类似于胃底腺型胃腺癌(GA-FG)。
临床特征
OGA最常见于60-70岁的患者。在日本,大多数肿瘤是在内镜筛查时发现;在其他地方,大多数患者出现反流症状。内镜检查显示息肉样、黏膜下肿瘤或平坦病变,伴有褪色的白色黏膜。肿瘤表面可见血管扩张或分支血管。
流行病学
这是一种罕见的肿瘤,但确切的发病率尚不清楚。大多数OGA和GA-FG病例来自日本,只有少数来自北美和欧洲。GA-FG的发病率为胃腺癌的1.6%,OGA与GA-FG相对发病率估计约为0.5。
病因
病因尚不清楚,但与HP感染无关。在澳大利亚的一项研究中,8名患者中有7名(546名)报告了减酸治疗史。
发病机制
从OGA到GA-FG存在形态连续。然而,关于OGA是否视为GA-FG的黏膜内成分,目前仍有讨论。在GA-FG中,WNT/β-catenin信号通路(CTNNB1、APC、AXIN1和AXIN2)基因的错义或无义突变相对频繁(50%)。除了CTNNB1突变外,这些突变也在OGA中发现(30%)。OGA中β-catenin核标记低或不存在,而高标记(>30%)是GA-FG的特征之一(26%)。GNAS突变存在于19%的GA-FG中,尚未在OGA中进行研究。
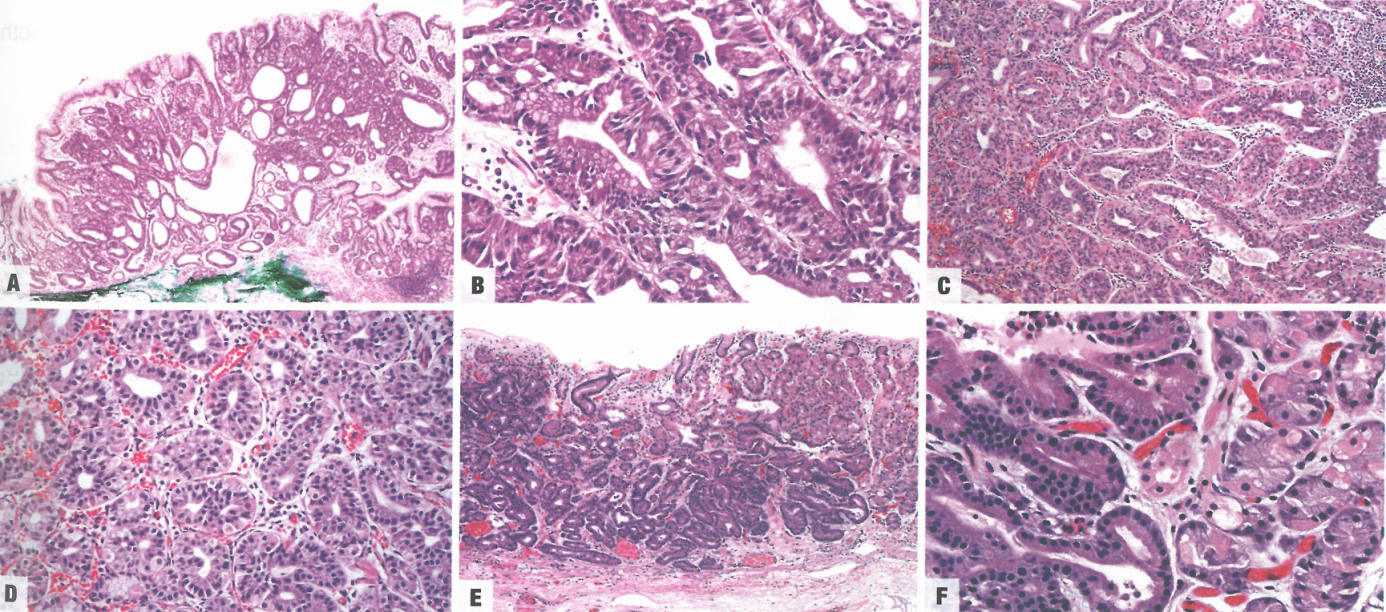
图3.23嗜酸腺腺瘤。A 低倍,发生于黏膜上部。B 高倍,肿瘤细胞向胃底腺细胞和壁细胞分化,就像泌酸腺。C 嗜酸性细胞显示壁细胞分化。D 主细胞样细胞的增殖。E 低倍,嗜酸性腺瘤主要占据胃底黏膜的较深区域;注意肿瘤性和非肿瘤性胃底腺之间的清晰边界。F 图C的高倍;注意未成熟型(左)的肿瘤性腺细胞与非肿瘤腺细胞(右)形成对比。
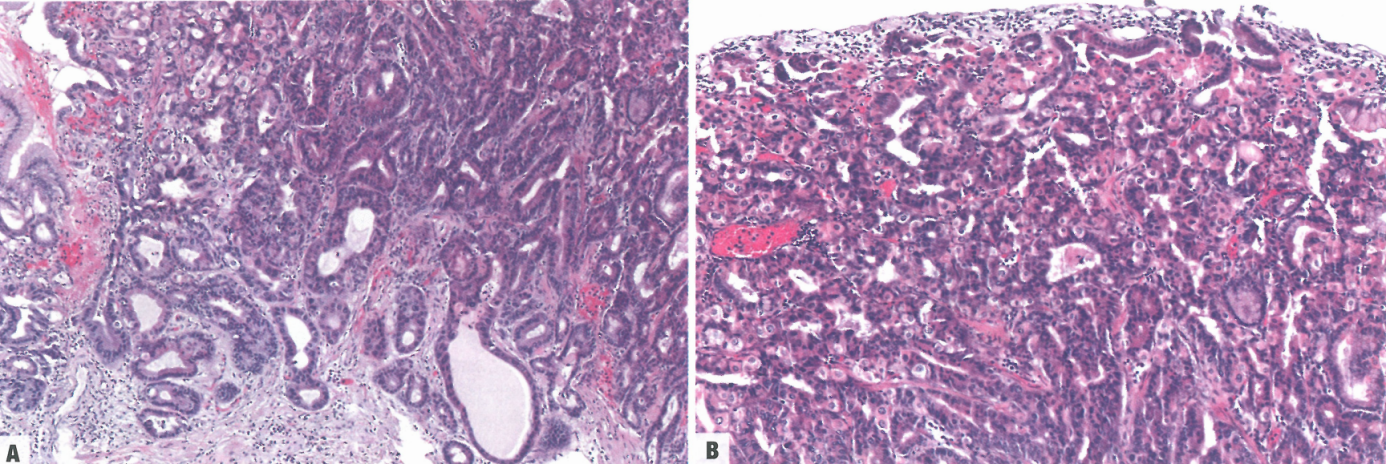
图3.24嗜酸腺腺瘤。A 转变为黏膜下浸润性癌。B 转变为癌。
大体表现
大小范围为3~18mm,在大多数情况下小于10mm。
组织病理学
OGA由高度分化的柱状细胞组成,具有淡染嗜碱性细胞质和轻度核异型性,模仿泌酸性(胃底)腺(主要是主细胞)。肿瘤可能位于黏膜的上部,但主要位于较深的黏膜中,并被小凹上皮覆盖。肿瘤由不规则结构组成,如管状融合和腺体侧向扩张。免疫组织化学证实向泌酸腺(胃底腺)的分化,如胃蛋白酶原I(主细胞)和H+/K+ATP酶(壁细胞)。占优势的细胞类型是未成熟的主细胞,对胃蛋白酶原I和MUC6均呈阳性。Ki-67增殖指数低,但分布不规则。
一些结构模式(如成簇和实性腺体以及吻合的条索)可能误认为神经内分泌肿瘤(NET)。尽管一些病变显示Syn和/或CD56的弱至中度阳性,但CgA阴性。
肿瘤显示向黏膜肌层推挤性边界,无促结缔组织增生性间质。当肿瘤侵犯黏膜下层时,应归入GA-FG腺癌亚型。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
基本标准:分化的柱状细胞在黏膜内增殖,伴淡嗜碱性细胞质和轻度核异型性,类似于嗜酸性(胃底)腺。
理想:免疫组织化学证实胃蛋白酶原I和MUC6均为阳性。
分期(TNM)
如果存在高级别异型增生,则分为pTis。
预后和预测
黏膜下浸润(进展为恶性肿瘤)的风险高(60%)。
未完待续......






































共0条评论