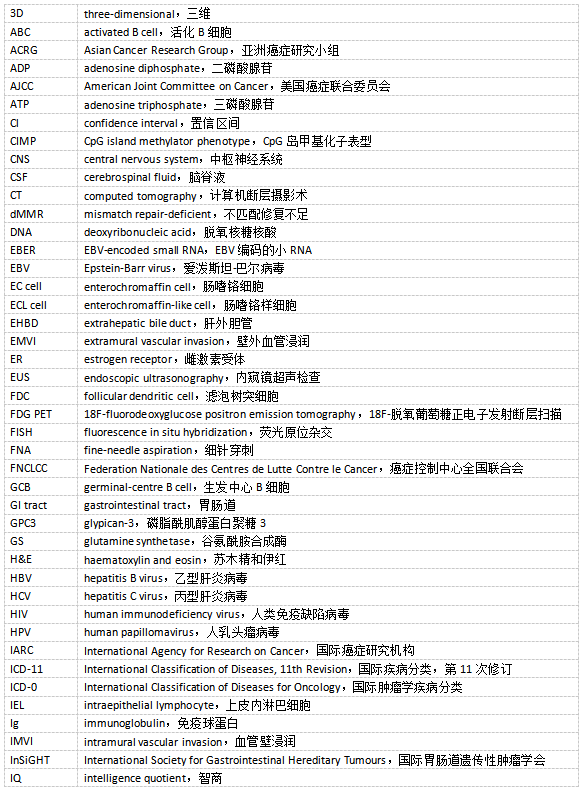
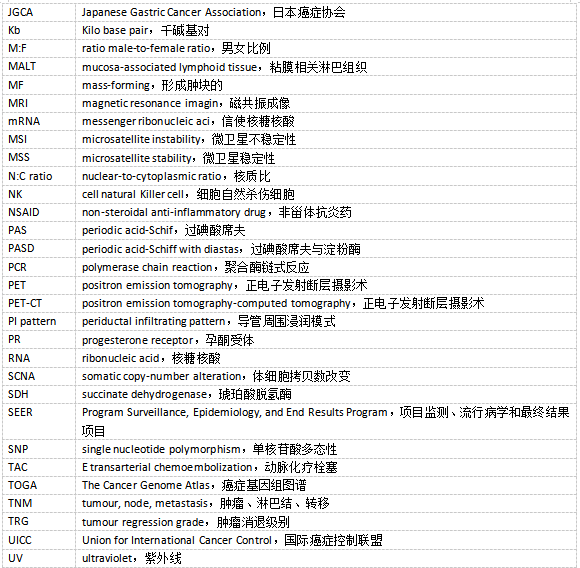
前言
《WHO肿瘤分类》系列丛书(也称为WHO蓝皮书)是全球诊断实践标准化的重要工具。WHO分类也作为将癌症研究转化为实践的工具。这些书所包含的诊断标准和规范是由该领域专家评估和辩论的证据所支撑的。每本书约有200名作者和编辑参与制作,他们自由地投入时间完成这项任务。我非常感谢他们的帮助;这是一个非凡的团队努力。
《WHO蓝皮书》第五版第一卷对整个系列作了若干重要改动。例如,这是第一本由编辑委员会领导的WHO蓝皮书。WHO肿瘤分类编辑委员会由病理组织提名的常设成员和在知情文献计量分析基础上选出的专家成员组成。诊断过程越来越具有多学科性,我们很高兴数名放射学和临床专家已经加入我们,以满足特定的需求。编辑委员会还包括一名患者代表。
第五版书籍格式最明显的变化是,多个系统共有的肿瘤类型放在一起处理,因此关于血液淋巴肿瘤和间叶性肿瘤有单独的章节。还有一章关于遗传性肿瘤综合征。遗传性疾病对个体患者的诊断越来越重要,在过去的10年里,对这些疾病的研究无疑为我们了解肿瘤生物学和行为提供了信息。增加一章专门讨论遗传性肿瘤综合征反映了这一重要性。
我们试图对肿瘤分类的多面性采取更系统的方法;每种肿瘤类型都根据其定位、临床特征、流行病学、病因、发病机制、组织病理学、诊断分子病理学、分期以及预后和预测进行描述。在适当的情况下,我们还纳入了大体表现和细胞学信息,以及基本的和理想的诊断标准。这种标准化的模块化方法部分是为了使书籍能够在线访问,但它也使我们能够提请注意信息很少的领域,以及我们知识中仍存在严重差距的领域。
WHO蓝皮书内容的组织现在遵循了从良性到恶性的正常进展—与第四版有所不同,但我们希望它会受到欢迎。
这些卷仍然根据解剖部位(消化系统、乳腺、软组织和骨骼等)进行组织,每种肿瘤类型都按照以下格式进行分类,这有助于以系统的方式组织书籍:
• 部位;例如,胃
• 类别;例如,上皮性肿瘤
• 家族(组);例如,腺瘤及其他癌前肿瘤性病变
• 类型;例如,腺瘤
• 亚型;例如,胃小凹型腺瘤
某种特定的肿瘤类型是否代表一个独特的实体(entity)而不是亚型(subtype)的问题持续困扰着病理医师,这也是科学文献中许多出版物的主题。我们继续根据具体情况处理这个问题,但我们认为有一些固有的规则可以应用。例如,尽管形态学表现不同,但多种组织学模式包含共享干细胞突变的肿瘤显然属于同一类型。同样,同一肿瘤类型内的遗传异质性可能对治疗产生影响。自新版起,术语的一个小变化是,与特定类型肿瘤相关的“变体型(variant)”一词已被“亚型”完全取代,以便更清楚地区分这一含义与与遗传改变相关的“变异”。
WHO蓝皮书深受病理医师的赞赏,对癌症研究人员也越来越重要。新的编辑委员会和我当然希望丛书将继续满足诊断标准的需求,促进诊断研究在全球范围内付诸实践。特别重要的是,癌症继续根据国际上相同的标准进行分类和诊断,患者能够从多中心临床试验以及在不同大洲进行的当地试验的结果中受益。
Dr Ian A. Cree
世界卫生组织肿瘤分类组组长
国际癌症研究机构
2019年6月
第1章 消化系统肿瘤介绍
在此奉献的《消化系统肿瘤WHO分类》是第五版《WHO肿瘤分类》系列丛书(也称为WHO蓝皮书)之一,反映了我们对消化系统肿瘤理解的重要进展。作为历史上第一次,分子表型与组织学特征对某些肿瘤的定义赋予同等重要的地位;然而,在大多数情况下,组织病理学分类仍然是诊断的金标准。WHO肿瘤分类系列旨在全世界使用,包括缺乏组织样本或特定技术设施限制病理医师依赖分子检测能力的环境。
自2010年第四版消化系统肿瘤卷出版以来,我们对许多肿瘤的病因和发病机制的理解取得了重要进展。然而,这种新信息对临床实践的改变程度是参差不齐的。对于本卷中描述的一些肿瘤,尽管我们现在对其分子发病机制有了更详细的了解,但临床上很少有分子病理学的应用。根据本书的定义和目标,肿瘤的分子病理学所关注的分子标志物涉及肿瘤的诊断、生物学行为、临床结局和治疗,而不只是描述分子发病机制。分子病理学的作用正在扩大。对于某些肿瘤实体,分子分析现在对于建立准确的诊断至关重要。其中一些分析需要调查体细胞(获得性)遗传改变、基因或蛋白质表达,甚至循环肿瘤标志物。对于某些肿瘤类型,需要特定的分析来预测预后或肿瘤进展,本卷详细概述了这些分析。下文总结了自第四版以来一些更显著的变化。更详细的描述参见每个主要肿瘤类别的章节介绍和/或肿瘤特异性章节。如果编辑委员会确定没有足够的证据证明有关特定肿瘤实体的新信息具有诊断或临床相关性,则第四版中的立场将作为本卷的标准。
我们对食管肿瘤的发生以及从炎症到化生(Barrett食管)、异型增生和最终腺癌的连续肿瘤进展的理解取得了实质性进展。这个过程最初是由胃食管反流病驱动的,该病导致食管细胞的分化和增殖被重新编程。
胃癌进展的分子途径不太清楚。大多数所谓的流行性胃癌现在视为炎症驱动,其病因通常与幽门螺杆菌感染有关。正是由于这种传染性病因,胃癌成为少数高度致死但可预防的癌症之一。慢性胃炎导致微环境(包括微生物组)的变化,导致粘膜萎缩/化生,在进一步的分子改变后可能进展为肿瘤。上胃肠道的化生改变被公认为早期癌症的癌前病变,但其确切的分子机制和祖细胞在致癌级联中的确切作用仍然是深入研究的主题。
食管鳞状细胞癌的癌前病变的发病机制不如胃癌的发病机制清楚。环境因素被认为起着重要作用,但人们对烟草使用和饮酒等特定因素导致的肿瘤变化的机制知之甚少。例如,最初认为HPV感染在鳞状细胞癌发生中起着关键作用,但最近的证据表明,在大多数食管鳞状细胞癌病例中没有这种关联。这一发现与我们目前对肛门鳞状病变的病因和发病机制的认识形成了对比,在肛门鳞状病变中,HPV感染似乎起着重要的病因作用,导致了与癌症相似的基因改变。
与十年前相比,现在对肠腺癌(小肠、大肠和阑尾)的发病机制有了更好的描述。癌症人群筛查的引入为更好地理解肿瘤前驱病变和与每种肿瘤相关的分子途径奠定了基础。例如,我们对传统腺瘤和锯齿状前驱病变的分子途径和生物学行为的了解,包括最近重新命名的无蒂锯齿状病变(以前称为无蒂锯齿息肉/腺瘤),在过去十年中迅速增长,这使临床医生能够提供量身定制的、以证据为导向的筛查和监测计划。我们对阑尾肿瘤的认识也有所提高。例如,我们现在知道,许多阑尾肿瘤是通过类似于小肠和大肠的肿瘤前驱病变发展而来,因此阑尾肿瘤的生物学潜能和分子途径得到了更好的认识。最近重新命名的阑尾杯状细胞腺癌(以前称为杯状细胞类癌/癌)是一个典型例子,其生物学潜能和组织学特征得到了更好的描述,从而改善了这些肿瘤的病理方法。
对于一些罕见的肿瘤,已经发现了独特的驱动突变,例如,胃母细胞瘤中的特征性MALAT1-GLI1融合基因和胃肠道透明细胞肉瘤和恶性胃肠神经外胚层肿瘤中的EWSR1融合基因。在这两个例子中,诊断现在都需要证明融合基因。
第五版的一个特别重要的变化是神经内分泌肿瘤(NEN)的分类,NEN发生在全身多个部位。在本书中,每个器官特定章节都涵盖了NEN,包括胰腺肿瘤章节,其中提供了描述每种功能性和非功能性亚型的详细章节。以前,这些肿瘤仅在内分泌器官肿瘤一书中详细介绍。指导所有NEN分类的一般原则见本主题的引言(消化系统神经内分泌肿瘤的分类,原书第16页)。为了巩固我们对这些肿瘤遗传学的进一步了解,一组专家于11月在癌症国际研究机构(IARC)举行了一次协商一致的会议,随后发表了一篇论文,他们在论文中建议在这些肿瘤发生的所有部位区分高分化神经内分泌肿瘤(NET)和低分化神经内分泌癌(NEC)。基因组数据也导致了混合性神经内分泌肿瘤分类的变化,现在将其归入“混合性神经内分泌-非神经内分泌肿瘤(MiNEN)”的概念类别。混合腺癌-神经内分泌癌(MANEC)显示类似于腺癌或NEC(而非NET)的遗传改变,这可能反映了肿瘤内的克隆进化,这是一个快速进步的研究领域。对这些混合癌的研究也可能加深对消化系统和身体其他部位肿瘤克隆性其他方面的理解。
不幸的是,其他解剖部位的混合性肿瘤(如食管腺鳞癌和粘液表皮样癌,以及肝细胞和胆管混合分化的肝癌)也仍然是不确定的对象。这些肿瘤中各种分化谱系的相对重要性仍然未知。目前还不确定这些肿瘤是如何发生的,以及在临床上应该如何治疗。这些问题有争议,因为缺乏确凿的证据,但这些肿瘤的病理标准和分类的改进应有助于规范诊断方法,促进更好的临床和基因组研究。
在当前的日常使用中,许多病理医师仍然不同意某些术语。在考虑使用特定术语和定义时,编辑委员会仔细考虑了我们目前对致癌途径的理解。总的来说,总体共识是,除非有强有力的证据支持这样做,并且拟议的改变具有临床相关性,否则不应改变既定的术语、定义和标准。对于某些肿瘤,我们对从正常上皮细胞到转移性癌的进展的理解仍然不足。例如,在某些肿瘤中,良性和恶性之间的界限可能是模糊的,在某些情况下,这种区别更多的是定义性的,而不是生物学的。这些肿瘤生物学需要未来更全面研究。
在第五版中,胃肠道浸润性癌前驱病变的术语已经有所标准化,尽管“异型增生”和“上皮内肿瘤*”这两个术语仍被认为适用于某些解剖位置的病变,以确认其持续的临床接受度。例如,“异型增生”一词更适合用于管状肠道的病变,而“上皮内肿瘤”更适合用于胰腺、胆囊和胆管的病变。然而,对于所有解剖位置,两级系统(低级别与高级别)被认为是肿瘤前驱病变的标准分级系统。这取代了以前用于胰胆管系统病变的三级分级方案。“原位癌”一词由于各种原因,尤其是其临床模糊性,在临床实践中继续受到强烈劝阻。该术语属于高度异型增生/上皮内肿瘤的范畴。基因组发现有助于确定一些肿瘤,如胰腺导管内肿瘤(即导管内嗜酸细胞乳头状肿瘤和导管内管状乳头状肿瘤)不同于胰腺导管内乳头状粘液肿瘤,这些肿瘤现在被归类为单独的实体。额外的临床和基因组信息也有助于识别足够不同的癌症亚型,以进行单独分类。
译注:intraepithelial neoplasia 以前译为“上皮内瘤变”是一种误解,臆测肿瘤形成的动态过程。根据创造这个术语的本人解释,neoplasia就是新生物。
在新的分子发现的支持下,对第四版分类进行了许多改进,涉及肝肿瘤。例如,最近从大规模分子谱研究中出现了常见肝细胞癌发生的分子变化的全面图景。与此同时,几种罕见的肝细胞癌亚型(可能占病例的20-30%)已被一致的形态分子和临床特征所定义,其中纤维板层癌及其诊断性DNAJB1-PRKACA易位就是一个典型的例子。肝内胆管癌现在被认为是一个独特的实体,有两种非常特殊的亚型:一种是大导管型,类似于肝外胆管癌,另一种是小导管型,与肝细胞癌具有相同的病因、发病机制和影像学特征。这两种亚型具有非常不同的病因、分子改变、生长模式和临床行为,体现了解剖学和组织遗传学/病理学分类之间的冲突。临床研究和研究方案需要在不久的将来纳入这些发现。此外,在分子研究结果的支持下,合并肝细胞胆管癌的定义及其与其他实体的区别最近变得更加清晰。胆管细胞癌不再被认为是组合性肝细胞-胆管癌的亚型,而是小导管肝内胆管癌的一种亚型,这意味着所有具有导管或小管表型的肝内癌现在都归入肝内胆管细胞癌的类别中。基于形态学的分子分析导致基于生物和分子因素组合的新分类,一个典型例子是肝细胞腺瘤的分类,它具有高度的临床相关性,并推动了在常规诊断中实施精细的形态学标准和分子检测。
在第五版中,胃肠道中发生的血液淋巴肿瘤和间叶性肿瘤(其中一些非常独特)被归为单独的章节,以确保一致性并避免重复。本版还强调了遗传性肿瘤综合征的重要性,将其纳入一个专门的章节,加强了对这些疾病的更多了解,我们希望这对所有读者都有帮助。
消化系统神经内分泌肿瘤的分类
NEN的一般特征
神经内分泌肿瘤(NEN)可发生在身体的大多数上皮器官中,包括许多变种,其病因、临床特征、形态和基因组发现以及临床结局差异很大。从历史上看,各种解剖部位的NEN是分开分类的,尽管各种分类系统有一些共同的特征,但器官系统之间术语和分类标准的差异造成了相当大的混乱。在2017年举行的协商一致会议的基础上,2018年11月WHO公布了所有NEN的统一分类框架。这种新的通用分类的关键特征是区分高分化神经内分泌肿瘤(NET)和低分化神经内分泌癌(NEC),前者在胃肠道发生时旧称类癌,后者与NET同样表达神经内分泌标志物,但现在已知两者不是密切相关的肿瘤。遗传证据以及临床、流行病学、组织学和预后差异支持将NEN分为NET和NEC的形态学分类。
根据核分裂率和Ki-67增殖指数评估的增殖活性,将NET分为G1、G2或G3。核分裂率表示每2mm2的核分裂数(2mm2相当于0.5mm视野直径、40倍放大倍数下10个高倍视野),即每个高倍视野面积为0.2mm2,计数50个视野(即总面积为10mm2)的核分裂象。尽管人们认识到,当只有小样本可用时,可能无法确定准确的核分裂率。Ki-67增殖指数是在扫描放大倍数下,找到最高标记(热点)区域,计数至少500个细胞来确定。如果两个增殖指标显示不同的级别,则采用较高的级别;一般来说,当存在不一致时,都是Ki-67增殖指数提示较高级别。NEC定义为高级别。目前的分类和分级系统主要基于2017年胰腺神经内分泌肿瘤的WHO分类,该分类正式引入了高分化肿瘤可能是高级别(well-differentiated neoplasms could be high-grade)的概念。在早期对胰腺和胃肠道NEN的分类中,G3类别当成低分化(即NEC)的同义词。然而,在发表了与胰腺NET(PanNET)相关的数据后,很明显,其他器官的NET也可能具有G3范围内的增殖率,这证明了当前版本的WHO分类将胰腺分类系统扩展到整个胃肠道NEN是合理的。
将NET和NEC截然分开,并分到不同家族的合理性有多种来源。尽管NEC和NET共有神经内分泌分化(基于CgA和Syn的免疫染色),但大多数NET的形态与NEC不同。NEC分为小细胞NEC(SCNEC)和大细胞NEC(LCNEC)。NET具有器官样结构(如巢状、条索状和带状)、均匀一致的核特征、粗糙的点彩状染色质,仅有轻微坏死。NEC具有不太明显的巢状结构模式,通常成片生长,核或呈梭形、密集伴细颗粒状染色质(SCNEC),或呈较圆的、明显非典型的核,有时有显著的核仁(LCNEC);常有大片坏死。NET可能显示级别进展,或表现为在单个肿瘤内,或在肿瘤进展过程中的不同疾病部位之间(例如原发性与转移性)。单个NET中同时存在低级别和高级别成分,这有力地证明了高级别成分仍然是一种高分化肿瘤。相比之下,NEC通常不伴发NET,而是发生于一些前驱病变(通常形成各个器官的非神经内分泌癌),如结直肠腺瘤或食管鳞状细胞异型增生。NEC也可能含有非神经内分泌癌成分,如腺癌或鳞状细胞癌。兼有两种成分(神经内分泌和非神经内分泌,各占肿瘤的30%以上)的混合性肿瘤归入一个总体类别:混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasm,MiNEN),它除了含有非神经内分泌肿瘤之外,仅在极罕见情况下含有高分化(NET)成分。新兴的基因组数据进一步提供证据,表明NET和NEC无关。特别是在胰腺中,高分化NET作为一个实体,其定义性特征是MEN1、DAXX和ATRX中的频繁突变;低分化NEC未见这些突变在,而是TP53、RB1及其他癌症相关基因的突变。散发性PanNET也伴有DNA修复基因MUTYH、CHEK2和BRCA2的种系突变。甚至胰腺的G3 NET也保留了其他高分化肿瘤的突变特征,在挑战性的病例中有助于区分G3 NET和NEC。其他胃肠道部位的NET和NEC的基因组比较仍在不断出现。这些部位的NEC与胰腺(和肺)的NEC共有频繁的TP53和RB1突变,但胰腺外NET通常缺乏频繁的重现性突变,降低了基因组分析的诊断价值,但胰腺外NET确实与其胰腺对应肿瘤共有染色质重塑途径的异常。
从临床角度来看,也有数据支持G3 NET和NEC之间的区别。NEC对含铂化疗常有反应(SCNEC具有强力反应),这些方案因此成为不同解剖来源NEC的标准治疗。然而,有些患者没有反应却活得更长,很可能他们实际上患有G3 NET。某些NET亚群已经批准了替代疗法;因此,临床需要将同样是高级别类别的NET与NEC区分开来。
新版与第四版对胰腺肿瘤分类的区别之一,是NEC的分级。以前,所有NEC都是G3级,就像高级别NET。目前建议不对NEC分级(根据定义NEC都是高级别的),以避免与G3类别肿瘤的混淆。
最近公布的对NEN进行统一分类的建议,已被WHO采纳,适用于整个胃肠道和肝胰胆管器官中出现的肿瘤。术语和分级标准见表1.01。各个器官的NET、NEC和MiNEN的具体特征,放在每个器官的相应章节中进行描述。重要的是要记住,尽管使用了统一的术语,但NEN在激素功能、临床表现、预后、形态学和基因组学方面存在重要的器官特异性差异;当前的分类系统旨在标准化诊断和分级方法,但并不取代反映每个NEN独特特征的病理诊断中包含的关键附加信息。
表1.01 胃肠道和肝胰胆管器官的神经内分泌肿瘤(NEN)的分类和分级
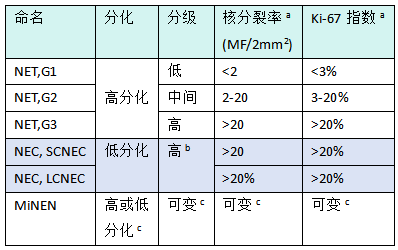
LCNEC,大细胞神经内分泌癌;MiNEN,混合性神经内分泌-非神经内分泌肿瘤;NEC,神经内分泌癌;NET,神经内分泌肿瘤;SCNEC,小细胞神经内分泌癌。
a 核分裂率表示核分裂数/2mm2(相当于0.5mm视野直径、40倍放大的10个高倍视野),在50个0.2mm2视野(即总面积为10mm2)中计数;Ki-67增殖指数值是在扫描倍数找到最高标记(热点)区域,计数至少500个细胞;最终级别取两个增殖指数中较高者,将肿瘤归入较高类别。
b 低分化NEC没有正式分级,根据定义视为高级别。
c 在大多数MiNEN中,神经内分泌和非神经内分泌成分的分化差,神经内分泌成分的增殖指数与其他NEC在同一范围内,但这个概念类别允许一个或两个成分可能高分化;因此,在可行的情况下,每个成分都应该单独分级。
高分化NEN:NET
神经内分泌肿瘤(NET)是具有神经内分泌分化(形态学和免疫组织化学特征)的高分化上皮性肿瘤,最典型表现为器官样结构、均匀一致的核和粗颗粒状染色质。NET可以是低级别(G1)、中间级别(G2)或高级别(G3)。
NET是相关肿瘤的一个广泛家族,可发生在胃肠道和肝胰胆管系统的任何器官中。以前的术语包括“类癌”和(胰腺肿瘤)“胰岛细胞瘤”和“胰腺内分泌肿瘤”。NET高分化性质意味着肿瘤细胞与非肿瘤性神经内分泌细胞非常相似,通常包括强表达通用的神经内分泌标志物(CgA和Syn),并且不同程度地表达特异性肽类激素。NET的形态特征差异很大,一些器官特异性亚型具有特征性组织学模式(见各个器官章节中的具体内容)。然而,NET通常显示特征性的结构模式,包括巢状、条索状和缎带状。肿瘤细胞常形成腺体,尤其是在回肠和胰腺,以及阑尾和十二指肠NET的部分病例。细胞核通常含有粗块状的染色质,形成典型的椒盐样外观,但有些NET显示更弥漫的颗粒状染色质,而另一些NET则具有显著的核仁。细胞质可能显示强烈的颗粒感,反映出大量的神经分泌颗粒朝向细胞的血管极。大多数NET的增殖率低,在第四版定义为核分裂率为<20个核分裂/2mm2,Ki-67增殖指数<20%。尽管在几乎所有病例中都发现核分裂率确实在这个范围内,但现在已明确,一些NET,特别是胰腺中发生的NET,Ki-67增殖指数>20%,在某些病例观察到高达70-80%的值。因此,Ki-67增殖指数不能单独用于最终区分NET和神经内分泌癌(NEC)。
NET之间的一个重要临床区别与它们的激素功能有关。功能性NET会产生与肿瘤异常产生的激素相关的特征性临床综合征。临床上非功能性NET也可能产生激素,可用血清学或免疫组织化学检测到,但不会导致临床症状。功能性NET的命名通常包括引起综合征的特定激素名称(胰岛素瘤、胃泌素瘤、胰高血糖素瘤等)。胰腺功能性NET的类型最多(见功能性胰腺神经内分泌肿瘤,原书第353页)。功能性胃泌素分泌NET(胃泌素瘤)通常发生在十二指肠,引起类癌综合征的NET通常发生在回肠。大多数胃NET是非功能性,但与高胃泌素血症相关的疾病(包括胃泌素瘤本身)可以诱导胃泌酸粘膜中由肠嗜铬样(ECL)细胞组成的NET。胆管、肝脏和直肠的NET通常也是非功能性。NET的另一个特征是生长抑素受体的表达(特别是丰富的SSTR2),这可以通过免疫组织化学或使用功能性放射学成像(如奥曲肽扫描和68Ga DOTATOC/DOTATAT/DOTANOC PET-CT)来检测。NET通常无法通过FDG PET检测到,但罕见的高级别病例除外。NET的另一个显著临床特征是其惰性的自然病史。尽管所有NET都被认为是恶性肿瘤,但如果完全切除,所有解剖部位的早期NET转移的风险都很低。较大或较高级别的NET可能会转移,难以治疗,但即使在晚期,仍有可能存活多年。
本书中胃肠胰NET分类和分级系统的统一,不要误解为NET是一组密切相关的同质肿瘤;事实远非如此。每个器官都会产生不同类型的NET,具有不同的功能、不同的组织学特征和不同的基因组基础。某些类型的NET(如胰腺和十二指肠)通常发生在多发性内分泌腺瘤1型(MEN1)患者中,并与MEN1的频繁体细胞突变有关,而其他NET(例如回肠和直肠)与该综合征或MEN1的突变无关。不同部位的NET之间也存在预后差异。这些独特的临床特征意味着NET的外科和内科治疗高度依赖于起源部位。出现远处转移的NET,试图查找起源部位,可能涉及放射学和病理学技术(例如,位点特异性转录因子的免疫组织化学)。
低分化NEN:NEC
神经内分泌癌(NEC)是一种具有神经内分泌分化的形态学和免疫组织化学特征的低分化上皮性肿瘤。NEC可以是小细胞NEC(SCNEC),梭形核,细腻颗粒状染色质,细胞质稀少,核推挤镶嵌(铸型);也可以是大细胞NEC,圆形核,有时核仁显著,中等量细胞质。所有NEC都是高级别肿瘤。
与神经内分泌肿瘤(NET)一样,NEC可出现在胃肠胰系统内的大多数部位,可以是纯NEC,也可以与不同数量的腺癌、鳞状细胞癌或其他成分混合。以前,“神经内分泌癌”这个术语也用于具有恶性行为(即转移)证据的高分化NET,但在目前的分类中,术语“癌”仅用于低分化肿瘤。NEC通常分为SCNEC或LCNEC;然而,在胃肠道内的某些部位,这种区分可能具有挑战性。根据定义,NEC是高级别,核分裂率>20/2mm2,Ki-67增殖指数>20%。在大多数情况下,远远超过这些阈值;然而,NEC偶尔可能具有20-50%的Ki-67增殖指数,特别是在暴露于化疗后,因此Ki-67增殖指标不能用于最终区分NEC和G3 NET。常有广泛坏死。证实神经内分泌分化对于确认NEC的诊断是必需的。为了诊断LCNEC,必须存在Syn或CgA的表达。诊断所需染色的确切范围和强度尚未明确界定,但应当超过散在的阳性细胞,形态学也应提示神经内分泌分化。
与NET相比,不同起源部位NEC在某种程度上更加同质。形态模式重叠,基因组改变也重叠,包括TP53和RB1中的常见突变。还可能发现其他器官特异性突变,这些突变是同一部位非神经内分泌癌的典型特征。NET发病机制最常见的基因突变,在NEC中未见。
NEC是高度侵袭性肿瘤,通常比同一部位出现的更常见的癌症类型更具侵袭性。就诊时通常已是晚期;因此,化疗通常是主要的治疗方法,即使对于可手术切除的病例,化疗也可能是最初的治疗选择。大量证据支持用含铂方案治疗肺外SCNEC;LCNEC对类似方案反应的证据促进了用含铂方案治疗所有NEC的广泛实践,但没有随机临床试验显示与用于非神经内分泌癌的替代方案相比具有更优的疗效。对铂反应的分子基础仍然是一个积极研究的领域。
混合性肿瘤:MiNEN
混合性神经内分泌非神经内分泌肿瘤(MiNEN)是一种混合性上皮性肿瘤,其中神经内分泌成分与非神经内分泌成分组合出现,每种成分的形态和免疫组织化学都可以识别为一种独立的成分,各占肿瘤的30%以上。
胃肠道和肝胰胆管系统中的大多数上皮性肿瘤被分类为纯型腺体或鳞状细胞肿瘤(或其前驱病变)或纯型神经内分泌肿瘤(NEN)。腺体(较少鳞状细胞)肿瘤可能有少量散在的神经内分泌细胞,可用免疫组织化学识别,但这一发现并不影响分类。少见情况下,上皮性肿瘤由数量可观的神经内分泌和非神经内分泌细胞群组成。以前,当每个成分各占肿瘤的30%以上时,这些混合性肿瘤被归类为“混合腺-神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)”。然而,认识到非神经内分泌成分可能不是腺癌,并存在一种或两种成分或许不是癌的可能性,这一类别的当前术语是“混合性神经内分泌-非神经内分泌肿瘤(MiNEN)”。MiNEN视为肿瘤的概念类别,而不是特异性诊断。不同类型的MiNEN出现在整个胃肠胰系统的不同部位,每种MiNEN都应使用反映其成分性质的特定部位术语进行诊断。简表1.01按解剖部位列出了MiNEN类别中包含的特定肿瘤。
要达到MiNEN的诊断标准,就要求形态学和免疫组织化学都能识别这两种成分。应通过Syn和/或嗜铬粒蛋白免疫染色来证实神经内分泌成分中的神经内分泌分化。在胃肠道和肝胰胆管系统中出现的MiNEN中,这两种成分通常都是癌;因此,神经内分泌成分通常是低分化神经内分泌癌(NEC),可以是大细胞NEC(LCNEC)或小细胞NEC(SCNEC)。罕见情况下,MiNEN的神经内分泌成分可能是高分化NEN。NEN可能伴发癌前病变,如消化管的腺瘤或胰腺的导管内肿瘤或囊性肿瘤。然而,非神经内分泌成分仅由癌前病变(浸润前)肿瘤组成的肿瘤不能视为MiNEN。同样,同一器官中独立出现的神经内分泌和非神经内分泌肿瘤不应归类为MiNEN,即使它们彼此接触(真正的碰撞肿瘤),因为MiNEN类别仅适用于其中两种成分可能是克隆相关的肿瘤。之前接受过新辅助治疗的癌也不应视为MiNEN,除非基于治疗前样本而诊断MiNEN,因为一些治疗过的癌所表现出的神经内分泌形态可能与从头发生的NEC成分中所见形态的预后意义不同。
简表1.01 胃肠道和肝胰胆管混合神经内分泌非神经内分泌肿瘤(MiNEN)的特定亚型

LCNEC,大细胞神经内分泌癌;NEC,神经内分泌癌;NET,神经内分泌肿瘤;SCC,鳞状细胞癌;SCNEC,小细胞神经内分泌癌。
根据主观的传统,每种成分应占肿瘤的30%以上,才能将肿瘤纳入MiNEN类别;诊断中可能会提到局灶性(<30%)神经内分泌分化的存在(特别是某一成分为低分化),但不影响诊断分类。然而,一个重要的考虑因素是发现非神经内分泌肿瘤伴发的局灶性(<30%)SCNEC。由于SCNEC具有明确的临床意义,即使是次要成分也应在诊断中提及。如果可行,应对MiNEN的两种成分单独进行分级;一些数据表明,神经内分泌成分的级别与预后相关。非神经内分泌成分应分为腺癌、腺泡细胞癌(胰腺)、鳞状细胞癌或任何其他可定义的肿瘤类别(视具体情况而定)。一般来说,由腺癌伴NEC成分组成的MiNEN可以保留MANEC的名称,预后较差(与纯型NEC重叠),与非神经内分泌成分无关。由腺癌和神经内分泌肿瘤(NET)组成的MiNEN已有报道,但其预后意义需要进一步研究。应记录神经内分泌成分的Syn和CgA免疫染色的强度和范围。
胃肠道的高分化神经内分泌肿瘤TNM分期
胃肠道的高分化神经内分泌肿瘤
分类的规则
该分类系统适用于胃肠道(包括胰腺)高分化神经内分泌肿瘤(类癌和非典型类癌)。肺神经内分泌肿瘤应根据肺癌的标准进行分类。皮肤的Merkel细胞癌有单独的分类。不包括高级别(3级)神经内分泌癌,它应根据相应部位的癌症分类标准进行分类。
高分化神经内分泌肿瘤(G1和G2)—胃、空肠/回肠、阑尾、结肠和直肠
区域淋巴结
区域淋巴结对应于癌的适当部位下列出的淋巴结。
TNM临床分期
胃
T-原发性肿瘤
TX 原发性肿瘤无法评估
TO 无原发性肿瘤的证据
T1 肿瘤浸润粘膜或粘膜下层,最大径≤1cm
T2 肿瘤浸润固有肌层或最大径>1cm
T3 肿瘤浸润浆膜下层
T4 肿瘤穿透内脏层腹膜(浆膜),或浸润其他器官或邻近结构
注释:
对于任何T,多发性肿瘤添加前缀(m)。
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 区域淋巴结转移
M-远处转移
M0 无远处转移
M1 远处转移
M1a 仅有肝转移
M1b 仅有肝外转移
M1c 肝和肝外转移
分期
I期 T1 NO MO
II期 T2,T3 NO MO
III期 T4 NO MO
任何T N1 MO
IV期 任何T 任何N M1
TNM临床分期
十二指肠/壶腹肿瘤
T-原发性肿瘤
TX 原发性肿瘤无法评估
TO 无原发性肿瘤的证据
T1 十二指肠:肿瘤浸润粘膜或粘膜下层,最大径≤1cm
壶腹:肿瘤最大径为1cm或更小,局限于奥迪括约肌内
T2 十二指肠:肿瘤浸润固有肌层或最大径>1cm
壶腹:肿瘤通过括约肌侵入十二指肠粘膜下层或固有肌层,或最大径>1cm
T3 肿瘤浸润胰腺或胰周脂肪组织
T4肿瘤穿透内脏层腹膜(浆膜)或浸润其他器官
注释:
对于任何T,多发性肿瘤添加前缀(m)。
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 区域淋巴结转移
M-远处转移
M0 无远处转移
M1远处转移
M1a 仅有肝转移
M1b 仅有肝外转移
M1c 肝和肝外转移
分期
I期 T1 NO MO
II期 T2,T3 NO MO
III期 T4 NO MO
任何T N1 MO
IV期 任何T 任何N M1
TNM临床分期
空肠/回肠
T-原发性肿瘤
TX 原发性肿瘤无法评估
TO 无原发性肿瘤的证据
T1 肿瘤浸润粘膜或粘膜下层,最大径≤1cm
T2 肿瘤浸润固有肌层或最大径>1cm
T3 肿瘤穿透固有肌层进入浆膜下组织,不穿透上覆浆膜(空肠或回肠)
T4 肿瘤穿透脏层腹膜(浆膜),或浸润其他器官或邻近结构
注释:
对于任何T,多发性肿瘤添加前缀(m)。
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 <12个区域淋巴结转移不伴>2cm的肠系膜肿块
N2 ≥12个区域淋巴结转移和/或最大径>2cm的肠系膜肿块
M-远处转移
M0 无远处转移
M1 远处转移
M1a 仅有肝转移
M1b 仅有肝外转移
M1c 肝和肝外转移
分期
I期 T1 NO MO
II期 T2,T3 NO MO
III期 T4 任何N MO
任何T N1,N2 MO
IV期 任何T 任何N M1
TNM临床分期
阑尾
T-原发性肿瘤a
TX 原发性肿瘤无法评估
TO 无原发性肿瘤的证据
T1 肿瘤最大径≤2cm
T2 肿瘤最大径>2cm但≤4cm
T3 肿瘤>4cm或浆膜下浸润或累及阑尾系膜
T4 肿瘤穿透腹膜或浸润其他邻近器官或结构,而不是直接延伸到邻近的浆膜下层,如腹壁和骨骼肌b
注释:
a 不包括高级别神经内分泌癌、混合性腺神经内分泌癌和杯状细胞类癌,它们应根据癌症分类标准进行分类。
b 肉眼可见的附着在其他器官或结构上的肿瘤归入T4。然而,如果显微镜下粘连处没有肿瘤,则应酌情将肿瘤分类为pT1-3。
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 区域淋巴结转移
M-远处转移
M0 无远处转移
M1 远处转移
M1a 仅有肝转移
M1b 仅有肝外转移
M1c 肝和肝外转移
pTNM 病理分类
pT和pN类别对应于T和N类别。
pNO 区域淋巴结切除标本的组织学检查,通常≥12淋巴结。如果淋巴结呈阴性,但未达到常规检查的数量要求,则归类为pNO。
pM-远处转移
pM1 显微镜下证实的远处转移
注释:
* pM0和pMX不是正确的类别。
分期
I期 T1 NO MO
II期 T2.T3 NO MO
III期 T4 NO MO
任何T N1 MO
IV期 任何T 任何N M1
注:此处提供的信息摘自TNM恶性肿瘤分类第八版。
TNM临床分期
结直肠和直肠
T-原发性肿瘤
TX 原发性肿瘤无法评估
TO 无原发性肿瘤的证据
T1 肿瘤浸润固有层或粘膜下层,或≤2cm
T1a 肿瘤<1cm
T1b 肿瘤大小1~2cm
T2 肿瘤浸润固有肌层或大小>2cm
T3 肿瘤浸润浆膜下或非腹膜化的结肠周围或直肠周围组织
T4 肿瘤穿透内脏层腹膜或浸润其他器官
注释:
对于任何T,多发性肿瘤添加前缀(m)。
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 区域淋巴结转移
M-远处转移
M0 无远处转移
M1远处转移
M1a 仅有肝转移
M1b 仅有肝外转移
M1c 肝和肝外转移
pTNM 病理分类
pT和pN类别对应于T和N类别。
pM远处转移*
pM1 显微镜下证实的远处转移
注释:
* pM0和pMX不是正确的类别。
分期
I期 T1 NO MO
IIA期 T2 NO MO
IIB期 T3 NO MO
IIIA期 T4 NO MO
IIIB期 任何T N1 MO
IV期 任何T 任何N M1
高分化神经内分泌肿瘤—胰腺(G1和G2)
分类的规则
该分类系统适用于胰腺高分化神经内分泌肿瘤(类癌和非典型类癌)。不包括高级别神经内分泌癌,它应根据胰腺癌的分类标准进行分类。
区域淋巴结
区域淋巴结对应于癌的适当部位下列出的淋巴结。
TNM临床分期
胰腺
T-原发性肿瘤a
TX 原发性肿瘤无法评估
TO 无原发性肿瘤的证据
T1 肿瘤局限于胰腺b,最大径≤2cm
T2 肿瘤仅限于胰腺,最大径>2cm但<4cm
T3 肿瘤局限于胰腺b,最大径>4cm或肿瘤浸润十二指肠或胆管
T4 肿瘤浸润邻近器官(胃、脾、结肠、肾上腺)或大血管壁(腹腔轴或肠系膜上动脉)
注释:
a 对于任何T,多发性肿瘤添加前缀(m)。
b 浸润邻近胰周脂肪组织是可以接受的,但不包括浸润邻近器官。
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 区域淋巴结转移
M-远处转移
M0 无远处转移
M1 远处转移
M1a 仅有肝转移
M1b 仅有肝外转移
M1c 肝和肝外转移
分期
I期 T1 NO MO
II期 T2,T3 NO MO
III期 T4 NO MO
任何T N1 MO
IV期 任何T 任何N M1
注:此处提供的信息摘自TNM恶性肿瘤分类第八版。

















共0条评论