消化系统肿瘤WHO分类第五版学习笔记(二)
往期回顾:
2 食管肿瘤
良性上皮肿瘤及其前驱病变
鳞状细胞乳头状瘤
Barrett异型增生
鳞状细胞异型增生
恶性上皮性肿瘤
食管腺癌和食管胃交界处腺癌NOS
腺样囊性癌
腺鳞癌和黏液表皮样癌
鳞状细胞癌NOS
未分化癌
神经内分泌肿瘤
食管肿瘤WHO分类
良性上皮肿瘤及其前驱病变
8052/0 鳞状细胞乳头状瘤NOS
8060/0 鳞状细胞乳头状瘤病
8148/0 食管腺体异型增生(上皮内肿瘤),低级别
8148/2 食管腺体异型增生(上皮内肿瘤),高级别
8077/0 食管鳞状上皮内肿瘤(异型增生),低级别
8077/2 食管鳞状上皮内肿瘤(异型增生),高级别
恶性上皮性肿瘤
8140/3 腺癌NOS
8200/3 腺样囊性癌
8430/3 黏液表皮样癌
8560/3 腺鳞癌
8070/3 鳞状细胞癌NOS
8051/3 疣状鳞状细胞癌
8074/3 鳞状细胞癌,梭形细胞
8083/3 基底样鳞状细胞癌
8020/3 癌,未分化,NOS
8082/3 淋巴上皮瘤样癌
8240/3 神经内分泌肿瘤NOS
8240/3 神经内分泌肿瘤,1级
8249/3 神经内分泌肿瘤,2级
8249/3 神经内分泌肿瘤,3级
8246/3 神经内分泌癌NOS
8013/3 大细胞神经内分泌癌
8041/3 小细胞神经内分泌癌
8154/3 混合性性神经内分泌-非神经内分泌肿瘤(MiNEN)
8045/3 组合性小细胞-腺癌
8045/3 组合性小细胞-鳞状细胞癌
----
形态学代码来自《国际肿瘤学疾病分类》第三版第二次修订版(ICD-O-3.2)。行为编码/0表示良性肿瘤;/1表示未说明、交界性或不确定的行为;/2表示原位癌和III级上皮内瘤肿瘤;/3表示恶性肿瘤,原发部位;/6用于恶性肿瘤转移部位。癌症登记处一般不使用行为代码/6。
考虑到我们对这些病变的理解发生了变化,本版本在第4版WHO分类的基础上进行了修订。
食管肿瘤TNM分期
食管
(ICD-O-3 C15)包括食管胃交界处(C16.0)
分类规则
该分类仅适用于癌,包括食管胃/胃食管交界处的腺癌。应当有组织学证实的疾病,并通过局部定位来确定病例的解剖学细分部位,以及组织学类型。肿瘤中点在食管胃交界处(OGJ)2cm以内,并向食管内延伸的肿瘤,使用食管癌方案进行分类和分期。累及OGJ的癌,其中点在贲门近端2cm以内(Siewert I/II型),按食管癌进行分期。
以下是评估T、N和M类别的程序。
T类别 物理检查、影像学检查、内窥镜检查(包括支气管镜检查)和/或手术探查
N类别 物理检查、影像学检查和/或手术探查
M类别 物理检查、影像学检查和/或手术探查
解剖部位细分
1.颈部食管(C15.0):起始于环状软骨的下缘,终止于距离上切牙约18cm的胸廓入口(胸骨上切迹)。
2.胸部食管
a) 胸上面(C15.3)从胸廓入口延伸到气管分叉处,距离上切牙约24cm
b) 胸中段(C15.4)是气管分叉和食管胃交界处之间的食管的近端一半。最下端水平距离上切牙约32cm
c) 胸下段(C15.5)长约8cm(包括腹部食管),是气管分叉和食管胃交界处之间的食管的远端一半。最下端水平距离上切牙约40cm
3.食管胃交界处(C16.0)。累及食管胃交界处(OGJ)的癌,其中点在贲门近端2cm以内(Siewert I/II型),按食管癌进行分期。中点距OGJ远端超过2cm的癌,即使累及OGJ,也使用胃癌TNM和分期。
区域淋巴结
无论原发肿瘤的位置如何,区域淋巴结都是食管引流区的淋巴结,包括颈部的腹腔轴淋巴结和食管旁淋巴结,但不包括锁骨上淋巴结。
TNM临床分类
T-原发性肿瘤
TX 原发性肿瘤无法评估
TO 无原发性肿瘤的证据
Tis 原位癌/高级别异型增生
T1 肿瘤侵犯固有层、黏膜肌层或黏膜下层
T1a 肿瘤侵犯固有层或黏膜肌层
T1b 肿瘤侵犯黏膜下层
T2 肿瘤侵犯固有肌层
T3 肿瘤侵犯外膜
T4 肿瘤侵犯邻近结构
T4a 肿瘤侵犯胸膜、心包、奇静脉、膈肌或腹膜
T4b 肿瘤侵犯其他邻近结构,如主动脉、椎体或气管
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 1~2个区域淋巴结转移
N2 3~6个区域淋巴结转移
N3 ≥7个区域淋巴结转移
M-远处转移
MO 无远处转移
M1 远处转移
pTNM病理分类
pT和pN类别对应于T和N类别。
pNO 区域淋巴结切除标本的组织学检查通常包括≥7个淋巴结。如果淋巴结呈阴性,但未达到常规检查的数量要求,则归类为pNO。
pM-远处转移*
pM1 显微镜下证实的远处转移
注释:
* pMO和pMX不是正确类别。
此处提供的信息摘自TNM恶性肿瘤分类第八版。
分期和预后组—食管和食管胃交界的癌*
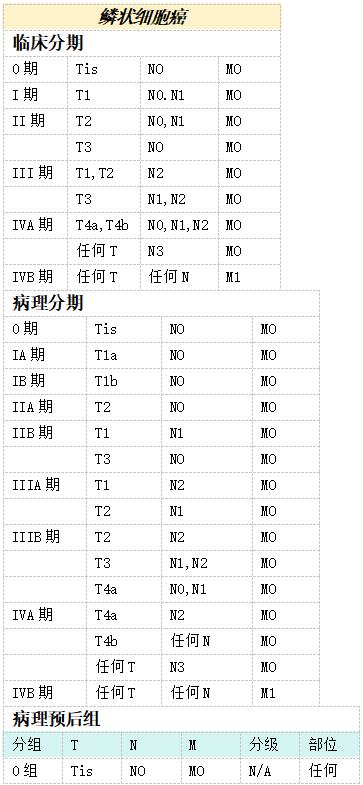
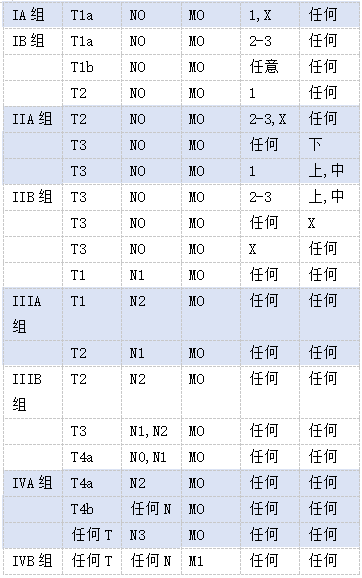
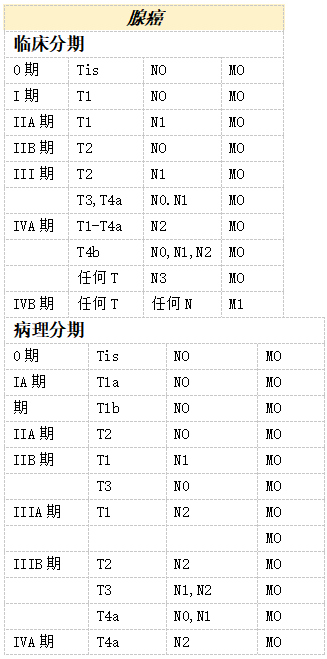
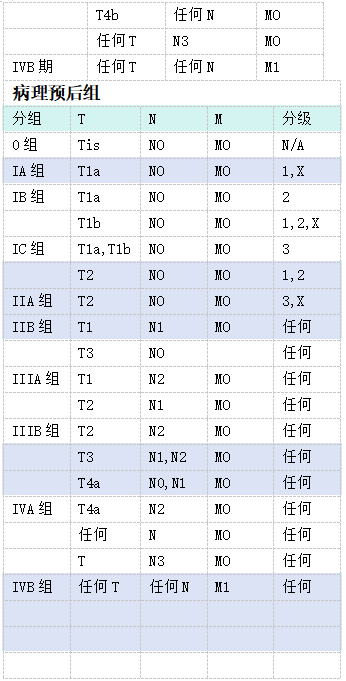
注释:
* AJCC出版适用于腺癌和鳞状细胞癌新辅助化疗后的预后组(类别加上前缀“y”)。
此处提供的信息摘自TNM恶性肿瘤分类第八版。
食管肿瘤: 介绍
本章描述上皮分化的良恶性食管肿瘤及其前驱病变。本章所涵盖解剖部位的ICD-0编码见简表2.01。最常见的良性病变,鳞状细胞乳头状瘤,将专门介绍。在第五版中,前驱病变通常与恶性肿瘤分开描述,这与第四版不同。这种改变是基于我们对前驱病变的生物学、病理特征和临床实践的相关性有了深入理解。
食管主要有两种前驱病变:Barrett异型增生和鳞状细胞异型增生。在过去十年左右的时间里,对于伴有高级别异型增生的Barrett食管患者,我们看到了从外科手术治疗到消融治疗的重要转变。同样的转变最终可能发生在对于低级别异型增生的治疗中,但这目前是一个有争议的问题。因此,目前二级(低级别与高级别)分类系统在临床上仍然有用,但如果消融也成为低级别异型增生的标准治疗方法,这种情况可能会改变。无论如何,我们现在对Barrett食管及其前驱病变癌变的分子途径和病理特征有了更深理解。与十年前相比,人们现在对两种最常见的异型增生类型—肠型和胃小凹型(胃型)的病理特征、生物学行为和临床关联有了更深理解,但它们与非肿瘤性再生病变的区别仍然是一个挑战,需要进一步研究。取样误差仍然是监测计划中一个值得关注的问题,但在Barrett食管监测中越来越多地使用刷取采样和基于细胞学的诊断,已经大大改善了普通和高危患者人群中杯状细胞和异型增生的检出率。世界各地对Barrett食管的定义一直存在争议:在美国,杯状细胞是诊断的必要标准,而在亚洲和欧洲国家,并不被认为这一特征是必需的。
鳞状细胞异型增生仍然是食管中尚未深入理解的肿瘤,也是世界各地病理医师之间存在分歧的话题。这是一种少见的实体,除非在食管鳞状细胞癌高发的地区,那里有筛查计划。自第四版以来,一个值得注意的变化是,现在人们普遍认为,二级分级系统比三级系统更可取(因为它的重复性和临床相关性都更好)。然而,食管鳞状细胞异型增生的病理特征及其变异,以及分子特征,仍然是需要进一步研究的领域。
食管最常见的两种恶性上皮肿瘤是腺癌和鳞状细胞癌。近年来,对这些实体的亚型有了更深理解,一些进展放在肿瘤的相应章节中介绍。这两种食管癌的发病率在世界各地有所不同,对其病因的理解也有所提高,例如某些环境和饮食因素。一个重要的变化是,对于没有接受新辅助放化疗的患者,这两种癌症的TNM分期标准现在有所不同。近年来,新辅助放化疗已成为食管癌治疗的主流;因此,人们越来越意识到治疗对癌症形态和分子生物学的影响及其消退模式,现在这些模式已被纳入分期系统,以确认其临床相关性。对于食管鳞状细胞癌和腺癌,现在强烈建议采用肿瘤分化的二级分级系统。
简表2.01 本章所涵盖解剖部位的ICD-0编码

在第五版中,食管腺癌和OGJ腺癌在一章,因为最近的数据表明这些肿瘤具有许多共同的病因、组织学和生物学特征。然而,读者应该意识到OGJ腺癌的定义发生了变化,现在包括肿瘤中点在交界处2cm以内的任何腺癌。
最近,食管癌治疗取得了重要进展,这与免疫疗法和靶向治疗有关。例如,现在被认为HER2(HER2)状态是OGJ腺癌对抗HER2治疗反应的预测因素。
混合性肿瘤的定义和诊断标准,如腺鳞癌和黏液表皮样癌,一直是令人困惑的问题。这些是罕见的肿瘤,但我们对其生物学特征的理解不足,主要是由于缺乏明确的诊断标准和对其发病机制的理解不足。例如,对于这两种癌是鳞状细胞癌还是腺癌的组织亚型存在争议,尽管它们似乎在两种情况下都会出现(鳞和腺),在世界不同地区的发病率不同。有些也可能来自食管腺导管(腺),但尚不清楚这些病例与来自黏膜上皮(鳞)的病例有何不同。
未分化癌是一种缺乏鳞、腺或神经内分泌分化的肿瘤。在第五版中,现在认为未分化癌是一种独特的实体,而不是鳞状细胞癌的亚型。
食管神经内分泌肿瘤(NEN)少见。它们现在根据与胰腺和胃肠型其他部位的NEN相同的标准进行分类。这些分类标准详见第1章介绍部分“消化系统神经内分泌肿瘤的分类”(原书第16页)。
一、良性上皮肿瘤及其前驱病变
01. 食管鳞状细胞乳头状瘤
定义
食管鳞状细胞乳头状瘤(squamous papilloma)是一种由鳞状上皮组成的良性食管上皮息肉,通常具有乳头状生长模式。
ICD-0编码
8052/0鳞状细胞乳头状瘤NOS
ICD-11编码
2E92.0&XH50T2食管良性肿瘤&鳞状细胞乳头状瘤
相关术语
无
亚型
鳞状细胞乳头状瘤病(8060/0)
部位
在美国的一项大型研究中,58%的鳞状细胞乳头状瘤位于下段食管。在亚洲人群中,鳞状细胞乳头状瘤更常见于中段食管。在中国台湾的一系列研究中,略多于一半(54%)的鳞状细胞乳头状瘤位于食管中部。
临床特征
大多数鳞状细胞乳头状瘤患者没有症状。内镜下,鳞状细胞乳头状瘤表现为小的白色的外生性赘生物,疣状表面有血管交叉。
流行病学
鳞状细胞乳头状瘤少见。内镜系列的患病率范围为0.01%~0.45%。在法国东北部的一项大型内窥镜系列中,男女比值为1.3:1。在许多其他人群中,鳞状细胞乳头状瘤在女性更为常见(男女比值在0.2:1~0.8:1之间)。鳞状细胞乳头状瘤通常出现在中年(中位年龄:50岁)。鳞状细胞乳头状瘤病可能出现在儿科或老年患者中。英语文献中报告了大约30例病例。
病因
鳞状细胞乳头状瘤的病因包括慢性黏膜刺激、HPV感染和遗传综合征。慢性黏膜刺激可能是由化学因素(如胃食管反流、饮酒、吸烟和腐蚀性损伤)或机械因素(如轻微创伤、静脉曲张硬化治疗、自膨胀金属支架、慢性食物嵌塞、鼻胃管插管和布基辅助食管扩张)引起的。胃食管反流在鳞状细胞乳头状瘤中的病因作用可能解释了为什么这些病变经常位于下食管。在某些系列中,鳞状细胞乳头状瘤患者中观察到的HPV感染率高达87.5%。鳞状细胞乳头状瘤病可能发生在局灶性皮肤发育不全(也称为Goltz-Gorlin综合征)或色素性血管瘤患者中;这两种遗传性疾病都是影响X染色体的罕见遗传性皮肤病。
发病机制
慢性黏膜刺激或HPV感染会导致黏膜损伤。由此产生的旺炽性再生反应刺激鳞状黏膜的增殖,导致鳞状细胞乳头状瘤。有人假设食管乳头状瘤与局灶性皮肤发育不全中早发性胃食管反流的高发病率有关。
大体表现
肉眼观察,鳞状细胞乳头状瘤通常具有白色、隆起的疣状表面。乳头状瘤通常很小(中位直径:3mm),但有报道称存在巨大的鳞状细胞乳头状瘤。
组织病理学
显微镜检查显示鳞状上皮乳头状增生,固有层为纤维血管轴心。通常可见具有挖空细胞形态特征的散在空泡细胞。不存在非典型核特征和病毒包含体。鳞状上皮的增殖模式通常是外生的,但也可以是内生性或尖顶状。鳞状细胞乳头状瘤中很少有异型增生的报道。
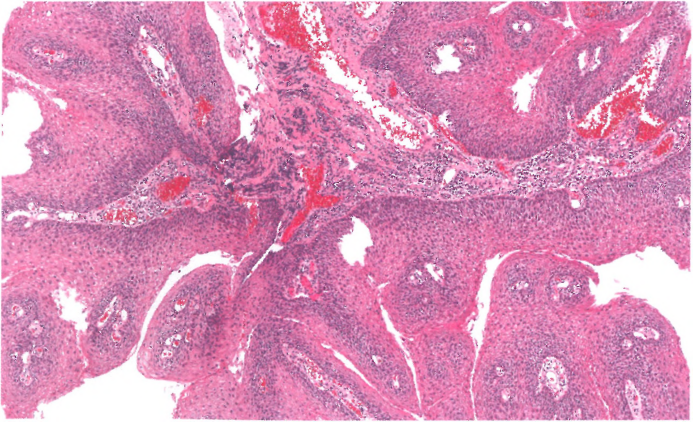
图2.01食管鳞状细胞乳头状瘤。外生生长模式;乳头状纤维血管轴心被增生性鳞状上皮包围,伴有角化不全。
鳞状细胞乳头状瘤应与纤维血管息肉区分开来,纤维血管息肉通常位于食管上部,被覆复层鳞状上皮,没有乳头状增生。鳞状细胞乳头状瘤也必须通过排除浸润来区分鳞状细胞癌。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:由鳞状上皮组成的乳头状瘤伴纤维血管轴心。
分期(TNM)
无临床相关性
预后和预测
鳞状细胞乳头状瘤切除后不复发。很少有报道称鳞状细胞癌与鳞状细胞乳头状瘤或鳞状细胞乳头瘤病有关。
02. Barrett异型增生
定义
Barrett异型增生是指形态明确的肿瘤性上皮,没有浸润,发生在食管的化生性柱状上皮区域。
ICD-0编码
8148/0食管腺体异型增生(上皮内肿瘤),低级别
8148/2食管腺体异型增生(上皮内肿瘤),高级别
ICD-11编码
DA23.1 Barrett上皮异型增生
2E92.0&XH3K13食管良性肿瘤&食管腺体异型增生(上皮内肿瘤),低级别
2E60.1&XH36M5食管原位癌&食管腺体异型增生(上皮内肿瘤),高级别
相关术语
低级别Barrett异型增生
不推荐:腺体异型增生。
高级别Barrett异型增生
不推荐:柱状异型增生。
亚型
无
部位
Barrett异型增生仅限于化生性食管黏膜。
临床特征
Barrett食管异型增生没有明显的临床、影像学或血清学表现。患者通常因潜在的Barrett食管而出现胃食管反流病等症状。内镜下可见异型增生,表现为平坦、斑块状或不规则的黏膜区域,与周围的非异型增生Barrett食管不同。溃疡、斑块、结节和狭窄等黏膜异常与癌症风险增加有关。
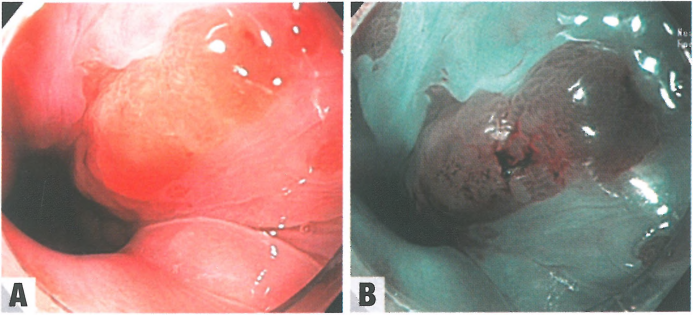
图2.02高级别Barrett异型增生。A 白光内窥镜检查显示2cm长的舌状Barrett食管,其高级别异型增生病灶表现为黏膜的轻微不规则和斑块状区域,血管模式略有丢失和充血。B 异型增生病灶最好用窄带成像来观察,有助于勾勒出异常区域。
流行病学
Barrett食管异型增生的风险因素与食管腺癌的风险因素相似(见原书第39页简表2.02)。异型增生主要发生在化生性肠型上皮,特征为存在杯状细胞。然而,肿瘤也可以发生在没有杯状细胞的黏膜。非杯状柱状上皮发生肿瘤的真正风险尚不清楚。
病因
见食管腺癌和OGJ 腺癌 NOS(原书第38页)。
发病机制
Barrett食管中的癌症发生发展次序是从炎症到化生、异型增生以及最终的癌症。由于慢性胃食管反流病,鳞状上皮转化为柱状上皮,最初为贲门型,没有杯状细胞;随后,会发展为杯状细胞化生,最终导致异型增生。已证明异型增生是由无杯状细胞上皮的克隆发展而来;在食管任何部位都没有杯状细胞的患者中,甚至在短节柱状化生的患者中都会出现异型增生和癌症。异型增生是多种遗传学和表观遗传学改变累积的结果,其中许多改变发生在异型增生之前。许多分子事件,特别是早期发生的分子事件,与细胞周期调控基因、凋亡、细胞信号传导和粘附途径的改变有关。Barrett食管相关肿瘤的晚期变化包括广泛的基因组异常、染色体功能的丢失和增加,以及(最重要的)以4N(四倍体)细胞组分和非整倍体增多为特征的DNA不稳定。异型增生显示Ki-67增殖指数增加,通常在隐窝底部最高,但在高级别异型增生的表面上皮中也可能很高。其他异常包括PCNA、CCND1、TP53、IGF2BP3和AMACR的突变。关于Barrett食管分子异常的更完整描述,请参阅食管腺癌和OGJNOS(原书第38页)。
大体表现
无临床相关性
组织病理学
最常见的两种异型增生类型是肠型和胃小凹型;后者也称为非肠型异型增生或胃型异型增生。异型增生罕见锯齿状生长模式。肠型和胃型异型增生的混合模式并不少见。肠型异型增生由具有肠分化的柱状细胞组成,包括杯状细胞和肠细胞样细胞。
就像炎症性肠病,根据Reid等人提出的分类系统,异型增生可分为阴性、不确定或阳性(低级别或高级别);然而,许多病理医师改用修订的维也纳异型增生分类法(见原书第34页表2.01)。低级别异型增生显示细胞学异常,但很少或没有结构异型性。细胞拉长、核增大、核深染和复层化,但在很大程度上保留核极性。复层化通常仅限于细胞质的基底部。杯状细胞的数量从少到多不等,其数量通常随着异型增生程度的增加而减少。
高级别异型增生显示更大程度的细胞学异型性,通常伴有结构异常。细胞显示明显的核增大(达到淋巴细胞大小的3-4倍),基底部到表面上皮显示全层的核复层化,明显的核多形性,不规则的核轮廓,和极性的显著丧失。表面上皮中核分裂数量通常增加,常见非典型核分裂象。可能出现管腔内坏死。部分病例中,异型增生核可能形状不规则,更圆,空泡状,有显著核仁;这在胃型异型增生中更为常见。高级别异型增生的隐窝可能显示大小和形状不规则,显得拥挤,和/或可能含有明显的出芽或成角。腺体背靠背和筛状结构并不少见。单独存在高级别细胞学或结构异常就能诊断高级别异型增生,但大多数病例兼有两种异常。
表2.01 Barrett食管异型增生的Vienna和Reid分类
胃小凹型(非肠型)异型增生中杯状细胞即使有也很少;相反,它的特征是显著的细胞质黏液。细胞呈较为均匀一致的柱状,通常单层排列。核小或稍增大,圆形至椭圆形,位于基底,没有复层化或多形性。部分病例中,核可呈笔杆状。高级别胃小凹型异型增生显示细胞的核质比显著增加,核轮廓更加不规则,常有开放的染色质模式、显著核仁和核分裂率升高。有些病例也可能核复层化。胃小凹型异型增生可能发生在没有杯状细胞的化生性柱状黏膜区域。
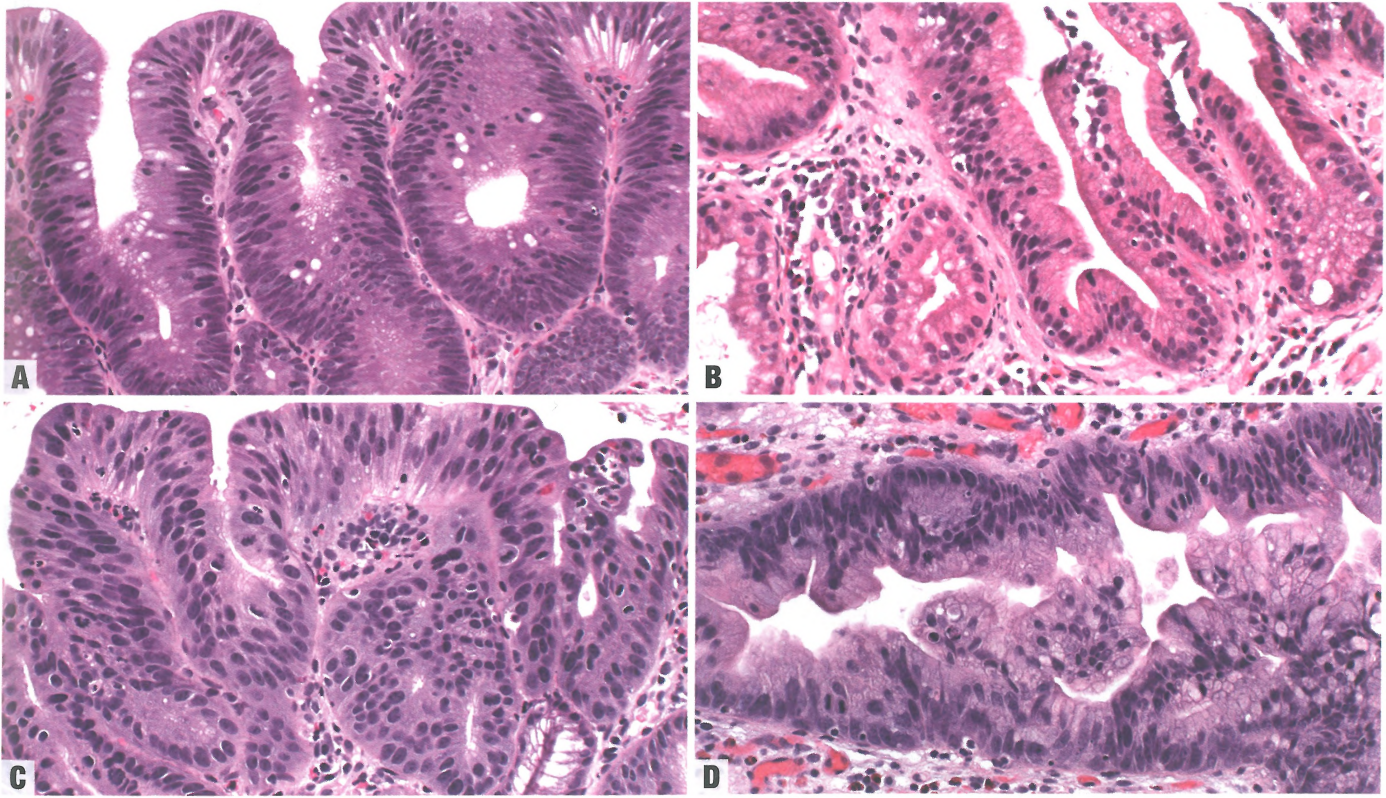
图2.03 Barrett异型增生。A 低级别,肠型。均匀分布的小管,内衬增大的、深染的、细长的、略微复层化的非典型细胞,核分裂数量增加,表面缺乏成熟。B低级别,胃小凹型型。核轻~中度增大、深染、圆形至椭圆形,轻微复层化,核分裂数量增加,但没有杯状细胞;细胞质含有丰富黏液。C 高级别,肠型。致密的隐窝,核明显增大,椭圆形至拉长,核染色,有多个核仁,全层复层化,核分裂数量增加,极性丧失和多形性。D 高级别,胃小凹型型。核增大、深染、细长、形状不规则,伴多形性、全层复层化、极性丧失,和核分裂数量增加;细胞质黏液明显减少。
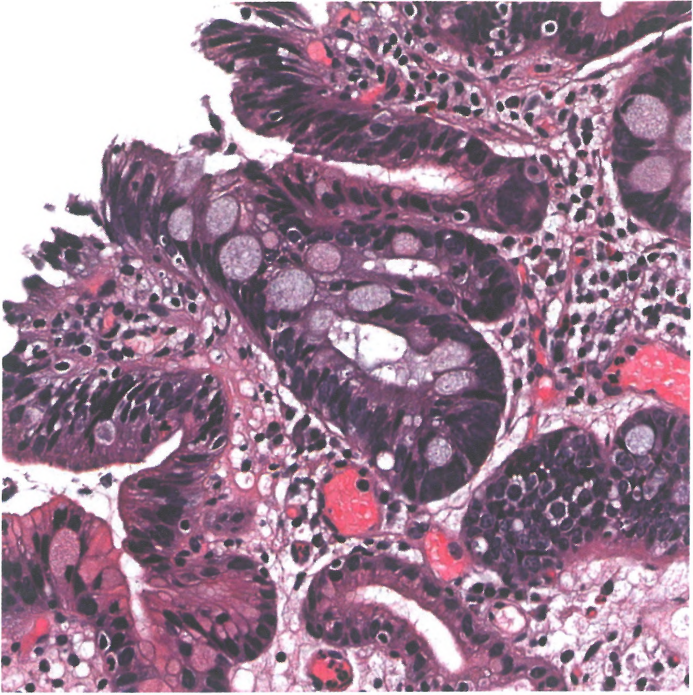
图2.04 Barrett异型增生伴肠化生性。肠型低级别异型增生,伴有多个杯状细胞。
就像炎症性肠病,异型增生有时可能早期发现,此时它仍然局限于隐窝的底部;这种病例称为隐窝异型增生。隐窝异型增生通常显示低级别细胞学特征,但有些病例也可能呈高级别细胞学变化。
使用p53、AMACR和IMP3免疫染色,有时可用于区分非异型增生和异型增生上皮,但结果不一致,价值参差不齐。例如p53,非突变模式不能排除异型增生。
细胞学
细胞学越来越多地用于Barrett食管及其相关肿瘤诊断活检的辅助手段。一般来说,异型性的程度取决于异型增生的等级,但在细胞学样本上诊断低级别和高级别异型增生的公认标准尚未建立。在一些研究中,细胞学在诊断低级别异型增生方面的观察敏感性低至31%,但与使用黏膜活检样本的诊断相比,高级别异型增生的细胞学诊断更准确,据报道敏感性为82%,特异性高达95%。细胞学检查,异型增生显示恶性肿瘤的一些非典型特征,如细胞弥散、无序排列、核质比增加、核增大、核深染、核膜不规则和染色质异常(粗块或透明)。细胞团的外围通常不规则。在高级别异型增生中,细胞粘附性更低,核质比更高,非典型核中度至明显增大。
诊断分子病理学
无临床相关性
诊断标准
必要标准:上皮明确的肿瘤性改变,无浸润。
注:明确的肿瘤性改变(异型增生)最常见表现为核增大、深染、拉长、多形性和复层化,伴核分裂数量增加,缺乏表面成熟,极性丧失。结构上,高级别异型增生中,肿瘤上皮可能表现为大小和形状异常的腺体,伴分支、复杂性增加,和/或背靠背生长模式,很少或没有插入的固有层。
分期(TNM)
无临床相关性
预后和预测
在各种研究中,观察到低级别异型增生向高级别异型增生或癌症的进展率在3%-23%之间,这无疑是观察者之间差异的结果。在一项荟萃分析中,单独进展为腺癌的合并年化发病率为0.5%,进展为高级别异型增生或腺癌为1.7%。在一些研究中,高达55%的高级别异型增生在5年的随访中进展为癌症,高级别异型增生伴有每年≥6%的癌症发病率。在最近的一项欧洲研究中,与低级别异型增生相关的腺癌进展风险是非异型增生相关风险的5倍。已证明低级别和高级别异型增生的进展率与达成一致诊断的病理医师数量有关。在一项研究中,15/25名(60%)检出异型增生病变伴结节的患者被诊断为食管癌症。腺癌和息肉样异型增生、溃疡或狭窄形成之间也观察到了类似的强关联。其他已评估的进展标记物包括p53、p16和DNA含量异常。几项研究表明,异常p53表达与肿瘤进展风险增加之间存在正相关。基因组不稳定性也是进展的有用标志。
03. 食管鳞状上皮异型增生
定义
食管鳞状上皮异型增生是一种明确的食管鳞状上皮肿瘤性改变,无浸润。
ICD-0编码
8077/0食管鳞状上皮内肿瘤(异型增生),低级别
8077/2食管鳞状上皮内肿瘤(异型增生),高级别
ICD-11编码
2E92.0&XH3Y37食管良性肿瘤&食管鳞状上皮内肿瘤(异型增生),低级别
2E60.1&XH9ND8食管原位癌&食管鳞状上皮内肿瘤(异型增生),高级别
相关术语
无
亚型
无
部位
鳞状上皮异型增生可发生在食管的任何部位,并且很可能遵循鳞状细胞癌的分布。
临床特征
食管鳞状细胞癌高危患者通常采用Lugol染色内镜和窄带成像相结合的方法进行随访。使用Lugol碘染色后,低级别异型增生表现为不染色或弱染色区域;高级别异型增生总是不染色。与肿瘤性疾病相关的特征包括体积大、外观不平坦、粉红色阳性征和多个独特的碘不染色病变。在窄带成像中,异型增生病变表现为褐色变色区域。窄带成像的异常反映了黏膜内癌的浸润深度和乳头内毛细血管环的变化。
流行病学
据报道,食管鳞状细胞异型增生的患病率从世界一些地区的3%到食管鳞状细胞癌发病率最高的国家(如中国和伊朗伊斯兰共和国)的38%。在中国的系列研究中,鳞状细胞异型增生最常见的级别是轻度,其次是中度和重度。大多数患者无症状;然而,较大面积的异型增生或糜烂,以及共存的鳞状细胞癌,都可能导致吞咽困难和出血等症状。鳞状细胞异型增生的发病率和性别分布与鳞状细胞癌相似。鳞状细胞异型增生最常见于40-60岁。
病因
食管鳞状细胞异型增生的风险因素与食管鳞状细胞癌的风险因素相似(见原书第48页简表2.03)。
发病机制
p53的过表达和CDKN2A的超甲基化(P16INK4a)在鳞状细胞异型增生中已有报道。
大体表现
鳞状细胞异型增生可表现为小的、浅表的或平坦的病变。
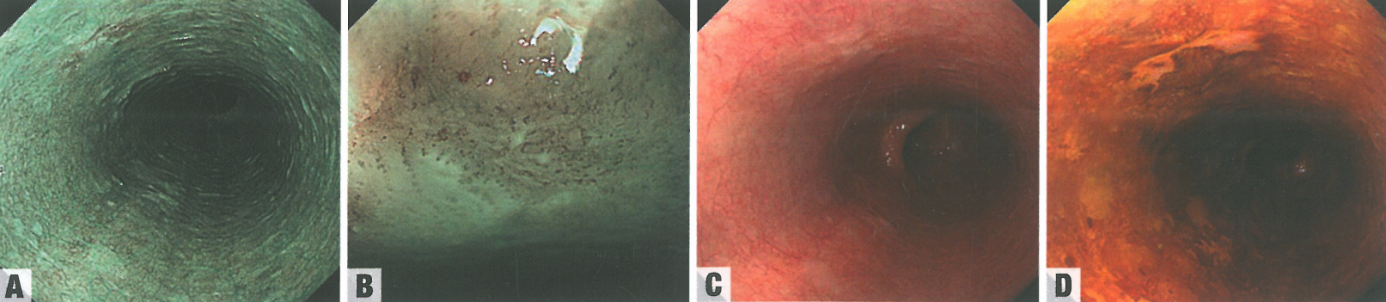
图2.05食管鳞状细胞异型增生。A 窄带成像,低倍,病变表现为左前壁约10mm大小的褐色区域,距离切牙30cm。B 窄带成像,高倍,乳头内毛细血管环轻度不规则,其间的黏膜颜色鲜艳。C 白光内窥镜,病变表现为平坦、轻微凹陷的病变,略微发红。D Lugol染色内镜,病变呈粉红色征阳性,边界清晰,不染色。
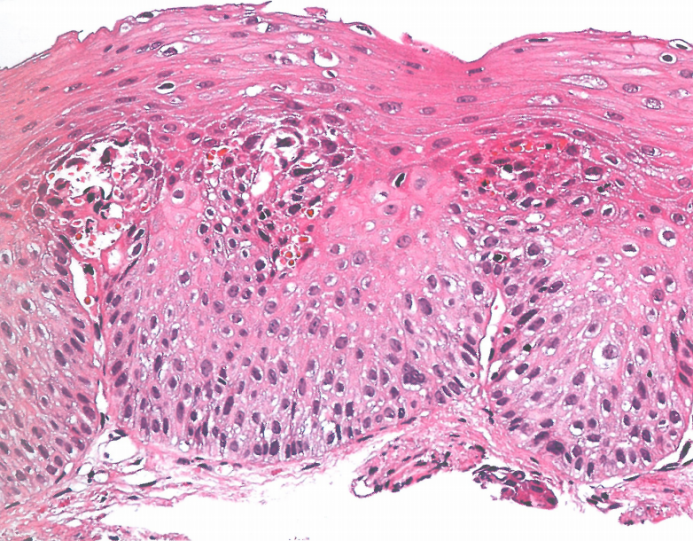
图2.06低级别食管鳞状细胞异型增生。基底细胞层扩张,核多形性轻微。
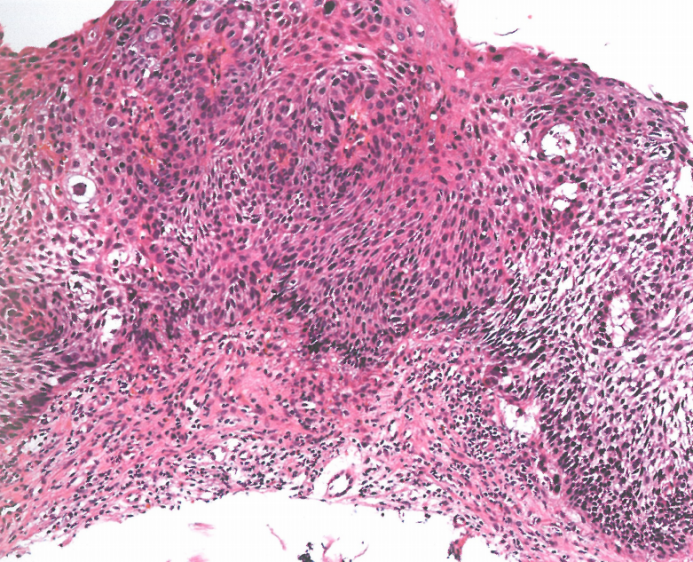
图2.07高级别食管鳞状细胞异型增生。全层异型增生,伴重度核多形性。
组织病理学
诊断鳞状细胞异型增生需要兼有细胞学和结构异型性。细胞学异型性的特征是核异型性,包括核增大、多形性、核深染、极性丧失和重叠。结构异型性的特征是上皮成熟异常。
鳞状细胞异型增生的分级存在争议;有两种主要系统都在使用。一些国家的病理医师使用三级系统(轻度、中度和重度)。其他国家使用二级系统(低级别和高级别),这是WHO目前推荐的分级系统。低级别异型增生定义为异型增生仅累及上皮的下半部分,只有轻微的细胞学异型性。当累及上皮的一半以上或存在重度细胞学异型性时(无论上皮受累程度如何),诊断为高级别异型增生。高级别异型增生包括的病变组在日本和亚洲其他地区也称为“原位癌”。
细胞学
食管球囊细胞学筛查主要基于鳞状细胞核的大小,在中国曾经用于早期检测鳞状细胞异型增生。
诊断分子病理学
无临床相关性
诊断标准
鳞状细胞异型增生
必要标准:细胞学异型性(核异型性:增大、多形性、核深染、极性丧失和重叠);结构异型性(上皮成熟异常)。
低级别
必要标准:仅累及上皮的下半部分,并且仅有轻微的细胞学异型性。
高级别
必要标准:累及上皮的一半以上或重度细胞学异型性(无论上皮细胞受累程度如何)。
分期(TNM)
无临床相关性
预后和预测
在中国的一项活检证实的食管鳞状细胞异型增生的研究中,在3.5年的随访期内,5%的轻度、27%的中度和65%的重度异型增生患者发生了临床诊断的食管鳞状细胞癌;随访13.5年后,这些比例分别增加到24%、50%和74%。在世界上鳞状细胞癌高发地区,如中国,通过筛查和早期治疗来检测鳞状细胞异型增生有望预防鳞状细胞癌的进展。
二、恶性上皮性肿瘤
04. 食管和食管胃交界处腺癌NOS
定义
食管和食管胃交界处腺癌NOS是一种具有腺体或黏液分化的食管上皮恶性肿瘤。
ICD-0编码
8140/3腺癌NOS
ICD-11编码
2B70.0食管腺癌
2B71.0 食管胃交界处腺癌
相关术语
无
亚型
无
部位
几乎所有的腺癌都发生在下段食管和食管胃交界处(OGJ)。食管腺癌和近端胃癌有时可能难以区分。理想情况下,应通过内窥镜确定(最近端的胃褶皱或栅栏状血管的最远端)OGJ;然而,这些信息并非总能获得。更复杂的是,Barrett食管改变会扭曲用于识别OGJ的标志。在目前的病理分期系统中,食管胃交界腺癌定义为其肿瘤中点在OGJ 2cm以内并延伸到食管。罕见情况下,腺癌发生在食管的中三分之一或上三分之一。此类病例很可能来自食管中的黏膜腺、黏膜下腺或异位柱状上皮(也称为入口斑或异位胃黏膜)。文献中报道了不到50例上段食管腺癌与异位胃腺体共存的病例。
临床特征
最常见的症状是吞咽困难、反流、体重减轻和疼痛。较少见症状是恶心、呕吐、贫血和消化不良。内镜活检证实了食管腺癌的诊断。EUS可用于确定癌的局部受累范围以及食管周围淋巴结转移。由于存在重复的黏膜肌层,pT1腺癌的EUS分期不太准确。可疑淋巴结可用EUS引导的细针穿刺(FNA)进行取样。影像学成像(CT、PET-CT或MRI)对于分期(识别任何远处转移)至关重要,对于评估对新辅助治疗的反应也很重要,
流行病学
食管腺癌的全球发病率为每10万人每年0.7例(男性1.1例,女性0.3例)。食管腺癌的发病率在北美、北欧和西欧、澳大利亚和新西兰最高,占全球所有病例的46%。在过去四十年中,其发病率的增长率是所有癌症中最高的,尤其是在高收入国家。在亚洲的一些地区,如以色列和新加坡,食管腺癌的发病率也略有增加。不到1%的食管腺癌发生在40岁以下的患者。癌症发生时的平均患者年龄为60多岁,食管腺癌主要发生在男性,其男女比为4.4:1;男性发病率是女性的3-9倍。发病率上升的时间趋势在两性中大致相同。男女比在高发地区较高,如北美(7.6:1)、大洋洲(6.2:1)和欧洲(6.0:1)。食管腺癌中的男性优势大于食管鳞状细胞癌或Barrett食管。
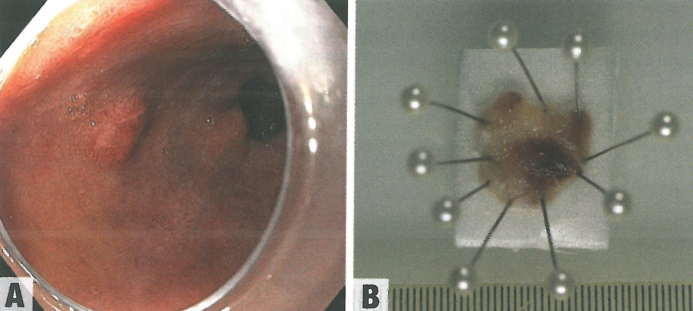
图2.08早期食管腺癌。A 内窥镜检查发现的一例。B 内窥镜切除术取出的标本。
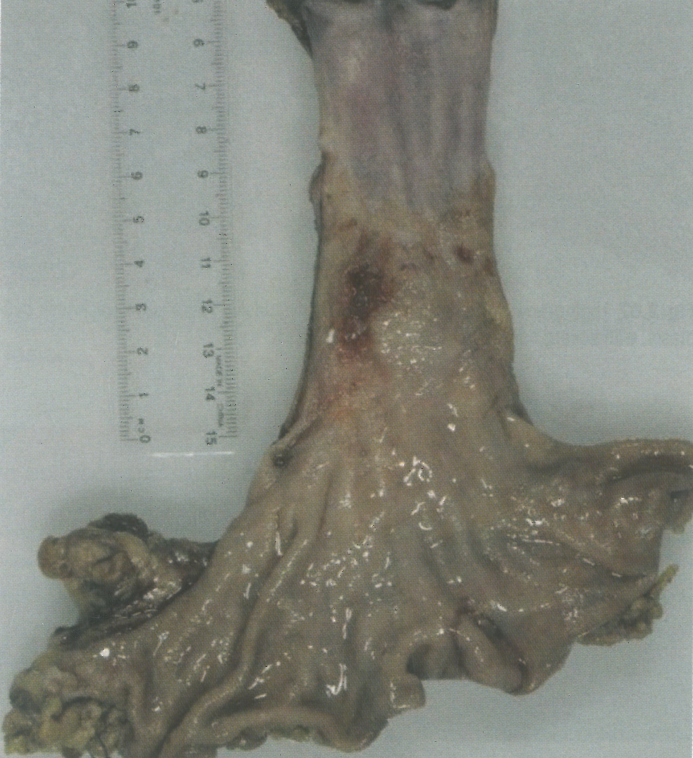
图2.09食管腺癌。大体照片,显示溃疡性生长;注意腺癌附近的黏膜变化,代表异型增生和Barrett食管。
简表2.02 食管腺癌的风险因素

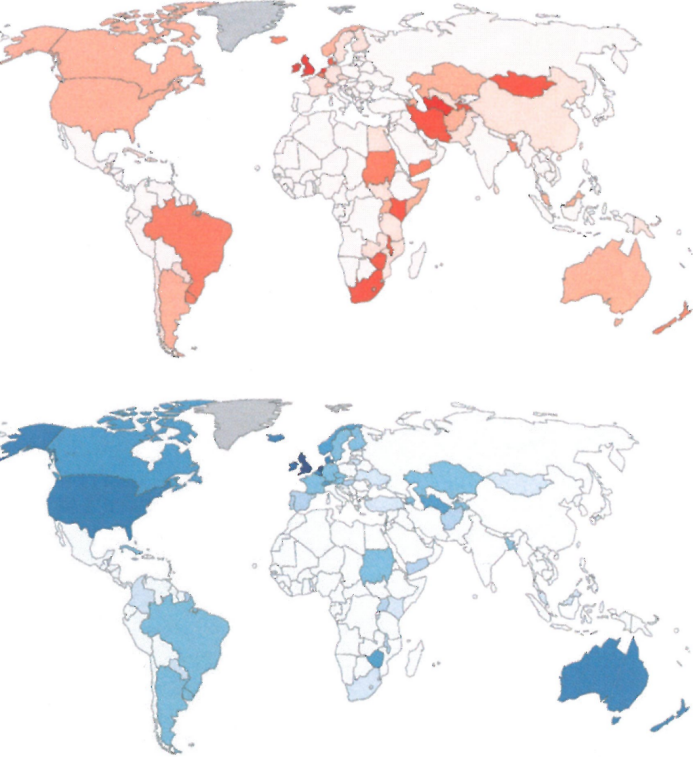
图2.10 2012年女性(上图)和男性(下图)每10万人每年食管腺癌的估计年龄标准化发病率。
发病机制
为了应对胃和肠型内容物的酸/胆汁反流和生态失调(微生物失衡)的影响,胃食管上皮基底部分的干细胞和/或祖细胞被重新编程为柱状细胞谱系。修复性上皮发育成非杯状细胞柱状上皮(近端胃型)。随着时间的推移,这种上皮细胞遵循两条分化线之一:胃途径(壁细胞和主细胞)或肠型途径(杯状细胞和Paneth细胞)。具有杯状细胞的肠型途径是Barrett食管的特征。最近的研究表明,早期Barrett肿瘤总是伴有肠化生。Barrett食管可能通过异型增生进展为腺癌。Barrett食管进展的遗传学和表观遗传学变化已经研究了几十年。一些基因(TP53和SMAD4)的突变以阶段特异性的方式发生,仅限于高级别异型增生和腺癌。
近年来,二代测序技术引发了累及食管腺癌全基因组测序的全球项目。这些项目揭示了与发病机制相关的关键基因途径和突变,鉴定了新基因,并表明食管腺癌化疗前和化疗后样本的基因组图谱相似。目前,这些全面但复杂的数据还没有临床应用,但未来可能会出现临床相关和诊断有用的预后和预测标记物。癌症基因组图谱(TCGA)的数据也表明,食管腺癌与染色体不稳定的胃癌非常相似。
大体表现
食管腺癌通常出现在晚期,表现为狭窄、息肉样、蕈样、溃疡性或弥漫性浸润性病变。较早期,腺癌可能表现为不规则斑块。早期癌可能表现为小结节,也可能在内镜下无法检出。癌旁可能有不规则的淡红色舌状黏膜(类似鲑鱼斑),代表Barrett食管和反流变化,与食管黏膜被覆鳞状上皮的灰白色形成对比。
组织病理学
食管腺癌显示胃、肠和混合(杂交)分化谱系,具有相应的形态学和免疫组织化学特征的证据。腺癌附近的黏膜可能显示Barrett异型增生和肠化生(Barrett食管)。食管腺癌可分为管状、乳头状、黏液性和印戒细胞模式。只有有限的证据表明这些模式的相关性;因此,模式是描述性而不是亚型。常见这些模式的混合。管状模式最常见,特征是不规则的、单层或吻合成网的管状腺体结构,内衬单层或复层化恶性上皮;肿瘤腺体通常有数量不等的细胞内黏液产物,腺体可能扩张。乳头型的特征是有乳头,罕见微乳头结构。黏液模式通常显示癌细胞漂浮在丰富的细胞外黏液中。纯黏液癌罕见,个案报道显示混合性黏液和印戒细胞模式。印戒细胞模式显示印戒样细胞,含有大的细胞内黏液空泡,将细胞核挤向周围。食管腺癌中存在印戒细胞提示预后较差。纯印戒细胞癌极罕见。食管腺癌的印戒细胞模式的报道发病率各不相同;最高相对发病率为7.61%。然而,这些报告中的诊断标准似乎不一致。差粘附性非印戒细胞模式在食管中似乎少见。
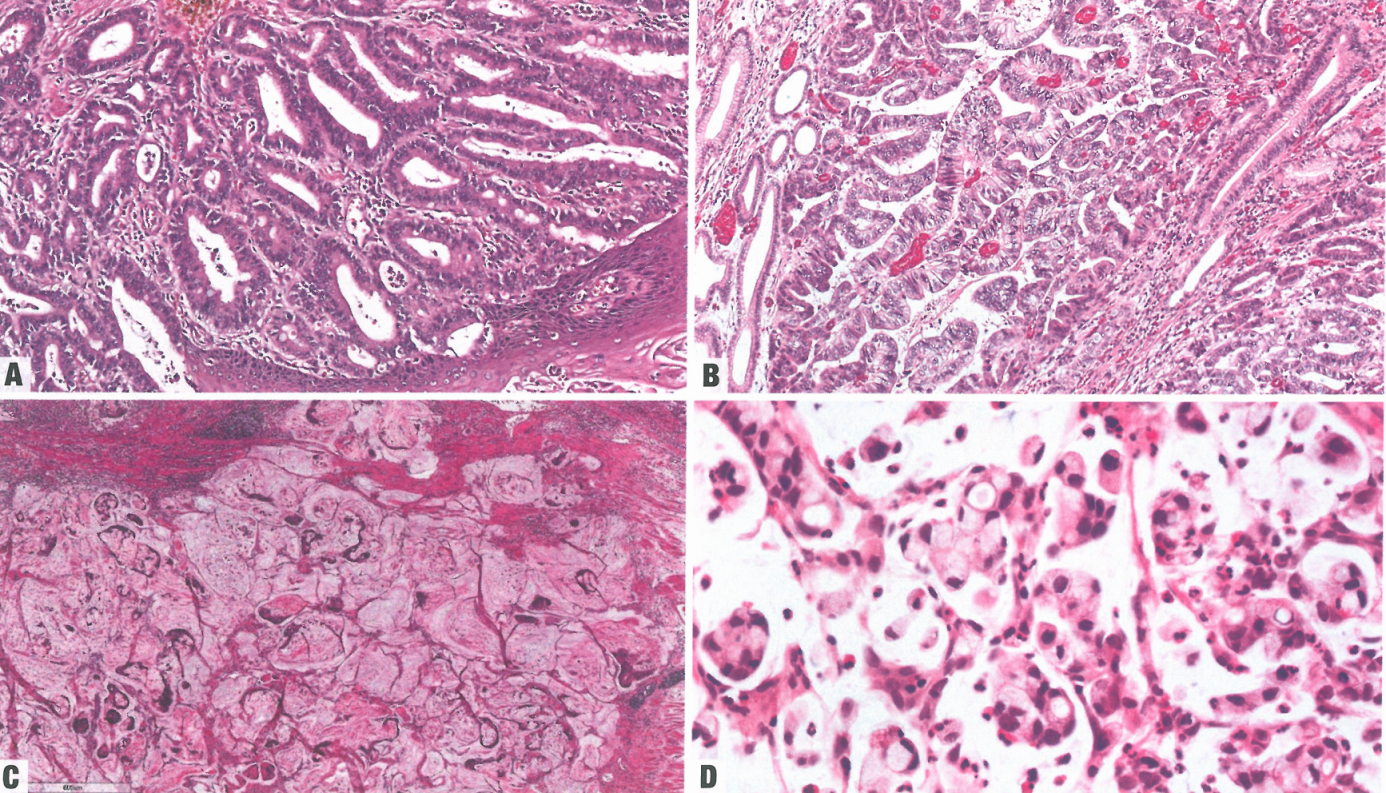
图2.11食管腺癌。A 管状模式。B 乳头状模式。C 黏液模式。D 印戒细胞模式。
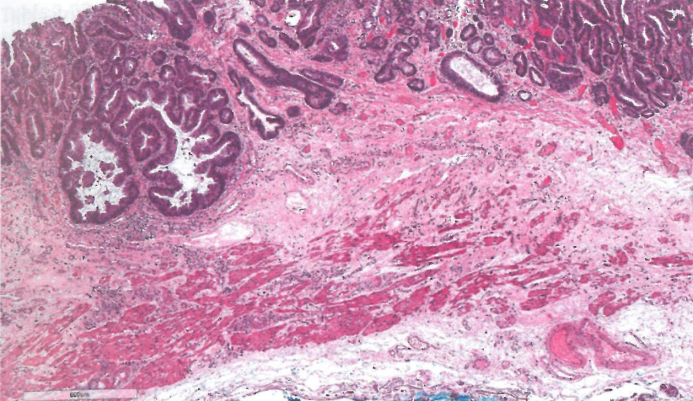
图2.12食管腺癌。Barrett食管发生的一例,伴双层黏膜肌层。
治疗效果
大约一半的食管腺癌在术前接受了放化疗,导致癌、邻近非肿瘤组织和转移淋巴结的形态变化。对于对术前放化疗有完全反应或大部分反应的患者,病变可能较小甚至不可见。在切面上,病变也可能表现为不规则的白色瘢痕和纤维化。术前放化疗后,食管腺癌常见黏液改变。组织学检查可能发现恶性细胞的细胞质变化(如空泡化、嗜酸细胞变化和神经内分泌变化),以及存在肿瘤巨细胞。核分裂象少见,但常见核变化(包括核深染、固缩、碎裂、增大和不规则)。黏膜表面的许多肿瘤细胞可能消失。癌部位显示纤维化、炎症和肉芽组织。因放化疗反应,残留癌可能表现为间质中的孤立细胞或细胞簇。间质反应包括纤维化;营养不良性钙化;坏死;炎症;黏液变性(无细胞黏液湖);泡沫状或含铁血黄素的巨噬细胞、异物巨细胞和胆固醇裂隙;以及成纤维细胞、腺体和血管的反应性变化。
浸润
食管腺癌可能检测到浸润性特征,如肿瘤出芽(定义为存在1-5个细胞的孤立细胞簇)和神经周围浸润。这些特征通常相互关联,并与肿瘤级别高、分期晚和生存率较差相关。
分级
食管腺癌的分级影响其分期。在美国癌症联合委员会(AJCC)癌症分期手册第八版中,1级(高分化)指95%以上的腺癌由完好的腺体组成。2级(中间分化)指50-95%的癌显示腺体形成。3级(低分化)指<50%的癌显示腺体形成。
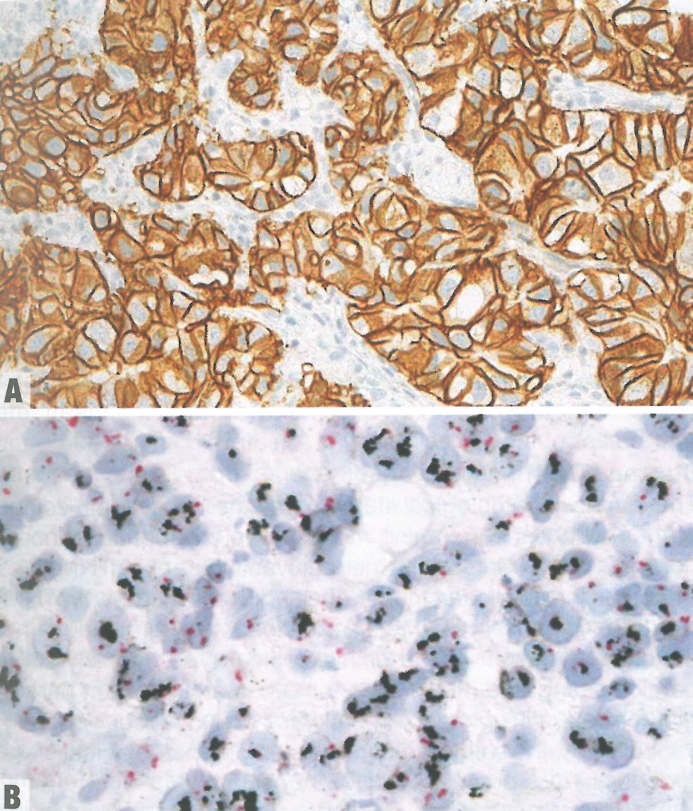
图2.13食管腺癌。A HER2免疫染色为3+;注意侧膜和基底侧膜染色。B 银原位杂交(SISH)证实HER2扩增;黑点表示扩增的HER2信号,红点表示二倍体CEP17信号。也可用FISH,但许多学者推荐SISH优于FISH。
免疫组织化学和组织化学
食管腺癌具有一致CK表达模式:CK7+、CK19+和CK20-,这与胃腺癌无法区分。组织化学染色包括PAS、AB和黏液卡红,可以识别低分化腺癌中的黏液。
鉴别诊断
在下段食管肿瘤的活检中,很难区分低分化腺癌和低分化鳞状细胞癌。鳞状细胞癌对CK5/6、p63(通常>75%阳性)和p40(比p63更特异)呈强阳性,而腺癌对CK7呈强阳性(通常>75%阳性),对鳞状细胞标记物呈阴性。对于免疫组织化学模式不明确且没有形态学上可识别的鳞状或腺体特征的病例,应考虑诊断为未分化癌。一些分化较差的腺癌可能表现出神经内分泌分化;此类病例对放化疗更耐受。术前放化疗可能会在两个方面使诊断复杂化。首先,在新辅助放化疗后,很难区分食管腺癌的黏液成分和无细胞黏液池;某些情况下CK染色可能有助于识别黏液内的癌细胞。其次,非肿瘤性上皮细胞的治疗相关改变可能包括细胞质和核变化,从而貌似癌细胞变化。萎缩和化生性腺体也可能存在诊断陷阱。
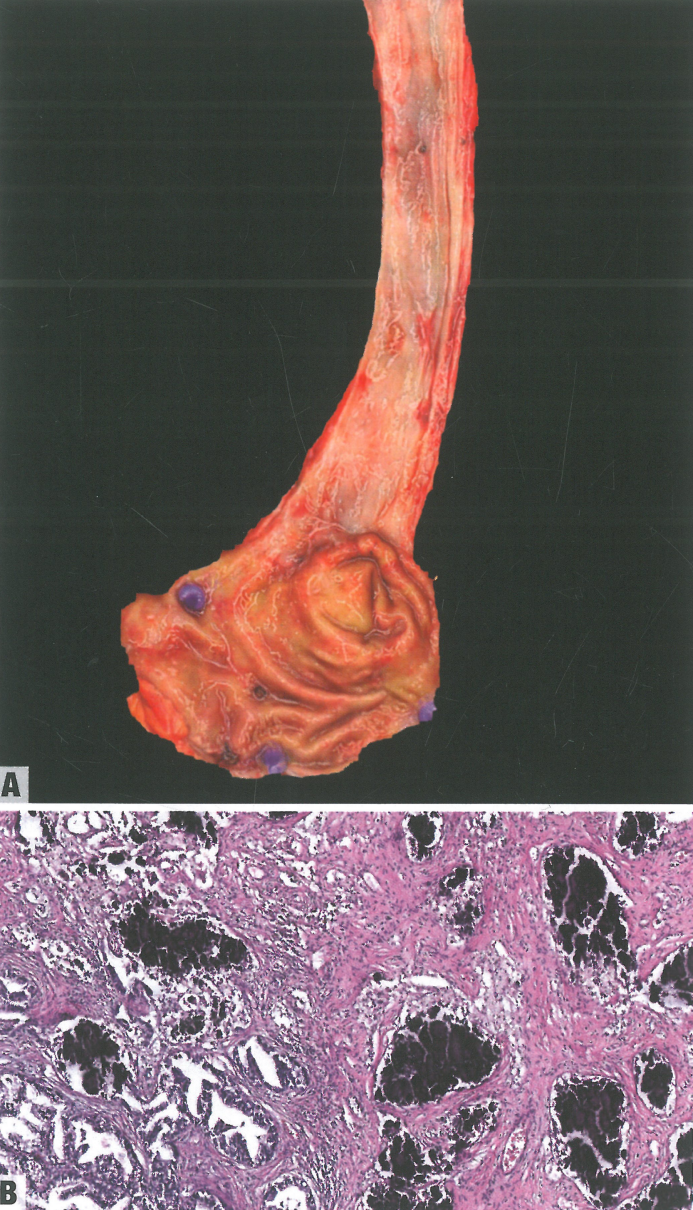
图2.14食管腺癌。A 新辅助化疗后的大体表现。B 术前放化疗的病例,显示腺癌中透明细胞变化,间质中有钙化和泡沫状巨噬细胞。
细胞学
细胞学在食管肿瘤检测中的应用正在增加。恶性腺上皮成分提示腺癌的存在,而恶性鳞状上皮成分提示鳞状细胞癌。细胞学上恶性鳞状细胞和腺细胞的混合应怀疑腺鳞癌或黏液表皮样癌的可能性。
诊断分子病理学
无临床相关性
诊断标准
必要标准:浸润性肿瘤内腺体或黏液分化的证据。
理想标准:免疫组织化学(在低分化病变中可能有必要证明向腺癌的分化)。
分期(TNM)
第八版AJCC癌症分期手册中有两种病理分期系统:一种用于之前未接受新辅助治疗的腺癌(pTNM),另一种用于辅助治疗后的腺癌(ypTNM)。在ypTNM分类中,分期组不受肿瘤分级或组织学类型的影响。在早期癌中,分级(G1-2或G3)是决定分期的重要参数。在接受辅助治疗的患者中,病理分期组之间的生存差异不太明显。
浸润固有层或黏膜肌层而不侵犯黏膜下层的上消化道腺癌定义为黏膜内腺癌(pT1a)。无不利病理特征的早期(pT1)食管腺癌,内镜切除加或不加射频消融是标准治疗方法。不利病理特征包括黏膜下浸润(pT1b)深度>500μm、低分化、淋巴管血管浸润和切缘受累。Barrett食管总是存在重复和扭曲的黏膜肌层,可能会导致对癌浸润深度的误判。
区域淋巴结通常是首先扩散的部位。目前食管腺癌的分期系统取决于阳性淋巴结的数量,因此依赖于广泛的淋巴结取样。接受新辅助治疗的患者需要更广泛的采样,因为淋巴结可能萎缩、无法触及。淋巴结转移癌可能消退。仔细检查和逐步切开显示纤维化或其他反应性变化的病例可能会发现小转移灶。大约一半的晚期食管腺癌患者在最初就诊时有远处淋巴结或器官转移。癌可能转移到腹膜、肝、肺、骨、脑和肾上腺。肝是最常见的远处传播部位。
预后和预测
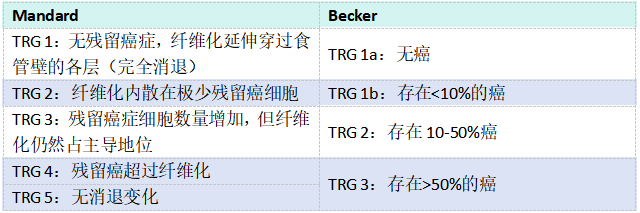
预测食管腺癌患者预后的最重要参数是病理分期。与生存相关的其他病理因素包括肿瘤大小、组织学特征(分级、淋巴管血管浸润、神经周围浸润和出芽)和组织学亚型。其他预后决定因素与治疗有关,如手术类型和手术切缘阴性。一些研究表明,腺鳞癌和黏液表皮样癌可能比传统食管癌的侵袭性更强。新辅助放化疗后,腺癌患者的生存取决于对治疗的反应。新辅助治疗后的肿瘤消退程度(TRG)和淋巴结分期下降与无病生存率的提高有关。残留癌的量决定TRG。评估食管腺癌TRG的最常见方法是Mandard系统,该系统根据存活肿瘤组织与纤维化的比例将肿瘤消退分为五级。四级Becker系统因其更好的可重复性,一些学者喜欢用它进行病理评估;该系统取决于存在的残留癌细胞的比例(详见表2.02)。
曲妥珠单抗是一种靶向人类EGFR家族成员HER2(HER2)的抗体,已被批准与其他化疗药物(顺铂和卡培他滨/氟尿嘧啶)联合治疗OGJ的晚期或转移性腺癌。下段食管腺癌应该对这种治疗也有反应。食管腺癌中HER2基因的扩增(通过原位杂交证明)和由此导致的HER2蛋白的过表达(通过免疫组织化学证明)预测了针对HER2靶向治疗的反应。食管腺癌HER2检测的方法因医疗机构而异;有人建议同时进行免疫组织化学和原位杂交,而其他许多人则建议仅在免疫组织化学结果不明确的情况下进行原位杂交。根据膜染色程度,HER2免疫评分定义为0、1+(微弱)、2+(弱~中等)或3+(强)。HER2阳性的食管胃腺癌通常显示基底外侧或外侧膜染色(与乳腺癌不同,乳腺癌通常显示完整膜染色)。
免疫肿瘤药物pembrolizumab(译注:帕博利珠,商品名Keytruda,可瑞达)在治疗晚期和转移性食管胃交界腺癌方面初步显示前景。微卫星高度不稳定性和PD-L1过表达是食管腺癌对免疫治疗反应的潜在生物标记物。
表2.02 Mandard和Becker系统用于评估癌症新辅助治疗后的肿瘤消退分级(TRG)
05. 食管腺样囊性癌
定义
食管腺样囊性癌是一种具有腺体分化的恶性食管上皮性肿瘤,上皮和肌上皮细胞在真腺腔和假腺腔内排列成筛状、管状或实体结构。
ICD-0编码
8200/3腺样囊性癌
ICD-11编码
2B70.Y&XH食管其他特定恶性肿瘤&腺样囊性癌
相关术语
无
亚型
无
部位
这些癌通常位于食管的中三分之一。
临床特征
最常见的症状是吞咽困难。内镜和EUS用于证实诊断和确定疾病范围;癌表现为突起/隆起或溃疡性病变。影像学评估(CT、MRI或PET)用于确定癌的临床分期。
流行病学
食管腺样囊性癌少见,仅报道了100多例。这些病例中约有一半来自亚洲人群。腺样囊性癌约占所有食管恶性肿瘤的0.1%。男性更常见,男女比例为3.5:1~5:1,最常见于60多岁(平均患者年龄:65岁;范围:36-84岁)。
病因
未知
发病机制
未知
大体表现
大体检查,腺样囊性癌或为突起,或为溃疡性病变。在早期,它通常位于黏膜下层,黏膜仍然完好无损。病变的平均大小为56mm,但肿瘤大小变化很大。
组织病理学
腺样囊性癌由上皮细胞和肌上皮细胞排列成许多筛状、管状(腺体)或实性模式的混合。筛状模式的特征是肿瘤细胞形成囊腔,其中含有AB阳性的嗜碱性糖胺聚糖(真腺)或PASD阳性的透明化基底膜物质(假腺)。在筛状和管状模式中,腺体衬覆内层上皮和外层肌上皮细胞,而实性模式没有管腔。常见神经周围浸润和淋巴管血管浸润。腺样囊性癌可能并存鳞状细胞癌或异型增生/原位癌。腺样囊性癌中的肌上皮细胞对p63、S100、SMA和calponin呈阳性。上皮细胞对CK、CEA和KIT(CD117)呈阳性。可能需要鉴别基底样鳞状细胞癌,因为它常有与腺样囊性癌相似的假腺样模式。然而,腺样囊性癌罕见鳞状细胞、中央坏死或显著核分裂象,基底样鳞状细胞癌对SMA和S100呈阴性。
细胞学
文献中没有记录食管腺样囊性癌的细胞学表现。
诊断分子病理学
无临床相关性
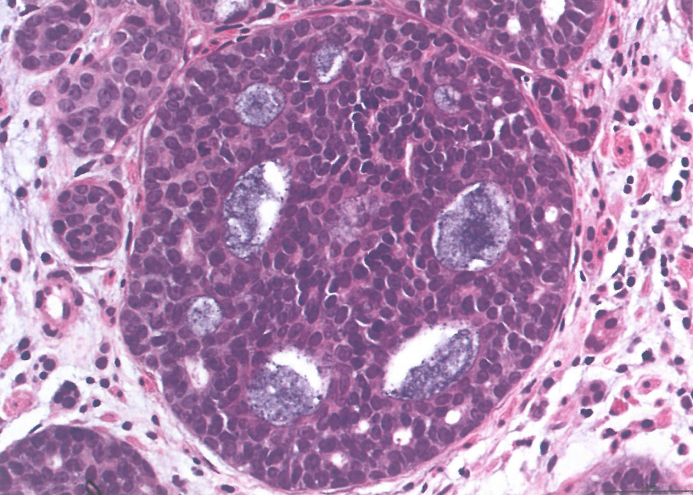
图2.15食管腺样囊性癌。筛状结构。
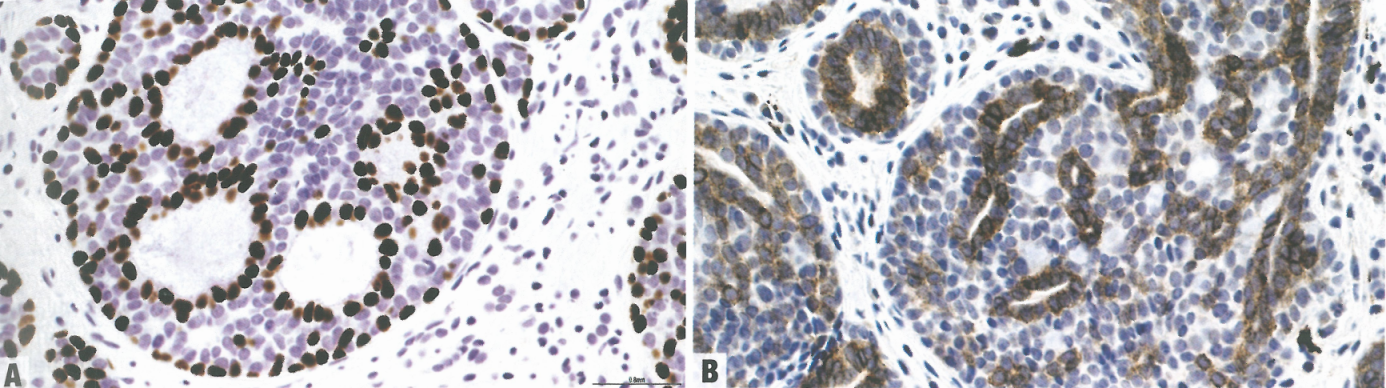
图2.16食管腺样囊性癌。A p63染色突出显示肌上皮细胞。B KIT染色突出显示管腔细胞。
诊断标准
必要标准:上述独特的组织学模式(在大多数情况下有诊断意义);免疫组织化学和/或重新活检(显示基底样分化的小活检标本)。
分期(TNM)
使用食管腺癌的分期系统。
预后和预测
预后取决于病理分期。在日本的系列研究中,半数病例中癌局限于黏膜下层,只有罕见的淋巴结转移。在其他人群中,淋巴结、肝脏、肺和大脑的转移发生率很高。预后不良,1年生存率为23%。
06. 食管腺鳞癌和黏液表皮样癌
定义
食管腺鳞癌是一种由单独的恶性鳞状成分和恶性腺成分组成的食管肿瘤。食管黏液表皮样癌是一种由恶性表皮样细胞、中间细胞和黏液细胞混合性组成的食管肿瘤。
ICD-0编码
8560/3腺鳞癌
8430/3黏液表皮样癌
ICD-11编码
2B70.Y&XH食管其他特定恶性肿瘤&腺鳞癌
2B70.Y&XH1J36食管其他特定恶性肿瘤&黏液表皮样癌
相关术语
无
亚型
无
部位
腺鳞癌最常见于中段食管,但在最近的系列病例中观察到下段食管病例占主导地位。黏液表皮样癌最常见于中、下段食管。
临床特征
临床特征与食管传统型腺癌或鳞状细胞癌相似。
流行病学
这些是罕见的肿瘤。腺鳞癌的中位患者年龄为60岁,男性发病率是女性的5倍。黏液表皮样癌占原发性食管癌的<1%,最常见于男性,患者中位年龄为58岁。
病因
其风险因素与传统型鳞状细胞癌的相关因素相似。
发病机制
食管腺鳞癌和黏液表皮样癌的起源尚不确定。最好的研究证据是来源于干细胞,可能来自食管腺的导管,导致双相分化,类似于其他腺鳞癌的发病机制。也有人提出,这些肿瘤只是原发性鳞状细胞癌,其中一个亚群经历了异常的腺体分化,或者是显示鳞状分化的原发性腺癌。腺鳞癌的模式也可能是两种不同的原发癌(一种腺癌和一种鳞状癌)碰撞的结果。总的来说,食管和涎腺具有共同的胚胎学,以及肿瘤偶尔局限于食管黏膜下层,这些情况支持了食管黏膜下层腺体的起源,但还需要进一步的证据。在其他部位,特别是涎腺,黏液表皮样癌具有明确的分子特征,包括导致融合基因的易位,而腺鳞癌未见易位。
大体表现
大体表现与鳞状细胞癌相似。
组织病理学
这些病变的单纯型组织学差异很大,但中间型似乎也存在;这些病变可能应被称为腺鳞癌。来自黏膜下腺体的单纯型黏液表皮样癌极为罕见。
腺鳞癌显示单独的腺癌和鳞状细胞癌成分并混合。一般来说,这些成分的比例并不相关,但日本食管癌症分类要求任一成分达20%以上;否则,仅根据主要成分对肿瘤进行分类。鳞状区域可呈任何程度的分化,其中可能包括没有明显角化或细胞间桥的区域。腺癌成分通常为管状或腺状,有细胞内或细胞外黏液的证据。鳞状巢内的单个黏液细胞是黏液表皮样癌的较典型表现。鳞状和腺体成分可能密切混合,也可能明显分开。一般来说,鳞状成分位于肿瘤表面,腺成分位于肿瘤深处。
食管黏液表皮样癌就像涎腺的对应肿瘤,由腺体和恶性鳞状细胞巢以及夹杂的含黏液上皮细胞组成。罕见病例伴有显著硬化、淋巴样组织和嗜酸性粒细胞。
细胞学
这些病变的细胞学检查具有挑战性,但细胞学上恶性鳞状细胞和腺细胞的混杂应怀疑腺鳞癌或黏液表皮样癌的可能性。
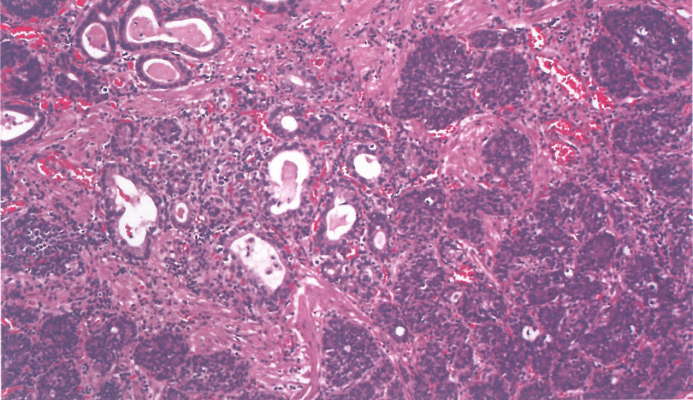
图2.17食管腺鳞癌。恶性鳞状细胞和腺体成分的特征性混合。
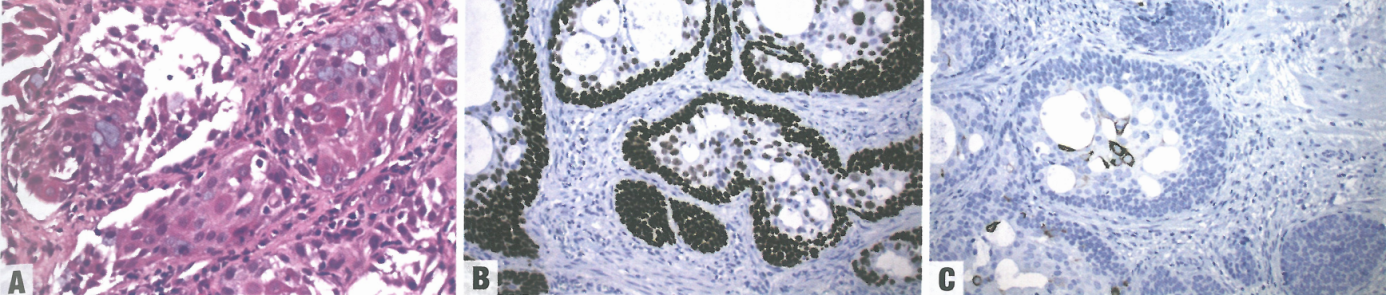
图2.18食管黏液表皮样癌。A 恶性鳞状细胞和含黏液细胞的特征性混合。B p63染色显示鳞状成分。C CK7染色显示产黏液细胞。
诊断分子病理学
无临床相关性
诊断标准
腺鳞癌
必要标准:单独的鳞状和腺癌成分;无中间细胞;有真正的腺体或黏液细胞分化。
注:单纯型鳞状细胞癌的鳞状病灶内出现腺样或微囊改变不足以诊断腺鳞癌。
黏液表皮样癌
必需:中间细胞;腺细胞和鳞状细胞的混合;真正的腺体或黏液细胞分化。
分期(TNM)
目前还没有明确的证据表明这些肿瘤的分期是否应遵循鳞状细胞癌或腺癌的分期。
预后和预测
与更常见的食管癌相比,还没有足够的研究来确定这些癌的预后。一些研究的结果表明,腺鳞癌和黏液表皮样癌可能比传统的鳞状细胞癌的浸润性更强。
07. 食管鳞状细胞癌NOS
定义
食管鳞状细胞癌NOS是一种恶性食管上皮肿瘤,表现为鳞状细胞分化,其特征是角质细胞伴细胞间桥和/或角化。
ICD-0编码
8070/3鳞状细胞癌NOS
ICD-11编码
2B70.1食管鳞状细胞癌
相关术语
梭形细胞鳞状细胞癌
可接受:肉瘤样癌;癌肉瘤;假肉瘤样鳞状细胞癌;息肉样癌;鳞状细胞癌伴梭形细胞成分。
简表2.03食管鳞状细胞癌的风险因素

简表2.04食管鳞状细胞癌中发现的关键遗传学异常总结(字母的倾斜与否,应调为一致)

亚型
疣状鳞状细胞癌(8051/3);鳞状细胞癌,梭形细胞(/80743);基底样鳞状细胞癌(8083/3)
部位
鳞状细胞癌最常见于食管中三分之一,其次是下三分之一。在日本的一项大型系列中,略多于一半(55%)的鳞状细胞癌发生在中食管,32%发生在下食管,14%发生在上食管。同样,在中国香港特别行政区的一系列研究中,约一半(49%)的肿瘤位于中食管,41%位于下食管,10%位于上食管。
临床特征
最常见的临床症状是吞咽困难,这通常表明疾病已进展至晚期。也可有胸痛、吞咽疼痛和体重减轻。上段食管肿瘤可能伴有喉返神经受累引起的声音嘶哑。早期疾病通常无症状,偶然发现。食管内任何持续性溃疡或难治性狭窄都应引起恶性肿瘤的关注。
诊断的金标准是上消化道内窥镜和活检进行组织学分析,伴或不伴细胞学刷取检查。图像增强内窥镜(如窄带成像)和染色内窥镜可以通过突出与肿瘤相关的异常血管模式或碘阴性来帮助识别早期病变。共焦显微内镜等不断发展的技术可能有助于更好地靶向活检。EUS可用于评估食管壁的浸润深度,并可能揭示区域淋巴结转移;然而,它在弥漫性浸润性疾病中是不可靠的。内镜黏膜切除术或内镜黏膜下剥离术是确定浅表疾病浸润深度的最佳手术。CT和FDG PET可用于更晚期疾病的分期和评估放化疗反应。
流行病学
食管鳞状细胞癌是全球癌症相关死亡的第六大原因。疾病发病率在地区之间甚至在单个国家内部都有明显的地理差异。亚洲食管癌症带的发病率最高(每10万人每年>10例),这个高发区从东亚延伸到中亚。在非洲印度海岸、巴西南部和乌拉圭以及加勒比海部分地区,观察到中等发病率(每10万人每年10-50例)。在过去的几十年里,北美和欧洲国家的食管鳞状细胞癌发病率(现在<10例/10万人年)一直在下降,而食管腺癌的发病率一直在上升。即使在高发病率国家,也存在明显的差异。例如,中国南方省份的这一比率远低于东北省份。总体而言,食管鳞状细胞癌在男性中更为常见,占病例的69%。这种男性优势在北美和欧洲国家更为明显,在这些国家,男性患这种疾病的可能性至少是女性的4倍。在中国和伊朗伊斯兰共和国等高发国家,男性占主导地位不太明显。诊断时的患者年龄中位数在70岁左右,大多数患者在40~80岁之间。食管和呼吸消化道的其他部位(如口腔和口咽)可能发生多发性鳞状细胞癌;这一发现既与这些区域普遍暴露于烟草烟雾等风险因素有关,也与食管中丰富的淋巴网络有关。
病因
食管鳞状细胞癌的病因是多因素的,严重依赖于所研究的人群。主要风险因素见简表2.03(原书第48页)。
发病机制
食管鳞状细胞癌是通过逐步进展的方式发生的,累积的遗传学异常推动了从组织学正常的鳞状黏膜到低级别上皮内肿瘤(异型增生)再到高级别上皮内肿瘤,最后到浸润性鳞状细胞癌的进展。TP53突变是一个关键的早期驱动突变。在上皮内肿瘤阶段发现的遗传变化包括非整倍性、拷贝数改变、与EGFR等基因扩增相关的变化,以及由于启动子高甲基化导致的CDKN2A等基因沉默。浸润性鳞状细胞癌所特有的基底膜外浸润所需的特定突变尚不清楚。通过上皮间质转化获得浸润和迁移能力非常重要。已证明EIF5A2扩增是诱导这种表型的一个因素。简表2.04(原书第49页)总结了食管鳞状细胞癌中发现的关键遗传学异常。
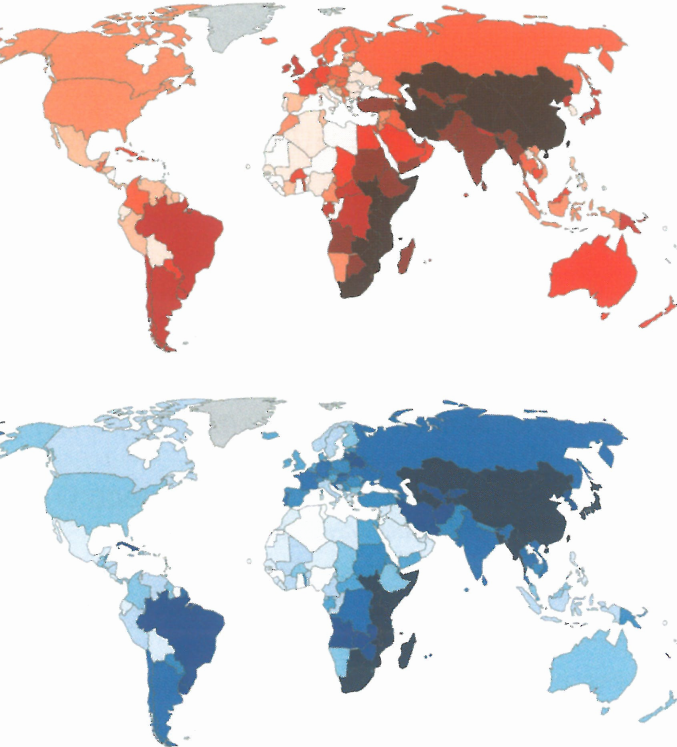
图2.19 2012年女性(上图)和男性(下图)食管鳞状细胞癌的估计年龄标准化发病率。
大体表现
鳞状细胞癌通常出现在晚期病理阶段,伴有溃疡性肿块。日本食管学会提供了最有用的大体分类,如图2.20所示。
组织病理学
分级
鳞状细胞癌在超出基底膜外有垂直和水平的肿瘤鳞状上皮生长。分级基于细胞学异型性、核分裂活性和角化的程度。通常采用三级分类(1、2、3级);然而,二级系统(1-2级与3级)可能具有临床相关性,因为1级和2级之间的病理区分通常显示出较高的观察者之间差异。
1级(分化良好)鳞状细胞癌包含增大的细胞,具有丰富的嗜酸性细胞质和角化珠。细胞学异型性很小,核分裂率低。浸润边缘呈推挤性,细胞保持有序(极性)。
2级(中分化)鳞状细胞癌具有明显的细胞学异型性,细胞排列不整齐。核分裂象易见。常有表面角化不全,但角化珠少见。
3级(低分化)鳞状细胞癌主要由基底样细胞形成巢,可有中央坏死。肿瘤巢由成片的或铺路石样排列的肿瘤细胞组成,偶有角化不全或角化细胞。
治疗效果
大多数晚期食管鳞状细胞癌患者采用术前化疗和放疗相结合的治疗方法。这通常会导致肿瘤细胞和肿瘤周围间质的渐进性变化,并伴有肉眼可见的肿瘤消退。细胞变化包括核增大或缩小、核空泡化、凋亡和坏死。死亡细胞释放的角质可能会积聚,发生营养不良钙化,并引发周围的巨细胞反应。可能会出现中性粒细胞或慢性炎症细胞反应。有纤维化,有时还有间质弹性组织增生。局部血管通常显示动脉硬化。
肿瘤消退的程度是一个重要的预后因素。通过比较残留肿瘤的数量和治疗诱导的纤维化的数量,在组织学检查中对其进行分级。评估肿瘤消退等级(TRG)最广泛使用的方法是Mandard系统(见原书第43页表2.02)。另一个系统依赖于肿瘤体积的估计减少百分比,<10%的残留肿瘤提示预后良好。病理完全反应(即完全或几乎完全根除肿瘤)是术前治疗的主要目标。
亚型
疣状鳞状细胞癌通常发生在慢性刺激、食管炎或既往食管损伤的情况下。因此,大多数病例表现为食管下三分之一的隆起性肿块。部分病例中,已证明与HPV51和HPV11有关。肿瘤由高度分化的鳞状细胞组成,只能轻微的细胞学异型性、很低核分裂活性和表面乳头状突起。角化突然发生,中间没有插入的颗粒细胞层,乳头结构底部存在杯状角质聚集。浸润性前沿的特征是宽阔的球茎形推挤性突起。肿瘤生长缓慢,转移少见。
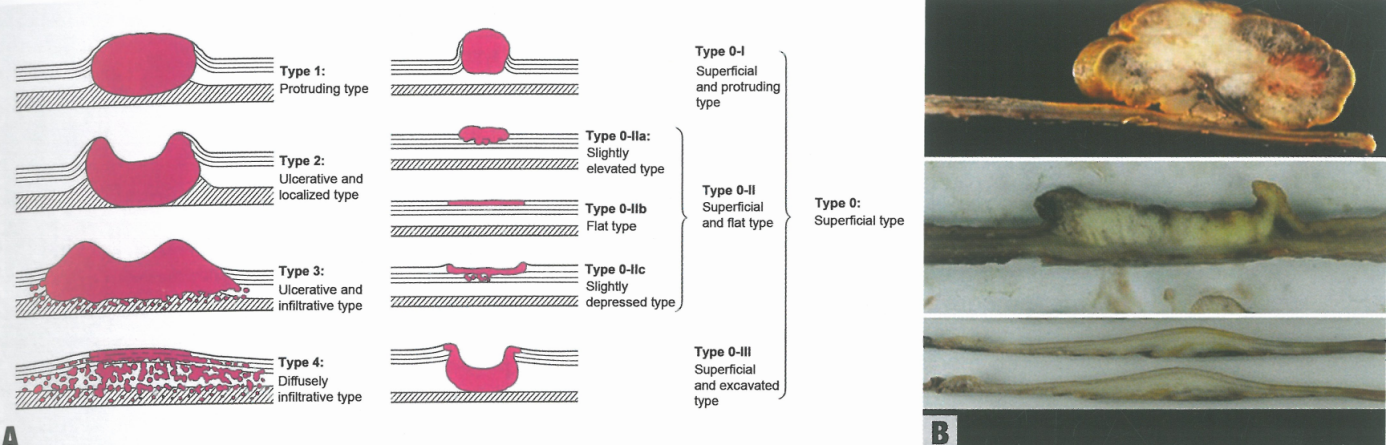
图2.20食管鳞状细胞癌NOS。 A 日本食管学会食管鳞状细胞癌大体分类。B 肿瘤切面根据日本食管学会分类为0-1型:浅表和隆起型(上),2型(晚期):溃疡性和局限型(中),4型(晚期):弥漫性浸润型(下)。
图中文字:
1型:隆起型 2型:溃疡和局限型
3型:溃疡和浸润型 4型:弥漫浸润型
0型:浅表型 0-I型:浅表和隆起型
0-II型:浅表和平坦型 0-IIa型:轻微隆起型
0-IIb型:平坦型 0-IIc型:轻微凹陷型
0-III型:浅表和挖掘型
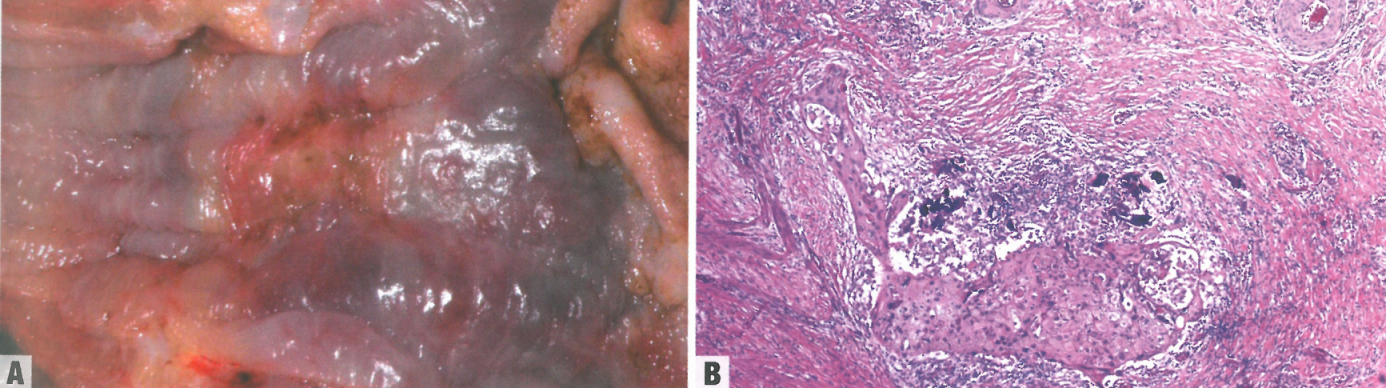
图2.21食管鳞状细胞癌。A 治疗后标本显示残留的黏膜异常。B 放化疗后效应,特征为肿瘤缩小、周围纤维化、角质聚集伴营养不良钙化、慢性炎症和动脉硬化。
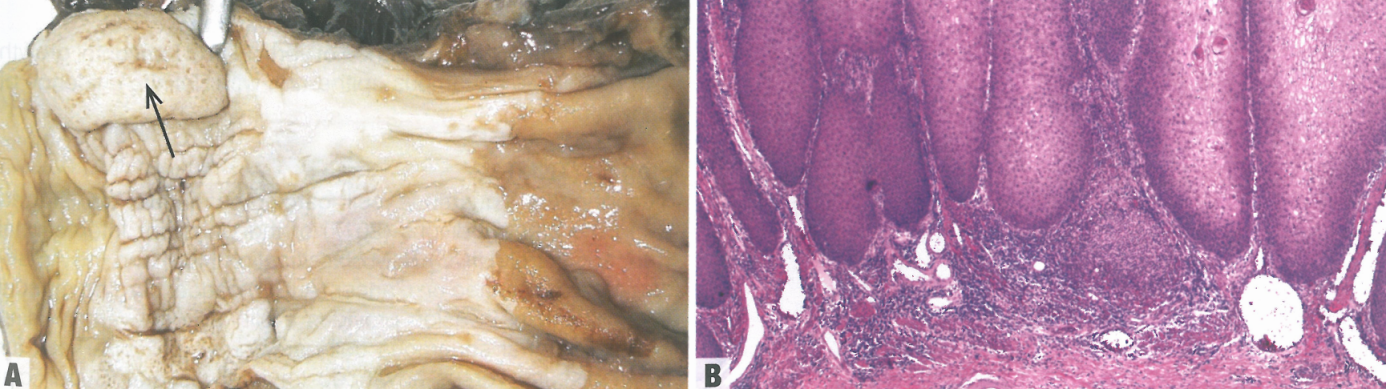
图2.22食管疣状鳞状细胞癌。A 典型蕈样表现(箭)。B 高分化细胞、杯状角质和推挤性模式是这种亚型的典型浸润模式。
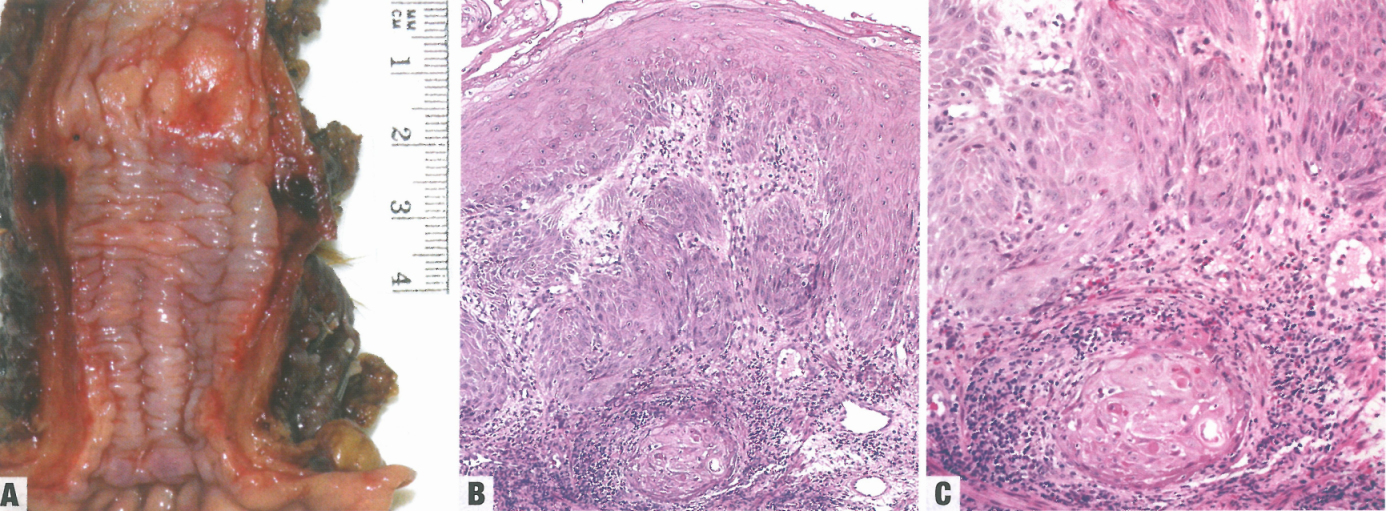
图2.23食管鳞状细胞癌。A 食管中部肿块大体照片。B 高分化病例;注意恶性鳞状细胞以成簇方式向黏膜下层浸润。C 高倍示浸润性恶性鳞状细胞簇。
梭形细胞鳞状细胞癌通常呈息肉样生长模式。显微镜下,肿瘤性鳞状上皮和梭形细胞呈双相模式。鳞状细胞通常呈高~中等分化,偶尔也可能是原位癌。梭形细胞成分为高级别恶性肿瘤,可有骨、软骨或横纹肌分化。尽管这些肿瘤往往很大,但预后有时比相同大小的传统型鳞状细胞癌要好,主要是因为管腔内生长而不是深部浸润性生长。
基底样鳞状细胞癌显示出明显的男性优势,约占所有食管癌的5%。与口咽的类似肿瘤不同,食管基底样鳞状细胞癌与HPV感染无关。肿瘤呈基底样细胞的实性或巢状生长模式,有时伴有中央粉刺性坏死,偶尔伴有假腺或筛状结构。肿瘤形态可能与罕见的原发性腺样囊性癌相混淆。通常需要通过免疫组织化学排除高级别神经内分泌癌(NEC)。原位鳞状细胞癌或传统型浸润性鳞状细胞癌的区域相对常见。该肿瘤具有高度侵袭性,预后比传统型鳞状细胞癌差,但这种差异通常没有统计学意义。
鉴别诊断
在小活检标本中,可能难以区分传统型鳞状细胞癌与其他亚型的鳞状细胞癌以及未分化癌或腺癌(见食管腺癌和OGJ NOS,原书第38页)。
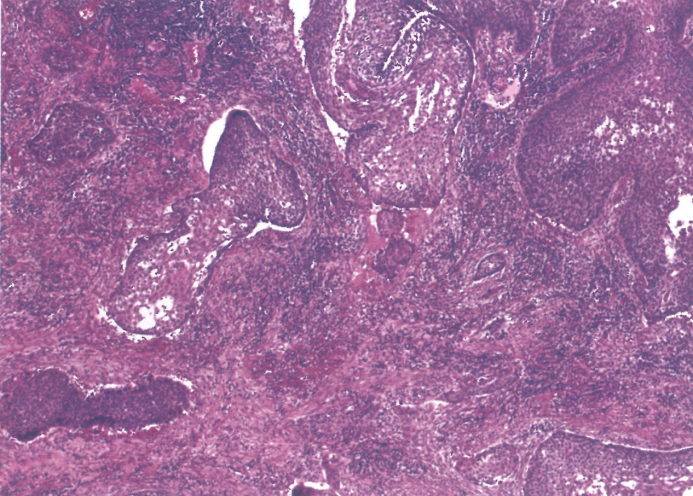
图2.24食管鳞状细胞癌。贲门失弛缓症患者食管中段出现浸润性中分化鳞状细胞癌。
细胞学
使用定向黏膜刷的细胞学取样和使用如细胞海绵技术等取样,对于高危人群的筛查具有成本效益,并有助于早期鳞状细胞瘤的初步诊断。
诊断分子病理学
目前,不需要进行分子检测。有关此肿瘤类型中存在的分子异常的更多信息,请参阅上述发病机制内容。
诊断标准
必要标准:肿瘤性鳞状上皮垂直和水平生长的组织学证据,和明确的浸润证据。
分期(TNM)
应使用国际癌症控制联盟(UICC)TNM分类的第八版和美国癌症联合委员会(AJCC)癌症分期手册对食管鳞状细胞癌进行分期。浸润深度提供了食管鳞状细胞癌临床相关的划分,分为浅表(或早期)疾病和晚期(或晚期)疾病。浅表性疾病是局限于黏膜和黏膜下层的浸润。它具有较低的区域淋巴结转移风险,如果黏膜下浸润深度<200 μm,可以通过局部切除治愈。晚期疾病是指侵犯超出固有肌层之外,具有较高的区域或全身转移风险。浅表性疾病占日本所有病例的35%,其5年生存率约为85%。晚期疾病的5年生存率<10-15%。
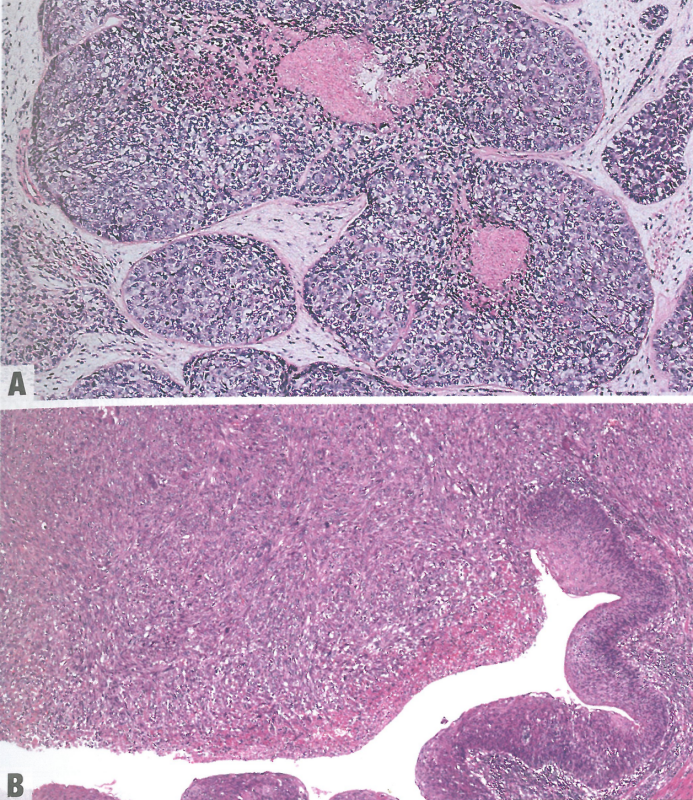
图2.25食管鳞状细胞癌。A 食管基底样鳞状细胞癌。基底样细胞形成圆形巢伴中心坏死。B 食管梭形细胞鳞状细胞癌。鳞状上皮出现异型增生和梭形细胞特征。
预后和预测
最重要的预后因素是分期,用于确定给定患者最合适的治疗方案。尽管表皮生长因子受体(HER1)在鳞状细胞癌中经常过表达,但针对该蛋白的靶向治疗未能提高生存率。免疫检查点抑制剂作为晚期疾病的新疗法具有潜在的前景。
08. 食管未分化癌
定义
食管未分化癌是一种恶性食管上皮肿瘤,显微镜下缺乏鳞、腺或神经内分泌分化的明确特征。
ICD-0编码
8020/3未分化NOS癌
ICD-11编码
2B70.Y&XH1Y4其他特定的食管恶性肿瘤未分化癌,NOS
相关术语
无
亚型
淋巴上皮瘤样癌(8082/3)
部位
最常见于下段食管或OGJ。
临床特征
最常见的症状是进行性吞咽困难,其次是胃食管反流、体重减轻和贫血。
流行病学
报道的相对发病率差异很大,占食管癌的0.18%到4%不等;这种明显的差异可能与缺乏诊断标准有关。在一项美国的研究报道中,患者的年龄在39~84岁之间(平均:65.5岁),主要是男性。
病因
未知
发病机制
未分化癌很可能是由食管上皮起源的鳞状细胞癌或腺癌的去分化引起的。在迄今为止最大规模的未分化癌研究中,16例中有12例(75%)与Barrett食管有关,其中一些癌含有局灶性腺分化。
大体表现
肿瘤呈外生性,边缘隆起,肿瘤中心在食管或OGJ。在大多数病例中,有凹陷和溃疡的中心区域。
组织病理学
肿瘤细胞形成大小不一的巢和成片排列。细胞中到大,胞质边界不清、双染性至轻微嗜酸性,呈合胞体样外观。核呈椭圆形和空泡状。偶见类似破骨细胞或横纹肌样细胞的巨大多形性核和多核巨细胞。
淋巴上皮瘤样癌可能是一种独特的未分化癌亚型。大多数报道的病例来自日本,临床上类似于传统型鳞状细胞癌。这种亚型的特征是成片排列的上皮样大细胞,核仁显著,细胞边界模糊。肿瘤周围有一种特征性的炎症浸润,富含淋巴细胞和浆细胞。与位于头颈部的类似肿瘤不同,食管淋巴上皮瘤样癌仅偶尔呈EBV阳性。
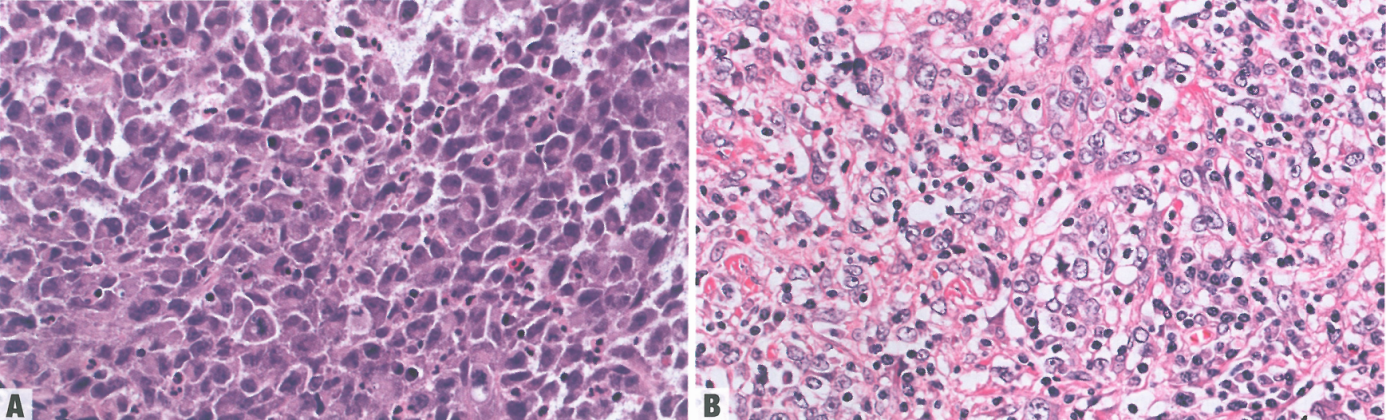
图2.26食管未分化癌。A 核多形性;偶见横纹肌样细胞。B 淋巴上皮瘤样癌亚型的特征是成片排列的上皮样大细胞,核仁显著,细胞边界模糊;肿瘤周围有一种富含淋巴细胞和浆细胞的特征性炎症浸润。
如有CK阳性,可能有助于排除非上皮性肿瘤,如黑色素瘤、淋巴瘤和肉瘤。并用其他免疫标记物来区分未分化癌与神经内分泌癌(NEC;CgA、Syn和CD56)、低分化鳞状细胞癌(p63和p40)和低分化腺癌(黏液)。
细胞学
未分化癌由没有分化迹象的恶性细胞组成。
诊断分子病理学
无临床相关性
诊断标准
必要标准:组织学上没有分化证据的恶性细胞;模棱两可的免疫组织化学。
分期(TNM)
食管未分化癌使用食管鳞状细胞癌的分期。
预后和预测
在美国的一项研究中,大多数未分化癌发现时已是晚期;预后差,1年生存率为25%。
09. 食管神经内分泌肿瘤
定义
食管的神经内分泌肿瘤(NEN)是具有神经内分泌分化的食管上皮性肿瘤,包括高分化神经内分泌肿瘤(NET)、低分化神经内分泌癌(NEC)和混合性神经内分泌-非神经内分泌肿瘤,后者是包括混合性腺-神经内分泌癌的总类别。
ICD-0编码
8240/3神经内分泌肿瘤NOS
8246/3神经内分泌癌NOS
8154/3混合性神经内分泌-非神经内分泌肿瘤(MiNEN)
ICD-11编码
2B70.Y&XH55D7食管其他特定恶性肿瘤&神经内分泌癌,高分化
2B70.Y&XH0U20食管其他特定恶性肿瘤&神经内分泌癌NOS
2B70.Y&XH9SY0食管其他特定恶性肿瘤&小细胞神经内分泌癌
2B70.Y&XH0NL5食管其他特定恶性肿瘤&大细胞神经内分泌癌
2B70.Y&XH7YE3食管其他特定恶性肿瘤&组合性小细胞癌
相关术语
可接受:类癌;高分化内分泌肿瘤/癌;低分化内分泌癌;混合性外分泌-内分泌癌;混合性腺-神经内分泌癌。
亚型
神经内分泌肿瘤,1级(8240/3);神经内分泌肿瘤,2级(8249/3);神经内分泌肿瘤,3级(8249/3);大细胞神经内分泌癌(8013/3);小细胞神经内分泌癌(8041/3);组合性小细胞-腺癌(8045/3);组合性小细胞-鳞状细胞癌(8045/3)
部位
NEN通常发生在下段食管,通常伴有化生性Barrett黏膜或(罕见)异位胃黏膜。NEC也可能发生在中段甚至上段食管。
临床特征
吞咽困难、疼痛、体重减轻、乏力,有时还会出现黑热病,是最常见的症状。有些NET是偶然发现。转移性NET可能伴有类癌综合征。NEC可能与副肿瘤综合征有关。内窥镜检查时,NET通常表现为息肉样或结节性黏膜下肿块,直径<2cm,而NEC较大,有浸润性溃疡。
流行病学
食管NEN极罕见。它们占所有胃肠胰NEN的0.04-1%,但据报道,一些国家的数字高达5%。男性的发病率高于女性(男女比6:1),主要发生在50~70岁(平均患者年龄:56岁)。
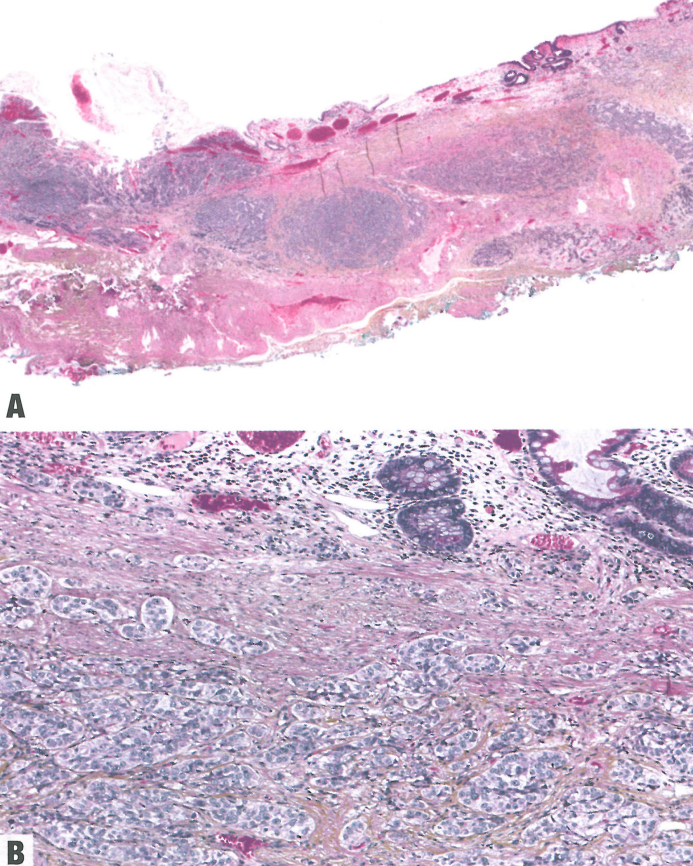
图2.27食管高分化神经内分泌肿瘤(NET)。A 低倍,Barrett黏膜病例的内镜切除标本。B 高倍,Barrett黏膜发生的下段食管肿瘤伴肠化生。
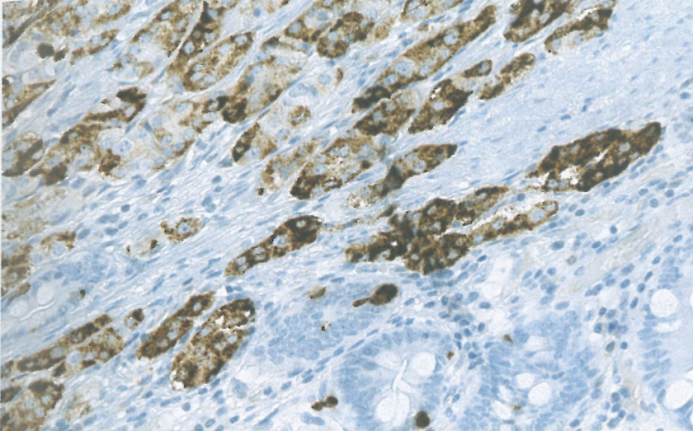
图2.28产生血清素的食管神经内分泌肿瘤(NET)。Barrett黏膜伴肠化生,其中发生下段食管高分化NET,表达血清素(间接免疫过氧化物酶染色)。
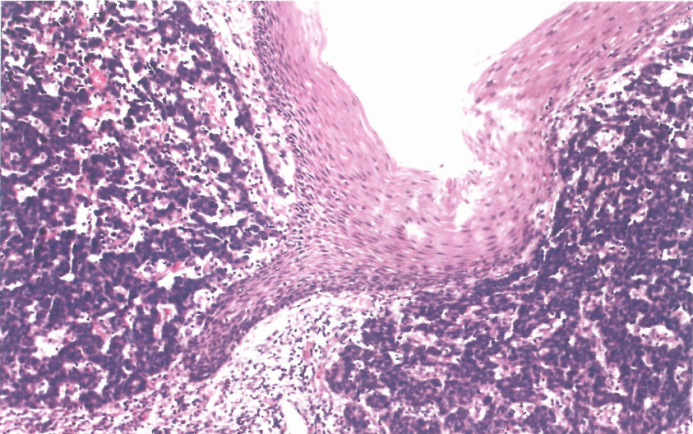
图2.29食管大细胞神经内分泌癌(LCNEC)。
病因
病因尚不清楚。下段食管黏膜下腺体或Barrett黏膜中的内分泌细胞可能解释了NEN好发于下段食管。NEC可能与饮酒和/或重度吸烟有关。
发病机制
最近一项对55个食管NEC的研究表明,TP53和RB1的失活突变率很高,这在大多数小细胞NEC(SCNEC)病例中都可以看到,此外还有其他三个基因:NOTCH1、FAT1和FBXW7。还报道了三种未知与食管或神经内分泌肿瘤发生有关的基因的重现性突变:PDE3A、PTPRM和CBLN2。
大体表现
NET通常是小病变。在对19例病例的系统回顾中,平均肿瘤大小为2.4cm。NEC通常是大块的深部浸润性肿瘤。它们可能是外生性或有溃疡。
组织病理学
NET:文献中报道的食管NET病例不到50例。它们显示高分化NEN的典型特征。生长模式可能是岛状或筛状。肿瘤由中等大小细胞组成,核质比低,细胞质丰富,核呈卵圆形,染色质分散,含有小核仁。存在不同数量的血管丰富的间质。可见局灶性坏死。CgA和Syn的表达证实了神经内分泌分化。免疫组织化学检测到各种激素,包括血清素、(肠)胰高血糖素、PP、胃泌素和降钙素。部分病例中,VMAT2的表达提示肠嗜铬样(ECL)细胞样表型。文献中分级信息很少,特别是旧文献中报道的病例,但大多数病例可以追溯分级为G1-2。
NEC:这些肿瘤占所有食管NEN的90%以上。它们分为小细胞NEC(SCNEC)和大细胞NEC(LCNEC);LCNEC的相对比例因研究而异,从12%到62%。与其他NEC一样,食管NEC通常呈实性、菊形团或栅栏状模式;常见坏死且通常广泛。核分裂活跃。SCNEC的特征是具有高核质比的中小型细胞,胞质稀少、嗜碱性,核细长,含有细腻分散的染色质,没有明显核仁。LCNEC的特征是具有嗜碱性细胞质的中~大细胞,核大、卵圆形,含有大核仁。神经内分泌分化应通过免疫组织化学进行确认。Syn表达是稳定特征,而CgA的表达(约占60%)通常是局灶性和弱表达。TTF1在约70%的病例中呈阳性。主要的鉴别诊断是基底样鳞状细胞癌,通常显示鳞状细胞分化的免疫组织化学证据,包括p63、p40和CK5/6的表达;然而,p63不可靠,因为它可能在一些食管NEC中检测到。
MiNEN:食管MiNEN通常由分化较差的NEC和鳞状细胞癌/腺癌(在Barrett黏膜或异位胃黏膜中)组成。也有报道称,罕见的碰撞肿瘤含有明显高分化NET成分和腺癌。
碰撞肿瘤:碰撞肿瘤不符合MiNEN的定义。
分级:食管NEN采用与其他胃肠胰NEN相同的系统进行分级。
细胞学
没有特定的细胞学特征。
诊断分子病理学
无临床相关性
诊断标准
必要标准:提示神经内分泌分化的形态学标准(必须通过免疫组织化学证实,如CgA或Syn)。
分期(TNM)
与发生在其他胃肠型部位的NET不同,没有专门针对食管NET的TNM分期系统。食管NEC和MiNEN的分期与食管癌的分期一致。
预后和预测
尽管旧文献中有相反的报道,但食管NET的预后似乎很好,主要取决于肿瘤大小和扩散程度。肿瘤分级的影响无法评估,因为可用的数据非常有限。转移性播散很少见。总生存期为1~23年。相比之下,NEC的预后非常差。诊断时常见转移和扩散。中位总生存期为8~15个月;大多数患者在诊断后2年内死亡。远处转移的存在似乎是最强的不良预后因素。LCNEC和SCNEC之间的生存率没有统计学上的显著差异。预后明显取决于Ki-67增殖指数。MiNEN的预后可能比纯NEC更好;中位生存期约为20个月,预后基于NEC成分的Ki-67增殖指数。
对于食管NEN的最佳治疗方法尚未达成共识。内镜切除可以成功治疗没有局部转移证据的小NET(<1-1.5 cm)。较大的肿瘤需要手术;转移性病例采用辅助化疗。NEC和MiNEN的治疗通常基于铂的化疗。只有局部扩散的肿瘤可以采用手术、化疗甚至放疗的联合治疗。
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论