往期回顾:
消化系统肿瘤WHO分类第五版学习笔记(一)
消化系统肿瘤WHO分类第五版学习笔记(二)
第3章 胃肿瘤
胃炎和化生:胃肿瘤的前驱病变
良性上皮肿瘤和前驱病变
胃底腺息肉
增生性息肉
异型增生
肠型腺瘤
胃小凹型腺瘤
幽门腺腺瘤
泌酸腺腺瘤
恶性上皮性肿瘤
腺癌
鳞状细胞癌
腺鳞癌
未分化癌
胃母细胞瘤
神经内分泌肿瘤
0 胃肿瘤WHO分类
良性上皮肿瘤及其前驱病变
8148/0 腺体上皮内肿瘤,低级别
8148/2 腺体上皮内肿瘤,高级别
8423/0* 锯齿状异型增生,低级别
8423/2* 锯齿状异型增生,高级别
肠型异型增生
胃小凹型(胃型)异型增生
胃小凹/隐窝异型增生
8144/0* 肠型腺瘤,低级别
8144/2* 肠型腺瘤,高级别
散发性肠型胃腺瘤
综合征性肠型胃腺瘤
8210/0* 腺瘤性息肉,低级别异型增生
8210/2* 腺瘤性息肉,高级别异型增生
恶性上皮性肿瘤
8140/3 腺癌NOS
8211/3 管状腺癌
8214/3 壁细胞癌
8255/3 混合亚型腺癌
8260/3 乳头状腺癌NOS
8265/3 微乳头状癌NOS
8430/3 黏液表皮样癌
8380/3 黏液腺癌
8390/3 印戒细胞癌
8390/3 低粘附性癌
8512/3 髓样癌伴淋巴样间质
8576/3 肝样腺癌
Paneth细胞癌
8070/3 鳞状细胞癌NOS
8560/3 腺鳞癌
8020/3 未分化癌NOS
8014/3 大细胞癌伴横纹肌样表型
8022/3 多形性癌
8033/3 肉瘤样癌
8035/3 破骨细胞样巨细胞癌
8976/1* 胃母细胞瘤
8240/3 神经内分泌肿瘤NOS
8240/3 神经内分泌肿瘤,1级
8249/3 神经内分泌肿瘤,2级
8249/3 神经内分泌肿瘤,3级
8153/3 胃泌素瘤
8156/3 生长抑素瘤NOS
8241/3 肠嗜铬细胞类癌
8242/3 ECL细胞类癌,恶性
9246/3 神经内分泌癌NOS
8013/3 大细胞神经内分泌癌
8041/3 小细胞神经内分泌癌
8154/3 混合性神经内分泌-非神经内分泌肿瘤(MiNEN)
————
这些形态学代码来自《国际肿瘤学疾病分类》第三版第二次修订版(ICD-O-3.2)。行为编码/0表示良性肿瘤;/1表示未指明、交界性或不确定的行为;/2表示原位癌和III级上皮内肿瘤;/3表示恶性肿瘤,原发部位;/6用于恶性肿瘤,转移部位。行为代码/6在癌症登记处一般不使用。
修订自第四版WHO分类,考虑到我们对这些病变的理解发生了变化。
*2019年4月国际癌症研究机构/WHOICD-0委员会批准了标有星号的代码。
1 胃癌的TNM分期
胃
(ICD-O-3 C16)
分类规则
该分类仅适用于癌症。应当有组织学证实的疾病。累及食管胃交界处(OGJ)的癌症,其中点在贲门近端2cm内(Siewert I/II型),按食管癌分期。中点距OGJ超过2cm的癌症使用胃癌TNM分期,即使累及OGJ也是如此。
在第七版基础上的改动基于国际癌症协会分期项目的建议。1
以下是评估T、N和M类别的程序。
T类别 体检、影像学检查、内镜检查和/或手术探查
N类别 体检、影像学检查和/或手术探查
M类别 体检、影像学检查和/或手术探查
解剖部位细分
1.贲门(16.0)
2.胃底(C16.1)
3.胃体(C16.2)
4.胃窦(C16.3)和幽门(C16.4)
区域淋巴结
胃的区域淋巴结是沿着胃小弯和大弯的胃周淋巴结,沿着胃左动脉、肝总动脉、脾动脉和腹腔动脉的淋巴结,以及肝十二指肠淋巴结。
其他腹腔内淋巴结如胰腺后、肠系膜和主动脉旁的受累归入远处转移。
TNM临床分类
T-原发性肿瘤
TX 原发性肿瘤无法评估
TO 无原发性肿瘤证据
Tis 原位癌:不侵犯固有层的上皮内肿瘤,高级别异型增生
T1 肿瘤侵犯固有层、黏膜肌层或黏膜下层
T1a 肿瘤侵犯固有层或黏膜肌层
T1b 肿瘤侵犯黏膜下层
T2 肿瘤侵犯固有肌层
T3 肿瘤侵犯浆膜下层
T4 肿瘤穿透浆膜(脏层腹膜)或侵犯邻近结构a,b,c
T4a 肿瘤穿透浆膜
T4b 肿瘤侵犯邻近结构a,b
注释:
a胃的邻近结构是脾脏、横结肠、肝脏、膈肌、胰腺、腹壁、肾上腺、肾脏、小肠和腹膜后。
b十二指肠或食管的壁内延伸按包括胃在内的任何部位的最大浸润深度分类。
c肿瘤延伸到胃结肠或胃肝韧带或大网膜或小网膜,没有脏层腹膜穿孔,为T3。
N-区域淋巴结
NX 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 1至2个区域淋巴结转移
N2 3至6个区域淋巴结转移
N3 7个或更多区域淋巴结转移
N3a 7至15个区域淋巴结转移
N3b 16个或更多区域淋巴结转移
M-远处转移
MO无远处转移
M1远处转移
注释:
远处转移包括腹膜种植、腹膜细胞学阳性和网膜肿瘤(不属于持续扩散的一部分)。
pTNM病理分类
pT和pN类别对应于T和N类别。
pNO 区域淋巴结切除标本的组织学检查通常包括16个或更多淋巴结。如果淋巴结呈阴性,但未达到常规检查的数量要求,则归类为pNO。
pM远处转移*
pM1 显微镜下证实远处转移
注释:
*pMO和pMX不是正确类别。
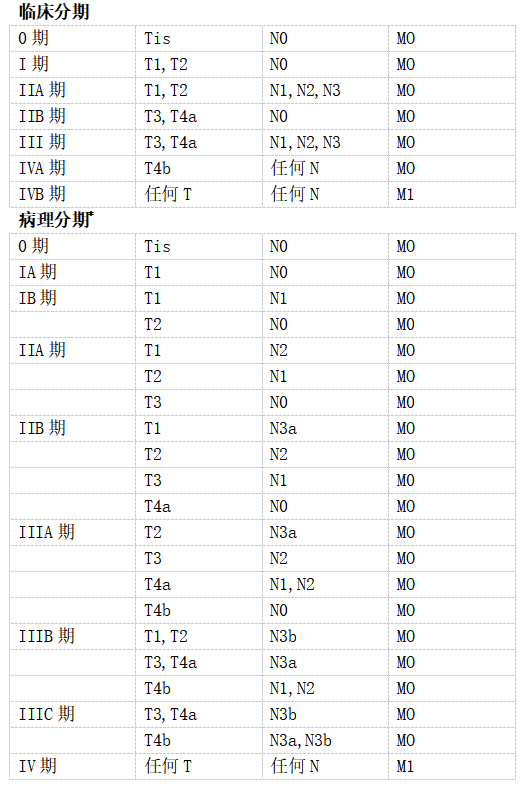
注释:
*AJCC公布了新辅助治疗后的预后组(前缀为“y”的类别)。
注:胃神经内分泌肿瘤(NET)采用NET特异性TNM分期系统进行分期,详见第1章(原书第20页)。
参考文献:
1 Sano T,Coit D,Kim HH,et al.for the IGCA StagingProject.Proposal of a new stage grouping of gastric cancer for TNM classification:International Gastric CancerAssociation Staging Project.Gastric Cancer 2017;20:217-225.
————
此处提供的信息摘自TNM恶性肿瘤分类第八版。有关TNM分类的具体问题,请访问https:/www.uicc.org/tnm-help-desk
2 胃肿瘤:介绍
上皮恶性肿瘤可发生在胃的任何部位(贲门、胃体或胃窦)。Siewert分类包括食管胃交界处癌症中的贲门腺癌,而国际癌症控制联盟(UICC)TNM分类的第八版规定,肿瘤中点距食管胃交界处远端>2cm(即进入近端胃)的任何癌症,应当使用胃癌系统分期,即使累及食管胃交界处也是如此。本章所涵盖解剖部位的ICD-0编码见简表3.01。
简表3.01本章所涵盖解剖部位的ICD-0编码

增殖性胃上皮病变包括非肿瘤性(良性)息肉、非浸润性肿瘤性病变(异型增生和腺瘤)和癌;他们的流行病学因地理、种族、传染源、生活方式因素和药物使用而异。胃癌(GC)是最常见的上皮恶性肿瘤,幽门螺杆菌(HP)相关性胃炎是其发生的主要致病因素。炎症相关的GC之前是Correa级联反应:一系列上皮表型和基因型变化(化生和异型增生),最终可能导致浸润性癌。因此,治疗长期胃炎、胃萎缩、化生和异型增生是GC二级预防的临床病理策略的重要组成部分。
胃癌前病变和GC都与一系列遗传学和表观遗传学异常有关。一些不常见的GC具有与遗传性肿瘤综合征相关的分子特征(见消化系统遗传性肿瘤综合症,原书第511页)。体细胞突变可能发生在增殖性和浸润前驱病变中(例如,胃底腺息肉中的CTNNB1突变、幽门腺腺瘤中的GNAS突变以及高级别异型增生和腺癌中的TP53突变)。
分子谱分析也为GC分类提供了一个新的框架。癌症基因组图谱(TCGA)研究网络和亚洲癌症研究小组(ACRG)提出了与四种GC亚型(EBV-阳性、微卫星稳定、基因组稳定和染色体不稳定)相关的关键(表观)遗传学分子异常,见表3.05(原书第94页)。特定的体细胞分子改变与GC、胃母细胞瘤和横纹肌样癌的罕见亚型有关。ERBB2(HER2)扩增可确定对分子靶向治疗敏感的GC亚型;因此,在高收入国家,肿瘤学诊断可能包括临床测序。然而,从本质上讲,胃癌的临床治疗仍然依赖于传统的组织学和pTNM分期(见胃腺癌,原书第85页)。
3 胃炎和化生:胃肿瘤的前驱病变
萎缩性胃炎和胃癌(GC)
胃黏膜的长期炎症可促进表型变化:固有层纤维化(取代腺体缺失)和/或固有腺体的化生转化(分泌黏液或嗜酸性)。这些变化导致黏膜萎缩(即,与胃各个部位的固有解剖结构相符的腺体缺失)。黏膜萎缩的定义包括固有腺体的消失和(肠型和/或假幽门)化生。(任何组织亚型的)黏膜萎缩导致功能变化,影响胃酸的产生以及胃蛋白酶原和胃泌素的分泌。胃蛋白酶原和胃泌素血清学可用于无创评估胃萎缩(以及GC风险)。萎缩的严重程度和部位(胃窦或泌酸黏膜)都与炎症的病因有关。在世界范围内,胃萎缩最常见的致病因素是HP感染,其次是自身免疫性疾病(部分病例可能因HP感染而触发)。虽然“萎缩性胃炎”一词在技术上仅适用于萎缩和炎症并存的病例,但在实践中,它通常被认为等同于“萎缩性胃病”一词。
胃腺体中的化生性萎缩
固有胃腺的任何化生转变都可以称为化生萎缩。肠化生和假幽门化生(也称为表达解痉多肽的化生)都与GC风险增加有关。已有证据表明肠化生与肠型GC有关;假幽门化生在胃癌的组织发生中的直接作用仍有争议。假幽门化生具有与幽门型腺体相同的形态和TFF2表达。假幽门化生也可能进一步向肠化转变。肠化生定义为肠型上皮(包括杯状细胞和富含柱状黏液的细胞)取代固有胃上皮。肠化生有两种亚型:小肠型和结肠型。根据黏液组织化学表达模式,肠化生也可分为I型(完全型,小肠型,分泌涎黏蛋白)或II型或III型(不完全型,结肠型,根据特定唾液黏液和/或硫黏蛋白的表达进一步细分)。III型肠化生最容易发生肿瘤转化。由于广泛肠化和富含磺黏液的肠化之间存在直接相关性,肠化的分布范围被认为是GC风险的可靠指标。免疫组织化学显示,完全肠化生表达肠型黏液,减少表达胃型黏液EMA(MUC1)、MUC5AC和MUC6。不完全肠化生共表达胃型黏液和MUC2.
胃炎的组织学分期
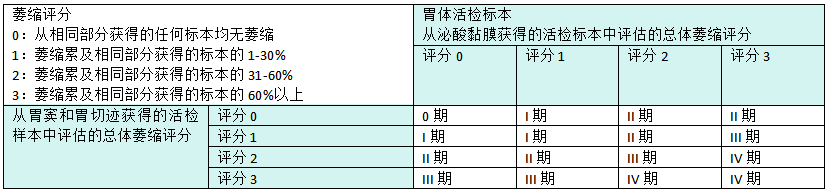
胃黏膜萎缩是非综合征性胃癌的癌变区域。胃炎评估的的操作环节(OLGA)分期系统根据萎缩评分,将胃炎按癌症风险增加分为5期(0-IV期)(见表3.01)。GC二级预防的国际指南使用OLGA分期系统来区分低风险(0-II期)和高风险(III-IV期)胃炎。另一种分期系统,即胃的肠型化生评估操作环节(OLGIM)系统,仅关注肠型化生评分。胃炎分期有助于患者定制个性化监测计划。最近的证据支持胃炎分期(高风险与低风险)与胃血清学(即胃蛋白酶原I/II和胃泌素阳性)之间的相关性。这种相关性可以在临床上用于GC二级预防的联合策略。
表3.01 胃炎评估的操作环节(OLGA)分期系统,萎缩评分适用于分泌黏液和泌酸部分
胃的异型增生
胃上皮异型增生最初被定义为胃腺体的癌前病变,涉及三种(不同表达)组织学变化:上皮异型性、异常分化和黏膜结构紊乱。胃异型增生(也称为上皮内肿瘤)现在定义为一种明确的肿瘤性病变(凹陷、平坦或隆起),没有间质浸润的证据。与异型增生表型相关的组织学变化的不同组合的病变,按传统分为不同的级别。目前,异型增生分为低级别或高级别,并且,早已证明去分化程度与GC风险直接相关。对于胃癌发生过程中出现的组织学表型,已经提出了各种分类(见原书第72页表3.02)。每一种分类都反映了其特定的疾病学方向(生物学、临床或治疗)。无论疾病学重点如何,世界各地的病理学家都同意胃异型增生为肿瘤性,这个坚实结论得到其去分化的形态、分子失调及其与癌症的强关联(以及进展为癌症的风险)的支持。
未完待续......
















共0条评论