[导读] 编译整理:强子
引言
对于鼻腔鼻窦处来说,有两种肿瘤是通过神经外胚层分化而得以界定的:一个是历史悠久的成员,即嗅母细胞瘤(olfactory neuroblastoma,ONB),这是一种CK阴性的神经外胚层肿瘤,结构上呈分叶状,且有数量不等的神经纤维性基质;另一个新确认的成员是嗅癌(olfactory carcinoma,OC),则是CK阳性的神经外胚层肿瘤,常混有结构良好的腺体。
作为《Surg Pathol Clin》杂志鼻腔鼻窦处病理综述的一部分,范德比尔特大学医学中心病理专家Perez等人对这组病种做了详细综述。为帮助大家更好的了解相关知识点并指导临床实践,我们将该文要点编译介绍如下。
嗅母细胞瘤
嗅母细胞瘤为鼻腔鼻窦处独有的恶性神经外胚层肿瘤。该肿瘤来源于嗅膜(olfactory membrane)的球形基底细胞(globose basal cells)。低级别嗅母细胞瘤一般容易诊断,但级别较高者可与鼻腔鼻窦处诸多小圆形蓝细胞肿瘤存在一定形态学重叠,因此要注意相应鉴别诊断,包括本文后续将要学习的、最近认识的嗅癌,也进一步对嗅母细胞瘤的范畴有了更精准的定义。
嗅母细胞瘤在鼻腔鼻窦肿瘤中占比2-3%。患者年龄分布宽泛,峰值为50-70岁,男性稍多。目前未明确有特殊发病危险因素。临床上,嗅母细胞瘤几乎总是发生于临近筛板的鼻腔上部。虽然也有鼻咽部、上颌窦、筛窦处异位嗅母细胞瘤的报道,但筛板之外部位诊断嗅母细胞瘤还是要慎重。
嗅母细胞瘤临床一般表现为肿物所致症状,如双侧鼻塞、鼻出血、头疼、眼部症状等。虽然该肿瘤源于嗅膜,但嗅觉丧失的情况罕见。影像学上,进展期嗅母细胞瘤一般为跨越筛板的哑铃形肿块,即鼻腔及颅内都有肿瘤成分。
临床上,嗅母细胞瘤的分期常采用Kadish-Morita方案,具体是根据肿瘤超出鼻腔的范围来确定不同的分期,详见表1。该分期也是预后意义最为显著的嗅母细胞瘤分期方案。临床上,大部分患者为C期。
表1.嗅母细胞瘤Kadish-Morita分期方案
A期:肿瘤局限于鼻腔;
B期:肿瘤累及鼻腔和鼻旁窦;
C期:肿瘤侵出鼻腔及鼻旁窦;
D期:有局部或远处转移。
组织学上,嗅母细胞瘤的病变中央位于黏膜下,结构为致密巢状及分叶状,周围为富于血管的间质,偶见钙化。该肿瘤在浆黏液腺周围呈浸润性生长,罕见情况下可定植至呼吸道黏膜。如前所述,嗅母细胞瘤为小圆细胞肿瘤,细胞核圆形至卵圆形,染色质颗粒状,部分病例中有小核仁。瘤细胞呈合体状,细胞分界不清,有数量不等的弱嗜酸性神经纤维基质,并有菊型团形成。
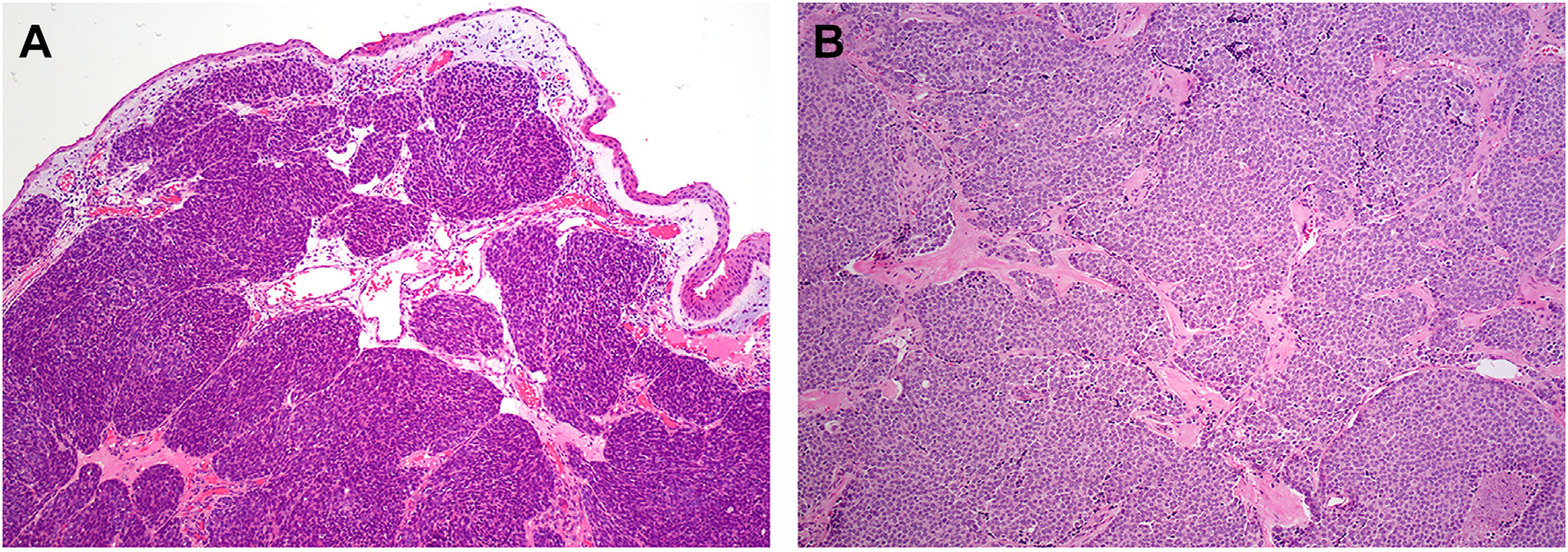 图1.嗅母细胞瘤,病变位于黏膜下,排列呈巢状、分叶状。
图1.嗅母细胞瘤,病变位于黏膜下,排列呈巢状、分叶状。
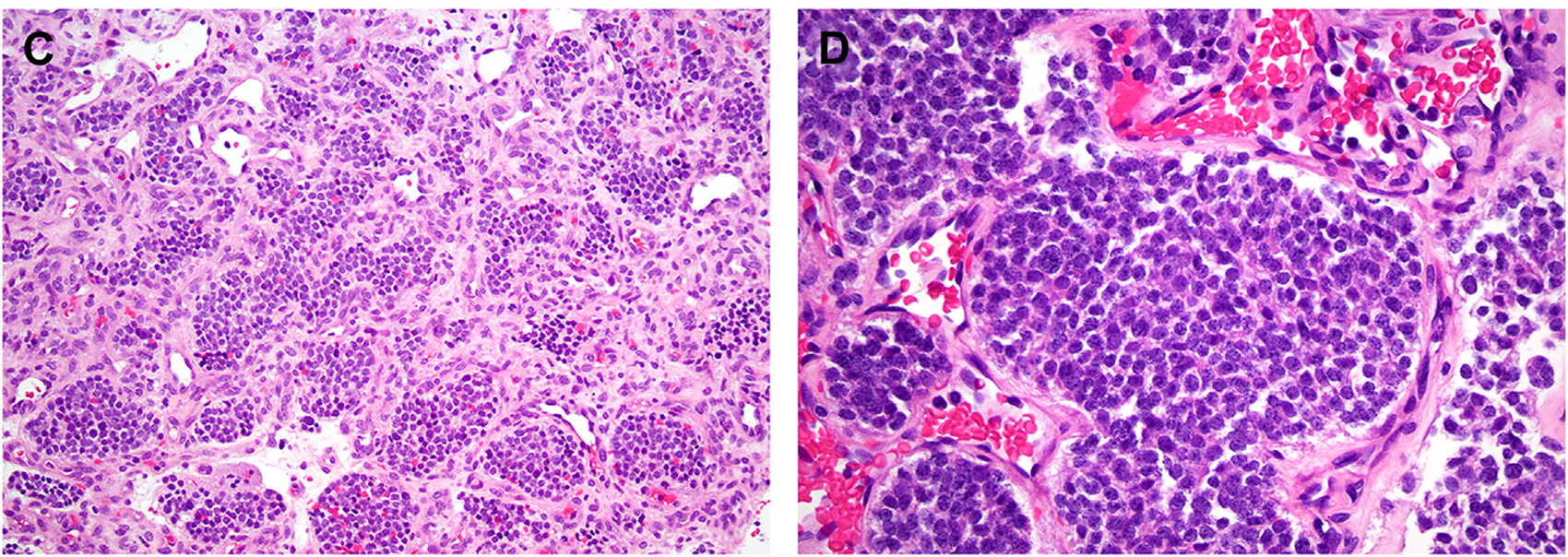 图2.嗅母细胞瘤间质血管丰富,瘤细胞的细胞核形态单一,圆形至卵圆形。
图2.嗅母细胞瘤间质血管丰富,瘤细胞的细胞核形态单一,圆形至卵圆形。
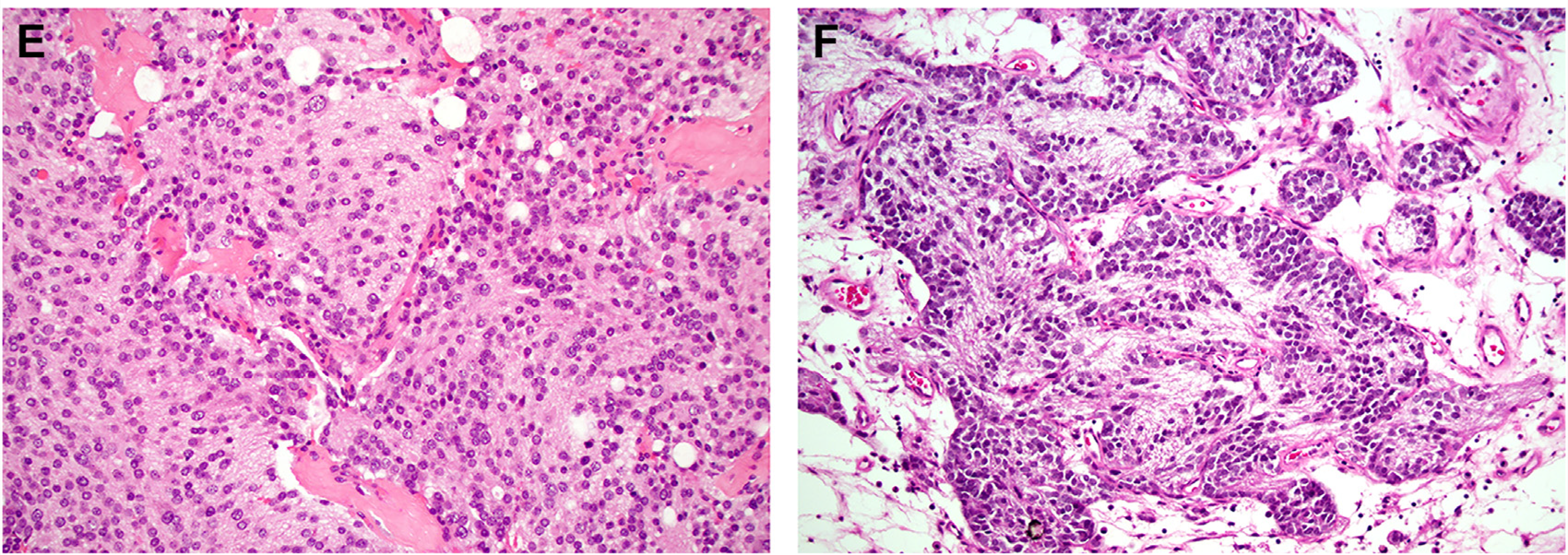 图3.图示嗅母细胞瘤的细胞呈合体样,伴显著神经纤维性基质,有菊型团形成。
图3.图示嗅母细胞瘤的细胞呈合体样,伴显著神经纤维性基质,有菊型团形成。
罕见情况下,有些病例其他方面均为典型嗅母细胞瘤、但有异源性分化,最常见表现为单纯腺体形成,但也有黑素细胞成分、鳞状成分、横纹肌母细胞成分、神经节母细胞瘤成分;罕见情况下还可有嗜酸性细胞改变及透明细胞改变。需要指出的是,嗅母细胞瘤的质地非常脆,因此送检标本中可有广泛挤压假象,所以会给冰冻切片诊断造成显著困难。
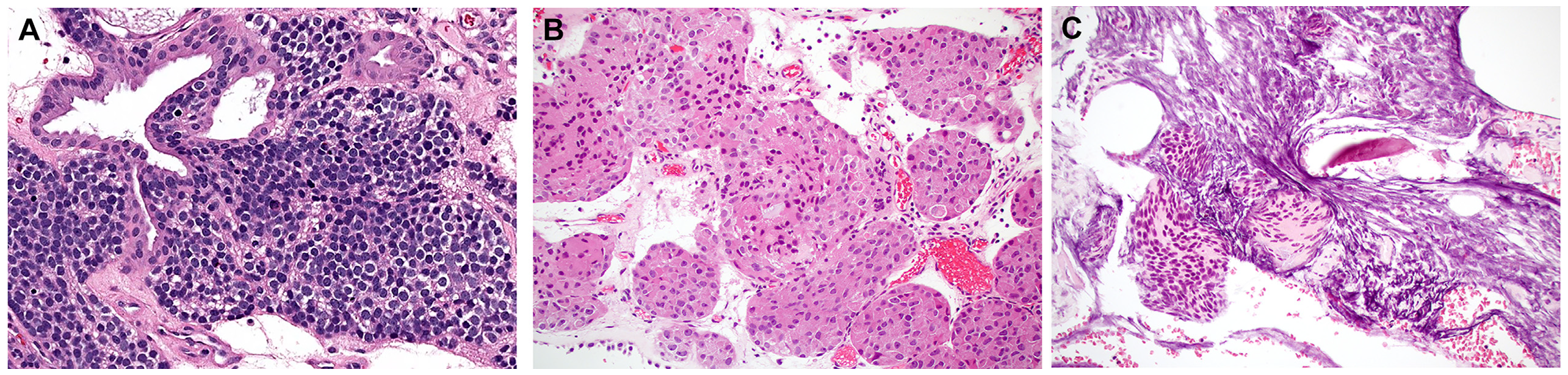 图4.嗅母细胞瘤,罕见情况下可有异源性分化,如本例所示的腺体形成(A);个别病例会有嗜酸细胞改变(B)。需要注意的是,嗅母细胞瘤的细胞可有广泛挤压假象,从而影响诊断(C)。
图4.嗅母细胞瘤,罕见情况下可有异源性分化,如本例所示的腺体形成(A);个别病例会有嗜酸细胞改变(B)。需要注意的是,嗅母细胞瘤的细胞可有广泛挤压假象,从而影响诊断(C)。
Hyams分级方案将嗅母细胞瘤分为四级,具体依据为分化程度,且这一方案也是预后判断的重要指标。由于Hyams分级方案并非采用评分制划分肿瘤级别,因此部分病例可能同时表现出多个级别的特征,导致诊断模糊。这种情况下,允许采用范围(如2-3级)进行分级。
表2.嗅母细胞瘤Hyams分级方案
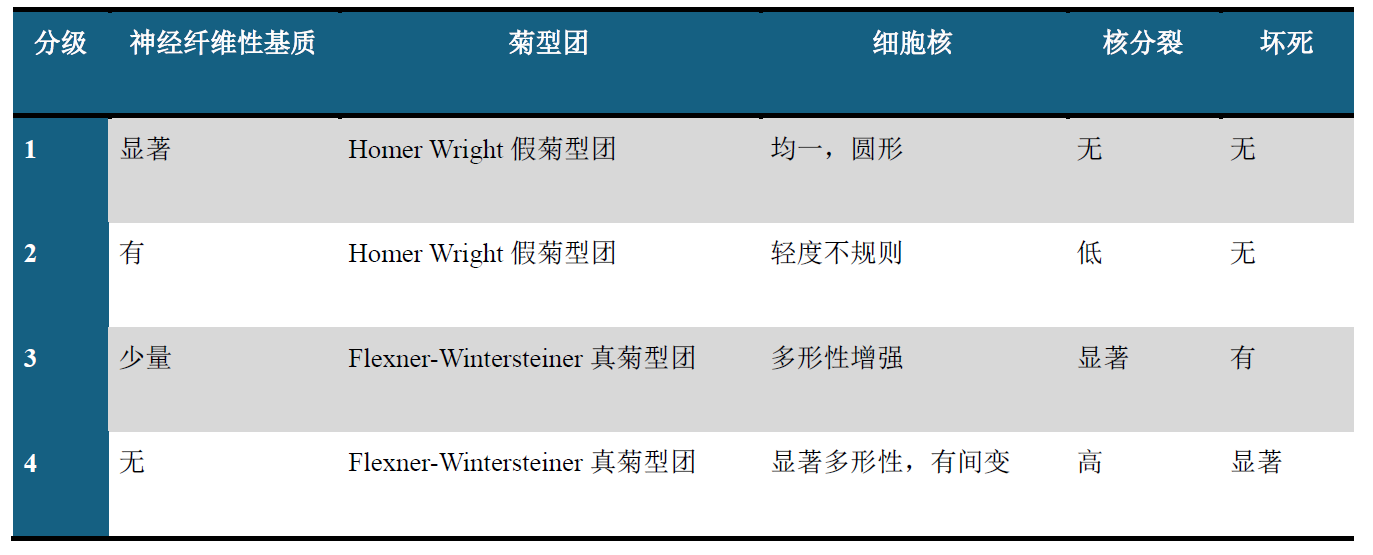
嗅母细胞瘤患者大部分确诊时为2级。就该表中的菊型团来说:高达1/3的低级别(1-2级)嗅母细胞瘤具有Homer-Wright假菊型团,即肿瘤细胞围绕神经纤维性基质构成;而高级别(3-4级)嗅母细胞瘤罕见情况下也会有Flexner-Wintersteiner真菊型团,即肿瘤细胞围绕中央的管腔分布。4级嗅母细胞瘤可出现显著的间变,导致其组织学特征几乎无法辨认出来,但学界日益质疑此类肿瘤是否真正属于嗅母细胞瘤。如果缺乏明确的低级别成分,则不要诊断为嗅母细胞瘤。
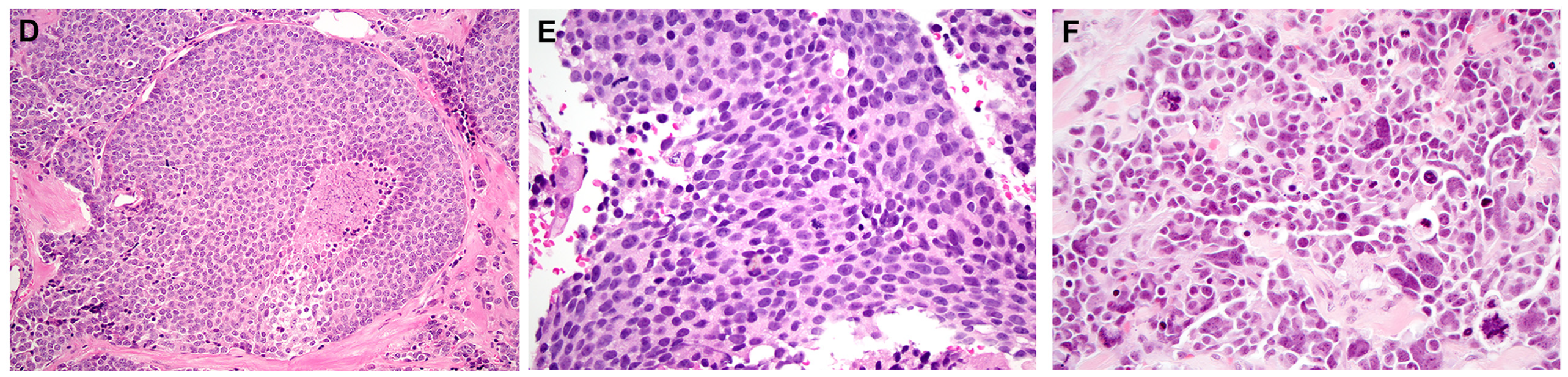 图5.图示高级别嗅母细胞瘤:显著坏死(左),细胞核多形性增强且核分裂增加(中),4级嗅母细胞瘤可有显著间变表现(右)。
图5.图示高级别嗅母细胞瘤:显著坏死(左),细胞核多形性增强且核分裂增加(中),4级嗅母细胞瘤可有显著间变表现(右)。
免疫组化方面,嗅母细胞瘤应归为CK阴性的神经内分泌肿瘤。该肿瘤总是表达多种神经内分泌标记,如Syn、CgA、INSM1大部分情况下均为弥漫、强阳性。虽然嗅母细胞瘤中CD56也是阳性表达,但最好不要仅凭CD56阳性而做出嗅母细胞瘤的诊断,因为这一指标并无特异性,在鼻腔鼻窦其他肿瘤中也常见阳性表达。
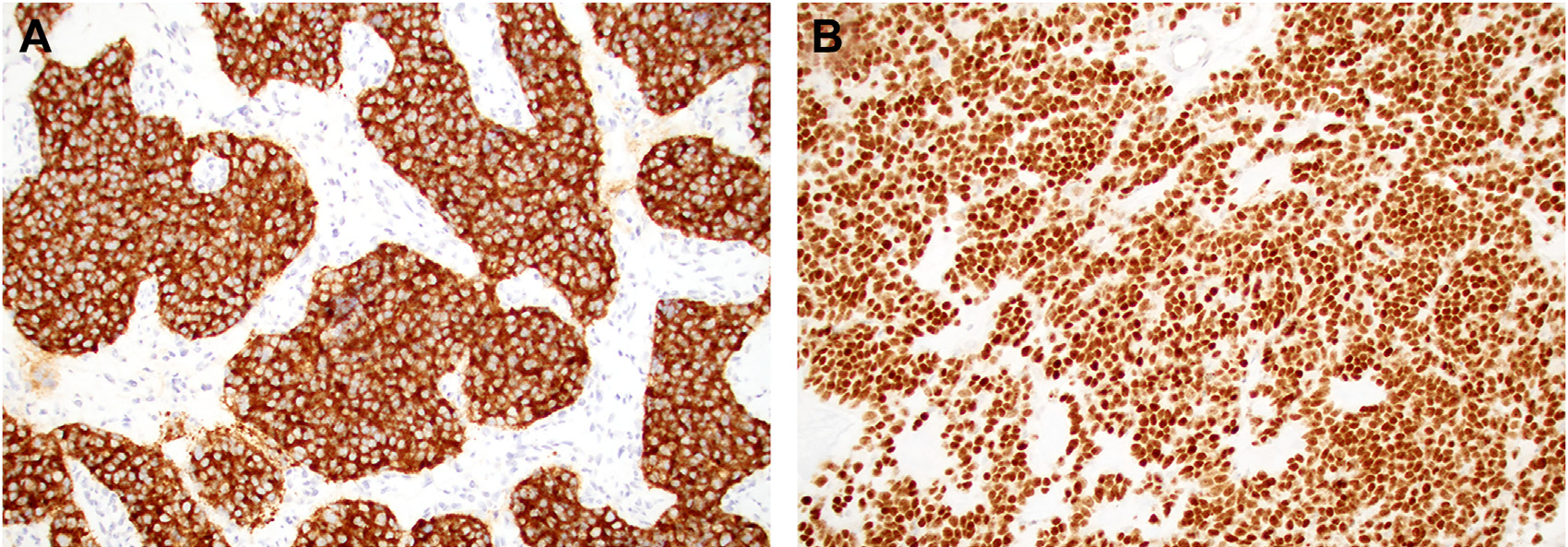 图6.嗅母细胞瘤弥漫、强阳性表达Syn(左)和INSM1(右)。
图6.嗅母细胞瘤弥漫、强阳性表达Syn(左)和INSM1(右)。
嗅母细胞瘤大部分情况下为CK以逆袭,但这一点仍存在争议。有文献称高达30%的嗅母细胞瘤有CK的表达,但这类数据大多来自于十几年前的研究,而过去十几年里,鼻腔鼻窦肿瘤已经有了广泛的重新分类,因此这些结果需慎重解读。当然,也的确有小部分其他方面均典型的嗅母细胞瘤局灶表达低分子量CK(如CAM5.2),但非局灶性的广谱CK(如AE1/AE3)表达还是要考虑包括嗅癌在内的其他诊断。
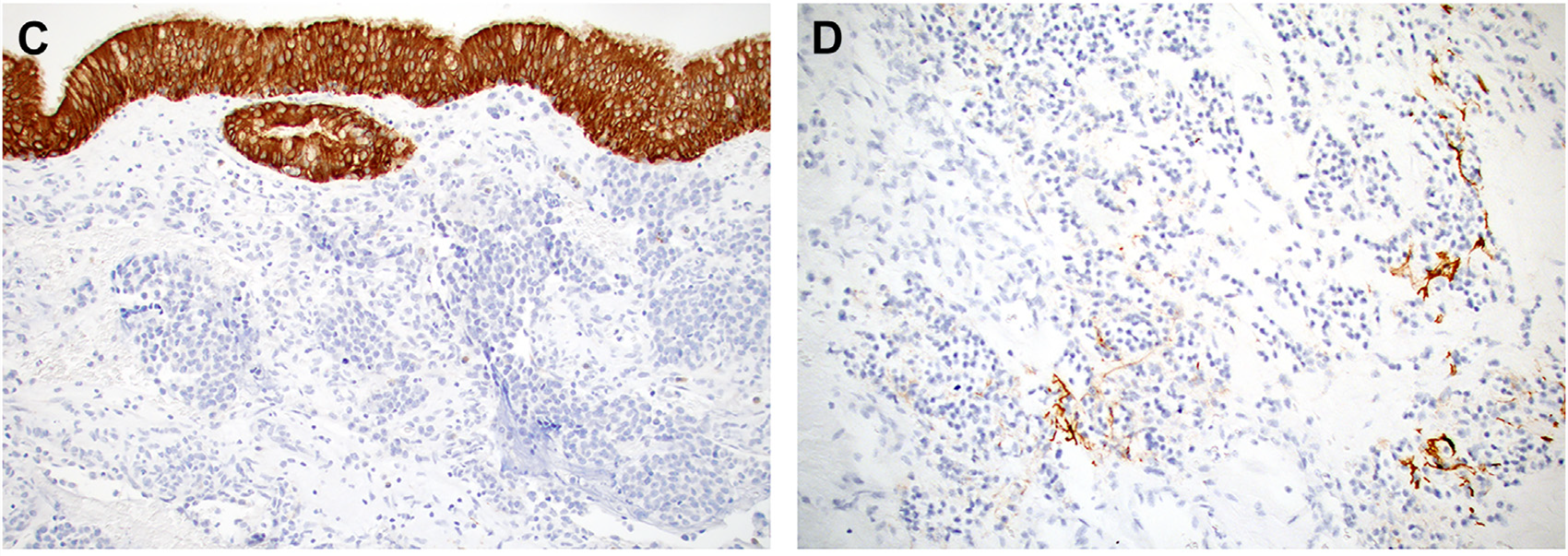 图7.嗅母细胞瘤一般AE1/AE3阴性(左),但也的确有少数病例可局灶表达CAM5.2(右)。
图7.嗅母细胞瘤一般AE1/AE3阴性(左),但也的确有少数病例可局灶表达CAM5.2(右)。
除神经内分泌标记和CK外,还有些其他免疫组化标记有助于嗅母细胞瘤的确诊。嗅母细胞瘤周围有网状支持细胞围绕,而这些细胞阳性表达S100和SOX10,这在鼻腔鼻窦其他肿瘤中并不常见。嗅母细胞瘤还强阳性表达calretinin。Ki-67的阳性率与Hyams分级相关,但尚未整合入分级中,也并未广泛用作预后指标。最近有报道称嗅母细胞瘤总是表达SSTR2A,而形态学有相似之处的其他病变中并不表达这一标记,因此有望作为一个新的诊断和治疗靶点。
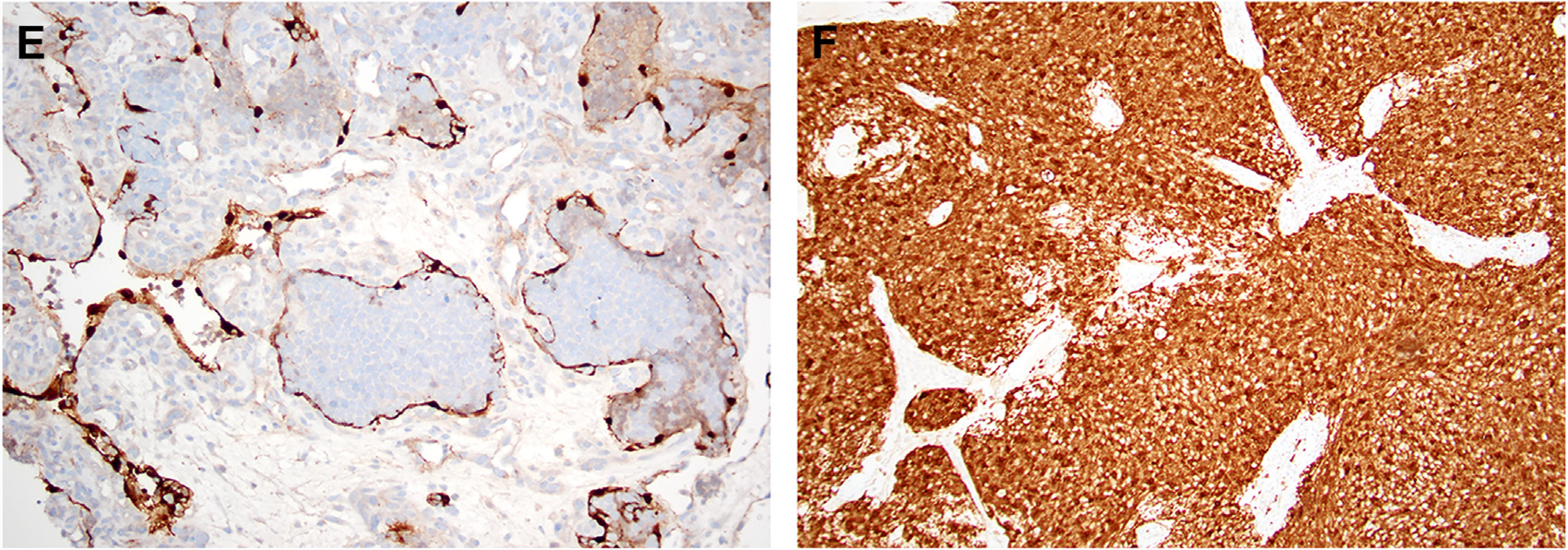 图8.嗅母细胞瘤的周围有S100阳性的支持细胞(左),且嗅母细胞瘤阳性表达calretinin(右)。
图8.嗅母细胞瘤的周围有S100阳性的支持细胞(左),且嗅母细胞瘤阳性表达calretinin(右)。
虽有多项大规模分子研究,但嗅母细胞瘤中仍未发现有明确的致癌驱动。文献中有涉及TP53、PIK3CA、NF1、CDKN2A、CDKN2C、CCND1、FGFR3改变的相关报道,但无一见于大量病例。如果存在TP53的改变,则临床预后不良。90%的嗅母细胞瘤中可见DMD的缺失,但其功能意义尚不明确。部分“CK阳性嗅母细胞瘤”最初报道称具有IDH2突变,但共识意见认为这类肿瘤最好归为大细胞神经内分泌癌或嗅癌。嗅母细胞瘤在甲基化谱分析(methylation profiling)中也属于独特的聚类。实际工作中,嗅母细胞瘤的诊断一般无需分子检测。
嗅母细胞瘤临床生物学行为具有广泛变异,从惰性至侵袭性不等。文献中报道的5年生存率60%至82%,10年生存率40%至63%。文献中有无病间隔10年以上出现晚期复发和转移的报道。前述Kadish-Morita分期方案和Hyams分级方案似乎都可用于预测嗅母细胞瘤的转移及总生存,即分期较高、级别较高者预后差。需要指出的是,嗅母细胞瘤尚未纳入AJCC或ICC的鼻腔鼻窦恶性肿瘤分期方案。
未完待续
点此下载原文献
参考文献
Mikula MW, Rooper LM. Olfactory Neuroblastoma and Olfactory Carcinoma: A Practical Review. Surg Pathol Clin. 2024;17(4):637-652.
doi:10.1016/j.path.2024.07.010






















共0条评论