[导读] 深圳市光明区人民医院 赵东晖 李庆军
病史:
患者,女,56岁,绝经后不规则阴道流血3次,每次持续4-5天。
影像检查:
MRI:子宫内膜明显增厚,内膜线不清,子宫后壁结合带消失,肌层受侵犯,深度>1/2层,左侧附件内见大小约11×13×14mm结节状等信号影,考虑子宫内膜癌伴左侧附件受累(符合FIGO 2014 ⅢA期)。
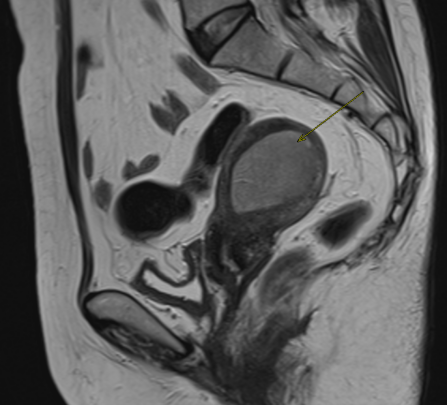

图1 本例MRI照片
病理检查:
大体:
于宫底见一隆起凸向宫腔肿物,肿物大小约为5×3.5×3cm,切面灰白,质韧。
HE形态:
1.肿瘤组织呈腺管样、乳头状、筛状、网状、靴钉样、实性等生长方式混合存在,管腔内特征性嗜酸性胶冻样分泌物;
2.瘤细胞可呈扁平、立方或柱状,胞质嗜酸,细胞边界不清,细胞核圆形、卵圆形、扁平或成角,染色质粗颗粒至透明泡状,核膜不规则、重叠,可见核沟形成,类似“甲状腺乳头状癌”核特征,轻至中度异型性;
3.浸润肌层。
 图2 刮宫组织低倍镜观察:筛网状结构,筛孔内嗜酸性分泌物
图2 刮宫组织低倍镜观察:筛网状结构,筛孔内嗜酸性分泌物
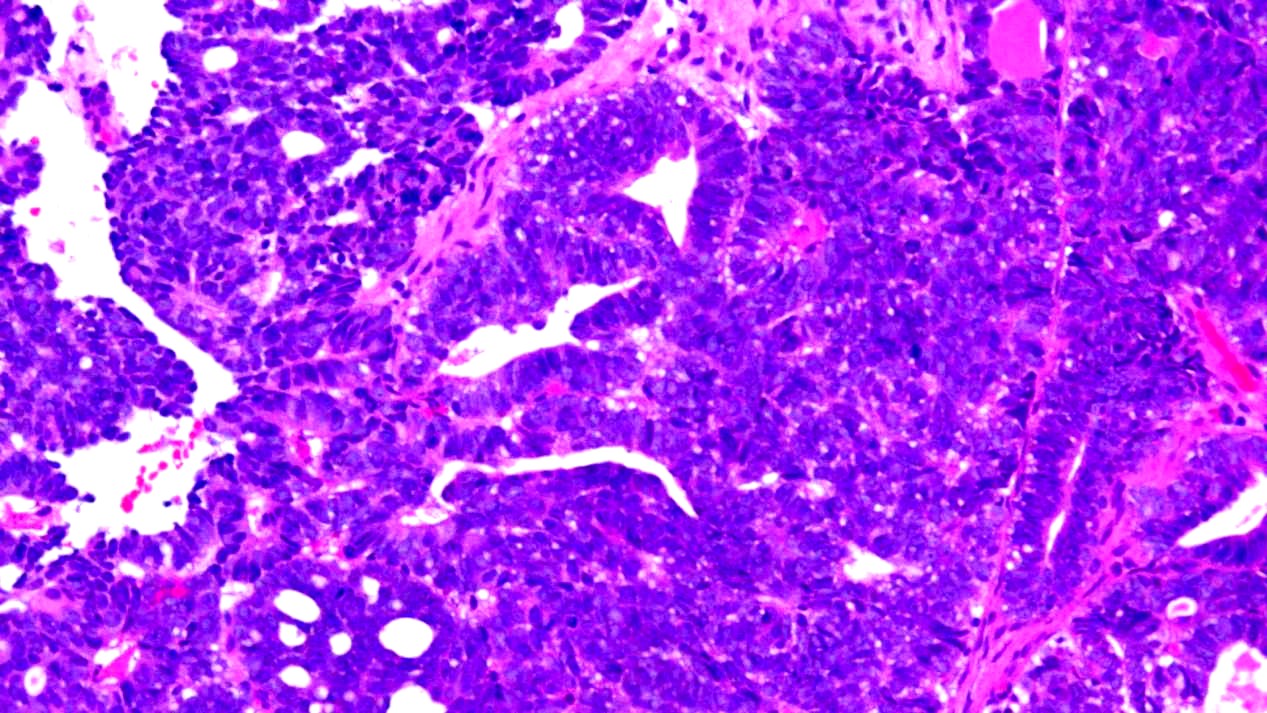 图3 筛状、腺样及少量乳头状结构
图3 筛状、腺样及少量乳头状结构
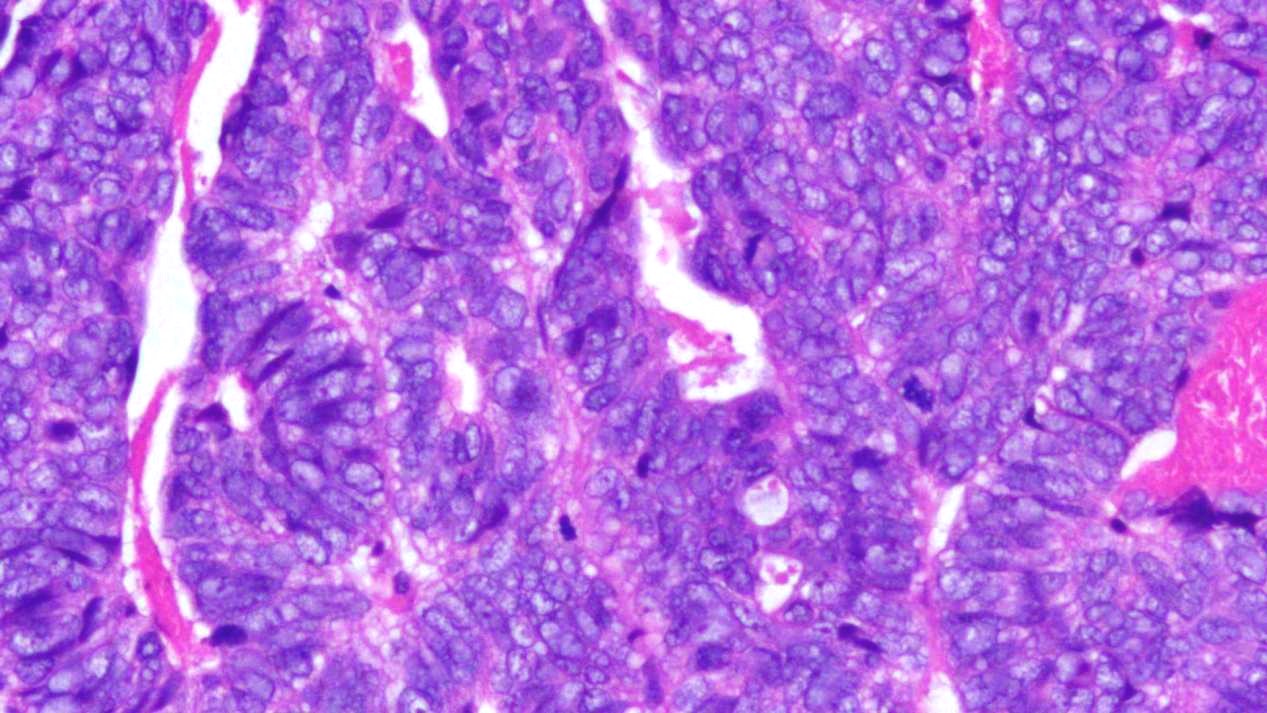 图4 瘤细胞呈扁平、立方及柱状,胞质嗜酸,细胞边界不清,细胞核圆形、卵圆形、扁平或成角,染色质粗颗粒至透明泡状,核膜不规则、重叠,见核沟形成,类似于甲状腺乳头状癌核特征
图4 瘤细胞呈扁平、立方及柱状,胞质嗜酸,细胞边界不清,细胞核圆形、卵圆形、扁平或成角,染色质粗颗粒至透明泡状,核膜不规则、重叠,见核沟形成,类似于甲状腺乳头状癌核特征
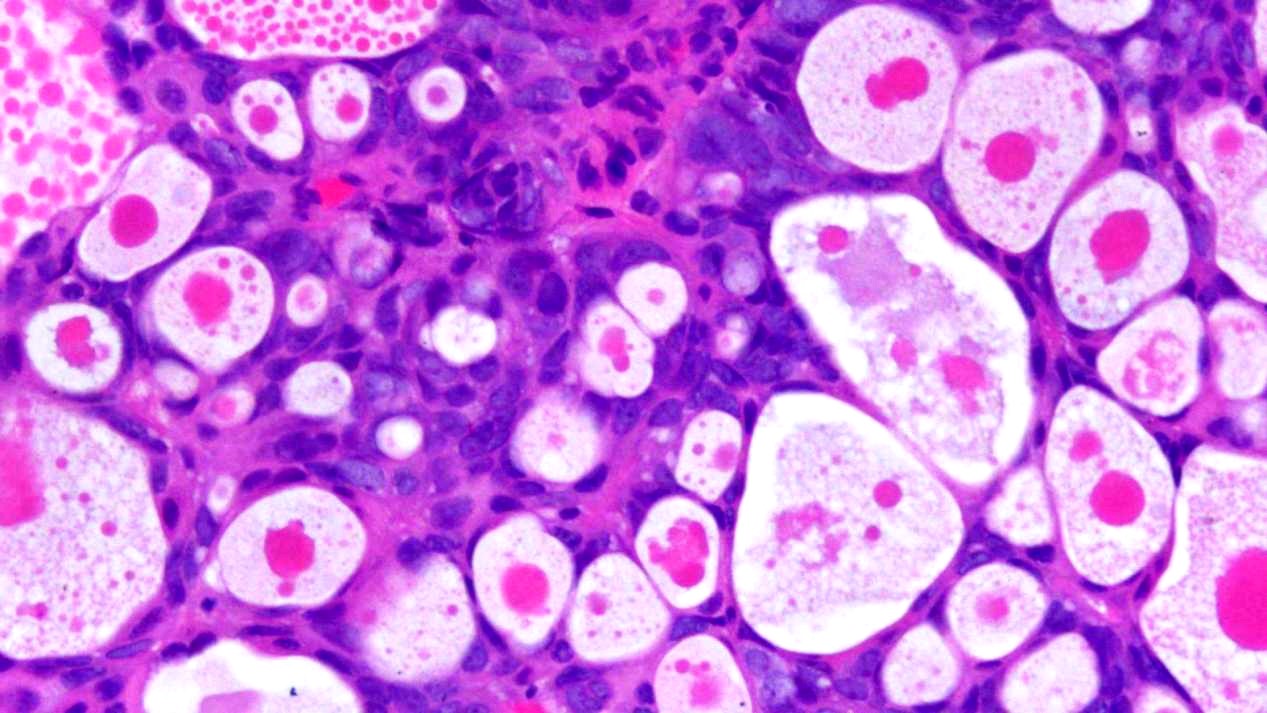 图5 高倍观,腔内嗜酸性胶冻样分泌物
图5 高倍观,腔内嗜酸性胶冻样分泌物
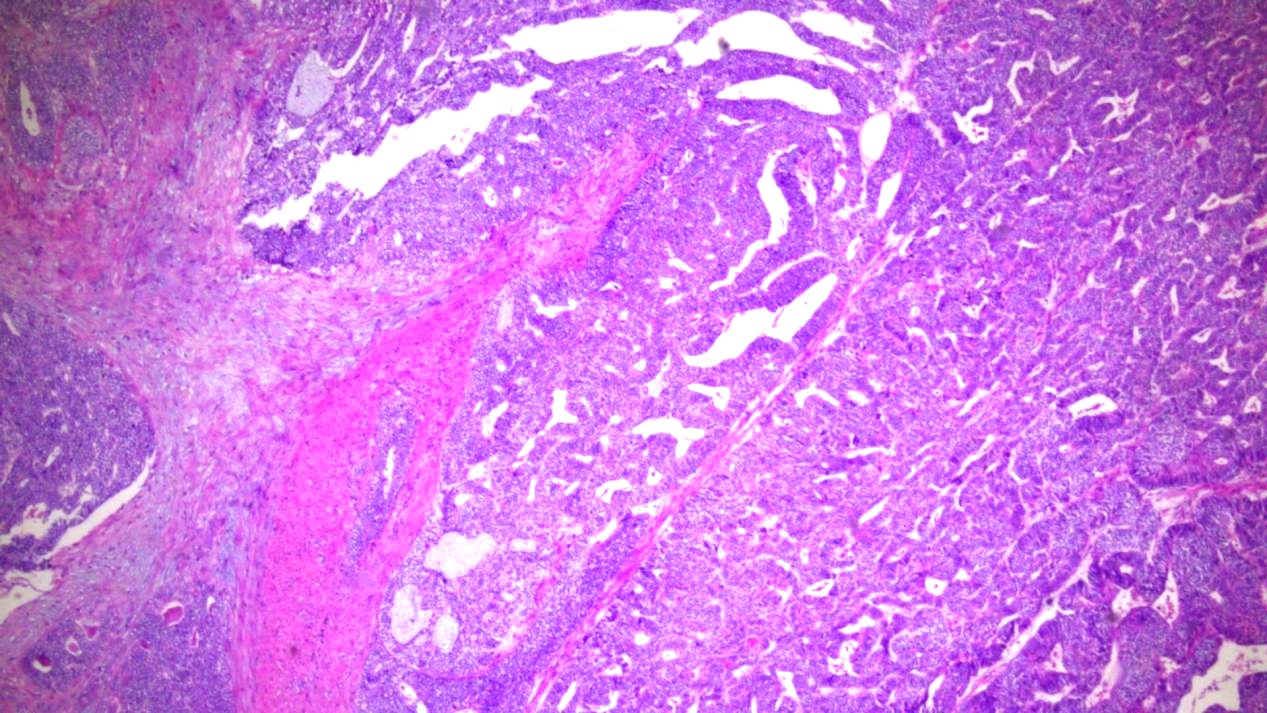 图6 浸润肌层,伴纤维组织增生
图6 浸润肌层,伴纤维组织增生
IHC:
1.AE1/AE3、Pax-8、Vimentin均(+);
2.ER(-),PR(个别+),p16(斑驳+),Ki67(约60%+),p53(散在弱+), GATA3(多量+),TTF-1(-),CD10(部分腔缘+),PTEN、CR、NapsinA均(-);
3.BRAF V600E(-),MLH-1、MSH2、MSH6、PMS2(均核+),为pMMR,提示MSS。
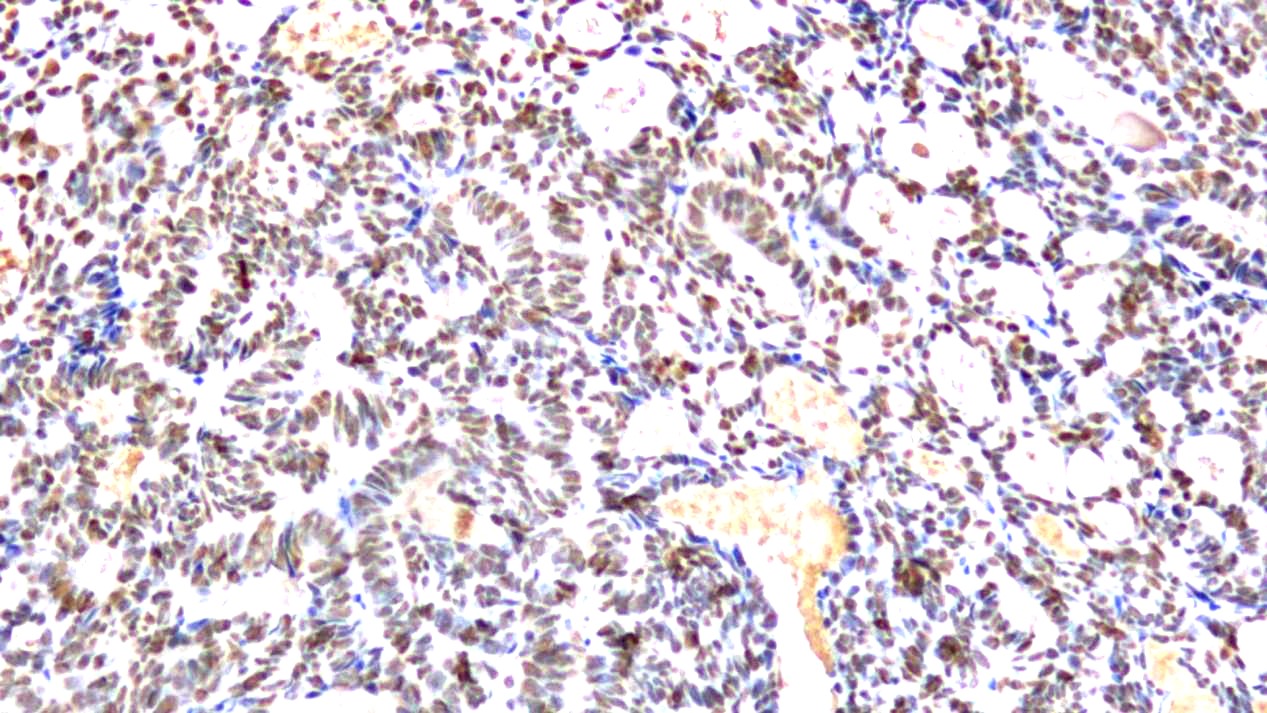 图7 PAX-8(+)
图7 PAX-8(+)
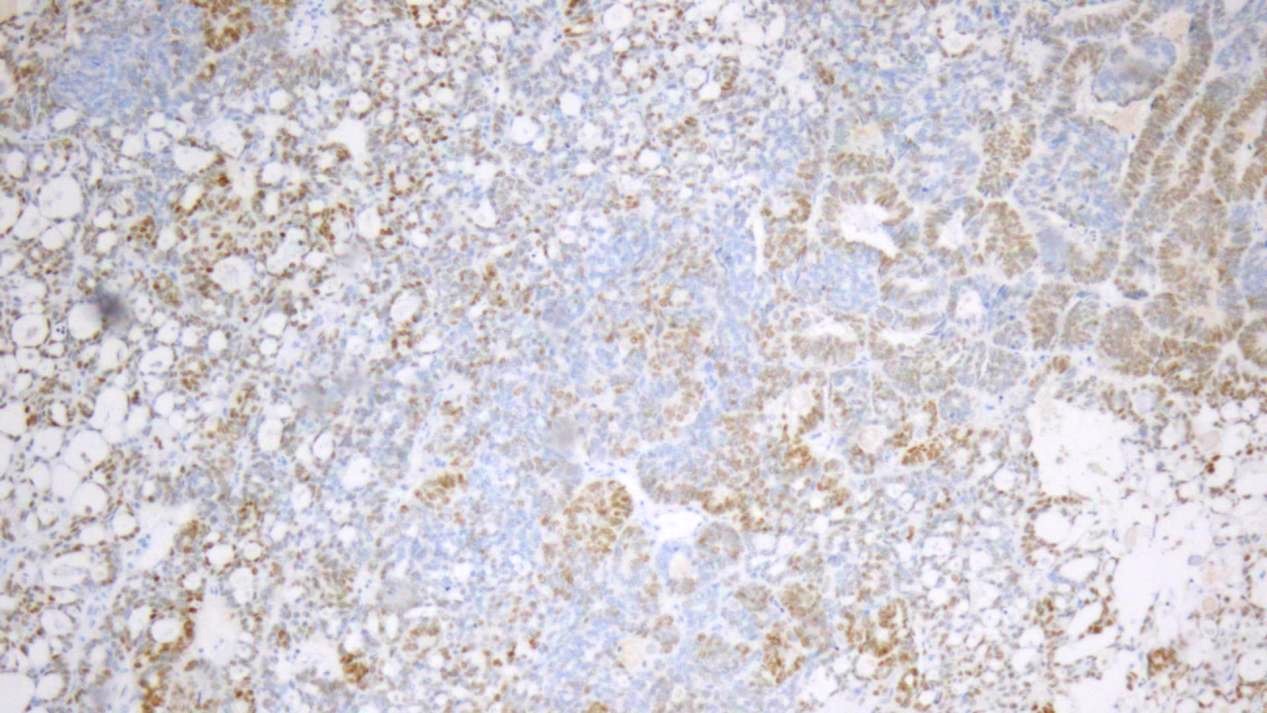 图8 GATA3(多量+)
图8 GATA3(多量+)
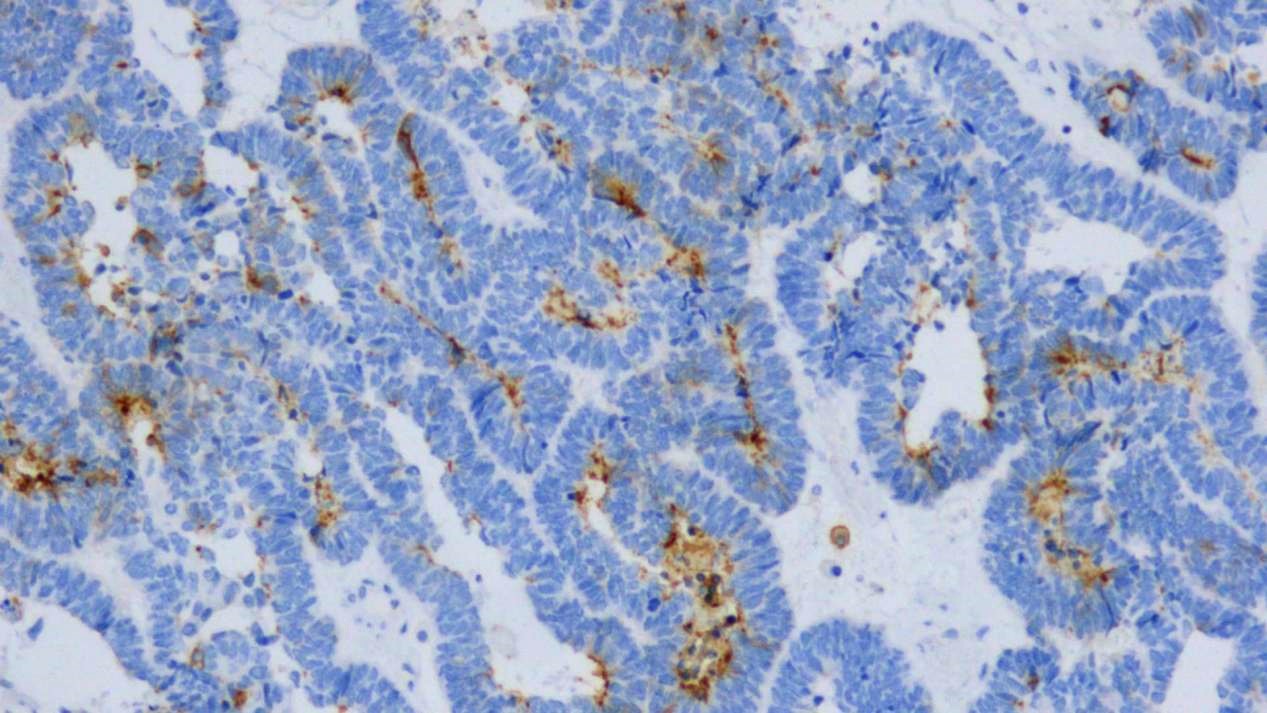 图9 CD10(部分腔缘+)
图9 CD10(部分腔缘+)
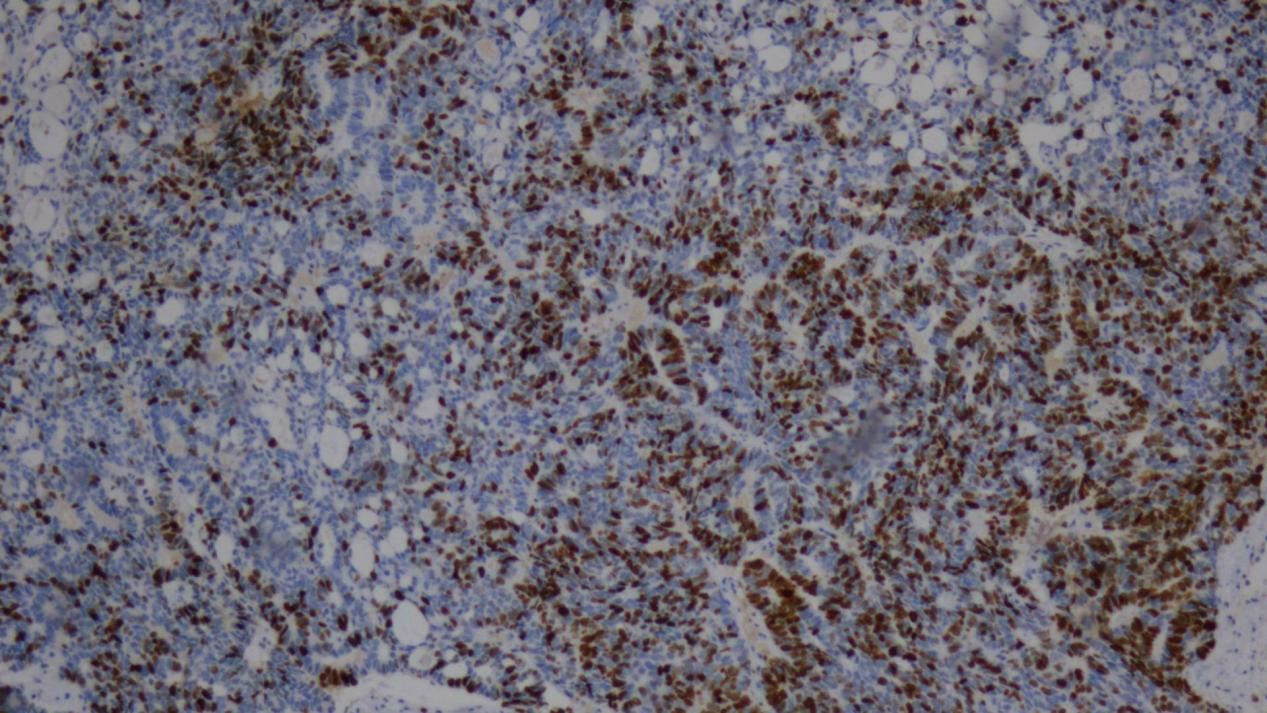 图10 Ki-67(约70%+)
图10 Ki-67(约70%+)
病理诊断:
全子宫+双附件切除标本:
-宫底处子宫内膜中肾样腺癌,肿物呈息肉样凸向宫腔,大小约为5×3.5×3cm,并向子宫肌壁内浸润性生长,>1/2肌层;
-宫颈管、宫颈、左右宫旁、右侧附件均未见肿瘤累及;
-左侧输卵管伞端处、左侧卵巢表面均见肿瘤组织累及;
-多个脉管内见癌栓,神经未见癌侵犯。
讨论:
概述:
2016年McFarland等首次报道中肾样腺癌(mesonephric-like adenocarcinoma,MLA),并于2020年纳入第5版女性生殖肿瘤WH0分类。
流行病学及临床影像特征:
MLA罕见,主要发生于卵巢和子宫体。好发于绝经后妇女,年龄范围26-91岁,平均59岁,中位60岁。
部分卵巢MLA患者因盆腔肿物巨大而出现腹痛、腹胀、尿频等症状,而原发于子宫内膜的MLA患者常出现阴道出血、异常排液及腰腹部疼痛等情况。影像学检查发现占位性病变。部分患者可出现CA125、CA19-9、HE4等血清肿瘤标志物的升高。
病理学特征:
大体:
子宫MLA常在子宫内膜面形成一个隆起、息肉状或菜花样的肿块,1.5-14.0 cm,68%患者有子宫深肌层的浸润;卵巢MLA可单侧或双侧发生,肿瘤最大径4-35 cm,切面呈(囊)实性,实性区灰白间灰褐色,可伴随出血、坏死。
镜下观察:
1.多种组织结构,如:腺管样、乳头状、筛状、网状、肾小球样、靴钉样、实性等,2种及以上结构混合存在;
2.管腔内嗜酸性胶冻样分泌物是MLA的特征性改变,但不是每一个病例都会出现;
3.肿瘤细胞可呈扁平、立方或柱状,胞质嗜酸,细胞边界不清,细胞核圆形、卵圆形、扁平或成角,染色质粗颗粒至透明泡状,核膜不规则、重叠,并可见核沟形成,类似于甲状腺乳头状癌的核特征;
4.细胞轻至中度异型性,罕见高度细胞异型性;
5.缺乏鳞化、黏液化生;
6.肿瘤周围缺乏中肾管残件/增生;
7.子宫MLA大部分起自子宫内膜,并向肌层浸润;
8.如果是卵巢MLA,常伴有子宫内膜异位病灶;
9.少见情况下,与其他类型苗勒源性肿瘤合并发生。
免疫组织化学:
与中肾腺癌相似,MLA通常不同程度阳性表达PAX8、GATA3、CD10(阳性信号位于腔缘),阴性表达ER、PR、WT1,这是基于CD10、GATA3阳性表达于中肾管/Wolffian源性男性泌尿系统上皮(即前列腺、精囊、输精管和附睾腺上皮)及相关肿瘤。常表达TTF1,并存在TTF1和GATA3的反向染色,p16斑驳阳性、p53野生型及DNA错配修复蛋白(MLH1、MSH2、MSH6和PMS2)阳性。
分子遗传学:
1.MLA:与宫颈中肾腺癌相似,81.8%卵巢MLA以及87.7%子宫MLA也出现KRAS的高频突变。几乎所有MLA病例未出现TP53突变、POLE核酸外切酶热点突变以及错配修复蛋白(MMR)不表达的情况。
2.混合成分的MLA:极少数卵巢和宫体MLA病例与苗勒病变合并存在,它们既可以有相同的KRAS/NRAS突变,也可以有各自不同的分子改变。
3.原发灶和转移灶分子改变对比:目前约半数MLA可发生转移,转移灶均保留与原发灶相同的克隆性。
鉴别诊断:
1.中肾腺癌:
(1)原发部位:中肾腺癌病变主体位于宫颈管深部及阴道壁内,子宫MLA主要发生于子宫内膜,并向子宫肌层深面浸润;
(2)周围是否存在中肾残件/增生:中肾腺癌周围常见,MLA癌旁不出现;
(3)MLA更常阳性表达TTF1,并存在GATA3与TTF1反向表达;
(4)分子遗传学不同点:MLA可出现苗勒源性肿瘤尤其是子宫内膜样腺癌相关分子改变(如PTEN、PIK3CA、CTNNB1);中肾腺癌缺乏相似的分子改变。
2.苗勒源性恶性肿瘤:
2.1 MLA与低级别子宫内膜样癌:
(1)组织形态学:前者往往具有多样的生长方式,管样结构内可见嗜酸性分泌物,细胞核常呈陶铸形、空泡状,挤压、重叠,甚至形成核沟;而后者组织结构相对单一,无MLA特征性分泌物,细胞核呈假复层柱状排列,染色质粗糙,无核折叠,如果出现鳞化和/或黏液分化,可排除MLA的可能;
(2)是否出现子宫内膜样癌的前体病变:癌周出现子宫内膜非典型增生/子宫内膜上皮内瘤变,提示子宫内膜样癌可能性大;
(3)免疫表型:若阳性表达 GATA3、TTF1,阴性表达ER、PR,则符合MLA的诊断。
2.2 MLA与浆液性癌:
如果肿瘤呈复杂乳头状或者腺样结构,被覆高核级上皮,TP53突变,并弥漫阳性表达p16,阴性表达GATA3及TTF1则倾向于浆液性癌。
2.3 MLA与透明细胞癌:
二者都有复杂的组织结构,同时阴性表达ER和PR,但是MLA缺乏透明细胞癌的靴钉样细胞,也鲜少出现透明的胞质,借助免疫组织化学NapsinA、GATA3、TTF1、CD10可资鉴别。
2.4 MLA与癌肉瘤:
尤其是具有梭形细胞区域的MLA,癌肉瘤存在TP53突变,而少部分TP53 野生型的病例中,也会存在POLE突变MSI等分子改变,但是不出现KRAS突变,因此可以通过分子层面加以鉴别。
3.MLA与类似于卵巢性索间质的子宫肿瘤:
有一定重叠,且均不程度表达上皮标志物、Calretinin、a-抑制素及CD10。不同点在于:(1)免疫表型:前者表达GATA3和TTF1,而后者不表达;(2)分子层面:后者具有ESR1或者GREB1重排,前者无以上基因的重排。
4.MLA与卵巢午菲管肿瘤:
(1)起源不同:前者起源于午菲系统下部区域的中肾残件;后者则来源于午菲系统上部的中肾残件;
(2)生物学行为:前者具有高度侵袭性;后者尽管具有低度恶性潜能,但生物学行为较惰性;
(3)免疫表型:后者阴性表达GATA3、TTF1、PAX8、EMA,前者则相反;
(4)分子改变:午菲管肿瘤存在KMT2D、STK11突变,没有获得KRAS/NRAS突变。
5.MLA与转移性癌:
转移性癌包括甲状腺乳头状癌、结直肠腺癌等,结合影像学定位、原发部位、既往史、多项免疫组织化学抗体联合使用以及分子检测方可确诊。
治疗及预后:
1.治疗:以手术治疗为主,行全子宫+双侧附件+种植或转移灶切除±盆腔、腹主动脉旁淋巴结清,部分患者术后辅以铂类联合紫杉醇的化疗或放疗。
2.预后:MLA是一类具有高侵袭性的恶性肿瘤,易发生复发转移且有肺部转移倾向。
小结:
MLA镜下形态的详实描述、免疫组织化学标志物的发现及应用、KRAS高频突变等分子遗传学特征的成功破译,使我们能从多维度将MLA与大部分其他(非)女性生殖系统肿瘤鉴别开来,并为MLA药物的开发提供了有效的靶点。
参考文章:
[1]磨娜,金玉兰.女性生殖系统MLA临床病理及分子遗传学研究进展[J],中华病理学杂志,2023.52(2):194-198.
[2]郑晓丹,陈光勇,黄受方.WHO女性生殖肿瘤分类第5版关于子宫体及宫颈腺癌分类的[J],中华病理学杂志,2021,50(5):437-441.
























共0条评论