编译整理:强子
肺癌免疫组化解惑答疑(1)
肺癌免疫组化解惑答疑(2)
肺癌免疫组化解惑答疑(3)
肺癌免疫组化解惑答疑(4)
肺癌免疫组化解惑答疑(6)
9. 哪些细胞学标本最适合进行免疫组化检查:细胞块?风干的涂片?酒精固定的涂片?脱色后的涂片是否适用?
简答:理论上,包括细胞块、酒精固定的涂片、风干涂片等在内的所有细胞学标本均可用于免疫组化检测。福尔马林固定的细胞块最为简洁,但细胞学标本中进行免疫组化,要求有严格的操作流程、对照、质控方案。
详述:细胞学标本中进行高度精确的免疫组化染色非常关键,因为目前高达40%的肺癌是仅由细胞学标本而做出诊断的。细胞学标本免疫组化的差别以及挑战在于前处理方式差异较大,缺乏相应评分方案中所需的组织结构及构型。
一般可将细胞学标本粗略的分为“细胞块”与“非细胞块”。细胞块是最易于进行免疫组化的细胞学标本,且大部分免疫组化方案均适用于福尔马林固定、石蜡包埋的标本。理论说来,可以在自动免疫组化染色设备上采取和福尔马林固定、石蜡包埋组织学标本相同的操作流程。不过,对于细胞块免疫组化而言,最大的问题在于缺乏固定前、以及制备过程中的内对照。
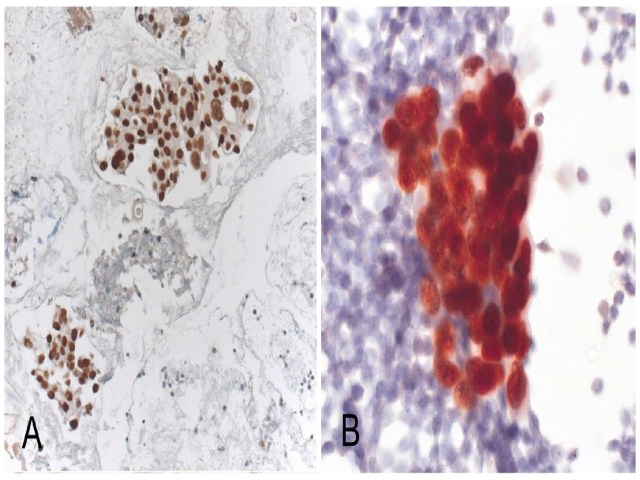
图14. 左图为细胞块标本,TTF-1阳性的腺癌;右图为乙醇固定、巴氏染色的非细胞块标本,TTF-1阳性的腺癌。
目前实际应用中的细胞块制备方案有十几种,美国最常用的有血浆凝血酶法(plasma thrombin)、Histogel法、Cellient自动化细胞块系统(Cellient automated cell block system)以及在这几种方法上进行的改良。几乎所有方案最终均为10%的福尔马林缓冲液固定并处理成石蜡包埋的组织块。固定前的处理有很多不同,仅就固定而言也有酒精固定、醇基固定、甚至有的直接固定在95%的酒精中。
尽管细胞块制备方案有诸多的不同,但此前的研究表明似乎并未导致相应免疫组化中出现系统性问题;最近有研究表明前处理因素可能会导致某些问题,尤其对于酒精固定或甲醇固定来说更是如此。此外,不同的制备方案也会影响多种抗体的表达情况。
非细胞块的细胞学标本也包括多种情况,如风干的涂片、酒精固定的涂片,以及某些商用试剂盒和液基法(如离心涂片、ThinPrep、SurePath)。它们的前处理和制备方法相互之间也有很大差异,因此这方面的标准化比细胞块的标准化难度更大。这方面进行免疫组化最多的为酒精固定的涂片或离心涂片,很多实验室通过这样的方法、巴氏染色后进行肺癌诊断。巴氏染色之前的处理对于免疫组化染色没有不利影响,因此可以将涂片分为三份,分别进行巴氏染色、免疫组化和其他特殊染色。此外,风干的涂片及丙酮或福尔马林固定的未染色涂片也可用于免疫组化。如涂片中有肿瘤成分,在做免疫组化之前最好先采图或扫描作为存档。
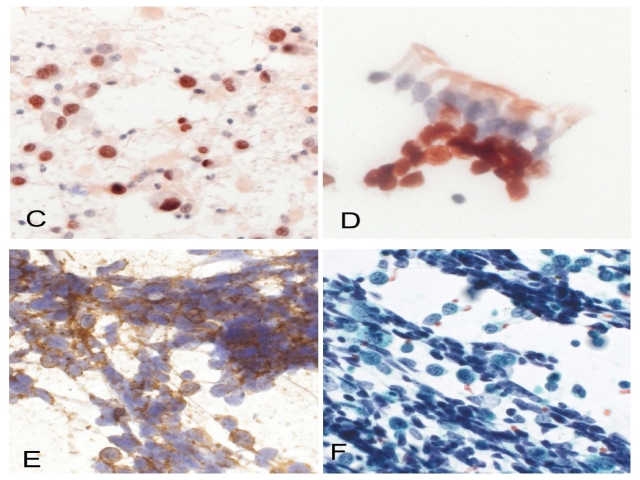
图15. 乙醇固定、巴氏染色的非细胞块标本。左上图为p40阳性的非角化型鳞状细胞癌;右上图为p40阳性、增生的良性基底细胞,伴呼吸道纤毛上皮(此为纤支镜刷片)。左下图为CD56阳性小细胞癌,右下为左下图对应的巴氏染色标本。
细胞块或非细胞块免疫组化实际应用中,制定详细的质控方案、并持续改进非常关键,尤其酒精固定的非细胞块标本,因为这类标本前处理变化太多,且尚无标准化方案。室间质控对于组织学标本、细胞学标本的免疫组化质量都很重要。
10.肺黏液性腺癌和类似的转移性病变鉴别时,推荐什么免疫组化指标:
简答:肺黏液性腺癌和类似的转移性病变鉴别时,尚无可用免疫组化指标。这种情况下,关键在于临床、病理多学科讨论。
详解:胃肠道及胰腺胆道系统腺癌转移至肺时,可出现显著黏液特征。此外,卵巢、乳腺及其他器官的黏液癌也可转移至肺。这些情况下仅凭形态学与肺原发黏液腺癌的鉴别可能很有难度,也有多个小组对这种情况下免疫组化的作用进行了研究。胰腺来源转移性腺癌和肺部浸润性黏液腺癌的鉴别更是困难,二者的免疫表型非常相似(均局灶表达CK20、CDX2);此外,浸润性黏液腺癌中特征性的贴壁生长,也常见于转移至肺的胰腺导管腺癌。即使经分子检测,也无法完全解决类似的鉴别诊断问题。另外需要指出的是,肺黏液腺癌(包括浸润性黏液腺癌)中很大一部分并不表达TTF-1和/或Napsin-A;但肿瘤内陷入的II型肺泡上皮可以正常表达,此时不要误判为阳性。
表2.肺原发黏液腺癌与相关鉴别诊断的免疫组化要点
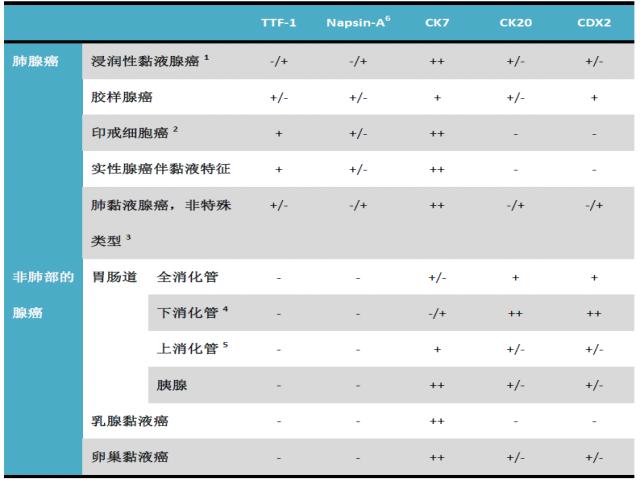
备注:各指标的结果中,–指阳性可能<10%;-/+指阳性可能10-40%;+/-指阳性可能40-70%;+指阳性可能70-90%;++指阳性可能大于90%;
1.包括了黏液腺癌和非黏液腺癌混合在一起的情况;
2.腺癌伴印戒细胞特征;
3.结肠及阑尾;
4.食管、胃及壶腹部;
5.所用抗体为单克隆抗体。
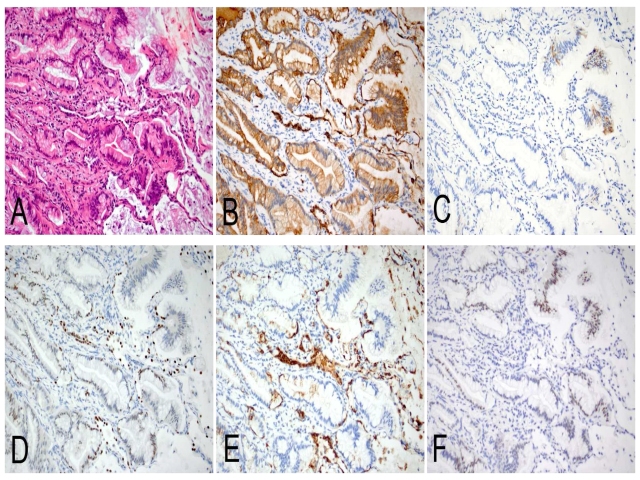
图16. 呈贴壁样及腺泡状的肺浸润性黏液腺癌一例(A);免疫组化CK7弥漫阳性(B),CK20局灶阳性(C),TTF-1(D)及Napsin-A(E)散在弱阳性,CDX2弱至中等阳性(F)。需要注意的是,陷入的II型肺泡上皮也表达CK7、TTF-1、Napsin-A。
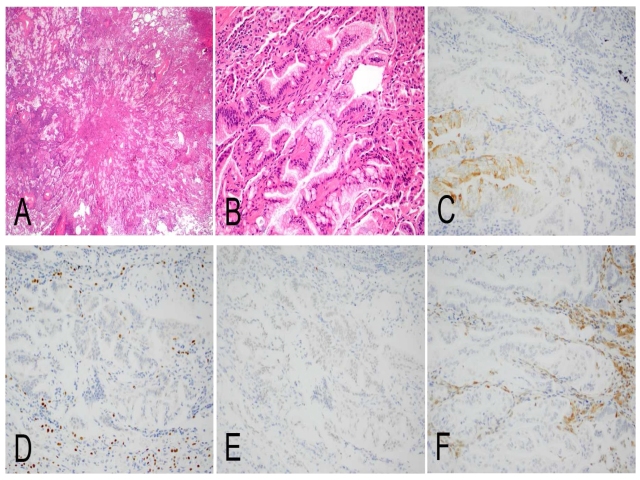
图17. 胰腺导管腺癌转移至肺部、并呈贴壁样生长一例。免疫组化CK7局灶阳性(C)、TTF-1阴性(D),CDX2弥漫弱阳性(E),SMAD4表达缺失(F)。需要注意的是,陷入的肺泡上皮细胞核TTF-1强阳性,不要误判为肿瘤阳性。有报道称SMAD4表达缺失可用于胰腺癌的诊断;但很大比例的肺部浸润性黏液腺癌也有该异常。
如所用Napsin-A抗体为多克隆性,判断肺部来源时候也可能不会有很高的特异性。有一项研究表明应用多克隆抗体时13例非肺来源的黏液腺癌中92%表达Napsin-A,8例肺黏液腺癌100%表达Napsin-A;而应用单克隆抗体时,前者无一表达,后者比例仅为38%。也有研究称应用多克隆抗体时,49例非肺来源的黏液腺癌无一表达Napsin-A,因此前述研究中特异性差可能与所用免疫组化平台有关。此外,多克隆Napsin-A在黏液腺癌中的非特异性着色表现为核旁区,而非单克隆抗体时的全胞质、颗粒状着色。
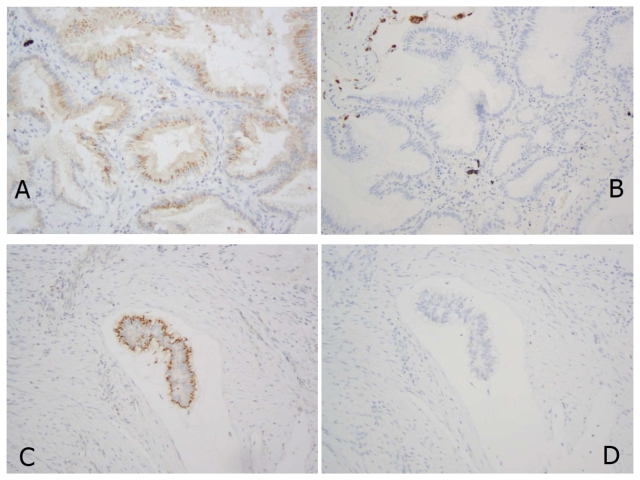
图18. 非肺部来源的癌中,多克隆Napsin-A(A为转移性胰腺导管癌,C为阑尾腺癌,所用抗体为多克隆性)可出现胞质顶端的颗粒状着色,而单克隆抗体则不着色(B、D分别对应A、C,但所用抗体为单克隆性)。
肺部浸润性黏液腺癌、及其他伴黏液特征的腺癌(尤其不表达TTF-1者)可表达HNF4α。不过,该指标为分化型转录因子,包括肝胆及胃肠道在内的原肠均广泛表达该因子,因此无助于肺黏液腺癌和胃肠道及胰腺原发黏液腺癌的鉴别。
其他转移性黏液腺癌、如乳腺及卵巢来源的,与肺部原发黏液腺癌的鉴别可通过免疫组化,如乳腺黏液癌表达GATA3、ER,卵巢黏液癌表达PAX8。不过,尽管文献中结果令人鼓舞,但实际工作中并不那么理想:并非所有的转移癌都会理想的表达相关标记!比如卵巢黏液癌,仅有40%会表达PAX8,因此类似鉴别时的敏感性较低。
未完待续
点击下载英文文献
参考文献
YatabeY,DacicS,BorczukAC,etal.Best Practices Recommendations for Diagnostic Immunohistochemistry in Lung Cancer[J].Journal of thoracic oncology,2018.
DOI:10.1016/j.jtho.2018.12.005



















共0条评论