编译整理:强子
肺癌免疫组化解惑答疑(2)
肺癌免疫组化解惑答疑(3)
肺癌免疫组化解惑答疑(4)
肺癌免疫组化解惑答疑(5)
肺癌免疫组化解惑答疑(6)
近几十年来,免疫组化领域取得了显著进步,如新型抗体的开发、增强显色技术的应用等,都使得免疫组化向着更敏感、更特异的目标前进;而免疫组化方面的进展,则使得该技术在临床诊断和治疗方面越来越重要。具体如肺癌:自2015年世界卫生组织肺癌分类中首次将免疫组化引入分类方案以来,免疫组化已成为肺癌诊断中不可或缺的技术手段,尤其小活检标本或细胞学标本、低分化肿瘤等情况下。
俗话说的好,“能力越强,责任越大”,由于免疫组化在肺癌的准确诊断及分类中作用极大,因此实际工作中存在相应“陷阱”及某些“注意事项”。有鉴于此,国际肺癌研究协会(International Association of Lung Cancer Study,IASLC)病理委员会选择了日常工作中肺癌诊断免疫组化最常遇到的一些问题,在结合文献、专家经验、委员会成员内部讨论基础上,达成了一定共识,并整理成文发表在国际肺癌研究协会官方期刊《Journal of Thoracic Oncology》。
为帮助大家更好的了解相关问题,并用于指导日常工作,我们将该文中要点编译介绍如下。
1.日常工作中,(非小细胞肺癌)免疫组化标记的最佳组合是什么?
简答:需要通过免疫组化对非小细胞肺癌进行分类时,金标准为TTF-1加p40;实际工作中,如无神经内分泌分化的形态特点,这两项指标一般即足以解决问题。对鳞状细胞癌的诊断来说,p40优于p63。
详解:免疫组化需结合临床及组织学所见来选择。对于已确定为肺原发的非小细胞肺癌来说,最主要就是鉴别腺癌和鳞癌;这种情况下,本文推荐选择TTF-1加p40。
Napsin-A可作为腺癌标记的第二选择项,但与相应手术切除标本进行比较时,TTF-1优于Napsin-A;当然二者结合,敏感性会更高。虽有研究称Napsin-A的敏感性优于TTF-1,但由于后者为细胞核着色,解读相对直观,且Napsin-A单克隆和多克隆抗体间的染色有一定差异(详见后述),因此本文还是推荐了TTF-1。需要指出的是,对于TTF-1阳性非小细胞肺癌来说,Napsin-A在神经内分泌肿瘤的分类中有一定价值,因为某些分子特点类似腺癌的大细胞神经内分泌癌可有Napsin-A的阳性表达,这一特征有助于将这部分肿瘤和高级别神经内分泌肿瘤(如小细胞癌)区别开来,后者一般为Napsin-A阴性。
P40抗体出现之前,鳞状细胞癌的免疫组化标记最常用为p63。P40针对的是p63的剪接变异体(splice variant),其敏感性和特异性均优于p63。高达20-30%的肺腺癌可表达p63,一般为少数细胞的弱至中等阳性,罕见病例中可出现弥漫阳性,也包括ALK阳性腺癌在内。P63阳性还可见于某些肉瘤、肌上皮瘤、淋巴瘤。TTF-1阴性、p63阳性时,即使其着色为弥漫阳性,也不要武断的判定为鳞状细胞癌,因为如后续p40阴性,则倾向于诊断为非小细胞肺癌-非特殊类型。P63阳性肺腺癌、肉瘤、淋巴瘤中p40阳性的可能性很小,但偶有肺腺癌病例会出现p40局灶弱阳性,因此该指标的阳性判定也是有一定要求的,详见后述。
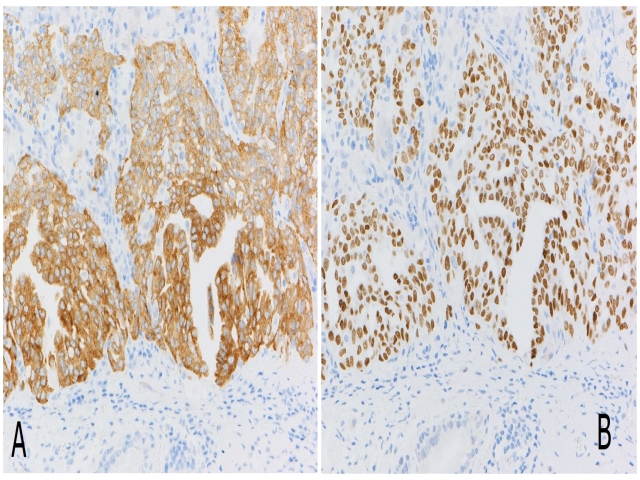
图1. 一例ALK阳性的肺腺癌(左);ALK阳性肺腺癌中,大多都会如本例一样,同时表达TTF-1(右)。
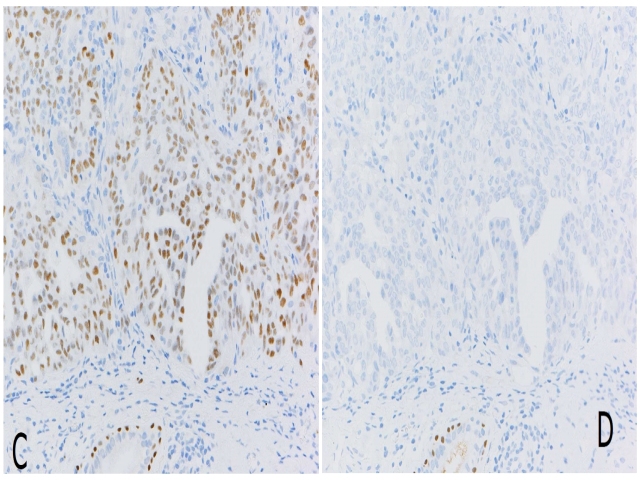
图2. 另一例ALK阳性肿瘤,但同时出现了p63(左)和p40(右)的表达不一致;这可能是p63单独用作鳞癌标记的陷阱之一。
如肺腺癌中Napsin-A作为TTF-1的“备胎”一样,对于考虑鳞癌而诊断疑难的病例,可联合应用p40、p63、CK5/6。
2.TTF-1和p40怎么样的着色才应判定为阳性?
简答:TTF-1局灶着色即可视为阳性,一定的临床背景下可提示肺腺癌;p40则应在50%以上的肿瘤细胞核着色时才判定为阳性,局灶、弱阳性不能据此诊断鳞状细胞癌。
详解:与其他免疫组化指标一样,TTF-1的敏感性和特异性也取决于所用抗体的克隆(详见后述)、检测方案及显色方案等。大部分研究中,75-80%的肺腺癌表达TTF-1,但伴黏液特征的腺癌则不表达。
TTF-1局灶着色即可视为阳性,一定临床背景下即可提示腺癌;对于肿瘤细胞仅局灶表达TTF-1、且具有TTF-1阴性实性成分的病例,应进行p40检测以排除腺鳞癌分化的可能。
与TTF-1不同,p40局灶弱阳性不能诊断为鳞状细胞癌,因为腺癌及其他肿瘤中也可有p40的局灶阳性。P40的阳性判断阈值应为50%以上的肿瘤细胞核阳性;10%以下的阳性不能作为诊断依据;10-50%阳性则需结合临床情况、着色程度等进一步讨论。需要注意的是,角化成分一般不表达p40,因此这部分的阴性并不能排除鳞状细胞癌。当然,角化是鳞状细胞癌的诊断标准之一,有角化的时候可能就无需免疫组化了。对于无法明确的病例,2015年世界卫生组织分类中建议诊断为非小细胞肺癌-非特殊类型,但这一名称应尽量少用。
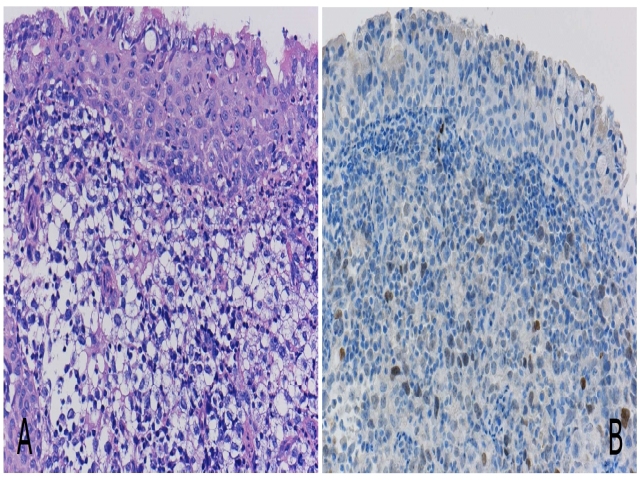
图3. 一例局灶表达TTF-1的肺癌病理:组织学瘤细胞呈透明细胞分化(左),该例中TTF-1可评判为阳性,因此该肿瘤应诊断为“非小细胞肺癌,倾向于腺癌”。
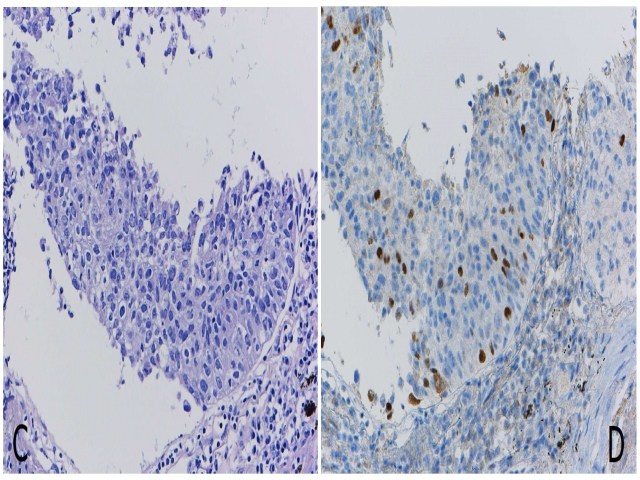
图4. 形态分化无法明确为腺癌或鳞癌的一例肺活检(左)。按照p40阳性判断标准,应为50%以上的瘤细胞阳性;该例虽有阳性着色,但为散在,因此不能明确诊断为鳞癌。
另一个重要问题是TTF-1和p40/p63在腺鳞癌中的诊断应用。首先,如果不是切除标本则不能诊断腺鳞癌;但小活检标本中如有两种细胞类型,则会考虑到腺鳞癌的可能。如两种成分在形态学上可明确为腺癌的腺样结构、角化型鳞状细胞癌,此时可能无需免疫组化来证实。但如果两种成分之一、或两种成分均为实性结构,则要求相应免疫组化指标在不同成分或不同区域中表达。相反,同一类细胞的双阳性(TTF-1、p40/p63)不能称之为腺鳞癌;这种情况最好诊断为非小细胞肺癌、倾向于腺癌。抗体的某些克隆会产生这种着色结果,详见后述。
另一种情况为靶向治疗后的EGFR突变型腺癌复发后表现为纯粹的鳞状细胞癌(p40阳性、TTF-1阴性)而仍有EGFR突变,有时会出现新的T790M突变。这种组织学类型的转化可能是酪氨酸激酶抑制剂耐药机制的反映。
未完待续
点击下载英文文献
参考文献
YatabeY,DacicS,BorczukAC,etal.Best Practices Recommendations for Diagnostic Immunohistochemistry in Lung Cancer[J].Journal of thoracic oncology,2018.
DOI:10.1016/j.jtho.2018.12.005

















共0条评论