7、分化不确定的肿瘤
01. 浅表血管粘液瘤
定义
浅表血管粘液瘤是一种浅表组织的粘液性肿瘤,由轮廓清晰的小叶组成,小叶含有细胞学温和的梭形细胞到星状细胞、薄壁的弯曲血管,位于大量的粘液样间质中。
ICD-O编码
8841/0浅表血管粘液瘤
ICD-11编码
2F7C&XH58A9结缔组织或其他软组织的行为不确定的肿瘤&浅表血管粘液瘤
相关命名
可接受:皮肤粘液瘤
亚型
无
部位
浅表血管粘液瘤出现在真皮和/或外阴皮下浅层。
临床特征
浅表血管粘液瘤通常表现为生长缓慢、无痛、常为外生性病变。大多数小于5cm。
流行病学
患者通常处于生育年龄。
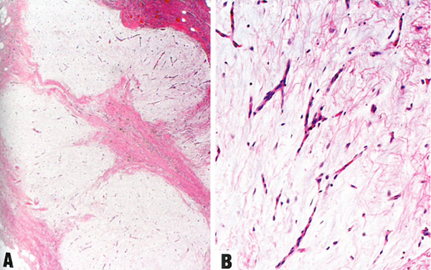
图13.24浅表血管粘液瘤。A 肿瘤通常显示粘液样小叶,界限清楚。B 肿瘤的特征是由温和的梭形细胞和弯曲血管组成,位于丰富的粘液间质中。
病因
未知
发病机制
如果呈多灶性,浅表血管粘液瘤可能是Carney综合征的表现之一。Carney综合症是一种常染色体显性遗传性疾病,通常由PRKAR1A(17q24)突变引起,少数由2p16的改变引起。Carney综合病包括一系列皮肤色素沉着异常、内分泌肿瘤或紊乱、粘液瘤、砂粒性黑色素神经鞘瘤和睾丸大细胞钙化性Sertoli细胞肿瘤。
大体检查
浅表血管粘液瘤通常为息肉样,切面呈胶状分叶状。
组织病理学
浅表血管黏液瘤的特征是由梭形和星状细胞以及薄壁弯曲血管组成的轮廓清晰的粘液样小叶的多结节增生。这些细胞具有卵圆形到圆形的核和细长的胞质突起,通常缺乏细胞异型性和核分裂象活性,并且通常伴有中性粒细胞浸润。尽管有些肿瘤具有混合的上皮成分(如陷入的鳞状上皮巢或附件结构),但没有明显浸润邻近组织的证据。肿瘤局限于皮肤部位的真皮和/或皮下组织,或粘膜部位的固有层。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要:仅累及浅表组织;非浸润性生长;粘液样间质小叶,细胞学温和,梭形至星状细胞;弯曲血管;间质中性粒细胞。
分期
无临床相关性
预后和预测
大约30%的肿瘤复发。完全切除可以降低局部非破坏性复发的风险。
02. 深部(侵袭性)血管粘液瘤
定义
深部(侵袭性)血管粘液瘤是一种浸润性良性粘液样梭形细胞肿瘤,发生在盆腔区深部软组织。
ICD-O编码
8841/0侵袭性血管粘液瘤
ICD-11编码
2F7C&XH4V74结缔组织或其他软组织的行为不确定的肿瘤&侵袭性血管粘液瘤
相关命名
可接受:深部血管粘液瘤;侵袭性血管粘液瘤
亚型
无
部位
这种肿瘤最常见于女性外阴阴道、会阴和骨盆区的深层软组织。
临床特征
患者通常出现大的无痛肿块或界限不清的肿胀。妊娠期间可能出现快速生长。最初的临床印象通常是前庭大腺囊肿或疝。罕见的肿瘤有蒂。肿瘤通常比临床检查时最初可察觉的要大得多,延伸得更深。
流行病学
深部(侵袭性)血管粘液瘤通常发生在育龄妇女,中位年龄40岁左右。
病因
未知
发病机制
HMGA2编码一种重要的转录调控DNA结构因子。HMGA(12q14.3)位点的重排大约见于三分之一的肿瘤,可能是基因内或基因外的。重排伴侣包括1、5、7、8、11、21号染色体,11q22.1处的YAP1被鉴定为新的融合伴侣。RT-PCR研究证实,在表现出HMGA2位点重排的深部血管粘液瘤中存在异常的HMGA2转录表达。
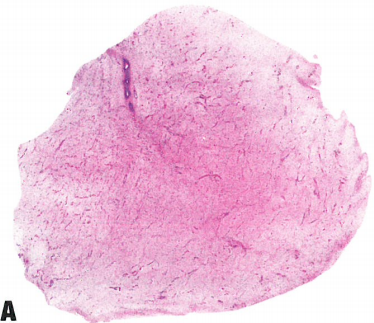
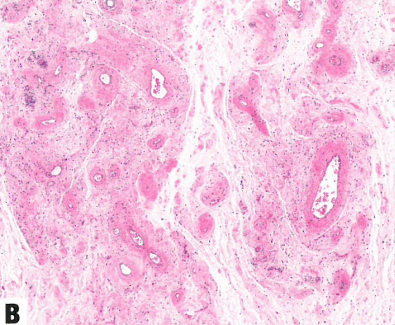
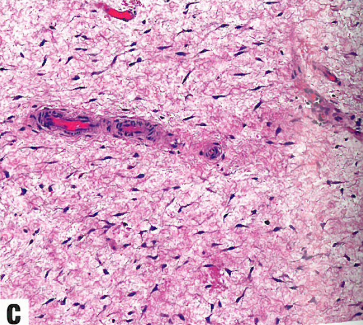
图13.25深部(侵袭性)血管粘液瘤。A 特征是细胞稀少,由温和的梭形细胞组成,位于丰富的粘液样间质中,间质有明显的血管。B 中到大口径血管,壁厚。请注意,不同口径的血管周围包裹着特殊的肌样束。C 肿瘤特征是细胞稀少,由温和的梭形细胞组成,位于丰富的粘液样间质中,散布着中到大血管。
大体检查
肿瘤通常边界不清,不规则地延伸到周围组织。大小不一,但通常较大(>10cm),切面有光泽,凝胶状至纤维凝胶状。可能存在血管充血、出血或纤维化区域。
组织病理学
侵袭性血管粘液瘤是一种均匀的少细胞肿瘤,由小的椭圆形、梭形和星状细胞组成,散布分布于大量的疏松黏液样间质中,间质含有细小的胶原纤维。核分裂象活性和核异型几乎不存在。间质通常含有中等大小的血管,其中一些血管具有厚的肌壁或透明变性。血管周围常见纤细的胶原纤维和平滑肌束。肿瘤缺乏包膜,常见浸润周围软组织,其特征是肌肉、神经和脂肪组织的陷入。
免疫组化,肿瘤细胞通常表达desmin、SMA、ER和PR,CD34反应性各不相同,但S100呈阴性。大多数病例中存在HMGA2核阳性。CDK4呈阳性,但MDM2阴性。Ki67增殖指数低(<1%的肿瘤细胞)。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:边界不清;粘液样间质中形态温和的梭形细胞呈均匀的少细胞增殖;中大血管,通常透明变性。
理想标准:血管周围有平滑肌细胞束和细小的纤维胶原聚集
分期
无临床相关性
预后和预测
多达30-40%的病例局部复发,有时在初次切除后多年(通常是几十年)复发,通常是在肿瘤最初未完全切除的情况下。充分的局部切除可能很困难,因为肿瘤延伸到邻近组织的程度可能比临床检查所认识到的要大。因此,建议进行广泛的局部切除(切缘1cm)。GnRH激动剂疗法已成功用于治疗不可切除的原发性或复发性肿瘤。
01. 上皮样肉瘤
定义
上皮样肉瘤是一种恶性间叶性肿瘤,表现出部分或完全呈上皮样细胞形态和免疫表型。已认可两种临床病理亚型:经典(或远端)型的特征是往往位于肢端部位和假肉芽肿生长模式;近端型(大细胞)亚型主要出现在近端/躯干区域,由巢状和片状的上皮样大细胞组成。
ICD-O编码
8804/3上皮样肉瘤
ICD-11编码
2B5F.2&XH4F96其他特指性部位的未归入其他部位的肉瘤&上皮样肉瘤
相关命名
无
亚型
经典型上皮样肉瘤(也称为传统型上皮样肉瘤或远端型上皮样肉瘤);近端型或大细胞上皮样肉瘤
部位
在女性生殖道内,外阴是最常见的部位。
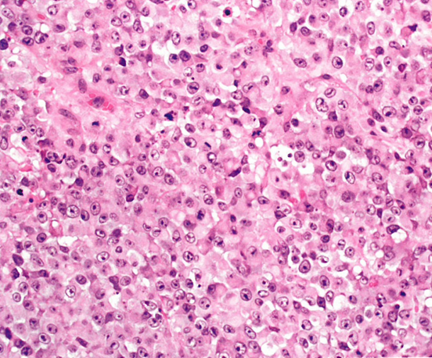
图13.27近端型上皮样肉瘤是女性生殖道最常见亚型,由具有丰富嗜酸性胞质的多边形细胞片组成,常见横纹肌样包含体。
临床特征
患者通常会出现快速增长的肿块。
流行病学
上皮样肉瘤少见,大多数累及外阴的肿瘤都是近端型。患者的年龄范围很广,发病高峰年龄30-50岁。
病因
未知
发病机制
SMARCB1(INI1)是SWI/SNF复合物的一部分,其表达缺失是这些肿瘤的恒定特征,可能是这些肿瘤中最早的遗传事件。上皮样肉瘤可以有复杂的核型。除了SMARCB1(INI1)的缺失外,发病机制在很大程度上尚不清楚
大体检查
肿瘤通常小于6cm,切面呈灰白色,可能是多结节。可能出现出血和/或坏死。
组织病理学
经典型上皮样肉瘤由上皮样和梭形肿瘤细胞形成细胞丰富的结节,伴中心变性和/或坏死,其生长模式有点像肉芽肿。坏死结节的融合,形成中心地图样坏死的匐行性肿块。近端型可有弥漫性或多结节性生长模式,通常累及皮下和深层软组织。在外阴,大多数病例为近端型,肿瘤细胞大,具有丰富的嗜酸性胞质和偏心核,核呈空泡状,核仁明显。常见横纹样包含体。粘液样间质可能局部存在或(罕见病例)占主导地位。此外,上皮样肉瘤的罕见病例表现出兼有经典型和近端型的杂合组织学特征。
免疫组化,肿瘤细胞表达CK、EMA和vimentin,SMARCB1(INI1)表达缺失。大约半数病例表达CD34,偶尔表达actin和desmin。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:上皮样细胞伴丰富的嗜酸性胞质,弥漫性或结节状生长;一定程度的EMA或CK阳性,和SMARCB1(INI1)表达缺失。
理想标准:CD34表达,通常为局灶性。
分期
分期与躯干四肢其他肉瘤的分期相似。
预后和预测
近端型上皮样肉瘤比传统(远端)型上皮样骨肉瘤的侵袭性更强,复发率和转移率更高。
02. 腺泡状软组织肉瘤
定义
腺泡状软组织肉瘤(ASPS)是一种罕见的组织起源不确定的肿瘤,主要影响四肢的深部软组织,其特征是不同程度失粘附性上皮样细胞排列成巢状,导致独特的腺泡状结构。其特征是特异性易位der(17)t(X;17)(p11.2;q25),导致ASPSCR1-TFE3基因融合。
ICD-O编码
9581/3腺泡状软组织肉瘤
ICD-11编码
2B5F2&XH8V95其他特指性部位的未归入其他部位的肉瘤&腺泡状软组织肉瘤
相关命名
无
亚型
无
部位
生殖道中最常见的部位包括子宫体和子宫颈、阴道和外阴。
临床特征
患者出现与子宫、阴道或外阴肿块相关的非特异性体征和症状。
流行病学
ASPS很少累及女性生殖道,最常见于10-40岁患者。
病因
未知
发病机制
ASPS的特征是不平衡的der(17)t(X;17)(p11.2;q25)易位,导致ASPSCR1和TFE3基因融合。
大体检查
肿瘤的切面呈黄褐色或灰色,偶尔伴有出血和/或坏死。
组织病理学
ASPS通常表现为具有细胞巢的分叶状结构,肿瘤细胞填充或占据细胞巢的中心;和/或表现为腺泡状结构,腺泡中央的肿瘤细胞粘附性丧失,形成细胞之间的空隙。一些肿瘤显示纯粹的成片生长。在分叶状肿瘤中,单个巢周围有明显的血窦样血管系统。可有细胞外透明变性,通常存在于局部。传统上,细胞不粘附,呈均匀的多边形,有丰富的颗粒状嗜酸性胞质,核圆形,居中或偏心,核仁明显。少数细胞有广泛的透明胞质。核分裂象少见。一些肿瘤具有PASD阳性的胞质内矩形或菱形晶体。免疫组化,所有肿瘤均呈TFE3弥漫性强阳性。罕见病例表达肌肉标记物或局部表达HMB45。
细胞学
在细胞学标本中,涂片显示大细胞,主要为单个细胞,具有颗粒或空泡。
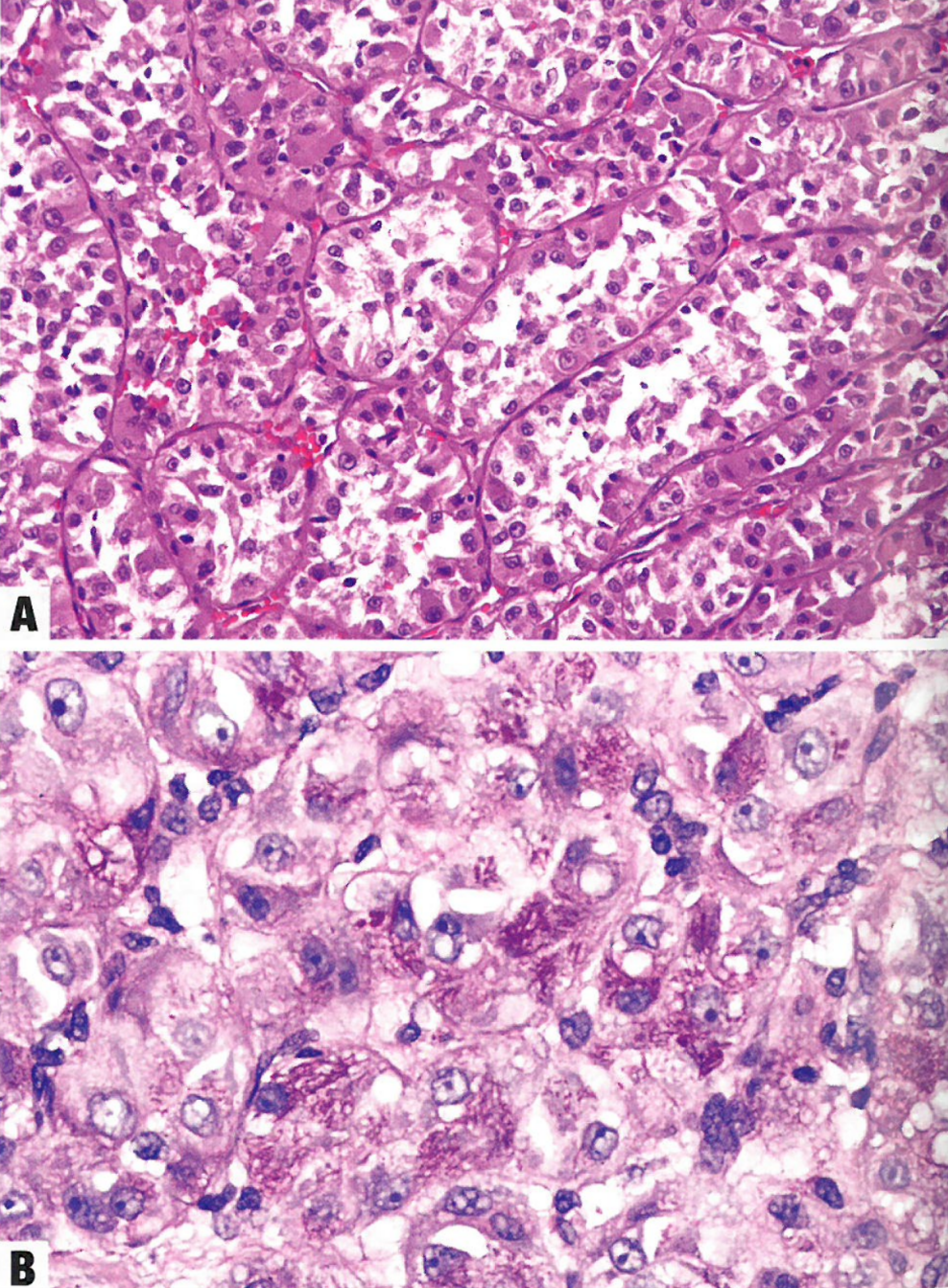 图13.28腺泡状软组织肉瘤。A富含胞质的嗜酸性肿瘤细胞形成典型的器官样巢状结构。B PASD染色。位于中央的一个大细胞显示细长的杆状胞质内结晶体,呈鞘状排列;许多周围细胞显示胞质内PAS阳性、耐淀粉酶颗粒。
图13.28腺泡状软组织肉瘤。A富含胞质的嗜酸性肿瘤细胞形成典型的器官样巢状结构。B PASD染色。位于中央的一个大细胞显示细长的杆状胞质内结晶体,呈鞘状排列;许多周围细胞显示胞质内PAS阳性、耐淀粉酶颗粒。
诊断分子病理学
证实TFE3重排或ASPSCR1-TFE3融合转录物可能有助于诊断。
诊断标准
必要标准:巢状、假腺泡状或成片生长;不粘附的细胞伴透明至嗜酸性颗粒状胞质;核分裂象少。
理想标准:免疫组化检测TFE3核表达(弥漫强阳性);PAS阳性胞浆内矩形或菱形晶体;有选择的病例鉴定der(17)t(X;17)(p11.2;q25)或ASPSCR1-TFE3。
分期
ASPS根据国际癌症控制联盟(UICC)肉瘤分期系统进行分期。
预后和预测
ASPS会晚期复发,有时在诊断后几十年复发。尽管数据有限,但女性生殖道出现的肿瘤可能比其他部位的肿瘤预后更好。迄今为止,只有一例文献报道的子宫体转移病例(转移到盆腔淋巴结)。
8、未分化小圆细胞肉瘤
01. 尤因肉瘤
定义
尤因肉瘤(Ewing sarcoma)是一种小圆细胞肉瘤,涉及FET基因家族成员(通常是EWSR1)和ETS转录因子家族成员的基因融合。
ICD-O编码
9364/3尤因肉瘤
ICD-11编码
2B52&XH8KJ8尤因肉瘤,原发部位&外周神经外胚层肿瘤(包括尤因肉瘤)
相关命名
不推荐:外周型原始神经外胚层肿瘤
一些以前被认为是尤因肉瘤亚型(尤因样肉瘤)的小圆细胞肉瘤在遗传学和临床上是不同的实体,包括CIC融合和BCOR重排肉瘤,这在《软组织和骨肿瘤WHO分类》第五版中有详细描述。
亚型
无
部位
宫颈、阴道和外阴
临床特征
宫颈、阴道或外阴肿块是女性生殖道最常见的表现。
流行病学
尤因肉瘤是极为罕见的病变,累及外阴的频率高于阴道和宫颈。影响绝经前女性,中位年龄为29岁(范围:10-65岁)。
病因
据报道,儿科患者存在罕见的易感种系突变。
发病机制
大多数肿瘤含有t(11;22)(q24;q12),导致EWSR1(EWS)和FLI1融合。
大体检查
肿瘤呈质软、有边界、无包膜的肿块,切面均匀和/或结节状、分叶状。
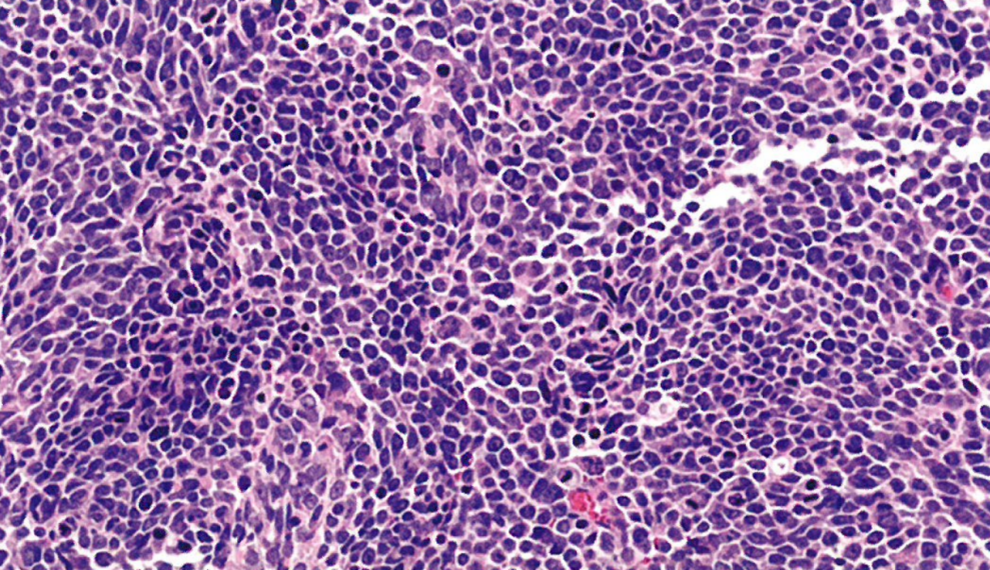 图13.29尤因肉瘤。小圆细胞成片排列,胞质稀少、嗜酸性,核深染,核分裂象活跃。
图13.29尤因肉瘤。小圆细胞成片排列,胞质稀少、嗜酸性,核深染,核分裂象活跃。
组织病理学
肿瘤由形态单一的小圆形细胞组成,排列成片或实性聚集,由纤维分隔。有时出现局灶性菊形团。核圆形,染色质粗糙,有小核仁。胞质稀少至丰富,嗜酸性或透明。核分裂象活跃,坏死常见。免疫组化,CD99呈弥漫性强阳性膜表达,FLI1呈核表达。常见广谱CK局灶阳性。desmin、myogenin和MYOD1均为阴性。
细胞学
细针穿刺标本中细胞丰富,由核深染、胞质稀少的单一小细胞组成。
诊断分子病理学
在大多数肿瘤中检测到EWSR1(EWS)-FL/1融合,但管也可能遇到其他变异型。
诊断标准
必要标准:小细胞形态;CD99膜阳性;证实EWSR1-FL1或变体融合(如有条件)。
分期
分期与相应部位的其他软组织肿瘤相同。
预后和预测
预后因素包括就诊时的分期、肿瘤位置、肿瘤大小、患者年龄和对治疗的反应。分子学检测确诊的病例中,大多数患者在完全手术切除后没有疾病迹象。外阴皮肤原发性尤因肉瘤的预后可能较好。
往期回顾:
WHO女生5ed第13章 下生殖道间叶性肿瘤(一)
WHO女生5ed第13章 下生殖道间叶性肿瘤(二)
WHO女生5ed第13章 下生殖道间叶性肿瘤(三)




















共0条评论