10. NTRK重排梭形细胞肿瘤(新增)
定义
NTRK重排梭形细胞肿瘤是一种低级别梭形细胞肉瘤,携带NTRK基因重排
ICD-O编码
无
ICD-11编码
无
相关命名
不推荐:宫颈的低级别纤维肉瘤;神经纤维肉瘤
亚型
无
部位
宫颈和/或子宫下段
临床特征
大多数患者表现为阴道出血或宫颈肿块。
流行病学
NTRK重排宫颈肉瘤患者的年龄范围为23至44岁(平均31岁)。
病因
未知
发病机制
除了与NTRK重排有关外,这些肿瘤的发病机制尚不清楚。
大体检查
肿瘤的中心通常位于宫颈间质,通常表现为质硬、略带肉样的病变。大小3-12cm。类似的病变可能累及子宫。
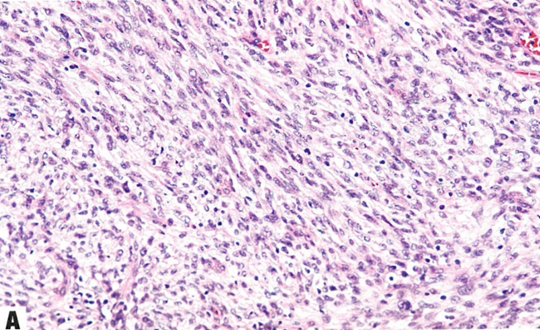
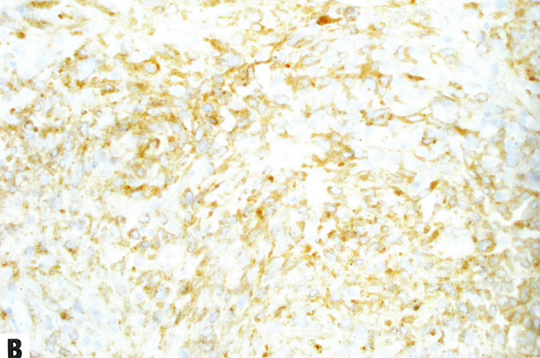
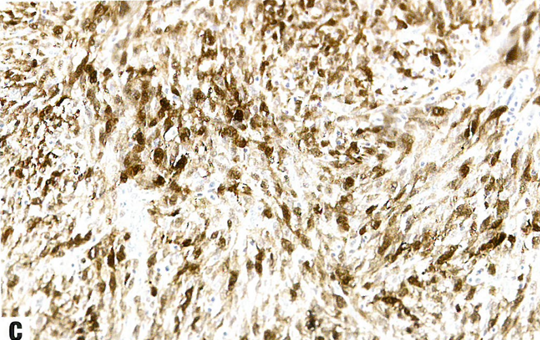
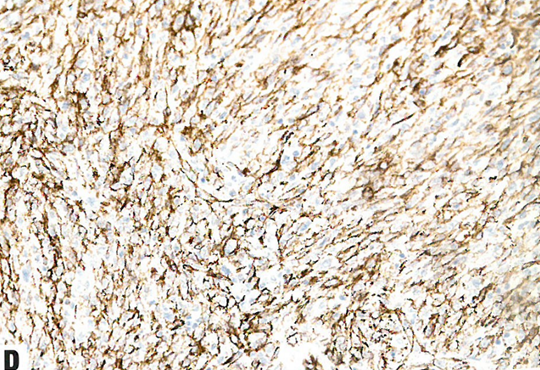
图13.13 NTRK重排肉瘤。A 这例宫颈肿瘤显示杂乱的轻度异型性梭形细胞。B TRK弥漫阳性。C S100阳性。D CD34阳性。
组织病理学
宫颈的NTRK重排肉瘤主要表现为形态一致的梭形细胞增殖,具有轻度至中度异型性和不明显的核仁。可能散在非典型合胞体样细胞。核分裂象计数多少不等(1-50个核分裂象/mm2)。可有鹿角状血管模式和坏死。迄今为止,尚无淋巴管或血管侵犯的报道。梭形细胞表达S100、CD34、TRK和cyclin D1。重要的是,不表达CD10、desmin、BCOR、ER或PR。
细胞学
无临床相关性
诊断分子病理学
证实NTRK重排有诊断价值。
诊断标准
必要标准:梭形细胞,核卵圆形,胞质稀少;梭形细胞表达S100和CD34;NTRK重排。
分期
NTRK重排肉瘤的分期方式与其他宫颈肉瘤相同。
预后和预测
宫颈的NTRK重排肉瘤的临床病程不一致,但至少有些肿瘤具有转移和侵袭性临床病程。数据有限,但较年长患者似乎有更高的疾病进展风险。文献报道的病例数量太低,无法确定预后或预测标记物。
3、血管肿瘤
01. 卡波西肉瘤
定义
卡波西肉瘤(KS)是一种局部侵袭性内皮细胞增殖,通常表现为多个斑块、斑块或结节形式的皮肤病变,但也可能累及粘膜部位、淋巴结和内脏器官。卡波西肉瘤与人类疱疹病毒(HHV8)感染密切相关,是病毒诱导的血管增殖的一个例子。
ICD-O编码
9140/3卡波西肉瘤
ICD-11编码
2B57.Z&XH36A5未指定原发部位的卡波西肉瘤&卡波西氏肉瘤
相关命名
无
亚型
无
部位
卡波西肉瘤可局限于外阴或播散。
临床特征
外阴卡波西肉瘤表现为蓝红色单发或多发性肿块或外生性硬结节,也可能貌似乳头状瘤或脓肿。病变可能无症状,也可能伴有疼痛或瘙痒。
流行病学
病变通常发生在10-40岁,或者很少发生在绝经后。艾滋病(AIDS)相关卡波西肉瘤和经典卡波西肉瘤是常见类型。
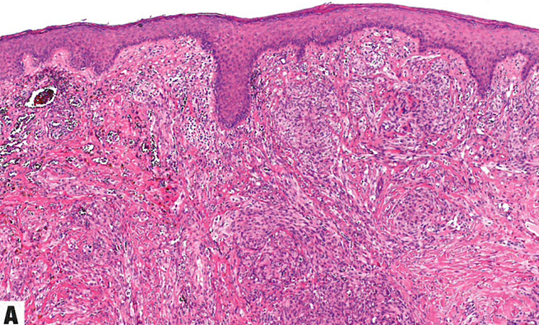
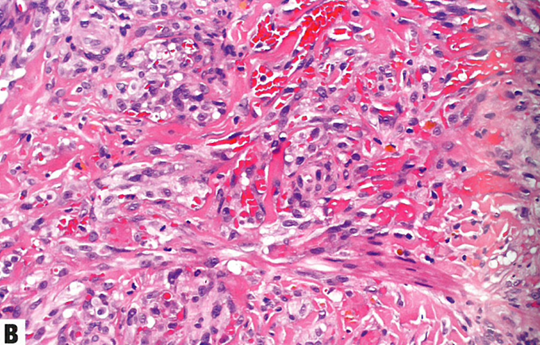
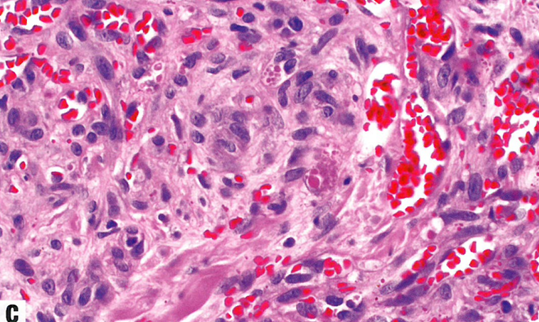
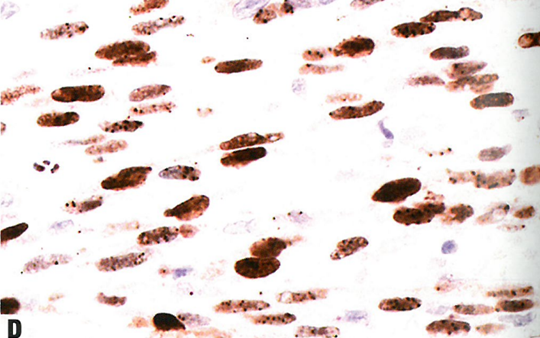
图13.14卡波西肉瘤。A 结节期。真皮因梭形细胞的细胞增殖而显著膨胀,伴小灶出血。还能看到扩张血管和含有红细胞的小的裂隙状腔隙。B 结节期。细胞丰满、形态一致,具有细长的卵圆形至梭形空泡状核。小血管腔散在分布,伴含铁血黄素巨噬细胞。C 偶见透明小球;位于细胞内或细胞外。D 梭形细胞核呈HHV8强阳性。
病因
HHV8(卡波西肉瘤相关疱疹病毒)感染是必需的,但不足以诱发疾病。
发病机制
由遗传、免疫和环境因素之间的复杂相互作用而致病。HHV8是一种主要通过性传播的DNA病毒,可以在所有形式的KS中检测到(>95%的艾滋病相关和不相关病例),其遗传学变异与特定人群有关。
大体检查
卡波西肉瘤表现为大小不等的出血结节或坏死肿块。
组织病理学
在卡波西肉瘤的斑块期,有小的裂隙状血管腔,分割周围的胶原纤维。血管腔内衬扁平至椭圆形内皮细胞,伴轻微异型性或无异型性,与淋巴浆细胞浸润、外渗红细胞和含铁血黄素沉积相混合,有时伴有细胞内/细胞外透明小球。在斑块和结节期,所有特征更明显。鳞状细胞,病变表达内皮标记物(如CD31、CD34、ERG)和淋巴管标记物(如D2-40),HHV8核阳性几乎恒定表达。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:裂隙状血管腔、分割胶原纤维、红细胞外渗和/或含铁血黄素沉积。
理想标准:HHV8免疫组化(有选择的病例)。
分期
无临床相关性
预后和预测
疾病的演变取决于卡波西肉瘤的类型和程度。罕见的转移病例已有报道。
02. 血管肉瘤
定义
血管肉瘤是一种恶性血管肿瘤,它不同程度地再现了内皮细胞的形态和免疫组化特征。
ICD-O编码
9120/3血管肉瘤
ICD-11编码
2B56.Y&XH6264血管肉瘤,其他特指性原发部位&血管肉瘤
相关命名
不推荐:血管肉瘤;淋巴管肉瘤;恶性血管内皮瘤
亚型
无
部位
血管肉瘤在子宫和卵巢更常见,但外阴和阴道也可能受累。
临床特征
患者出现阴道出血、贫血和/或非特异性胃肠道症状。外阴肿瘤可能表现为白色丘疹。
流行病学
患者就诊时的中位年龄为47岁(范围1787岁)
病因
大多数病例是散发性。在一个亚组中,放射治疗和慢性淋巴水肿是易感因素。
发病机制
血管肉瘤具有遗传学异质性。大多数病例都有复杂核型,没有重现性染色体变化。几乎所有的放疗后和慢性淋巴水肿相关的继发性血管肉瘤都发生高水平MYC基因扩增(位于8q24),这罕见于原发性血管肉瘤。
大体检查
大多数肿瘤形成易碎的出血性大肿块,边缘不清,表面溃疡。宫颈的扁平斑块状肿瘤也有报道。
组织病理学
大多数血管肉瘤具有分叶状结构,具有密集的、吻合的流产型血管腔和囊腔;以及成片的梭形和上皮样细胞,伴出血和坏死。肿瘤细胞有多形性,核大、深染。核分裂象通常很多。可有明显的间质透明变性。免疫组化,肿瘤细胞表达CD31、CD34因子VIII和ERG。一些血管肉瘤表达D2-40或CK。ER和PR均为阴性。
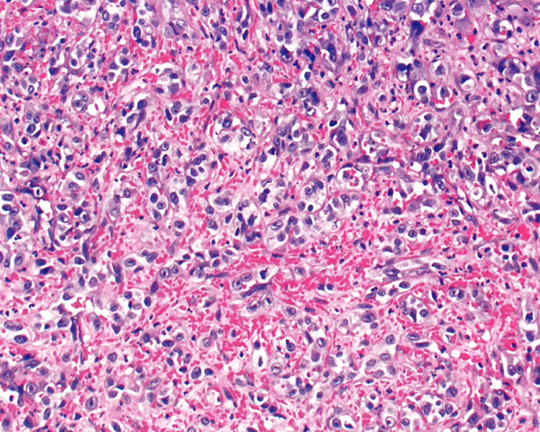
图13.15阴道上皮样血管肉瘤。非典型上皮样细胞,形成不规则血管腔,伴显著出血。
细胞学
无临床相关性
诊断分子病理学
证实MYC扩增可能有帮助,但仅适用于辐射相关或淋巴水肿相关的血管肉瘤。
诊断标准
必要标准:内衬非典型内皮细胞的结构复杂的血管;可见实性模式和上皮样形态。
理想标准:内皮标记物的免疫反应性(有选择的病例)
分期:
不建议对血管肉瘤进行分期,因为它们具有典型的侵袭性自然史,不符合软组织肿瘤分期系统。
预后和预测
与软组织肿瘤的一般情况一样,预后取决于分期(疾病范围)。晚期肿瘤的平均总生存期<30个月。大部分证据来自子宫和宫颈病例。已经证实,上皮样改变、坏死和切缘状态等因素对血管肉瘤的预后具有重要意义,需要在妇科肿瘤进行具体验证。年龄较大的患者、后腹膜部位和较大的肿瘤体积与不良预后有关。最常见的远处转移部位是肺,其次是淋巴结、软组织、骨骼、肝脏和其他部位(包括脑)。
4、平滑肌肿瘤
01. 下生殖道的平滑肌瘤
定义
平滑肌瘤是一种良性平滑肌肿瘤。
ICD-O编码
8890/0平滑肌瘤NOS
ICD-11编码
2E86.1&XH4CY6其他或非特指部位的平滑肌瘤&平滑肌瘤NOS
相关命名
无
亚型
上皮样平滑肌瘤;粘液样平滑肌瘤
部位
最常见于外阴。
临床特征
下生殖道的平滑肌瘤通常<5cm。可能表现为生长缓慢、无痛的肿块;许多病例在临床上当成囊肿。
流行病学
平滑肌瘤是下生殖道最常见的间叶性肿瘤。大多数患者年龄30-60岁。
病因
病因尚不清楚。Alport综合征和COL4A5和COL4A6种系缺失的患者可发生食管、气管支气管树、外阴和子宫的弥漫性平滑肌瘤病。
发病机制
未知
大体检查
下生殖道的平滑肌瘤通常边界清晰、结节状、橡胶状,切面呈白色至褐色凸起,类似于子宫肌瘤。可能出现囊性变(通常由水肿引起)以及(在大肿瘤中)局灶性出血至斑片状出血。
组织病理学
平滑肌瘤由交叉束状排列的细胞学温和的梭形细胞组成,梭形细胞具有丰富的嗜酸性胞质,核细长,一端渐细或两端钝圆。大多数病例只有轻微的细胞学异型性,核分裂象计数<2.3个/mm2(相当于直径为0.53 mm、面积为0.22 mm2视野<10个/10HPF)。可能发生缺血性或透明变性坏死,但不存在肿瘤细胞坏死。下生殖道肿瘤往往具有局部或弥漫性透明化或粘液水肿间质。
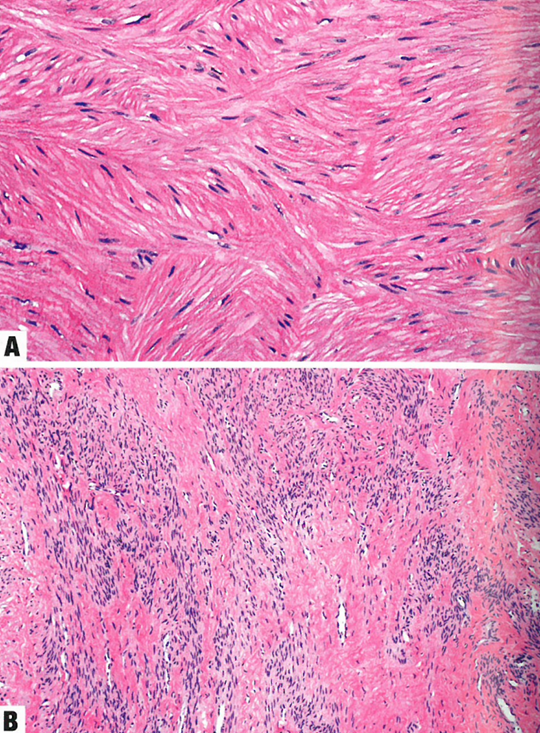
图13.16平滑肌瘤。A 下生殖道的平滑肌瘤通常具有典型的梭形形态。B 一些下生殖道平滑肌瘤有明显的透明变性。
粘液样平滑肌瘤、上皮样平滑肌瘤、奇异形核平滑肌瘤和核分裂象活跃的平滑肌瘤等亚型罕见。亚型的分类标准可能与子宫的分类标准相似,但数据有限。已经提出了不同的风险分层标准。最近一项研究表明,子宫平滑肌肿瘤标准优于其他标准。因此,下生殖道非典型平滑肌肿瘤的恶性潜能可以根据子宫标准来定义。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:传统型平滑肌瘤:梭形细胞,交叉束状,轻度至中度细胞学异型性,核分裂象计数<4.6个/mm2(相当于直径0.53mm、面积0.22mm2视野<10个/10HPF),且无肿瘤细胞坏死。
分期
无临床相关性
预后和预测
如果平滑肌瘤未完全切除,可能局部复发,但最近的数据表明复发风险很低。
02. 下生殖道的恶性潜能未定平滑肌肿瘤
定义
恶性潜能未定平滑肌肿瘤(STUMP)特征超过平滑肌瘤及其亚型,但不足以诊断平滑肌肉瘤,仅少数病例表现为恶性。
ICD-O编码
8897/1恶性潜能未定平滑肌肿瘤
ICD-11编码
2F9C&XH1EN1结缔组织或其他软组织的行为未知的肿瘤&恶性潜能未定平滑肌肿瘤
相关命名
不推荐:非典型平滑肌肿瘤
亚型
无
部位
下生殖道,主要是外阴和阴道区域
临床特征
临床特征不特异,包括患者发现的无症状肿块、与肿块相关的症状,以及在临床评估无关疾病的过程中偶然发现。大多数恶性潜能未定肿瘤中只有少数是恶性的。
流行病学
与子宫平滑肌肿瘤相似,平滑肌瘤亚型和平滑肌肉瘤在下生殖道的发病率低于梭形细胞平滑肌瘤。
病因
未知
发病机制
该部位的发病机制目前尚不明确,但下生殖道STUMP的发病机制可能与其他部位相似。参见子宫平滑肌瘤(原书第272页)和子宫体恶性潜能未定平滑肌肿瘤(原书第279页)。
大体检查
大体呈异质性,从平滑肌瘤样(白褐色,坚硬,切面呈旋涡状)到平滑肌肉瘤样(白-褐色,肉样,不同程度的坏死和出血)。
组织病理学
STUMP是根据组织学标准不能确定良性或恶性的肿瘤。通常,在评估和分类妇科平滑肌肿瘤时,会考虑细胞学异型性程度、核分裂象计数和肿瘤细胞坏死。由于这三个特征的某种组合阻碍了平滑肌瘤或平滑肌肉瘤的分类,“恶性潜能未定平滑肌肿瘤”通常被用作诊断类别,以界定这些复发风险低(但非零)的肿瘤。由于与患者不良预后的有关,有人建议评估潜在子宫STUMP病例的其他形态特征,包括非典型核分裂象、上皮样形态、血管浸润和浸润性/不规则肿瘤边缘。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
下生殖道STUMP的诊断标准尚未明确。然而,研究已经验证并建议使用传统的子宫方法和标准对下生殖道平滑肌肿瘤进行分类。参见子宫体STUMP一节中的表6.03(原书第280页)。
分期
无临床相关性
预后和预测
关于下生殖道STUMP的预后数据有限。然而,最近少数根据子宫平滑肌肿瘤标准将下生殖器平滑肌肿瘤归类为STUMP的研究发现,恶性潜能的风险低。
03. 下生殖道的平滑肌肉瘤
定义
平滑肌肉瘤是一种由显示平滑肌分化的细胞组成的恶性肿瘤。
ICD-O编码
8890/3平滑肌肉瘤NOS
ICD-11编码
2B58.Y&XH7ED4平滑肌肉瘤,其他特定原发部位&平滑肌肉瘤NOS
相关命名
无
亚型
上皮样平滑肌肉瘤;粘液样平滑肌肉瘤
部位
外阴比阴道更常见。
临床特征
患者可能出现阴道出血或继发于肿块的直肠或泌尿道症状。
流行病学
平滑肌肉瘤是下生殖道最常见的肉瘤。患者在诊断时通常40-60岁,但更年轻患者也有报道。
病因
该部位的具体病因尚不清楚。
发病机制
参见子宫平滑肌肉瘤(原书第283页)和本丛书的《软组织和骨肿瘤WHO分类》中的发病机制部分。
大体检查
孤立的肿块,通常>5cm,边界清楚或浸润性边界。切面柔软或坚硬,肉样,白色-褐-灰色至粉-褐色,有不同程度的出血、坏死和囊性改变。粘液样肿瘤通常会渗出粘稠物质或呈凝胶状。上皮样肿瘤往往柔软,呈黄褐色。
组织病理学
平滑肌肉瘤由梭形细胞交叉束状排列,具有丰富的嗜酸性胞质,核细长,一端渐细或两端钝圆。肿瘤至少有以下三个特征中的两个:中度至重度细胞学异型性,核分裂象计数>4.6个/mm2(相当于直径0.53mm、0.22mm2视野>10个/10HPF)和肿瘤细胞坏死。可能存在缺血性或透明变性坏死,必需区分肿瘤细胞坏死。
已经提出了不同的外阴阴道平滑肌肿瘤风险分层标准,每种标准都有其独特的方法。传统上,恶性肿瘤的标准基于以下至少三个特征:大小>5cm、浸润性生长、中度至重度细胞学异型性和核分裂象计数>2.3个/mm2(相当于直径0.53mm、面积0.22mm2视野>5个/10HPF)。最近的一项研究比较了这些拟议标准的预测准确性,发现当应用子宫平滑肌肿瘤标准时,外阴阴道平滑肌肿瘤分为良性、恶性潜能不确定和恶性的交通与子宫肿瘤是平行的。因此,有人建议将下生殖道平滑肌肿瘤按子宫标准进行分类;在这项研究中,浸润性生长本身并不能作为恶性肿瘤的预测因素。该部位的原发性粘液样或上皮样平滑肌肉瘤罕见;尽管分类标准可能与子宫分类标准相似,但数据有限。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
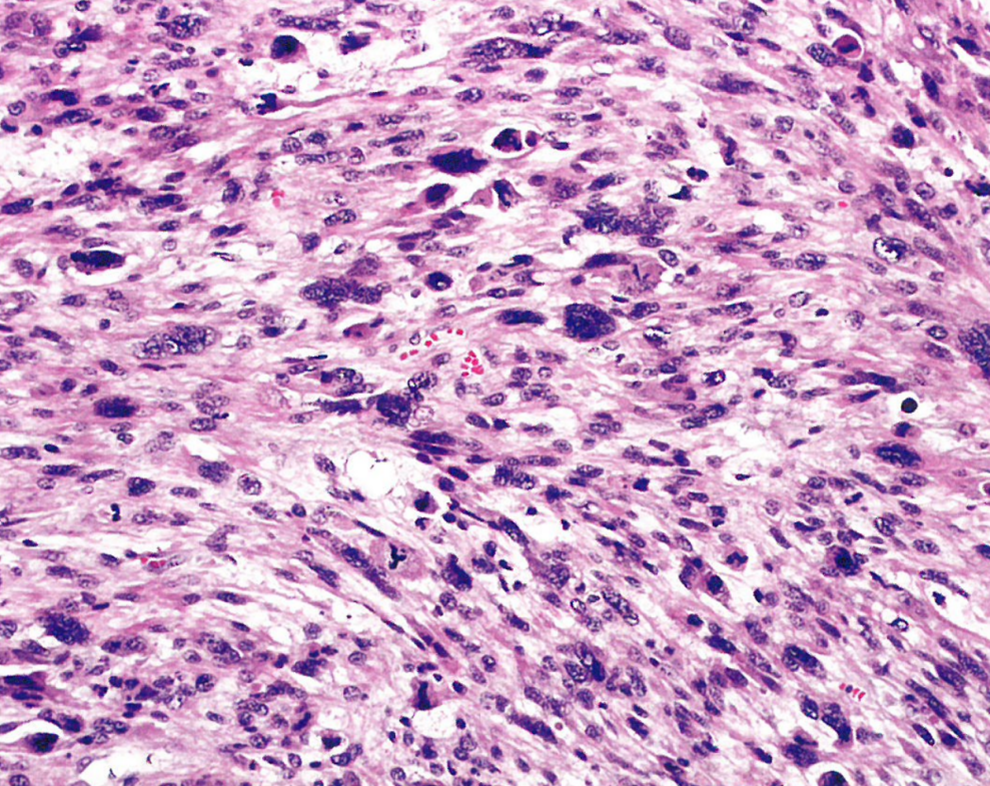
图13.17下生殖道平滑肌肉瘤。梭形平滑肌肉瘤,显著细胞学异型性和活核分裂象活跃,并有非典型核分裂象。
诊断标准
必要标准:
梭形细胞平滑肌肉瘤:梭形细胞交叉束状排列,表现出以下三个特征中的至少两个:中重度细胞异型性,核分裂象计数>4.6个/mm2(相当于直径0.53mm、面积0.22mm2视野>10个/10HPF),以及肿瘤细胞坏死;或以下四个特征中的三个:大小>5cm,浸润性生长,中重度细胞异型性,核分裂象计数>2.3个/mm2(相当于直径0.53mm、面积0.22mm2视野>5个/10HPF)。
粘液样或上皮样平滑肌肉瘤:数据有限,但这些亚型的诊断标准可能与子宫粘液样或上皮样平滑肌肉瘤的诊断标准相当。
分期
下生殖道平滑肌肉瘤根据第八版国际癌症控制联盟(UICC)TNM分类系统进行分期。
预后和预测
预后和预测与妇科其他部位的平滑肌肉瘤相似。外阴阴道平滑肌肉瘤被定义为高级别,经常发生局部和远处复发。大多数患者最终死于疾病。
5、横纹肌肿瘤
01. 横纹肌瘤
定义
横纹肌瘤是一种良性间叶性肿瘤,表现为横纹肌分化。
ICD-O编码
8905/0生殖器横纹肌瘤
ICD-11编码
2E86.2&XH5AF2横纹肌瘤&生殖器横纹肌瘤
相关命名
可接受:生殖器横纹肌瘤
亚型
无
部位
大多数病例发生在阴道,而少数病例累及外阴或宫颈。
临床特征
生殖器横纹肌瘤通常无症状,并在临床检查中因其他原因而偶然发现。当出现症状时,这些病变可能导致性交痛、出血或尿路压迫。
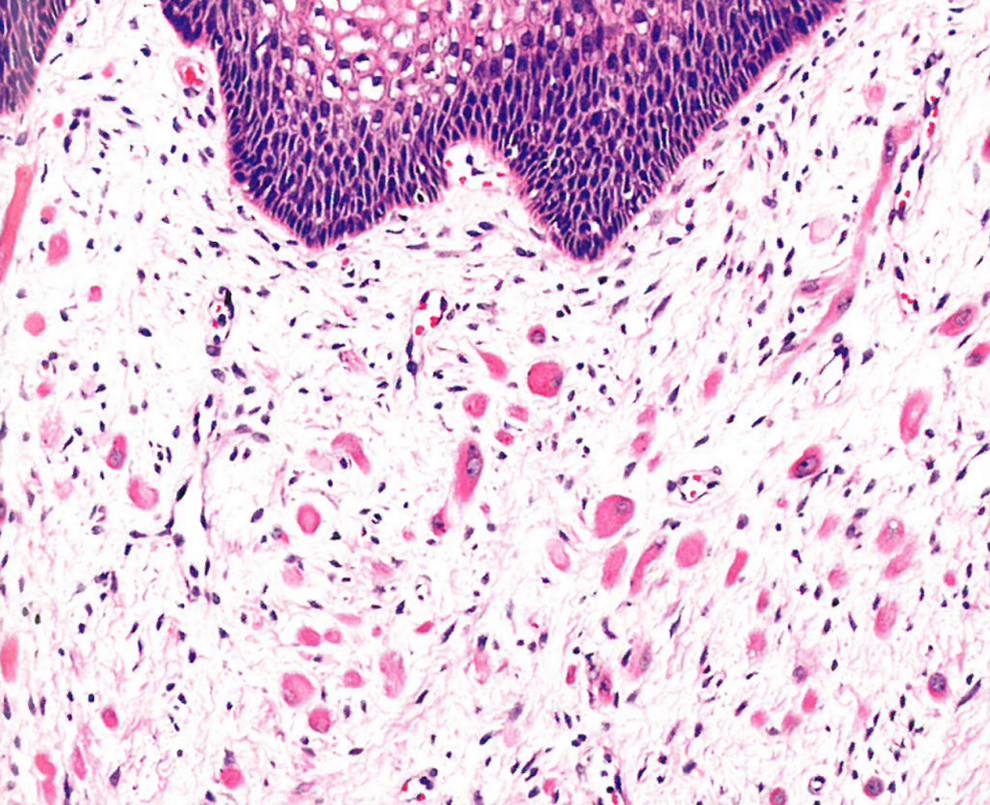 图13.18生殖器横纹肌瘤。杂乱排列的梭形细胞和有横纹的带状细胞,位于上皮下方的纤维血管间质内。
图13.18生殖器横纹肌瘤。杂乱排列的梭形细胞和有横纹的带状细胞,位于上皮下方的纤维血管间质内。
流行病学
生殖道横纹肌瘤是最少见的心外横纹肌瘤亚型,通常发生在30-55岁的女性。
病因
与胎儿横纹肌瘤相比,生殖器横纹肌瘤尚未被报道与基底细胞痣综合征有关。
发病机制
1例的免疫组化分析显示AKT/mTOR信号通路激活的证据。全基因组微阵列分析未检测到2例生殖器横纹肌瘤患者的体细胞拷贝数改变或等位基因缺失事件。没有证据表明刺猬通路基因的体细胞变化。
大体检查
横纹肌肉瘤通常是一种孤立的息肉样或结节性病变,通常<3cm,切面呈灰色、橡胶状至有光泽。
组织病理学
这些病变的特征是梭形、卵圆形或带状细胞以杂乱模式排列,在上皮下方增殖。肿瘤细胞具有丰富的嗜酸性胞质,并有明显的横纹。无核分裂和核多形性。这些细胞表达desmin和横纹肌分化标记物,包括myogenin和MYOD1。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
必要标准:上皮下方界限分明的梭形至卵圆形细胞增殖,具有杂乱模式;具有横纹的带状细胞数量不一;无异型性或核分裂象。
理想标准:横纹肌标记物阳性(有选择的病例)。
分期
无临床相关性
预后和预测
生殖道横纹肌瘤是良性肿瘤,通常通过局部切除治愈。
02. 横纹肌肉瘤
定义
横纹肌肉瘤是表现为横纹肌分化的恶性间叶性肿瘤家族。
ICD-O编码
8900/3横纹肌肉瘤NOS
8910/3胚胎性横纹肌肉瘤NOS
8920/3腺泡状横纹肌肉瘤
8901/3多形性横纹肌肉瘤NOS
ICD-11编码
2B55.Y&XHOGA1横纹肌肉瘤,其他特定原发部位&横纹肌肉瘤NOS
2B55&&XH7099横纹肌肉瘤&腺泡状横纹肌肉瘤
2B55&和XH5SX9横纹肌肉瘤,原发部位&多形性横纹肌肉瘤NOS
2B55&XH83G1横纹肌肉瘤&胚胎横纹肌肉瘤NOS
相关命名
不推荐:葡萄状肉瘤;胚胎性和腺泡状混合的横纹肌肉瘤
亚型
无
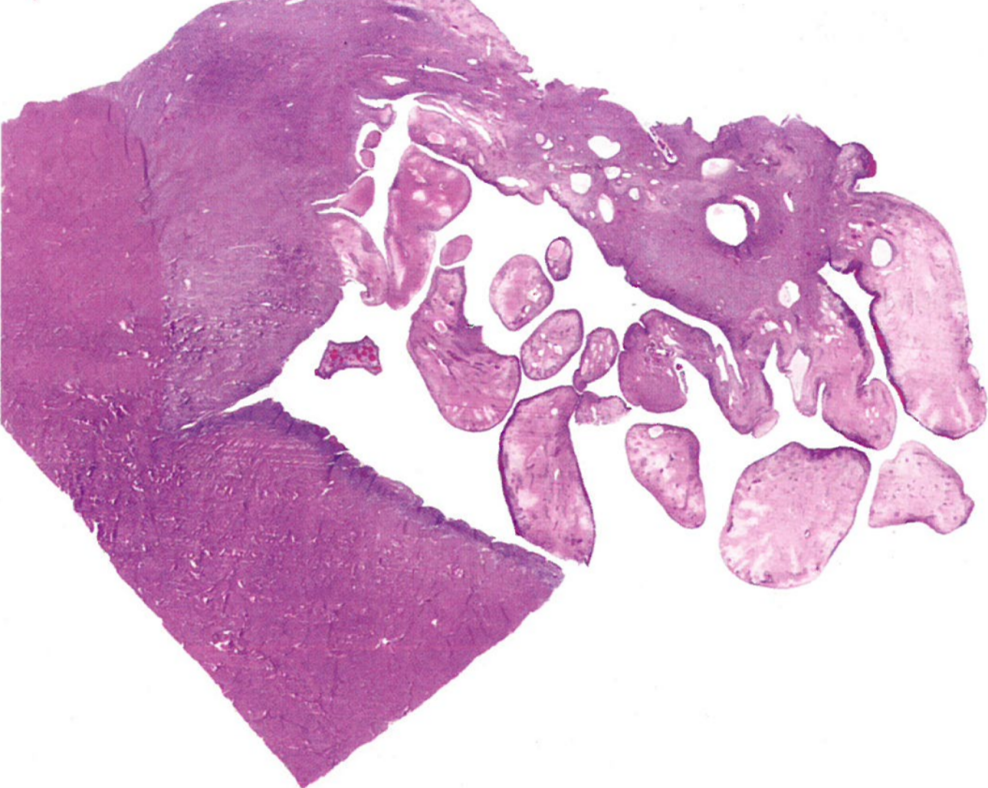 图13.19葡萄状胚胎横纹肌肉瘤。肿瘤显示多个指状突起,并轻微浸润子宫肌层。表面上皮下方有明显的水肿和一层细微的形成层。
图13.19葡萄状胚胎横纹肌肉瘤。肿瘤显示多个指状突起,并轻微浸润子宫肌层。表面上皮下方有明显的水肿和一层细微的形成层。
部位
女性生殖道(FGT)内不同部位的发病率因组织亚型而异。多形性横纹肌肉瘤通常见于子宫体。在下FGT中,胚胎性横纹肌肉瘤(ERMS)最常见于儿童的阴道,青少年和成人的宫颈和子宫体;腺泡状横纹肌肉瘤(ARMS)最常见于外阴。
临床特征
横纹肌肉瘤患者经常出现出血,骨盆检查发现肿块。宫颈和阴道ERMS通常表现为息肉,并可能从阴道口脱出,有时呈葡萄状外观。多形性横纹肌肉瘤通常发生在绝经后患者中,经常出现异常阴道出血。
流行病学
ERMS占下发灶横纹肌肉瘤的75%以上。大多数ERMS发生在儿童,而ARMS和多形性横纹肌肉瘤发生在老年人。
病因
患有DICER1综合征(种系DICER1突变)的人有患宫颈ERMS的风险(见DICER1综合症,第556页)。
发病机制
在ERMS中,RAS信号通路突变激活MAPK效应通路,抑制肌细胞生成素表达并阻断肌生成。在ARMS中,t(2;13)或t(1;13)易位产生PAX3-FOXO1或PAX7-FOXO1融合基因,编码转录因子,激活参与增殖、存活、分化和运动调节的PAX3I-PAX7靶基因。对一例多形性横纹肌肉瘤的分子研究发现PIK3CA和TP53突变。据报道,在一小部分宫颈ERMS中存在体细胞DICER1突变。
大体检查
横纹肌肉瘤通常呈肉样、灰红色外观。葡萄状ERMS通常表现为粘膜下多发性息肉样葡萄状肿块。
组织病理学
ERMS通常为息肉状,部分表面被覆鳞状上皮或腺上皮。常有交替出现的细胞密度,少细胞的粘液水肿区域和密集的原始细胞区域,后者位于表面上皮下方和先前存在的陷入的腺体(子宫颈和子宫体)周围。在葡萄状肿瘤中,可以看到表面上皮下方的细胞丰富的形成层(可能不太明显)和围绕先前存在的陷入的静止期子宫内膜腺体周围的袖套状结构。如果水肿/粘液样间质的少细胞区占主导地位,则肿瘤可能与息肉混淆。肿瘤细胞有圆形、卵圆形或梭形核,胞质稀少。可见多少不等的带状细胞,但通常不明显。偶见具有丰富嗜酸性胞质的细胞、具有胞质横纹的横纹肌母细胞和多核巨细胞。肿瘤显示出活跃的核分裂象和凋亡。可能发生间变(分叶状深染核>相邻细胞的3倍)。大约40%的肿瘤含有胎儿型软骨。一些肿瘤也可能含有局灶性腺泡状区域,但分子分析对于确定这些病例是否含有融合基因是必要的。
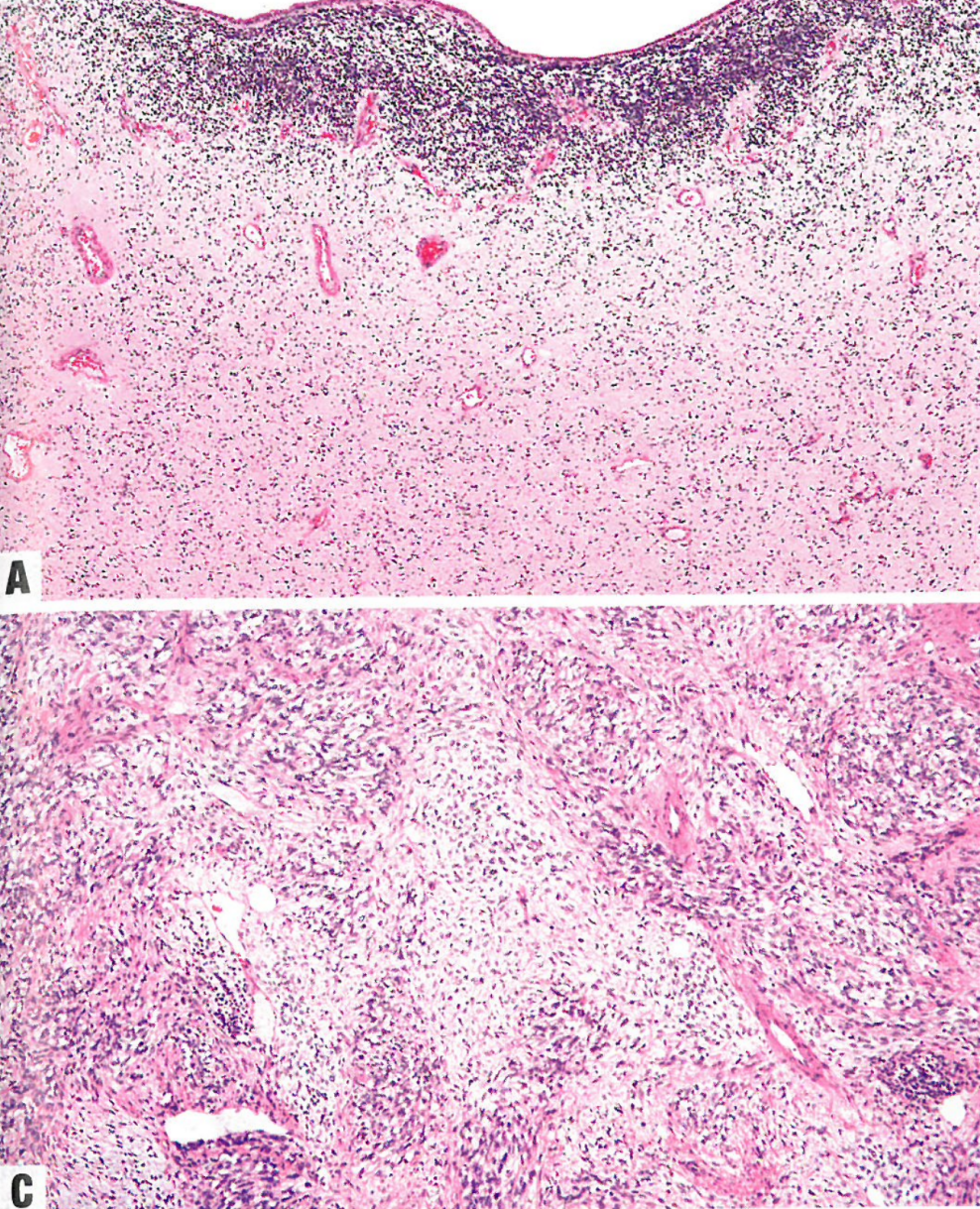
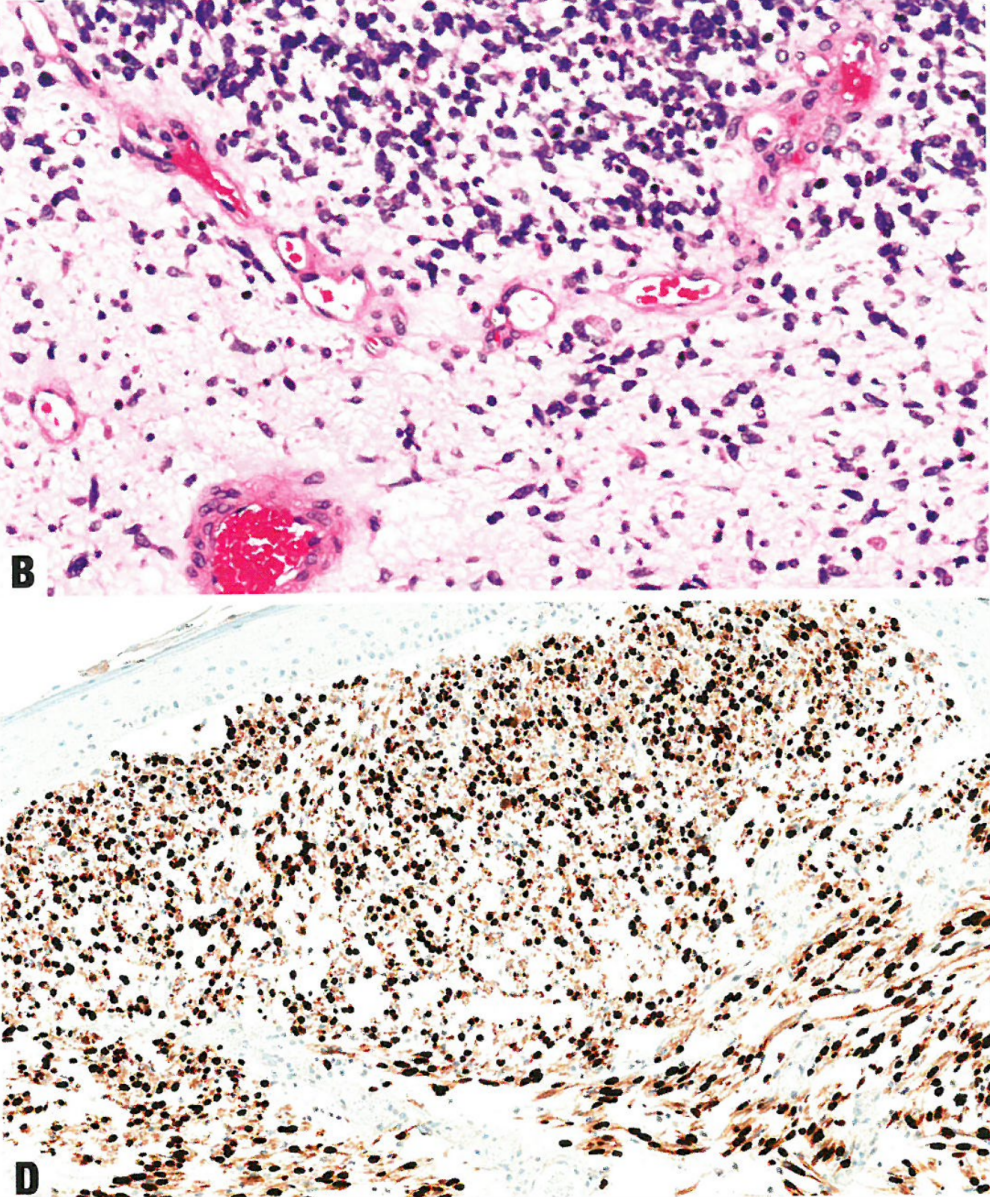 图13.20胚胎性横纹肌肉瘤。A 上皮变薄,上皮下方为细胞丰富的形成层,更下方为细胞较少的粘液样区。B 深染的圆形至梭形细胞,胞质稀少。C 少细胞区和富细胞区交替出现。核深染,胞质稀少。D myogenin呈核阳性。
图13.20胚胎性横纹肌肉瘤。A 上皮变薄,上皮下方为细胞丰富的形成层,更下方为细胞较少的粘液样区。B 深染的圆形至梭形细胞,胞质稀少。C 少细胞区和富细胞区交替出现。核深染,胞质稀少。D myogenin呈核阳性。
ARMS由小圆蓝细胞组成,伴多少不等的横纹肌母细胞,生长在松散粘附的巢或腺泡状结构中,由胶原间质隔开。中央的细胞不粘附,周边的细胞粘附在纤维间隔。可有多核细胞。可能见到无纤维间隔的实性模式。多形性横纹肌肉瘤表现为圆形、多边形、奇异形或梭形细胞的混合,具有明显的异型性,伴或不伴巨细胞和横纹肌母细胞。
免疫组化,横纹肌肉瘤表达myogenin(胚胎性表达少)和MYOD1;两者都有特异性。两者在ARMS中的表达通常比ERMS更弥漫。MSA、desmin、myoglobin和myosin可能阳性,但SMA阴性。ARMS可能表达广谱CK和神经内分泌标记物。其他肿瘤组织中出现的横纹肌肉瘤成分(如腺肉瘤中的肉瘤性过生长或癌肉瘤中的异源性肉瘤)不应当分型。
细胞学
无临床相关性
诊断分子病理学
有选择的病例,证实融合基因的可能有帮助(见上文发病机制)。
诊断标准
必要标准:ERMS:原始细胞呈交替的细胞密度,伴上皮下方聚集(形成层),伴或不伴明显的横纹肌分化;
ARMS:腺泡状模式(经典型或实性);
多形性横纹肌肉瘤:存在奇异形细胞伴显著异型性,伴或不伴巨细胞和横纹肌母细胞;
所有亚型:横纹肌标记物阳性(肌细胞生成素和MYOD1)。
理想标准:分子确认(有选择的病例)。
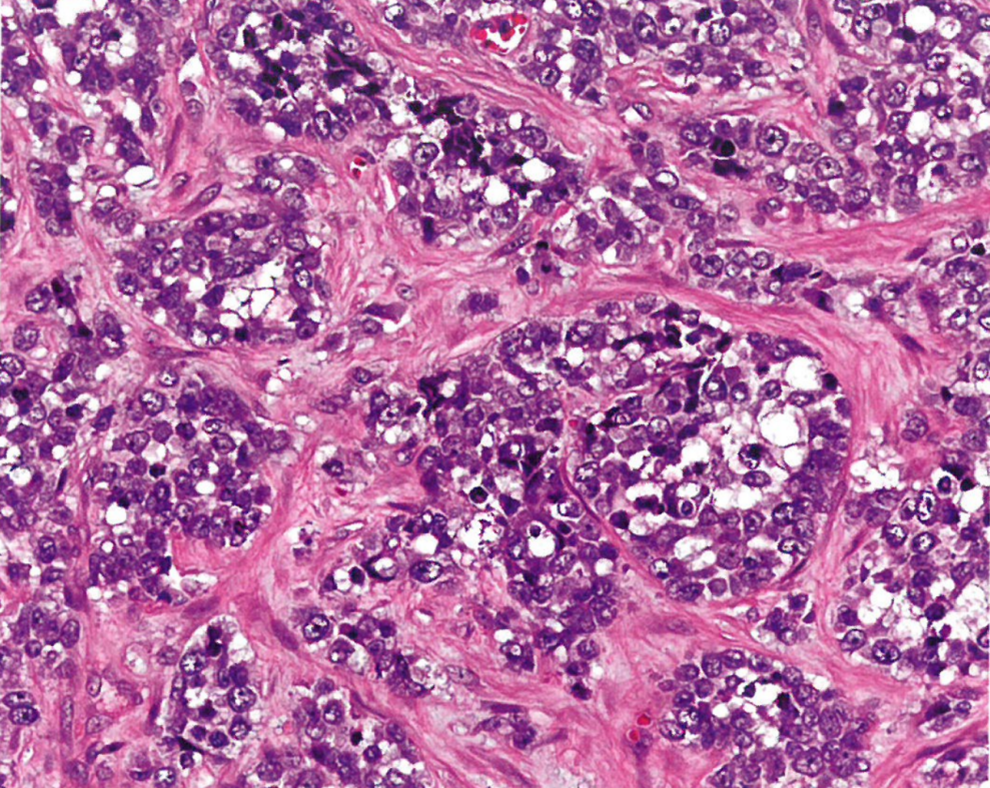 图13.21腺泡状横纹肌肉瘤。由圆形细胞巢组成,胞质嗜酸性,有纤维间隔。
图13.21腺泡状横纹肌肉瘤。由圆形细胞巢组成,胞质嗜酸性,有纤维间隔。
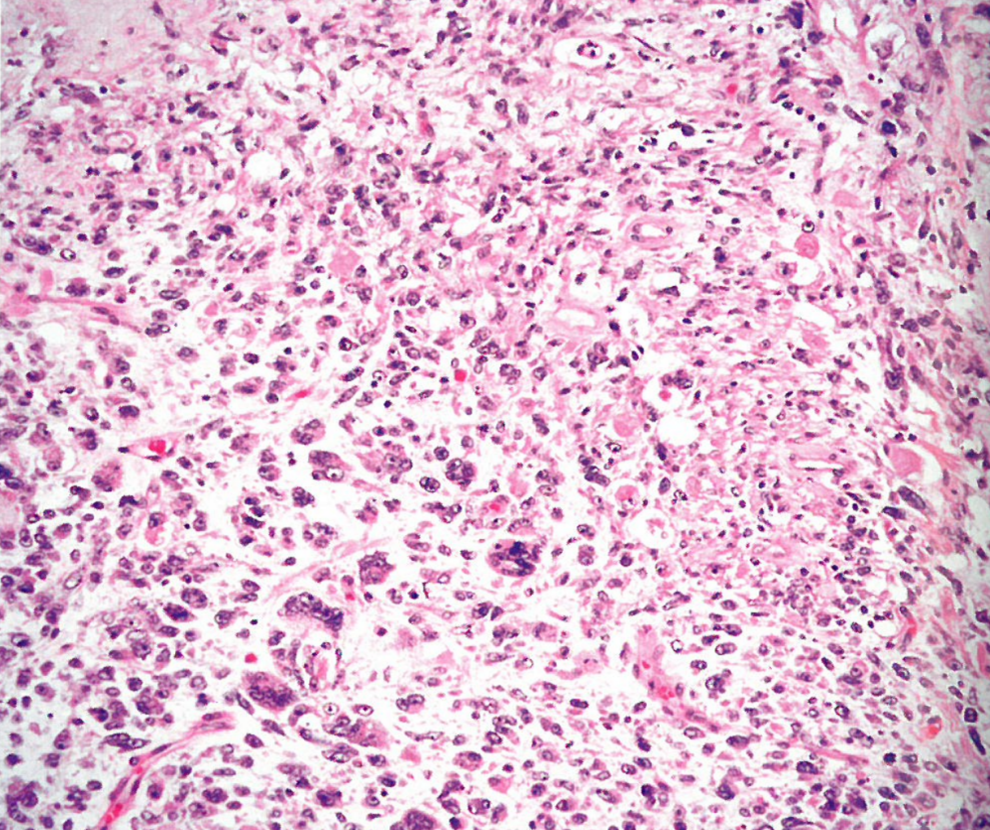 图13.22多形性横纹肌肉瘤。肿瘤细胞有明显的多形性,有些是多核。可见横纹肌母细胞分化。
图13.22多形性横纹肌肉瘤。肿瘤细胞有明显的多形性,有些是多核。可见横纹肌母细胞分化。
分期
根据肿瘤、淋巴结和转移状态进行病理分期,临床组取决于疾病范围。在组间横纹肌肉瘤研究组(IRSG)临床分期系统中,FGT是预后有利的部位,非转移性肿瘤为1期。
预后和预测
女性下生殖道型横纹肌肉瘤的5年总生存率约为70%,这与大多数胚胎性横纹肌肉瘤一致,因为ERMS比多形性横纹肌肉瘤和ARMS具有更好的预后。患者年龄年轻、非转移性疾病、ERMS组织学和癌症定向手术治疗都与生存率的提高有关。具有ARMS组织学但没有基因融合的肿瘤,临床结局类似于具有ERMS组织学的肿瘤。ERMS中的间变与预后不良有关。
6、周围神经鞘瘤
01. 良性周围神经鞘肿瘤
定义
神经鞘瘤(Schwannoma,雪旺瘤)是良性周围神经鞘肿瘤之一,全部或几乎全部由分化的肿瘤性雪旺细胞组成。神经纤维瘤也是良性周围神经鞘肿瘤之一,由分化的雪旺细胞、神经束膜/神经束膜样细胞、纤维母细胞、肥大细胞和残留的散布在粘液样和胶原性细胞外基质中的有髓和无髓轴突组成。
ICD-O编码
9540/0神经纤维瘤NOS
9560/0神经鞘瘤NOS
ICD-11编码
2F3Y&XH98Z3其他特定部位的良性非间叶性肿瘤&神经鞘瘤
2F3Y和XH87J5其他特定部位良性非间质肿瘤和神经纤维瘤NOS
相关命名
不推荐:神经鞘瘤(neurilemmoma)
亚型
无
部位
神经鞘肿瘤在女性下生殖道的所有部位都罕见。外阴是最常见的受累部位,但累及阴道、子宫底、子宫颈、输卵管和卵巢的病例也有报道。其他类型的良性外周神经鞘肿瘤在女性下生殖道尚无报道。
临床特征
临床表现包括月经过多、阴道斑点、下腹/盆腔疼痛、外阴/阴唇/阴蒂肿块、不育,以及影像学偶然发现。
流行病学
神经鞘瘤和神经纤维瘤患者的年龄在0-71岁。患有丛状神经纤维瘤(通常发生在神经纤维瘤病1型的情况下)和/或阴蒂受累的患者往往更年轻,包括儿科和先天性病例。
病因
女性下生殖道的一些神经纤维瘤出现在神经纤维瘤病1型的背景下,据报道,神经纤维病2型患者中有一种罕见的丛状神经鞘瘤。其他神经纤维瘤和神经鞘瘤是散发性的。此外,还报道了一例子宫颈黑色素性神经鞘瘤(现指定为恶性黑色素细胞神经鞘瘤),但未说明患者有无Carney综合征的特征。
发病机制
神经鞘瘤主要与编码merlin(NF2/schwanomin)的NF2基因失活有关,而神经纤维瘤与编码神经纤维蛋白(NF1)的NF1基因失活有关。在神经纤维瘤中,只有施旺细胞是肿瘤性的。
大体检查
神经鞘瘤通常为有包膜的肿块,切面呈杂色,包括多少不等的褐-灰色组织、出血灶、囊性变和黄色瘤样改变引起的黄色。相比之下,神经纤维瘤质硬、无包膜,切面均匀、有光泽到粘液样、褐-灰色。
组织病理学
神经鞘瘤的特征是双相外观,交替出现致密Antoni A区和疏松/微囊Antoni B区。A区常有Verocay小体,由栅栏状排列的核组成。炎症变化包括包膜下淋巴细胞和泡沫状巨噬细胞,后者通常出现在B区。退行性血管变化包括透明血管、血毛细血管扩张和血管周围轻微出血,伴含铁血黄素巨噬细胞。肿瘤细胞含有细长的波浪状核和细长的胞质突起。散在的奇异形核和核分裂象活性没有预后意义。具有多结节生长模式的丛状神经鞘瘤在阴蒂和外阴区域更为常见。网状模式也有报道。免疫组化,神经鞘瘤表达S100(弥漫阳性)和sOX10(广泛阳性)。与神经纤维瘤不同,神经鞘瘤中CD34的表达通常仅限于包膜下区域和间隔纤维组织。
神经纤维瘤无包膜,具有波浪形小核和细长的胞质突起,陷入不同程度的粘液样或胶原间质中。胶原蛋白聚集就像切碎的胡萝卜。丛状神经纤维瘤由于累及多个神经束,每个神经束都被神经束膜包裹,因此显示多结节生长模式。核分裂象通常不明显。免疫组化,雪旺细胞表达S100和SOX10(不如神经鞘瘤广泛),而CD34阳性纤维母细胞则呈典型的格子状网络。神经周细胞呈EMA和GLUT1阳性。
细胞学
神经鞘瘤的细针穿刺涂片通常表现为梭形细胞形成的粘附性合胞体碎片。仅凭细胞学制片可能难以将神经鞘瘤与其他梭形细胞肿瘤区分开来,其诊断需要与粗针活检和/或相关的S100染色。由于胶原间质增加,神经纤维瘤的术中涂片和细针穿刺标本通常细胞稀少。
诊断分子病理学
无临床相关性
诊断标准
神经鞘瘤
必要标准:Antoni A和B区和/或Verocay小体
理想标准:广泛的S100和SOX10表达。
神经纤维瘤
必要标准:少细胞的梭形细胞肿瘤,具有不同程度的粘液样至胶原性间质。
理想标准:神经鞘成分呈S100和/或SOX10阳性,纤维母细胞成分呈CD34阳性。
分期
无临床相关性
预后和预测
神经鞘瘤和神经纤维瘤表现为良性,传统型神经鞘瘤的恶性转化极为罕见;在迄今为止文献报道的少数病例中,最常见的转化形式是上皮样恶性外周神经鞘瘤。较少见病例的转化特征是传统型恶性外周神经鞘瘤、原始神经外胚层细胞、横纹肌肉瘤和/或血管肉瘤的病灶。
02. 颗粒细胞瘤
定义
颗粒细胞瘤是一种显示神经外胚层分化的肿瘤,由上皮样细胞到多边形细胞组成,具有丰富的嗜酸性、独特的颗粒状胞质。
ICD-O编码
9580/0颗粒细胞瘤NOS
9580/3颗粒细胞瘤,恶性
ICD-11编码
2E8Y&XH09A9间皮组织和其他特指性器官的良性肿瘤&颗粒细胞瘤NOS
2C7Y和XH90D3女性生殖器官的其他特指性恶性肿瘤和颗粒细胞瘤,恶性
相关命名
不推荐:颗粒细胞雪旺瘤;颗粒细胞神经鞘瘤;颗粒细胞肌母细胞瘤;Abrikossoff瘤
亚型
无
部位
外阴是女性生殖道内最常见的受累部位,卵巢、宫颈和阴道也有极少病例。大阴唇是成人和儿童最常见的位置;很少发生耻骨区和阴蒂受累。
临床特征
颗粒细胞瘤表现为生长缓慢、可推动、非压痛的肿块,通常<4cm。被覆表皮可能出现溃疡、脱色或增厚,呈鹅卵石状外观,患者可有瘙痒症状。
流行病学
这种肿瘤最常见于30-60岁的黑人女性。儿童外阴颗粒细胞瘤极为罕见,患者的中位年龄为8.5岁。
病因
多发性颗粒细胞瘤可能与Noonan综合征有关。
发病机制
总体上,在72%的颗粒细胞瘤中发现了影响VATPase辅助基因的功能丧失突变。这些基因在内体pH调节中起着关键作用。影响这些基因的功能丧失突变与解剖部位无关,也与病变的良恶性无关,在其他肿瘤中尚未检测到此类突变。
译注:内体(endosome)是所有真核细胞细胞质中发现的膜结合囊泡。它们是细胞内的分选细胞器,调节蛋白质和脂质与细胞分泌和内吞途径的其他成分(如质膜、反高尔基体网络(TGN)和溶酶体)的运输。
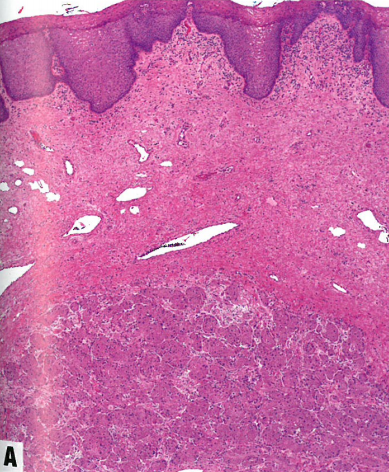
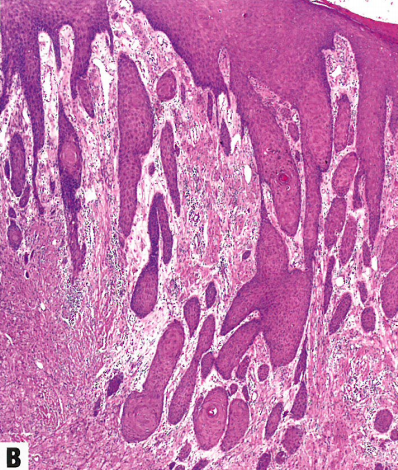
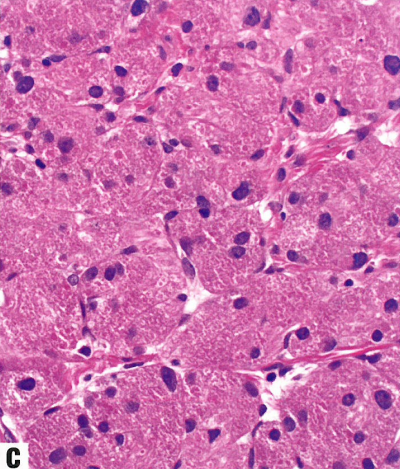
图13.23颗粒细胞肿瘤。A 中镜,边界清晰但无包膜的肿瘤,嗜酸性细胞形成大巢,有大量嗜酸性胞质。B 45岁女性外阴颗粒细胞瘤,上方假上皮瘤样增生。广泛的假上皮瘤样增生可以貌似鳞状细胞癌,这是臭名昭著的诊断陷阱。C 高倍显示颗粒细胞瘤的特征:中等大小的细胞,具有丰富的颗粒状、嗜酸性胞质和圆形核,染色质细腻。
大体检查
外阴颗粒细胞瘤是小的、质硬的、通常是孤立的白色结节,边界清晰,累及真皮/粘膜下层或皮下组织。
组织病理学
颗粒细胞瘤的边界不清,显示成片、巢状和小梁结构,由大的、形态单一的上皮样至多角形细胞组成,含有大量致密的嗜酸性颗粒状胞质。细胞边界可能模糊,产生合胞体样外观。核通常位于中心,核形态产业化较大,范围从小而均匀、轻度深染,到核增大、空泡状伴明显核仁。核分裂象计数多少不等,但通常不明显。胞质的细颗粒外观是由于溶酶体的大量积累,含有较大胞质内颗粒伴透明空晕。常见神经周围浸润。有时可见上方假上皮瘤样增生,当其范围广泛时,可能令人担心鳞状细胞癌。颗粒细胞瘤通常表达S100、SOX10、nestin、inhibin和calreitinin。
恶性颗粒细胞瘤罕见。其特征变化较大,从明显的肉瘤到形态温和不等。有关详细的组织学和免疫组化特征以及与侵袭行为相关的组织学特征的描述,请参见《软组织和骨肿瘤WHO分类》。
细胞学
无临床相关性
诊断分子病理学
形态学疑难病例,检测ATP6AP1或ATP6AP2中的功能丧失突变有助于支持颗粒细胞瘤的诊断。
诊断标准
必要标准:大的椭圆形至圆形细胞形成巢状和小梁状;丰富的、致密嗜酸性颗粒状胞质;免疫组化检测S100阳性。
分期
详细说明,请参阅《软组织和骨肿瘤WHO分类》。
预后和预测
大多数外阴颗粒细胞瘤和所有部位的颗粒细胞瘤都是良性的。有关预后的详细描述,请参阅《软组织和骨肿瘤WHO分类》。
往期回顾
WHO女生5ed第13章 下生殖道间叶性肿瘤(一)
WHO女生5ed第13章 下生殖道间叶性肿瘤(二)

































共0条评论