[导读] 编译整理:强子
(四)PD-L1免疫组化
免疫组化PD-L1是一项用于乳腺癌免疫检查点抑制剂疗效预测的新型标记物。在原文写作时,FDA已批准了三种PD-L1检测方案作为“伴随诊断”以确定根据FDA批准的适应症、患者是否适用于某些特殊的免疫检查点抑制剂,其中也包括了用于三阴型乳腺癌的Ventana PD-L1(S142)检测,详见表4。
表4.PD-L1免疫组化伴随诊断具体信息简介

PD-L1免疫组化的实施及解读包括了多种注意事项,且不同瘤种之间有所不同、不同检查点抑制剂之间的判断有所不同。癌症免疫治疗、伴随诊断、预测性生物标记等,都在迅速的发展中。毫无疑问,乳腺癌中的相关适应症以及检测方案也会随着我们的研究而有所改变。
该文写作时FDA批准的免疫检查点抑制剂相关药物适用病种及判读指标:
1.派姆单抗:宫颈鳞状细胞癌,联合阳性分数(combined positive score,CPS)≥1;食管鳞状细胞癌,CPS≥10;胃/胃食管交界处癌,CPS≥1;头颈部鳞状细胞癌,CPS≥1;非小细胞肺癌,肿瘤细胞阳性比例分数(tumor proportion score,TPS)≥1%;尿路上皮癌,CPS≥10。
2.纳武单抗:非小细胞肺癌,肿瘤细胞阳性比例(tumor cell labeling,TC)≥1%。
3.阿替利珠单抗:非小细胞肺癌,TC≥50%,免疫细胞阳性比例(immune cell labeling,IC)≥10%;三阴型乳腺癌,IC≥1%;尿路上皮癌,IC≥5%。
1.进展期乳腺癌中的检查点抑制
2019年3月,美国FDA加速批准了PD-L1抑制剂阿替利珠单抗联合白蛋白-紫杉醇化疗用于PD-L1阳性进展期三阴型乳腺癌。该药物的获批,对于乳腺癌的治疗来说是一个分水岭:这不仅是乳腺癌中获批的第一个免疫检查点抑制剂,也是靶向治疗首次应用于三阴型乳腺癌。该药物的获批,是基于IMPassion130的3期临床试验结果:PD-L1阳性进展期三阴型乳腺癌接受阿替利珠单抗联合白蛋白-紫杉醇化疗,其无进展生存期有了显著延长(2.2个月),且总体生存有了显著临床意义的改善(7-10个月)。
2.PD-L1为乳腺癌的伴随诊断指标
进展期三阴型乳腺癌中,PD-L1免疫组化是阿替利珠单抗治疗所需的伴随诊断。FDA批准的方案中强调,乳腺癌中的PD-L1状态可以通过FDA批准的检测方案来确定。本文写作时,FDA批准用于乳腺癌的PD-L1唯一检测方案就是Ventana PD-L1(S142)检测,具体用的PD-L1抗体克隆号为SP142,即前述IMPassion130的3期临床试验中所用抗体。该检测方案不同于FDA批准用于其他癌种的检测,如Dako平台中用克隆号22C3抗体的22C3 Pharm Dx、用28-8抗体的检测等。本文发表时,Ventana PD-L1(SP263)检测已有作为补充诊断的商用产品,但当时FDA还并未批准其作为伴随诊断。
Ventana PD-L1(SP263)检测用的是免疫细胞(immune cell,IC)评分标准来评估三阴型乳腺癌中的PD-L1状态,具体是指肿瘤区域内PD-L1阳性免疫细胞占该区域所有细胞的比例,确定是否适用于阿替利珠单抗的阈值为1%。也就是说,如果三阴型乳腺癌有下述情况,则视为PD-L1阳性:PD-L1阳性免疫细胞在肿瘤区域所占的比例≥1%。这里的免疫细胞指的是肿瘤相关的所有免疫细胞,并非仅仅是肿瘤内浸润的淋巴细胞,也包括了浆细胞、中性粒细胞、巨噬细胞。这一评分方案不同于前述表4中其他瘤种所用的TPS、TC、CPS评分方案。
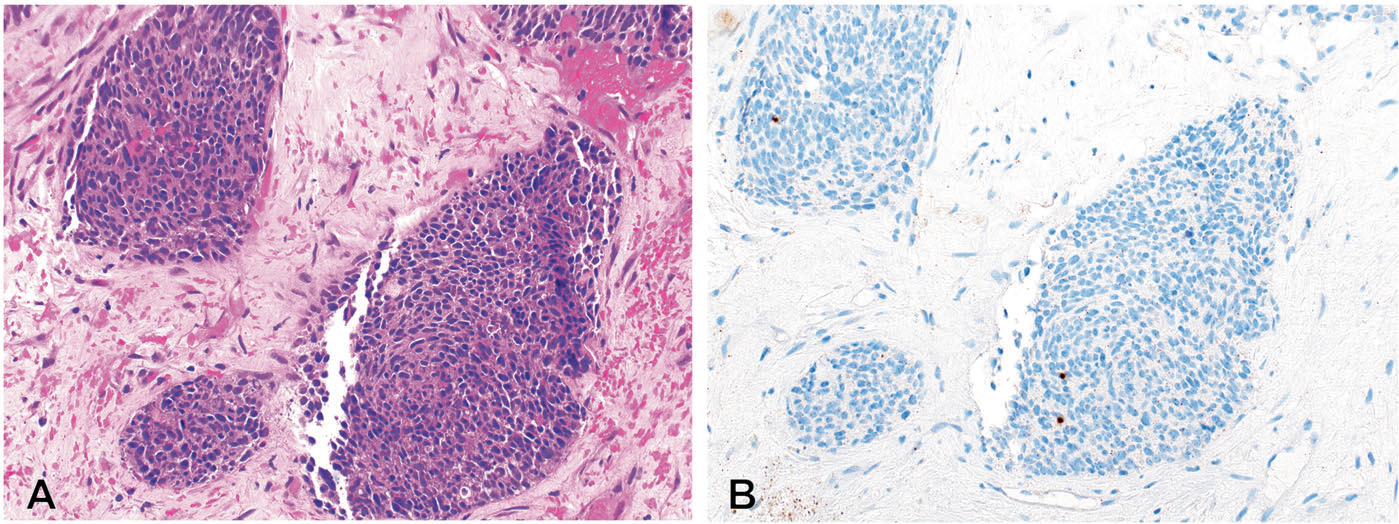 图15.乳腺癌中的PD-L1。本例为原发三阴型乳腺癌,伴少许炎症细胞浸润,且PD-L1免疫组化阴性,因此IC评分为0%;肿瘤细胞可见非特异性的点状胞质着色。
图15.乳腺癌中的PD-L1。本例为原发三阴型乳腺癌,伴少许炎症细胞浸润,且PD-L1免疫组化阴性,因此IC评分为0%;肿瘤细胞可见非特异性的点状胞质着色。
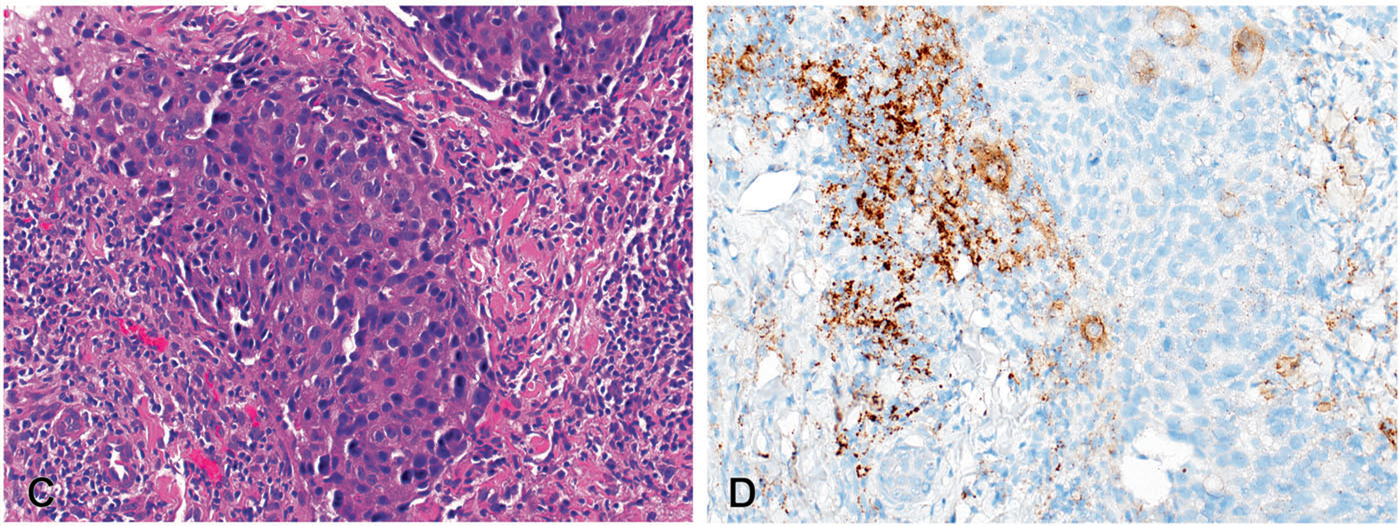 图16.乳腺癌中的PD-L1。本例为原发三阴型乳腺癌,伴显著PD-L1阳性的炎症细胞浸润,其IC评分为20-25%,高于相应≥1%的阈值。
图16.乳腺癌中的PD-L1。本例为原发三阴型乳腺癌,伴显著PD-L1阳性的炎症细胞浸润,其IC评分为20-25%,高于相应≥1%的阈值。
3.PD-L1免疫组化中的标本因素
Ventana PD-L1(S142)检测不适用于细胞蜡块或涂片,也不适用于脱钙标本。作为伴随诊断,PD-L1检测可以在原发肿瘤进行,也可以在转移性肿瘤进行。目前还不完全清楚原发肿瘤的免疫微环境如何预测转移性肿瘤的免疫治疗效果,因为后者会有一段时间的间隔、和/或进行过其他的系统性化疗;但原发肿瘤或转移性肿瘤的阳性结果都意味着患者适用于已批准的治疗方案。
不过,标本类型及部位会影响PD-L1的检测结果:转移性肿瘤的PD-L1表达可能不同于原发肿瘤,且一般炎症程度比原发肿瘤更低(也就是免疫细胞的数量更少)。某些部位的转移(如肝脏)中,炎症要比其他部位的转移(如肺)更低。免疫细胞总体数量较低的部位中,PD-L1阳性免疫细胞数量也可能更低、因此≥1%的可能性也就更低。因此,应避免在肝脏转移性肿瘤进行PD-L1检测。
4.PD-L1判读中的陷阱
PD-L1评分的可重复性,在诸多瘤种中都是一个值得关注的问题,在乳腺癌中尤其严重。虽然肿瘤细胞中PD-L1的标记评分有可重复性,但免疫细胞中的PD-L1评分是否有可重复性还是有很大争议的,尤其是准确区分<1%与1%。病理医师标准化培训,图像化的解读指南,图片分析软件,这些都可能改善PD-L1的IC评分可重复性,但尚需进一步全面研究。此外,乳腺癌中的PD-L1检测应只做IC评估、而不是TC评估;且仅在浸润性癌边缘处评估IC。
转移至淋巴结病灶的IC评估可能问题尤其大,因为此时需区分“肿瘤相关”免疫细胞和淋巴结内正常存在的淋巴细胞。癌巢周围有相关促纤维组织增生,可能有助于这种情况下的肿瘤区域定义。坏死区也可见PD-L1的非特异性着色,且可能会有非特异性沉着导致的着色,评分中要注意排除这两种情况。
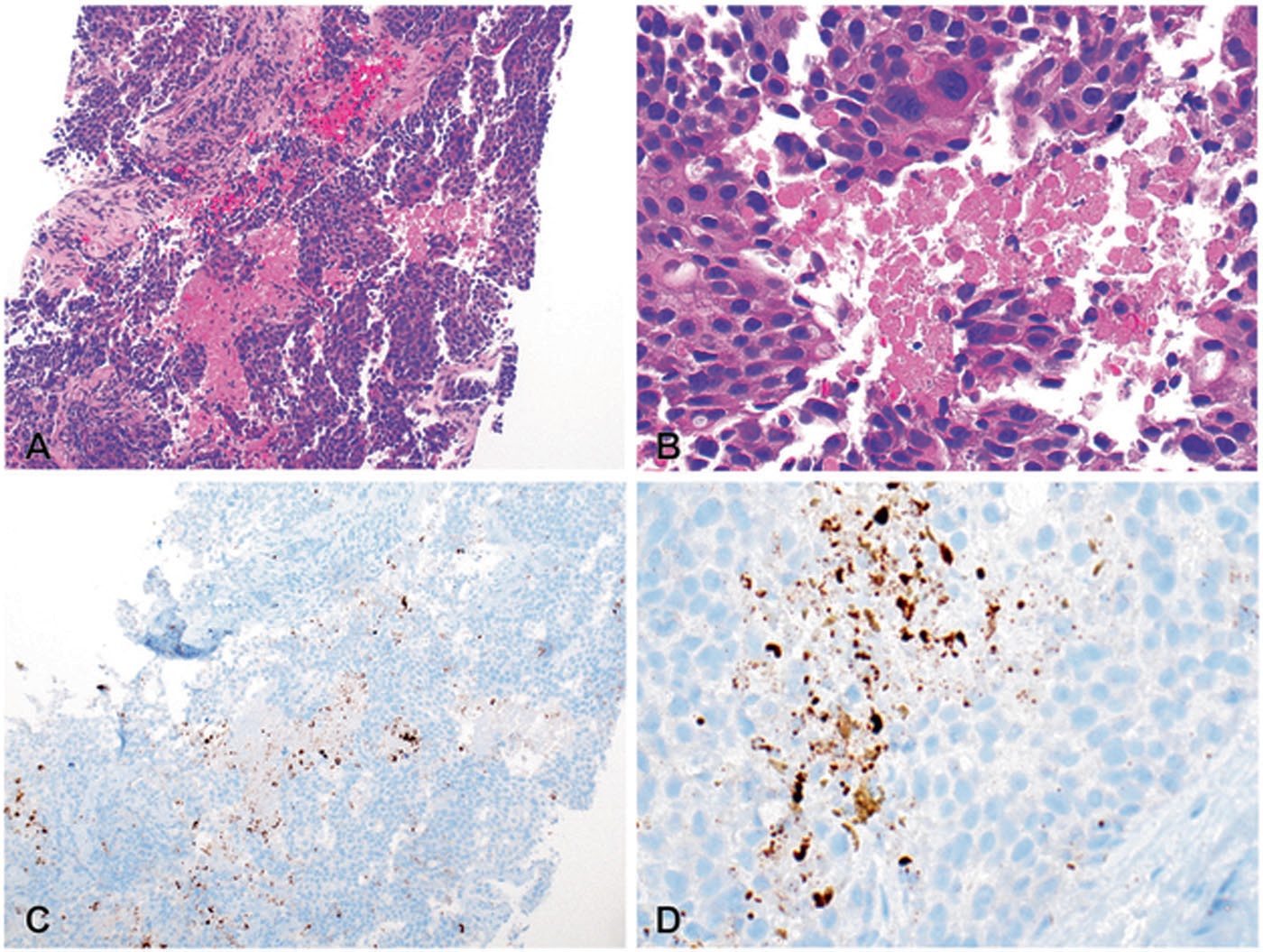 图17.PD-L1免疫组化中的非特异性着色。乳腺原发三阴型癌,可见大量坏死(A、B),Ventana PD-L1(SP142)的检测中,可见非特异性着色(C、D)。肿瘤PD-L1阴性,但有PD-L1阳性免疫细胞,在整个肿瘤区域占比<1%,因此本例IC评分<1%。
图17.PD-L1免疫组化中的非特异性着色。乳腺原发三阴型癌,可见大量坏死(A、B),Ventana PD-L1(SP142)的检测中,可见非特异性着色(C、D)。肿瘤PD-L1阴性,但有PD-L1阳性免疫细胞,在整个肿瘤区域占比<1%,因此本例IC评分<1%。
5.PD-L1检测中的关注点及争议
泛瘤种的PD-L1检测中,一个主要的问题就是缺乏充分的抗体对照/检测验证。用已知PD-L1结果的对照切片做对照验证及检测能力测试,会极大的促进PD-L1检测的标准化。此外,不同克隆号的PD-L1抗体用相同检测方案(即相同检测步骤)的情况下,对于PD-L1的敏感性是相同的;但Ventana PD-L1(SP142)检测(如SP142抗体、用Ventana检测平台)的敏感性要低于其他抗体及相应检测方案。这一检测的敏感性较低,是因为检测所用的方法相应参数是根据Ventana PD-L1(SP142)做IC检测而进行优化的。实际上,这就意味着Ventana PD-L1(SP142)检测不能直接和22C3克隆的Pharm Dx、28-8克隆的Pharm Dx、Ventana PD-L1(S263)检测互换,因为后面这三种检测可能会将更多的肿瘤归为PD-L1阳性。
6.新兴标记物的确定
PD-L1是有价值的预测性生物标记,但并不完美。PD-1/PD-L1检查点抑制剂疗效较好,也可见于部分肿瘤并不表达PD-L1的病例,尚需进一步研究来确定并定义乳腺癌免疫治疗的最佳标记物。未来的免疫治疗生物标记物最大可能是包括多项,如整合CD8阳性细胞计数、肿瘤浸润性淋巴细胞评分、遗传学改变,甚至其他未知的指标也可能整合入ER-/HER2-/PD-L1+乳腺癌的免疫组化检测中。
——全文完——
往期回顾:
旧文新读-乳腺病理中某些特殊免疫组化指标判读及陷阱(一)
旧文新读-乳腺病理中某些特殊免疫组化指标判读及陷阱(二)
旧文新读-乳腺病理中某些特殊免疫组化指标判读及陷阱(三)

















共0条评论