[导读] 编译整理:wangxiaoxi
黏液乳头状室管膜瘤
定义
黏液乳头状室管膜瘤是一种神经胶质肿瘤,以血管周围梭形或上皮样肿瘤细胞呈放射状排列伴血管周围黏液样改变和微囊形成(CNS WHO 2级)为特征。
ICD-O编码
9394/1 黏液乳头状室管膜瘤
ICD-11编码
2A00.0Y & XH15U1 其他特异性脑胶质瘤 & 黏液乳头状室管膜瘤
相关术语
无
亚型
无
部位
黏液乳头状室管膜瘤几乎只发生于脊髓圆锥和终丝,是其中最常见的肿瘤,在一项研究的320例终丝室管膜瘤中占83%。已经描述了多灶性,源自颈胸脊髓、侧脑室、第四脑室和脑的示例也是如此。CNS外的肿瘤也可被识别;最常见的是骶尾部(类似脊索瘤)或骶前位肿瘤,子宫附件、坐骨肛门窝、纵隔和肺中描述的示例罕见。当黏液乳头状室管膜瘤发生在较高水平的神经轴时,必须排除圆锥/终丝原发。
临床特征
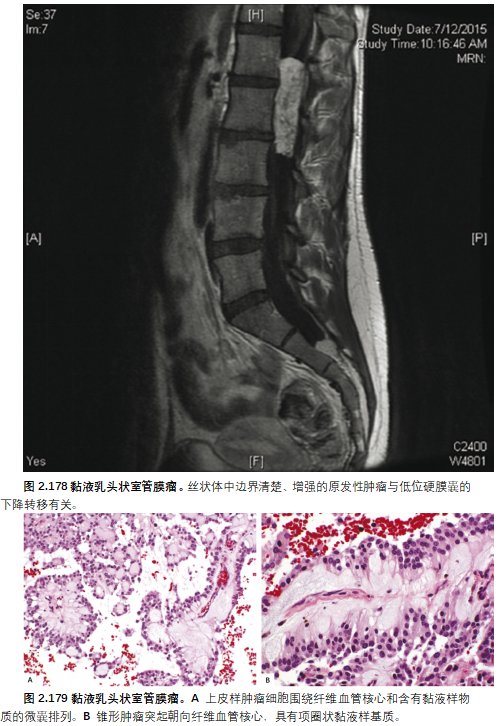
下背痛,通常是慢性的,几乎是黏液乳头状室管膜瘤的持续表现,可伴有坐骨神经痛、脊髓病的感觉运动障碍、阳痿或大小便失禁。可能需要紧急神经外科干预来恢复下肢功能。神经影像学表现为典型的卵圆形,界限分明,对比度增强肿块。脑脊液传播,特别是远端鞘囊的播散,在就诊时可能很明显。
流行病学
美国和欧洲报告的发病率为每100万人年发生0.6-1.0例,M:F比率为1.4-2.1 。黏液乳头状室管膜瘤可发生于所有年龄,但最常见于成人;一项SEER项目分析发现,25-29岁和45-59岁的患者病例率最高(美国,2004-2012,n = 773)。在另一项SEER计划研究中(针对年龄≤21岁的患者;美国,1973-2012,n = 122),中位患者年龄为16岁,63%的病例发生在男性患者。
病因
未知
发病机制
黏液乳头状室管膜瘤的发病机制尚不清楚。在这些肿瘤中已经描述了各种反复出现的染色体拷贝数异常,但没有一致的结构变异或其他驱动突变。与Warburg代谢表型相关的关键酶,包括HK2、PKM2和PDK的上调已经被证实。
肉眼外观
黏液乳头状室管膜瘤常有包膜,质地柔软,呈粉红色至灰褐色,可见凝胶状,可出现囊性变和出血。
组织病理学
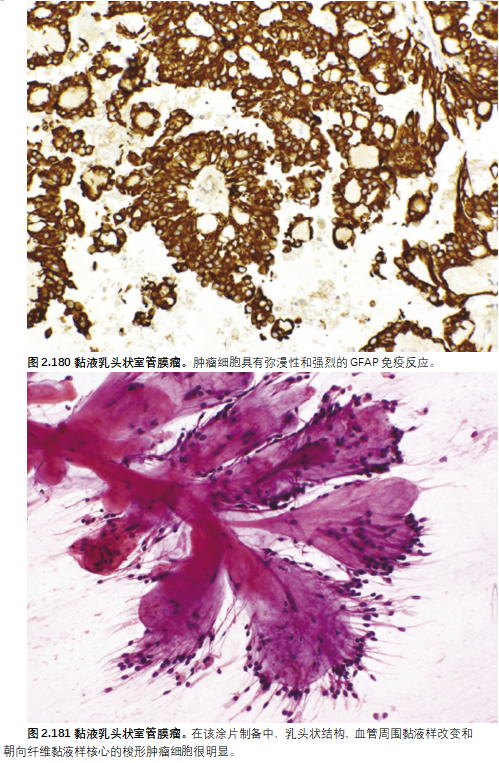
典型的是在玻璃样纤维血管核心周围呈放射状排列的立方到细长的肿瘤细胞,呈乳头状,血管周围和微囊中有嗜碱性粘液样物质积聚。黏液样物质,以PAS和阿利新蓝阳性突出显示,有助于识别很少(如果有的话)表现为乳头状结构并由融合片层中的上皮样细胞组成的例子。肿瘤细胞纺锤形和束状生长很常见,在其他典型病例中可见多形性肿瘤巨细胞亚群。显示针状网状蛋白染色的嗜酸性PAS阳性小球(气球)是偶发特征。常见的继发性改变包括纤维化、出血和含铁血黄素沉积。典型的黏液乳头状室管膜瘤最多仅表现出低水平的有丝分裂活性,Ki-67标记指数通常不超过2-3%。被称为“间变性黏液乳头状室管膜瘤”的例外情况表现为局部细胞过多和粘蛋白减少,并伴有以下至少两种特征:≥2个核分裂/mm2、Ki-67标记指数≥10%、微血管增生和自发性坏死。
免疫表型
GFAP的弥漫性免疫反应可区分黏液乳头状室管膜瘤与转移癌、副神经节瘤、神经鞘瘤、脊索瘤和黏液样软骨肉瘤。S100的免疫标记也很典型,CD99和CD56的反应性很常见。肿瘤细胞核对OLIG2无免疫反应性,通常不存在点状细胞质EMA标记。黏液乳头状室管膜瘤通常用AE1/AE3全角蛋白混合物标记,但它们通常对CAM5.2、CK5/6、CK7和CK20呈阴性。
细胞学
经典黏液乳头状室管膜瘤的术中压片和涂片显示上皮样至梭形细胞轮廓,血管周围肿瘤细胞呈乳头状结构伴血管周围黏液样改变,肿瘤细胞围绕黏液样微囊排列。这些特征在适当的临床环境中具有诊断价值。这些特征在细针穿刺材料中也可能很明显,可以评估GFAP的确证性表达。
诊断分子病理学
具有典型形态的黏液乳头状室管膜瘤很容易识别,但这些肿瘤也具有独特的DNA甲基化特征。然而,具有典型室管膜瘤组织病理学特征的肿瘤,尤其是具有伸长细胞型或乳头状模式的腰骶段病变,也可能与黏液乳头状室管膜瘤聚集在一起。这反映了黏液乳头状室管膜瘤可以表现出很少的黏液样改变,形成通常室管膜型的假菊形团,并表现出梭形细胞(tanycytic)特征。黏液乳头状室管膜瘤甲基化谱在非特征性组织病理学特征背景下的预后意义仍有待明确。已经记录了16号染色体的反复获得和10号染色体的丢失。
必要和理想的诊断标准
框2.40黏液乳头状室管膜瘤的诊断标准

分期
由于黏液乳头状室管膜瘤可能会出现软脑膜播散,一些研究小组建议应在初次手术和诊断后进行脑脊髓MRI和脑脊液细胞学检查。
预后和预测
脊髓黏液乳头状室管膜瘤在儿童和成人中的预后相对较好,10年总生存率大于90%。然而,许多患者的疾病持续存在,需要反复手术和辅助治疗,因为黏液乳头状室管膜瘤通常由于局部晚期生长和/或脑脊液播散至硬膜囊或更多的吻侧神经轴索而无法完全切除。儿科患者发生此类播散的风险较高,在≥50%的患者中诊断时可能很明显。发生于圆锥的肿瘤比马尾神经的预后差,因为前者与脊髓致密粘连,不太适合切除。放疗可改善无进展生存期。细胞学异型性和适度的有丝分裂活性似乎不影响结局。间变性肿瘤的侵袭性行为风险增加。脊髓黏液乳头状室管膜瘤很少转移至神经外部位,但转移经常使骶尾部肿瘤的病程复杂化。
室管膜下瘤
定义
室管膜下瘤是一种胶质瘤,其特征为均匀至轻度多形性肿瘤细胞核聚集在丰富的纤维基质中,易于发生微囊性改变(CNS WHO 1级)。
ICD-O编码
9383/1 室管膜下瘤
ICD-11编码
2A00.0Y & XH8FZ9 其他特异性脑胶质瘤 & 室管膜下瘤
相关术语
不推荐:室管膜下肾小球样星形细胞瘤。
亚型
无
部位
最常见的起源部位是第四脑室(50-60%的病例)和侧脑室(30-35%),其次是第三脑室和脊髓,其中室管膜下瘤优先作为颈胸段的偏心性肿块出现。已经报告了大脑、小脑、延髓和桥小脑角的实例。
临床特征
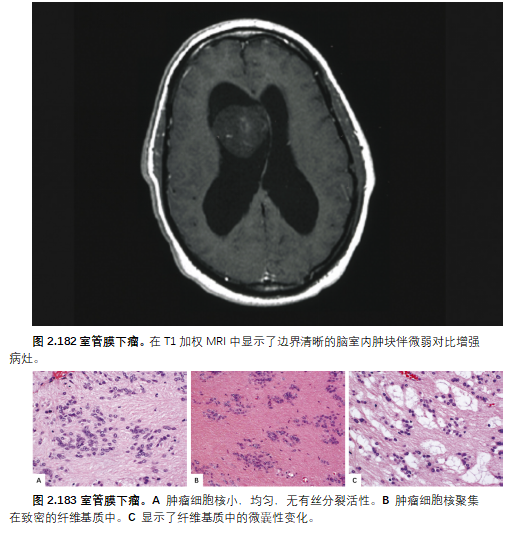
室管膜下瘤常无症状,仅在神经影像学上因无关原因或尸检时偶然发现。症状性颅内出血通常与脑室阻塞和颅内高压的表现相关,偶尔显示肿瘤内/脑室内出血的证据。提示脊髓病的感觉运动缺陷是髓内病变的特征。
影像
大多数室管膜下瘤的边界清晰,在T1加权MRI上为低或等信号,在T2加权MRI上为高信号;有些表现为钙化、囊性改变和对比增强病灶。
流行病学
由于室管膜下瘤在临床上常无症状,因此缺乏可靠的发病数字。一项针对466例颅内病例的SEER项目分析(美国,2004-2013)发现,总发病率为0.055例/10万人-年,男女比例约为2.5:1,发病高峰为40-84岁成人。室管膜下瘤约占室管膜肿瘤的8%,占颅内肿瘤的小于1%。
病因
易感因素有待进一步明确。家族性病例(包括同卵双胞胎中的例子)已得到充分证实,但较为罕见。其中包括与1型毛发指端综合征和胚系TRPS1突变相关的示例;散发性室管膜下瘤的一个子集也携带TRPS1突变。还在遗传性无虹膜和PAX6突变以及胚系PTPN11突变的努南综合征患者中描述了孤立的病例。据报告,颅咽管瘤患者会发生罕见的第三脑室室管膜下瘤。19号和6号染色体的丢失,后者仅限于幕下肿瘤,似乎在许多散发病例中发挥作用。
发病机制
室管膜下瘤显示的染色体或基因异常如何促进肿瘤发展目前尚不清楚。
肉眼外观
室管膜下瘤坚硬,灰色,通常是局限性的;颅内的例子通常以外生性的方式膨出到脑室。囊性改变、钙化和局灶性出血(不常见)可能明显。
组织病理学
典型的是小的、常染的、圆形至椭圆形的细胞核(类似室管膜下胶质细胞)聚集在大量的纤维胞质突起基质中。微囊性改变很常见,特别是侧脑室室管膜下瘤,钙化也是如此。可能会遇到核多形性和增生性微血管异常,特殊情况下会出现低水平的有丝分裂活性,甚至出现非栅栏状坏死。正如经典的室管膜瘤可以局灶性表现为室管膜下瘤型组织学一样,室管膜下瘤也可能局灶性表现为血管周围假菊形团。室管膜下瘤为主的肿瘤伴典型室管膜瘤结节(称为“混合性室管膜瘤-室管膜下瘤”)已得到公认,并在下文中提及(见预后和预测)。其他典型的例子也可能含有纤维性星形胶质细胞或(罕见的)肥胖细胞形态的成分。血管硬化和扩张、出血和含铁血黄素沉积很常见。奇怪的包括黑色素沉着和肉瘤变化。
免疫表型
室管膜下瘤表现出弥漫性GFAP免疫反应性,可显示局灶性点状EMA表达,但频率低于室管膜瘤。据报道,一些细胞表达OLIG2或突触素,但这似乎是例外。SOX10标记(如果存在)有限。还报告了HIF1α、TOP2B、MDM2、核仁素和磷酸化STAT3,以及水通道蛋白-1和水通道蛋白-4的表达。室管膜下瘤保留ATRX表达,不表达突变型IDH1 p.R132H或BRAF p.V600E基因产物,并且(除了罕见的延髓病变)H3 p.K28M(K27M)为阴性,但保留H3 p.K28me3(K27me3)表达。
细胞学
在涂片和压片中可见室管膜下瘤相对一致的圆形或椭圆形核特征、核聚集和纤维基质,这也可能显示黏液样和微囊性变化。
诊断分子病理学
分子分析显示幕上、后颅窝和脊柱解剖隔室中的室管膜下瘤具有不同的DNA甲基化谱。然而,尽管在这些分析中,每个部位具有室管膜下瘤组织病理学特征的肿瘤聚集在一起,而不被置于其他分子组中,但一些引起典型室管膜瘤形态学诊断的肿瘤也可能与典型室管膜下瘤聚集在一起。面对表面上不一致的形态学诊断,室管膜下瘤DNA甲基化谱的预后意义仍有待明确。
复发性拷贝数异常包括19号染色体丢失和6号染色体部分丢失(幕下病例)。已记录TRPS1突变。表现出室管膜下瘤型组织学的罕见脑干胶质瘤为H3 p.K28M(K27M)-突变型。
必要和理想的诊断标准

分期
无临床相关性
预后和预测
室管膜下瘤的预后极佳。术后复发罕见,即使在次全切除后也是如此,仅有室管膜下播散或间变性进展的特殊情况报告。细胞学多形性、偶见有丝分裂和坏死未证明具有预后意义。Ki-67标记指数 > 1%表征了一些室管膜下瘤表现出复发或监测中显著的间期生长。根据室管膜瘤成分的组织学对混合性室管膜瘤-室管膜下瘤的传统分级是基于历史序列的,这些病变的表现比单纯的室管膜下瘤更具有侵袭性,但最近的分析没有重复这一观察。19号染色体状态和DNA甲基化谱的评估可能证明对混合性或形态不明确病变患者的风险分层有用。表现出室管膜下瘤组织学特征的脑干胶质瘤中H3 p.K28M���K27M���突变的发生与快速致死性进展无关。
-----全文完-----
往期回顾
WHO CNS 5th(2021)室管膜肿瘤(一)
WHO CNS 5th(2021)室管膜肿瘤(二)
WHO CNS 5th(2021)室管膜肿瘤(三)
WHO CNS 5th(2021)室管膜肿瘤(四)
WHO CNS 5th(2021)室管膜肿瘤(五)
WHO CNS 5th(2021)室管膜肿瘤(六)


















共0条评论