[导读] 编译整理:强子
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(一)
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(二)
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(三)
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(四)
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(五)
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(六)
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(七)
春季尝鲜-第五版WHO关于甲状腺肿瘤的那些事(八)
5. “高级别”甲状腺癌的亚型及特征
预后介于较好的分化型滤泡细胞来源甲状腺癌(乳头状癌及滤泡癌)和极差的间变性癌之间甲状腺癌的诊断标准,已争论了几十年了。二十世纪八十年代提出低分化的结构、即实性/梁状为标准。岛状癌被认为是这组肿瘤的表现,即低分化“岛状”结构并伴高增殖级别(核分裂、肿瘤坏死)。2017年提出的都灵共识标准及目前的WHO分类都明确了诊断低分化甲状腺癌的组织学标准,并确定了其预后介于分化型和未分化(间变性)癌之间。
早在2000年,就有人提出根据肿瘤坏死及高核分裂对甲状腺乳头状癌进行分级。后续明确,增殖分级(根据核分裂高级肿瘤坏死)也可以确定预后为中间型的肿瘤,而不必考虑组织学分化中的乳头、滤泡或实性/梁状/岛状结构。因此,最新WHO分类中确定了两组预后风险居中的高级别非间变性滤泡细胞来源的癌,详见表4及下述。
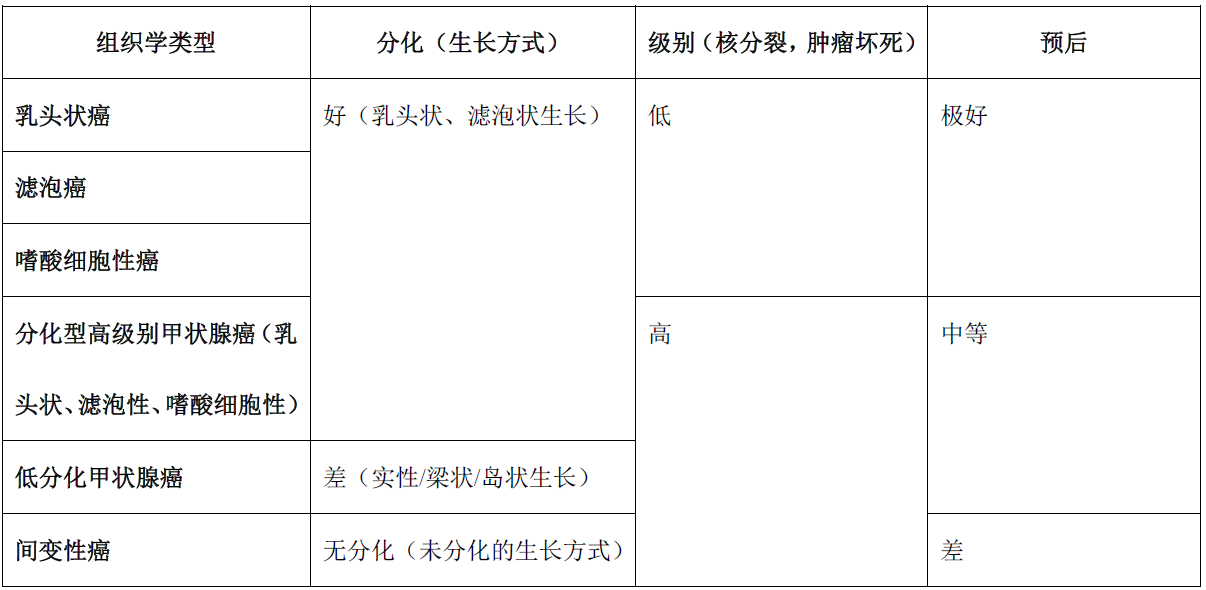
备注:组织学特点混杂的肿瘤,应按照分级最高、分化最差的成分进行分类。
A:低分化甲状腺癌(poorly differentiated thyroid carcinoma,PDTC),具体为浸润性、高级别的滤泡细胞来源的癌,结构呈实性、梁状、岛状生长(或兼有上述特征)而组织学为低分化。
B:分化型高级别甲状腺癌(differentiated high-grade thyroid carcinoma,DHGTC),具体为浸润性、高级别的滤泡细胞来源的癌,由于其仍有滤泡细胞来源高分化癌的独特结构和/或细胞学特征(如乳头状癌的细胞核特征和/或结构特点、滤泡癌的滤泡状生长),因此仍有分化。
约50%的高级别、非间变性甲状腺癌不会摄取放射性碘,也证实上述分类是合理的,因此对于这类患者可能需要新型治疗方案,尤其是针对某些分子异常进行的系统性治疗。
从临床及流行病学的角度来说,滤泡细胞来源的高级别非间变性癌、即低分化甲状腺癌和分化型高级别甲状腺癌具有某些共同点:二者均罕见,在所有甲状腺癌中的比例自不足1%、至6.7%不等;欧洲及南美人群发生率较高,北美及日本的发生率较低,这说明该组肿瘤的发生中可能有种族因素或饮食因素(碘)的影响。临床上,一般见于50岁以上成人,且表现为生长迅速的肿物,女性稍多。肿瘤一般较大(4cm或更大),并超出甲状腺范围,伴大血管侵犯、甲状腺周围软组织和骨骼肌的侵犯,附着于神经周围或侵犯神经。约30-50%的病例容易查见淋巴结转移。病理学上,该组肿瘤大体即有广泛浸润,但罕见情况下可有部分包膜。大体也可见局灶出血及肿瘤坏死。
低分化甲状腺癌和分化型高级别甲状腺癌的鉴别在于组织学检查,详见表5。低分化甲状腺癌具有实性梁状或岛状结构。部分病例中,瘤细胞的细胞核小而深染、呈扭曲的葡萄干样表现,类似甲状腺乳头状癌的细胞核。罕见情况下,可见大而多形性的细胞核。低分化甲状腺癌的标志是存在肿瘤性坏死,可表现为小灶区,或大片坏死物伴瘤细胞残影及核尘。如果无肿瘤性坏死,则核分裂应达到至少3个/10HPF(或约2mm2)才能达到低分化癌的诊断标准。核分裂活跃的嗜酸细胞性癌常有坏死,由于其一般为实性或梁状生长,因此可满足低分化甲状腺癌的诊断标准;罕见情况下,低分化甲状腺癌可由透明细胞构成。
表5. 滤泡细胞来源的高级别甲状腺癌组织学诊断标准
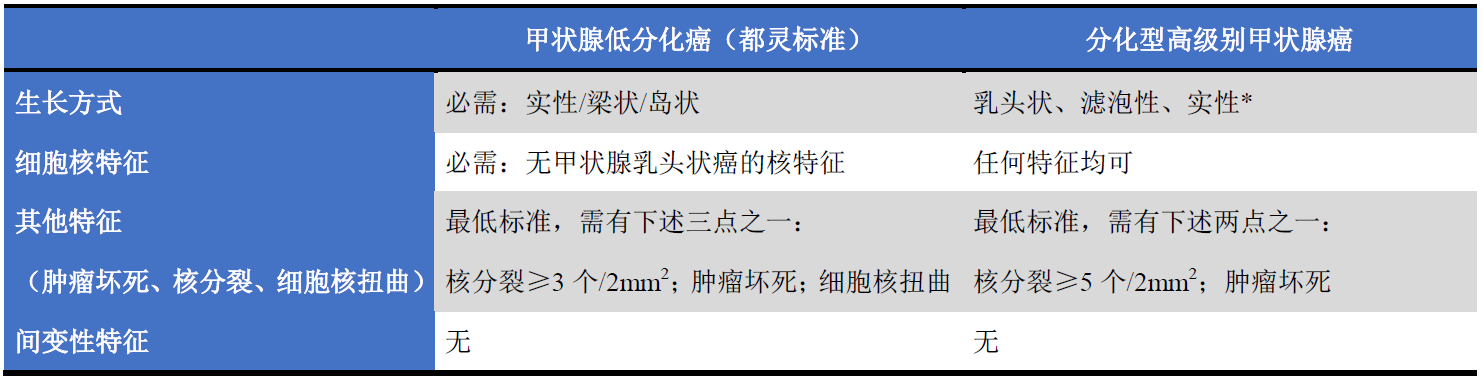
*:呈实性生长、且有甲状腺乳头状癌核特征的肿瘤,归为高级别分化型甲状腺癌。
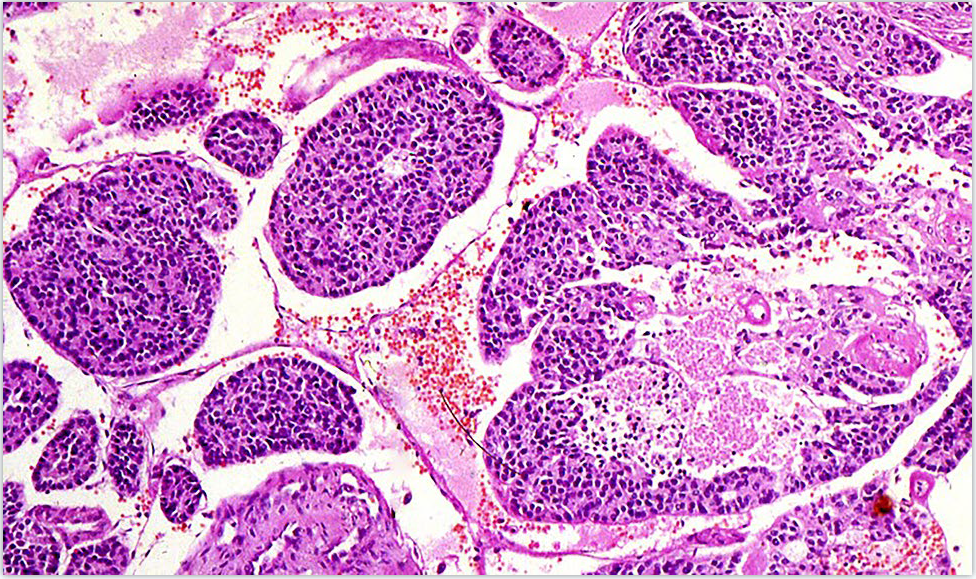
图1. 低分化甲状腺癌,本例呈实性巢状结构,无甲状腺乳头状癌的细胞核特征,有肿瘤坏死。
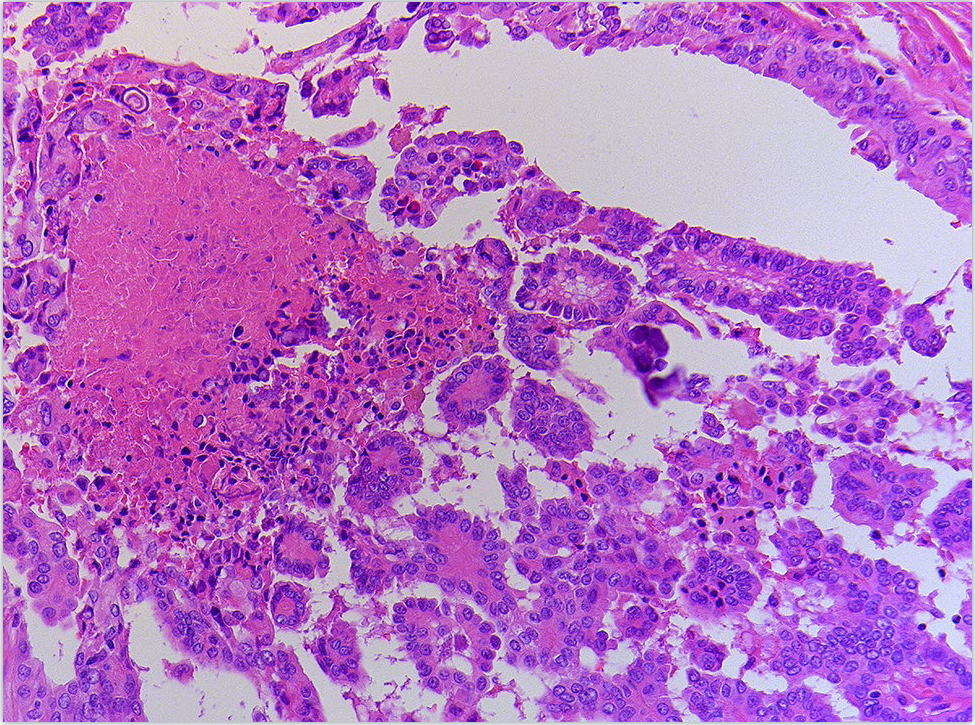
另一方面,分化型高级别甲状腺癌生长方式类似高分化肿瘤,且大部分病例中为乳头状。乳头状癌的细胞核特征可广泛存在,但部分区域也可有核增大及多形性。确定为分化型高级别甲状腺癌的特征性组织学表现为坏死和/或显著核分裂活性(超过5个/10HPF或约2mm2)。常见血管侵犯、淋巴管侵犯、神经周围侵犯、甲状腺外侵犯。
图2. 高级别甲状腺乳头状癌,图示一例BRAF样高级别甲状腺乳头状癌中的肿瘤性坏死。
新版WHO分类中不再支持用高倍视野来计算核分裂,因为不同的显微镜下其面积是不同的。WHO分类中推荐用平方毫米作为标准,而不必考虑所用显微镜型号及数字切片的问题。不过,由于该领域大部分研究都是用的高倍视野,因此在描述中仍保留了这部分。
免疫组化方面,低分化甲状腺癌和分化型高级别甲状腺癌均表达TTF1、PAX8、CK(一般为CK7)、Tg。Tg多为弱阳性,且为局灶、逗点状着色。Ki-67增殖指数高,一般为10-30%。免疫组化可用于排除其他肿瘤,如髓样癌、甲状旁腺癌、转移至甲状腺的癌,且可用于证实血管侵犯。尤其需要注意的是伴显著核分裂及肿瘤坏死的侵袭性髓样癌,这时常表现为实性及梁状生长,但免疫组化降钙素、CgA、单克隆CEA可用于和滤泡细胞来源低分化肿瘤的鉴别。
从分子生物学角度来说,低分化甲状腺癌和分化型高级别甲状腺癌具有BRAF(BRAF V600E)、RAS的驱动突变或较为少见的基因融合(一般为RET或NTRK3)。此外,还常有侵袭性继发突变,最常见为TERT启动子,某些病例中为PIK3CA及TP53。如果严格定义无甲状腺乳头状癌核特征性的情况下,低分化甲状腺癌多见RAS突变;相反,分化型高级别甲状腺癌大部分为BRAF V600E突变驱动,因为大部分具有乳头状癌的细胞-结构特征,这也解释了为什么分化型高级别甲状腺癌颈部淋巴结转移几率较高的问题。
大规模研究中,低分化甲状腺癌(都灵标准)的10年总生存率46%,疾病特异性生存率60%。不满足都灵标准的高级别非间变性滤泡细胞来源的癌(如分化型高级别甲状腺癌)疾病特异性生存率近似(56%),但高级别甲状腺乳头状癌的无病生存率可能低分化甲状腺癌差。低分化嗜酸细胞性甲状腺癌的预后似乎和非嗜酸细胞性低分化甲状腺癌的预后相似。
高级别非间变性滤泡细胞来源的癌罕见类型为包裹性及局限于甲状腺内的情况。尽管这类肿瘤有些会浸润血管,但肿瘤切除后患者的8-10年疾病特异性生存率居中。低分化癌罕见于青少年。有一组来自三个单位的六个病例研究,发现具有DICER1的体细胞性突变;其中2例也具有种系突变,因此为DICER1综合征。该组肿瘤所致死亡率为30%。
未完待续
点击下载原文文献
参考文献
Baloch ZW, Asa SL, Barletta JA, et al. Overview of the 2022 WHO Classification of Thyroid Neoplasms. Endocr Pathol. 2022;10.1007/s12022-022-09707-3.
doi:10.1007/s12022-022-09707-3

















共0条评论