[导读] 编译整理:张仁亚,王强
α1抗胰蛋白酶缺陷
α1抗胰蛋白酶缺陷(α1-Antitrypsin deficiency,AATD)为SERPINA1基因点突变所致的常染色体共显性遗传病(共显性是显性遗传的一种特殊形式,指一对等位基因在杂合状态下,两个基因的作用都完全表现出来,没有显隐之分)。该基因编码的是蛋白酶抑制剂α1-抗胰蛋白酶,具有广泛的抗蛋白水解和抗炎功能。这种酶主要在肝脏合成、并分泌入血。该基因的突变导致产生错误折叠的蛋白,从而在肝细胞内质网中蓄积并损伤肝脏。
对于该病,目前已识别出超过100个等位基因或变异体,其中部分与肝脏疾病相关。野生型蛋白被命名为M,野生型等位基因纯合子表现为PiM表型(基因型PiMM)。最常见的严重缺陷变异体是Z和S。杂合子PiMS和PiMZ表型通常不会致病,但属于危险因素,需要“二次打击”才会引发慢性肝病。相比之下,PiZZ纯合子会导致严重的α1-抗胰蛋白酶缺陷,分泌蛋白水平下降约85%,常随时间进展为纤维化、肝硬化及肝细胞癌。与PiZZ相比,PiSS和PiSZ等表型导致的疾病严重程度较轻。
α1抗胰蛋白酶缺陷的临床症状及严重程度高度不一,具体取决于年龄和基因缺陷的变异型。对于婴儿和儿童来说,临床可从无症状、至胆汁淤积性肝病、肝炎、甚至进展为肝硬化,罕见出现爆发性肝衰竭病例。成人患者的表现也有类似谱系性,具体从无症状状态、到脂肪变性、肝炎、纤维化、肝细胞癌都可以出现。
α1抗胰蛋白酶缺陷的特征性组织学表现是汇管区周围肝细胞内存在大小不一、PAS阳性、淀粉酶消化后仍有着色的嗜酸性小球。随着病变进展,这些小球可扩展至肝小叶的其他带,甚至在肝小叶内弥漫分布。早期诊断可能难度较大,尤其儿童患者;小于3个月的婴儿中,具有诊断意义的小球可表现非常轻微、甚至完全缺失,需要依靠表型分型或基因分型进行确认。将α1抗胰蛋白酶缺陷相关的胆汁淤积与其他病因(如新生儿肝炎或胆道闭锁)区分开来具有重要临床意义,尤其是考虑对疑似胆道闭锁患儿行手术治疗时(Kasai手术,即肝门空肠吻合术,是治疗胆道闭锁的首选和标准外科手术)。
α1抗胰蛋白酶缺陷标本中其他组织学表现可能还有汇管区和小叶的轻到中度淋巴细胞性炎症、肝细胞的细胞核轻度大小不一、轻度脂肪变性、程度不等的纤维化。新生儿可出现肝细胞气球样变、巨细胞转化、坏死、胆汁淤积、胆管减少及胆管反应,类似新生儿肝炎或胆道闭锁的病理特征。
图5为一例22岁男性,因Crohn病行甲泼尼龙、英夫利昔单抗、甲氨蝶呤治疗;肝脏相关的酶轻度升高,自身免疫性抗体及肝炎病毒血清检测结果阴性,超声为肝脏脂肪变性。为排除药物所致肝损伤、原发性硬化性胆管炎、脂肪性肝病而行肝脏活检。活检标本组织学为汇管区极轻微的淋巴细胞浸润,肝细胞内有模糊的嗜酸性小球,但其他方面无显著异常。淀粉酶消化后的PAS染色,在汇管区周围肝细胞内可见大量大小不一的玻璃样变小球,免疫组化进一步证实为α1-抗胰蛋白酶。后续检查发现该患者α1-抗胰蛋白酶表型为杂合型(PiMZ),血清α1-抗胰蛋白酶水平为75mg/dL(正常参考值为90-200 mg/dL)。
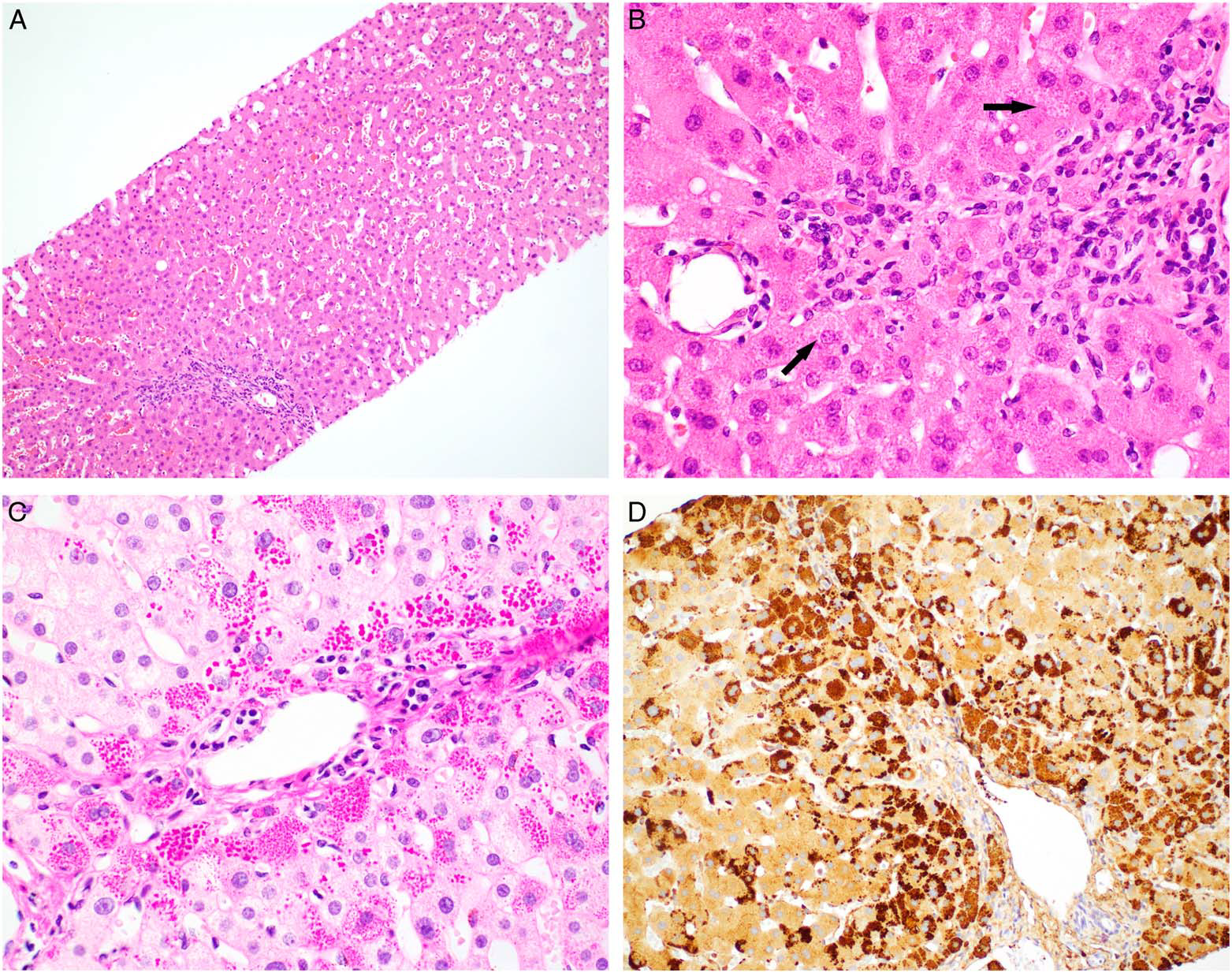 图5.本例α1-抗胰蛋白酶表型为杂合型(PiMZ)患者的肝脏活检,为近乎正常的组织学表现;仅见极轻微的汇管区淋巴细胞浸润、肝窦轻度扩张;高倍镜下在汇管区周围肝细胞内隐约可见胞质内嗜酸性小球(A、B)。淀粉酶消化后PAS染色,汇管区周围肝细胞内可见大量玻璃样变小球(C);免疫组化检测,胞质内小球α1-抗胰蛋白酶阳性(D)。
图5.本例α1-抗胰蛋白酶表型为杂合型(PiMZ)患者的肝脏活检,为近乎正常的组织学表现;仅见极轻微的汇管区淋巴细胞浸润、肝窦轻度扩张;高倍镜下在汇管区周围肝细胞内隐约可见胞质内嗜酸性小球(A、B)。淀粉酶消化后PAS染色,汇管区周围肝细胞内可见大量玻璃样变小球(C);免疫组化检测,胞质内小球α1-抗胰蛋白酶阳性(D)。
还要注意的是,淀粉酶消化后PAS着色的球形包涵体偶见于非α1抗胰蛋白酶缺陷的其他类型肝病,且此时的包涵体甚至也可能免疫组化α1抗胰蛋白酶阳性,具体如心力衰竭和Budd-Chiari综合征所致的静脉流出道受阻、病毒性肝炎或酒精引起的终末期肝病。这些包涵体可能随机分布,且出现于这些疾病时并无临床意义。尽管如此,查见这样的包涵体还是要提醒临床医师注意可能为α1抗胰蛋白酶缺陷,哪怕是存在明确肝病病因的情况下。
纤维蛋白原贮积病
纤维蛋白原贮积病是纤维蛋白原在肝细胞内质网中的合成、蓄积或分泌异常所致,进而导致血浆纤维蛋白原水平低下或缺失,或产生功能异常的纤维蛋白原,从而引发出血倾向。
纤维蛋白原主要在肝细胞内合成,由三条多肽链构成,即α、β、γ,其编码的基因分别为FGA、FGB、FGG。这些基因之一(主要是FGA)的突变会导致先天性纤维蛋白原缺乏,进而可以大致分为I型缺乏(量的缺乏)和II型缺乏(性质的缺乏)。I型缺乏包括无纤维蛋白原血症和低纤维蛋白原血症,II型则包括异常纤维蛋白原血症和低异常纤维蛋白原血症。纤维蛋白原贮积病还可因其他继发性原因导致,如获得性蛋白质分泌缺陷,一般是药物或感染引起的。
根据组织学和超微结构特征,肝细胞内的纤维蛋白原包涵体可分为三种类型:
I型包涵体:呈多边形,轮廓不规则;电子显微镜下可见扩张的粗面内质网中充满管状结构,后者排列成指纹样弯曲的束状;
II型包涵体:毛玻璃样表现;电子显微镜下可见扩张的粗面内质网中充满颗粒状或纤维样物质;
III型包涵体:圆形嗜酸性小球,周围有透明空晕;包涵体在电子显微镜下的特征和I型、II型相似,具体为管状或颗粒状物质构成。
有研究在重新评估了三例不伴有低纤维蛋白原血症的病例后,提议使用一个特异性较低的术语来指代II型和III型包涵体,如“苍白小体”(pale body)。他们的研究结果表明,II型和III型包涵体可能更多的是代表细胞对应激的反应、而不是和基因突变相关的遗传性纤维蛋白原贮积病相关。
HE染色切片中,可能难以识别出纤维蛋白原包涵体。其胞质改变可能会被误判为组织固定所致人为现象。淀粉酶消化后PAS染色、磷钨酸苏木精染色中更容易识别。免疫组化也有帮助,但大部分临床实验室可能并无相应抗体。电子显微镜下特征性的指纹状表现也有确诊意义。
图6病例为9岁男孩,皮肤良性囊肿手术切除前检查,发现肝脏相关的酶轻度升高,胫前区轻微瘀斑。病毒感染及自身免疫性疾病的血清检测结果阴性。肝脏活检未见汇管区及肝小叶的炎症、脂肪变性、胆汁淤积、纤维化。不过,肝细胞胞质丰富,隐约可见多个嗜酸性球形包涵体。电子显微镜下粗面内质网扩张,其中有致密排列的弯曲、管状电子致密结构,呈指纹样。全外显子测序确定FGA基因35号密码子存在杂合性错义突变。综合上述信息,本例诊断为低纤维蛋白原血症,患者的血浆纤维蛋白原水平仅为85mg/dL(参考值为215-464)。
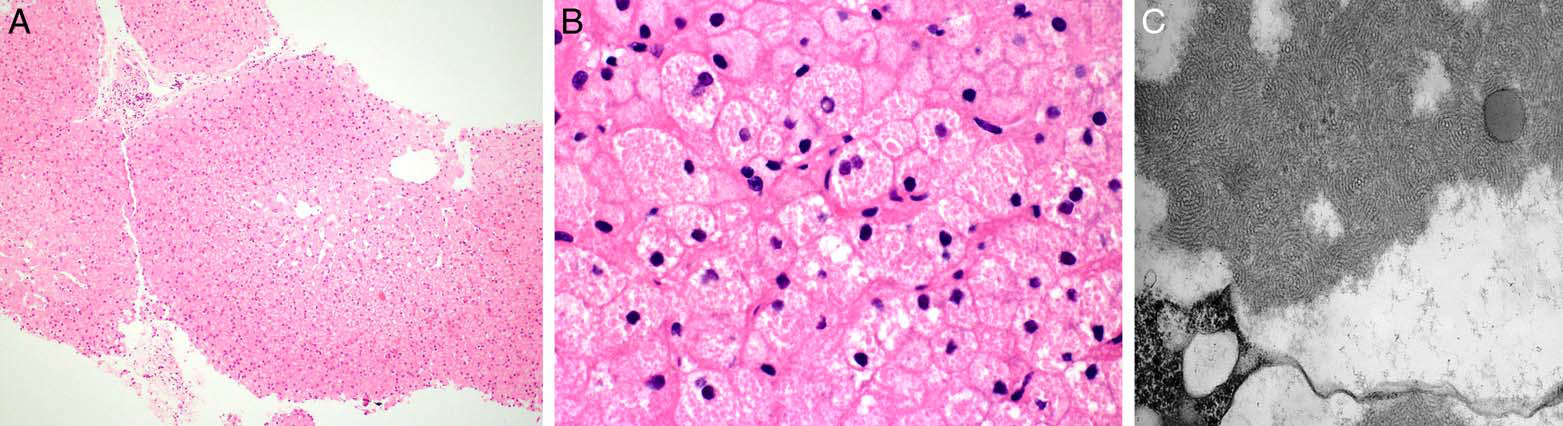 图6.低纤维蛋白原血症患者,肝脏活检组织学表现近乎正常,高倍镜下可见肝细胞增大、胞质内隐约有大量球形嗜酸性包涵体。电子显微镜下可见粗面内质网扩张,内有致密排列的弯曲、管状电子致密结构,呈指纹样。
图6.低纤维蛋白原血症患者,肝脏活检组织学表现近乎正常,高倍镜下可见肝细胞增大、胞质内隐约有大量球形嗜酸性包涵体。电子显微镜下可见粗面内质网扩张,内有致密排列的弯曲、管状电子致密结构,呈指纹样。
未完待续
往期回顾:
明察秋毫-活检貌似正常的某些肝脏疾病(一)
明察秋毫-活检貌似正常的某些肝脏疾病(二)
明察秋毫-活检貌似正常的某些肝脏疾病(三)















共0条评论