[导读] 编译整理:强子
非典型导管内增生
非典型导管内增生(atypical intraductal proliferation,AIP)也曾被称为非典型筛状病变(atypical cribriform lesion,ACL)或可疑导管内癌的非典型增生(atypical proliferation suspicious for intraductal carcinoma),目前其定义为:表现出比高级别前列腺上皮内瘤变(HGPIN)更显著的结构复杂性和/或细胞非典型、但未达到导管内癌(IDC)的诊断标准。Hickman等认为,AIP有两个特征:(1)跨管腔的疏松筛状结构;(2)细胞核相对均一,并无典型IDC时特征性的细胞核表现、也无管腔内坏死。不过,并非所有专家都认为需要达到跨管腔的增生才能诊断AIP。疏松筛状结构的定义则是腔隙结构占导管内细胞增生性病变的比例> 50%。
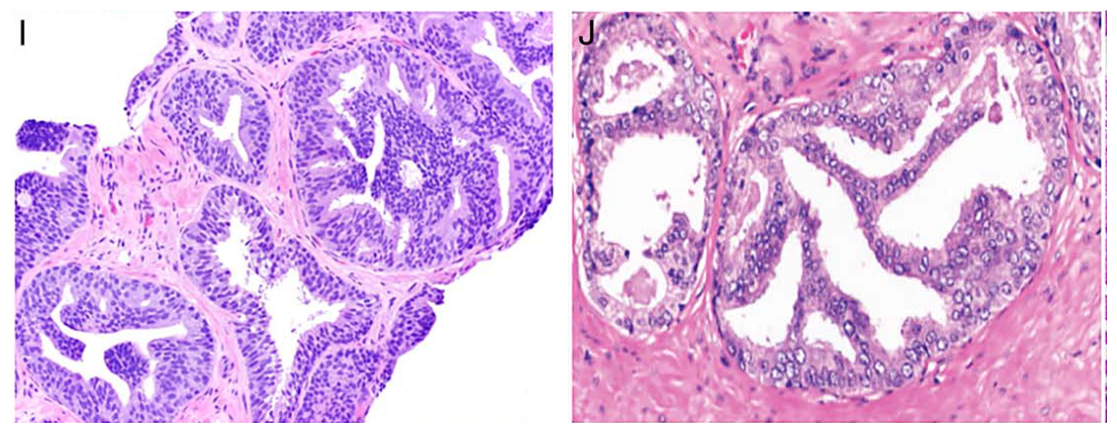 图6.(左)非典型导管内增生,特征介于高级别前列腺上皮内瘤变(HGPIN)和导管内癌(IDC)之间。此处筛状增生细胞密度高,但仅有轻度异型性;(右)非典型导管内增生,细胞密度不高,但细胞核非典型更显著,且核呈透明表现。
图6.(左)非典型导管内增生,特征介于高级别前列腺上皮内瘤变(HGPIN)和导管内癌(IDC)之间。此处筛状增生细胞密度高,但仅有轻度异型性;(右)非典型导管内增生,细胞密度不高,但细胞核非典型更显著,且核呈透明表现。
AIP中ERG阳性病例在不同报道中差异较大,从27%至72%不等。不过,有两项研究发现AIP和浸润性癌的ERG阳性情况近100%的一致,这说明它们有共同的克隆来源。AIP中PTEN缺失的几率为52%至100%不等,显著高于HGPIN中PTEN缺失几率(0%),且接近IDC。有三项研究发现,AIP和浸润性成分中PTEN缺失的一致率也很高(77%至100%)。
AIP中分子改变几率的巨大差异进一步印证了以下观点:AIP与非典型小腺泡增生(atypical small acinar proliferation,ASIP)类似,代表的是一个涵盖较广的诊断性范畴,而非具有独特生物学特征的病种。这也表明对于AIP还需更多研究,包括临床随访、分子特征的研究等。有趣的是,最近有研究提出采用一组生物标记物(Appl1/Sortilin/Syndecan-1)来帮助解决AIP诊断中的不确定性,并将其进一步分为HGPIN或IDC;但这一组合仍需进一步验证并与分子特征进行关联性分析。
只有在前列腺切除组织全部包埋的情况下,才能有把握的诊断真正的孤立性AIP。活检中的孤立性AIP罕见,因为大部分都伴有癌。文献中仅有两项对此类问题追踪重复活检的研究,且均发现孤立性AIP后续有50%至67%诊断出了癌,这一比例远高于HGPIN中后续诊断出癌的几率:Shah等人报道了12例仅有AIP的病例,后续有重复活检的6个病例中,4例发现了不同级别的癌,1例伴有IDC;第二项研究为36例仅有AIP、后续做了重复活检的病例,其中18例(50%)有恶性肿瘤,具体15例为浸润性癌,3例仅为AIP。
最近有研究将AIP活检结果(n=126)与预后之间的关系进行了分析,其中47例进行了前列腺切除且有切片可阅。该研究具体分组为活检中有分级分组1-2组的癌且伴AIP(无IDC或筛状肿瘤),对照组则无AIP。前者前列腺切除标本中有预后不良组织学表现的比例为89%,而后者仅为38%。
需要指出的是,AIP中的PTEN及ERG免疫组化结果都不能明确预测前列腺切除标本中的预后信息。这说明Gleason分级分组1组或2组查见AIP,意味着有未取到的高危型前列腺癌的风险,而这类患者本应适合密切随诊。
一项仅针对根治性前列腺切除标本进行的研究中,310例AIP或IDC的病例中有46例伴浸润性癌,且AIP相关的癌(n=10)和/或IDC相关的癌(n=36)相比无这些特征的腺泡腺癌(n=264)来说,前者分期与分级更高。AIP相关的癌与IDC相关的癌在分期、分级、淋巴结阳性情况、PTEN/ERG免疫组化方面均无差异。一项前列腺切除临床随访研究中,纳入了901例伴IDC、AIP、或HGPIN的病例,其中具有AIP的病例在生化复发风险方面显著高于伴HGPIN的病例,但显著低于伴IDC的病例。伴AIP的病例相比伴HGPIN的病例来说,Gleason评分显著更高、肿瘤体积更大、pT分期更高。总之,上述结果都提示,AIP的相关临床特征更像是IDC、而不是孤立性的HGPIN。
在本次会议前的调研中,67%的参与者强调,如果病例中仅有AIP,则需加做PIN4鸡尾酒的三项染色,并在报告中备注相关临床意义。这是为了排除浸润,因为伴筛状特征的浸润性腺癌可能会类似AIP。与此对应,对于同时有分级分组1组癌的AIP来说,75%的也会经过免疫组化而得以证实。这也与世界卫生组织的建议相符:粗针穿刺中检出AIP,需尽早重复活检。伴有更级别癌的情况下,大部分参与者都表示不会对AIP再加做免疫组化。
表3.关于AIP的会议投票结果
1.导管内疏松筛状增生、并伴以核仁显著为特征的细胞核非典型、但并无致密筛状/实性结构、无更显著的多形性核、无粉刺状坏死的情况下,应诊断为非典型导管内增生(AIP);(一致率93%)
2.粗针穿刺活检中,不管是孤立性AIP、还是伴浸润性癌的AIP,都要报告出来;(一致率59%)
3.粗针穿刺活检中有AIP的时候,不管是单独存在、还是混在占比更多的分级分组1级的癌中,都要做解释性备注;(一致率83%)
4.对于无明确IDC的根治性前列腺切除标本来说,不管所伴浸润性癌的分级分组,都要报告出其中的AIP。(一致率19%)
需要说明的是,该会议上对于问题1和问题3,很快就得出了共识,即什么情况下诊断AIP,以及仅有AIP、或AIP伴分级分组1组的癌时要对AIP做解释性备注。实际上,AIP对于更有临床意义的癌具有较强的预测意义。相反,对于根治性前列腺切除标本来说,仅19%的参与者会报告其中的AIP而不管肿瘤的具体分级分组;对于这一类型的标本来说,除了分组、分期、切缘状态外,AIP是否有更多预测意义,还没有更多数据可以参考。
非典型腺瘤样增生/腺病、增生性炎性萎缩
非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH;或称腺病)为拥挤的小腺体形成界清的簇状表现,不伴、或伴轻度的细胞核非典型,且并无浸润性模式。其最重要的鉴别诊断为Gleason评分3分的浸润性腺癌。AAH/腺病最常见位于移行带,因此多见于经尿道切除标本、而粗针穿刺活检中取到的要少一些。AAH/腺病至少会有不连续的基底细胞层,且免疫组化中AMACR常为轻至中度着色。
本次会议上之所以讨论AAH/腺病,是因为其某些分子遗传学改变、形态学改变与癌存在重叠。腺病FISH检测表明,60%的病例具有染色体8p缺失,9%的病例具有7号、8号、10号、12号、Y染色体的改变,且PTOV1表达升高,这些都与HGPIN相似。作为HGPIN和浸润性癌特征的端粒缩短,在AAH/腺病中的检出率约20%,而PIN中的检出率为68%,癌中的检出率为83%。需要注意的是,端粒缩短、或同时相邻有癌的AAH/腺病更常见表达AMACR。不过,有研究中的55例AAH/腺病中均无TMPRSS2-ERG重排。
上述结果表明,AAH/腺病可能是分级分组1组腺癌的前驱病变。报告出这一结果可能可以提醒其他会诊的病理专家关注特定的可疑病灶,并解释为何该病灶未被诊断为癌。不过,大家一致认为,AAH/腺病最多适合作为注释或显微镜下描述纳入报告,而不应作为首要诊断呈现。
关于增生性炎性萎缩(proliferation inflammatory atrophy,PIA)的描述为:散在分布的增生性腺上皮灶,形态学表现为单纯性萎缩、或萎缩后增生,且伴炎症。文献中已有PIA合并发生、或直接转化为HGPIN的报道。虽然部分萎缩性病变被视为PIA谱系中的一部分,比如萎缩后增生,有时也可能会类似浸润性癌,但基底细胞免疫组化标记和/或PIN4鸡尾酒的免疫组化标记可以做出排除。
PIA病灶中,增生的细胞占比增多,即Ki-67增殖指数较高。分子研究表明,PIA病灶中的GSTP1甲基化水平稍高于正常上皮,但低于PIN。虽然大部分研究都表明,PIA/局灶萎缩中并无TMPRSS2-ERG基因重排,或仅罕见有这一现象,但炎症程度重、且病变中萎缩上皮正处于向早期浸润性癌转化阶段的PIA病例中已经观察到有该基因融合以及ERG的mRNA和蛋白表达。对前列腺切除标本中炎症性萎缩病变的拓扑数字标注研究表明,伴有炎症的萎缩组织比无炎症的萎缩组织更倾向于靠近癌灶。这说明,PIA和低级别的癌之间至少有弱的相关性。与前所述相反,活检中的PIA则与检出有临床意义的癌几率降低存在相关性(优势比0.54)。上述结果都说明,PIA可能是某些早期的癌、或PIN的前驱病变,这一结果具有生物学意义,或可应用于癌症预防领域。目前来说,常规诊断为PIA并无临床意义。
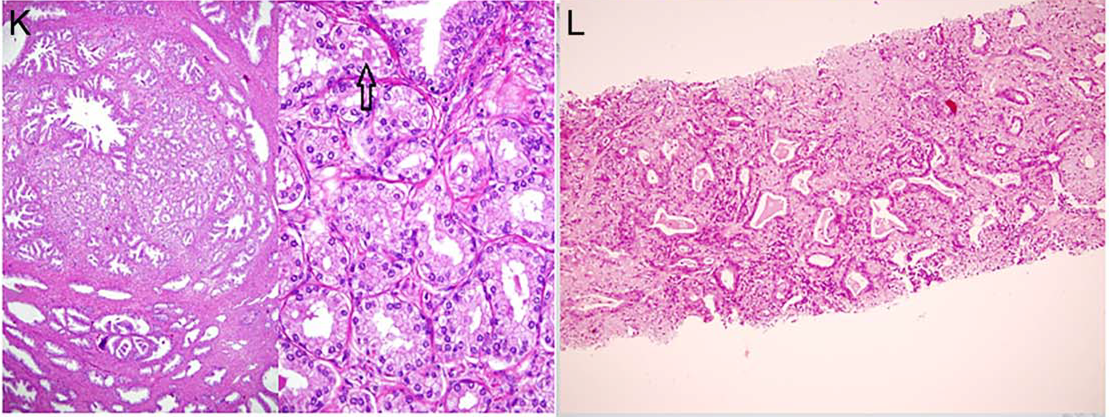 图7.(左图)良性前列腺增生(BPH)结节中的非典型腺瘤样增生(AAH/腺病)。病变无非典型特征,且可见淀粉样小体(箭头所示)。(右图)增生性炎性萎缩,背景为炎性表现,腺泡细胞的胞质减少,且有反应性特点。
图7.(左图)良性前列腺增生(BPH)结节中的非典型腺瘤样增生(AAH/腺病)。病变无非典型特征,且可见淀粉样小体(箭头所示)。(右图)增生性炎性萎缩,背景为炎性表现,腺泡细胞的胞质减少,且有反应性特点。
本次会议上,参会者赞同AAH/腺病和PIA在当前的临床实践中并无实际意义;关于是否应报告这一结果,未达成共识意见。
表4.关于PIA和AAH/腺病的会议投票结果
1.前列腺活检中,可疑病变具有类似、或可考虑为可疑浸润癌的特征时,可以选择性的报告为萎缩或增生性炎性萎缩(PIA),这样做是合理的;(一致率66%)
2.前列腺活检中很少遇到AAH/腺病。活检中可以选择性的报告AAH/腺病,但建议在可疑低级别浸润性腺癌的病例中还是要报告出来。(一致率54%)
要点小结
1.不要报告低级别PIN;
2.同时有癌、或有可疑为肿瘤的非典型小腺泡增生时,无需报告HGPIN;
3.对于IDC来说,致密筛状至实性的增生、无显著细胞核非典型及多形性,是要比极度细胞核非典型和多形性更有说服力的诊断标准,但这两种情况常都存在;
4.筛状HGPIN应被归为AIP;
5.仅有AIP、或AIP伴分级分组1组的癌的情况下,需要加备注,因为可能与更激进的特征有关;有浸润性癌的情况下,无需报告AIP;
6.PIA及AAH/腺病无需报告,但病理医师也可以自行决定将其放在镜下描述部分。
——全文完——
往期回顾:
前列腺癌前驱病变-来自国际泌尿病理学会的共识(一)
前列腺癌前驱病变-来自国际泌尿病理学会的共识(二)















共0条评论