[导读] 作者:陈旭
临床概要
男,28岁,装修工人,右手隐痛3月余,伴肿胀4天。MRI:右手大鱼际处可见一直径约为3cm肿物,考虑肿瘤病变可能。
大体观察
(右手大鱼际软组织病变)灰褐灰白不整形组织一块,大小5.5cm×4.3cm×3.6cm,组织切面灰白灰褐实性质稍硬,与周围组织界限不清,局部可见坏死。
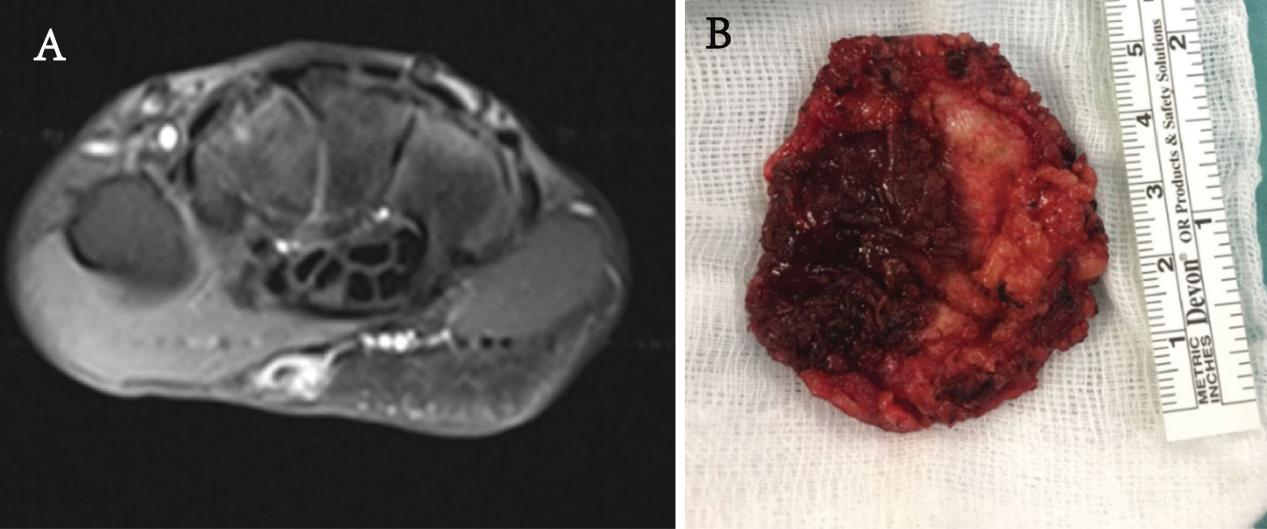
图1.患者影像及手术标本大体。(A)轴位T1加权MR图像查见手部大鱼际区肿物,与周围组织界限不清。(B)肿物切除标本。
组织学特点
低倍镜下,肿瘤细胞呈片状排列,实性生长,可见出血及坏死。中倍镜下,肿瘤细胞呈梭圆形,部分呈现上皮样形态改变,散在分布于出血组织中。高倍镜下,细胞异型性明显,核空泡状,核仁明显,可见核分裂像及灶状肿瘤性坏死,间质可见黏液变性,部分肿瘤细胞呈现横纹肌样形态改变。
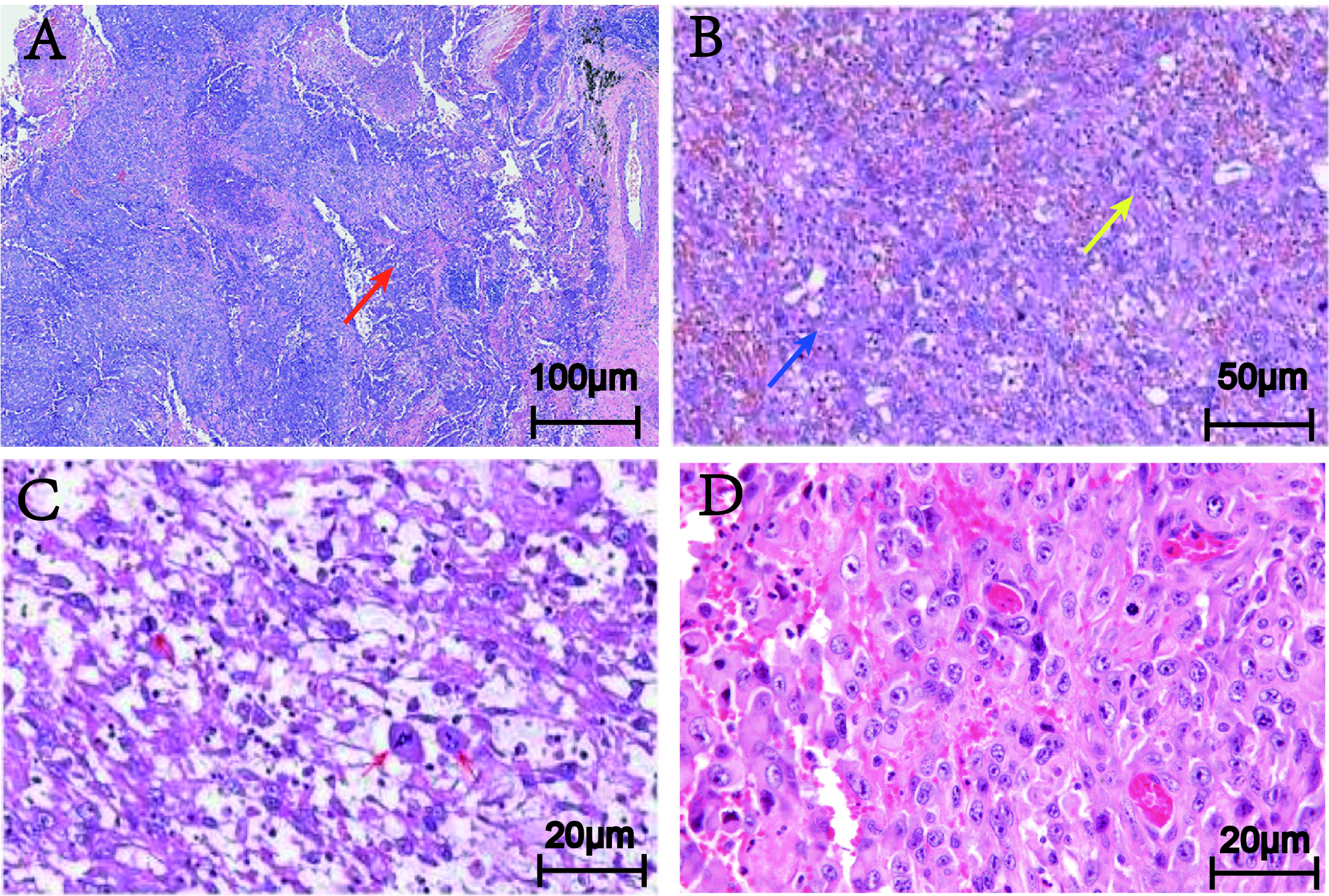
图2.病变组织形态学特点。(A,10X)低倍镜下,肿瘤呈实性片状生长,可见出血及坏死,侵犯周围血管平滑肌;(B,20X,图A红色箭头标记处)中倍镜下,肿瘤细胞呈现梭圆形,类似上皮样形态,分布于出血组织中;(C,40X,图B蓝色箭头标记处)高倍镜下,肿瘤细胞核大深染,染色质粗糙,核仁明显(红色箭头所示),间质呈黏液样变性;(D,40X,图B黄色箭头)部分肿瘤细胞呈现横纹肌样形态改变,其间红细胞弥漫分布。
免疫组化
肿瘤细胞表达:AE1/AE3(+),Vimentin(+),CD34(+),P63(-),HMB45(-),S-100(-),ERG(-),FLI-1(-),SS18-SSX(-),SMARCA4A(BRG1)(+),SMARCB1(INI-1)(-),MyoD1(-),Myogenin(-),EZH2(+),Ki-67(增殖指数约为80%)。
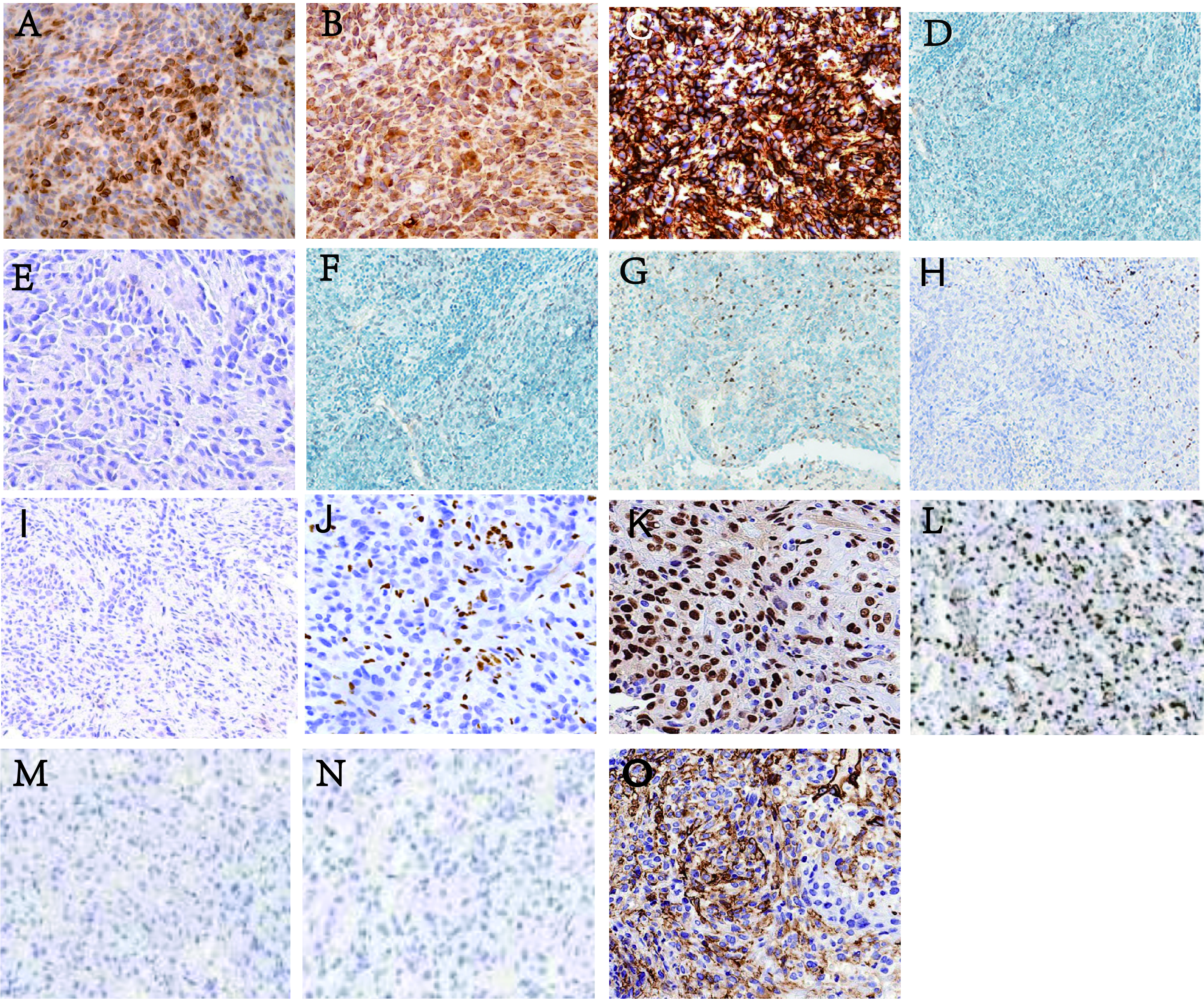
图3.免疫组化。(A)AE1/AE3;(B)Vimentin;(C)CD34;(D)P63;(E)HMB45;(F)S-100;(G)ERG,血管内皮细胞阳性;(H)FLI-1,血管内皮细胞阳性;(I)SS18-SSX;(J)SMARCB1(INI-1),血管内皮细胞阳性;(K)SMARCA4A(BRG1);(L)Ki-67;(M)MyoD1;(N)Myogenin;(O)EZH2
最终诊断
(右手大鱼际)上皮样肉瘤,经典亚型。
随访
患者术后行吉西他滨+多西他赛治疗,术后随访9个月,未见转移及复发。
小结
上皮样肉瘤是一种较少见的间叶源性恶性肿瘤,肿瘤细胞部分或完全有上皮样细胞形态和免疫表型,临床上常表现为皮下或深部软组织缓慢生长的肿物,易复发或发生淋巴结转移,预后较差。上皮样肉瘤有两种亚型:经典型上皮样肉瘤和近端型上皮样肉瘤。组织学上,经典型上皮样肉瘤由梭形细胞和上皮样细胞组成,多以上皮样细胞为主,当以梭形细胞为主时,易被误诊为纤维性肿瘤;部分病例间质囊性扩张伴出血,似上皮样血管肉瘤形态;20%病例伴有营养不良性钙化和骨化;少数病例也可见破骨样巨细胞。
经典型上皮样肉瘤和近端型上皮样肉瘤表达上皮标志物,包括CK、EMA、CK8和CK19,同时表达Vimentin;超过半数的上皮样肉瘤病例表达CD34,是该肿瘤重要的免疫表型,40%-67%病例表达ERG,一般为弱阳性,需注意与血管肿瘤相鉴别;SMARCB1(INI-1)蛋白胞核表达缺失,是该肿瘤的特征性免疫表型,有助于与其他类型的软组织肉瘤相鉴别。
上皮样肉瘤需与其他非肿瘤性和肿瘤性疾病相鉴别,包括各种类型坏死性肉芽肿性炎、类风湿结节、良性纤维组织细胞瘤、腱鞘巨细胞瘤等,但该类肿瘤与上皮样肉瘤形态不同,且不表达上皮标志物EMA和CK。
需要与上皮样肉瘤鉴别的肿瘤如下:
(1)肾外恶性横纹肌样瘤:主要发生于3岁以下的儿童,形态学与近端型上皮样肉瘤有重叠,且两者SMARCB1(INI-1)表达均缺失,但恶性横纹肌样瘤常表达AE1/AE3和EMA,不表达CD34和ERG。
(2)上皮样血管肉瘤:上皮样肉瘤有明显的出血和囊性变时,易与上皮样肉瘤混淆,但上皮样血管肉瘤表达CD31,且SMARCB1(INI-1)胞核阳性。
(3)滑膜肉瘤:双相性滑膜肉瘤既有梭形细胞又有上皮样细胞,局灶表达CK和EMA,与上皮样肉瘤相似。但滑膜肉瘤SMARCB1(INI-1)胞核阳性,且有特征性的分子遗传学改变,t(X:18)和SS18-SSX1/2融合性基因。
目前,手术切除和放、化疗是最易接受和最有效的方法。Zeste基因增强子同源物2(EZH2)是PRC2的催化亚基,驱动组蛋白甲基化和基因沉默。SMARCB1(INI-1)的丢失导致EZH2的异常激活。2020年,针对EZH2抑制剂氢溴酸他泽司他被批准用于上皮样肉瘤的治疗,为此类患者带来新的治疗方法和希望。
参考文献
1. Grünewald T G P, Postel-Vinay S, Nakayama R T, et al. Translational aspects of epithelioid sarcoma: current consensus[J]. Clinical Cancer Research, 2024, 30(6): 1079-1092.
2. Zhang S, Jing C, Liu H, et al. Epithelioid sarcoma: A single-institutional retrospective cohort study of 36 cases[J]. Journal of Orthopaedic Surgery, 2021, 29(3): 23094990211029349.
3. Gounder M, Schöffski P, Jones R L, et al. Tazemetostat in advanced epithelioid sarcoma with loss of INI1/SMARCB1: an international, open-label, phase 2 basket study[J]. The Lancet Oncology, 2020, 21(11): 1423-1432.
4. Krotewicz M, Czarnecka A M, Błoński P, et al. Distal and proximal epithelioid sarcoma—differences in diagnosis and similarities in treatment[J]. Oncology in Clinical Practice, 2025, 21(1): 60-70.
5. Farzaliyev F, Steinau H U, Ring A, et al. Classic type of epithelioid sarcoma of the distal upper extremity: clinical and oncological characteristics[J]. Hand, 2023, 18(6): 1037-1043.
















共0条评论