[导读] 编译整理:强子
导管内癌
导管内癌(intraductal carcinoma,IDC)名称的最初应用是1985年,早于PIN的广泛认识之前,用于描述“癌通过导管扩散的方式”。3级的HGPIN最初是等同于原位癌的,但当时IDC的概念尚未广泛推广,所以那时候很大程度上IDC被归类为了HGPIN的范畴之中。1996年,有研究在51例根治性前列腺切除术病例中观察到IDC是一种不同于异型增生、但二者常相互混杂的病变,作者当时还是将其称为HGPIN。尽管早有上述描述,但直至2016年IDC才获得世界卫生组织的正式认可-这是在大量研究证实IDC与不良病理特征及临床预后之间存在相关性之后才得以实现的。
关于IDC的定义,目前还有一定争议。不过,大部分研究都赞同:IDC是一种使导管腔扩张的病变(即有基底细胞包绕),其特征为中度至重度非典型细胞的增生,可形成筛状结构,甚至趋于呈实性生长。没有实性或致密筛状结构的时候,也有人提出:呈疏松筛状结构或微乳头状结构的病变如果具有显著细胞核异型性(部分研究中是指细胞大于正常的6倍)、或者具有坏死,则足以诊断为IDC。
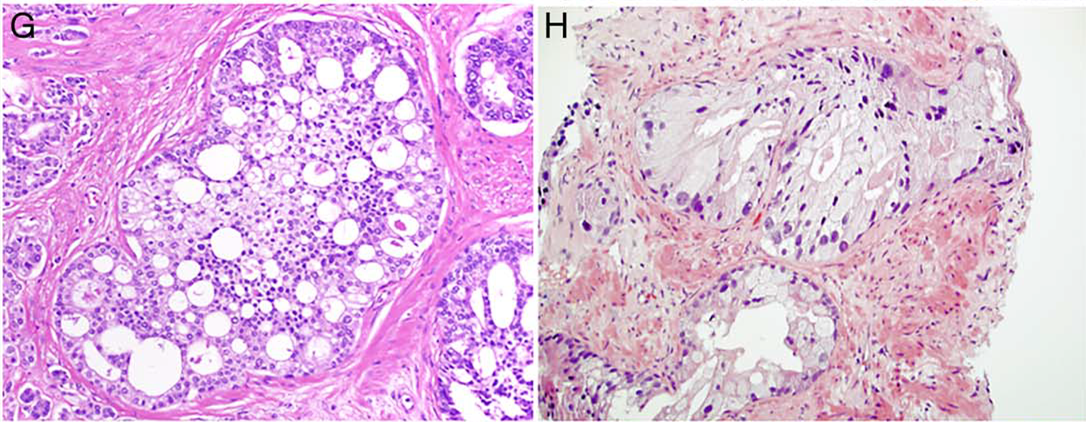 图5.(左)呈典型筛状结构的导管内癌,周边可见小而致密的基底细胞。(右)导管内癌中,常见显著核增大;但仅此一项不足以诊断为导管内癌。
图5.(左)呈典型筛状结构的导管内癌,周边可见小而致密的基底细胞。(右)导管内癌中,常见显著核增大;但仅此一项不足以诊断为导管内癌。
IDC定义的不一致,可能导致了观察者可重复性的问题,尤其是细胞核增大程度这一方面。2014年一项涉及39位专家在数字切片的研究中,HGPIN可以达到70%的一致性,浸润性癌的一致性为73%,而IDC的一致性只有43%。该研究中的38个病例有19个(50%)作为可能是IDC的备选病例,其中有5例(26%)被2/3的专家评估为IDC;但有9例(47%)被2/3的专家评估为非典型导管内增生(AIP)或IDC。不过,该研究的局限性在于专家并未评估整张数字切片,评估的是图片。
据报道,IDC与高级别、高分期、高肿瘤负荷的癌相关;且IDC也与预后不良、生化或临床复发相关。IDC最常见同时伴有高级别的浸润性前列腺癌。这方面可能有两种解释:IDC是疾病进展后期的病变,出现于浸润性癌形成之后(主流观点);IDC的发生与浸润性癌“齐头并进”。由于相邻无癌的孤立性IDC仅为罕见情况下遇到,这就更明显的对“IDC是癌前病变”的观点提出了质疑。
IDC的鉴别诊断主要应注意AIP(详见后述)、浸润性筛状癌(无基底细胞)、筛状型基底细胞增生、透明细胞筛状增生、前列腺导管腺癌。对前列腺导管腺癌来说,形态学为假复层柱状细胞、排列呈乳头状/筛状结构并伴裂隙样腔隙,具体可以为浸润性、也可以为导管内生长。
IDC中已报道了几种分子特征:常见为拷贝数改变,如IDC在特定微卫星标记位点上呈现的杂合性缺失(LOH)几率高于前述四种模式的浸润性癌;相比HGPIN来说,IDC则有某些染色体失衡。最近的研究主要针对的是PTEN和ERG:PTEN缺失一般见于伴ERG重排的病例,因此这两个标记可能可以用于评估克隆性、以及用于评估前列腺癌发生过程中的时序关系。免疫组化中PTEN着色部分或完全缺失的IDC病例占比为58-84%,这一数字远高于浸润性癌中的平均比例,当然后者会因肿瘤分级不同而不同;且很多PTEN缺失的IDC也会有ETS基因的重排。IDC中ERG重排的几率不一,文献报道为55%至75%,且与伴随的浸润性癌的状态相符合。
如前所述,前列腺切除标本中孤立性发生(即不伴浸润性癌)的IDC、或仅伴分级分组1组前列腺癌的IDC罕见。这类病变伴有PTEN缺失的几率低,且仅罕见有ERG重排。有研究对15例这样的病例做了二代测序研究,发现孤立性IDC中有MAPK通路和PI3K通路的活化型致癌驱动突变,而在伴随的分级分组1组前列腺癌中未见这些改变。这些结果支持这样的观点:此类病例中,IDC应被视为一种独立的高级别病变、很可能属于浸润前病变,而不是低级别浸润性癌的癌前病变。
HGPIN、IDC、浸润性癌的时序关系大多仍有争议,因为很难通过纵向分析来研究这一问题。用ERG表达状态和TMPRSS2-ERG基因断裂作为克隆性的标记,用PTEN缺失状态作为追踪病变相关克隆性时序演化的标记,Haffner等人通过全基因组测序研究发现IDC与其相邻的浸润性癌之间存在克隆上的相关性。尤其需要指出的是,他们发现有相当一部分的ERG阳性、PTEN阴性HGPIN和IDC病变很可能在克隆上是来源于相邻的PTEN阴性浸润性腺癌。这可能说明伴PTEN缺失的IDC半数以上(有时甚至包括部分HGPIN)并非癌前病变,而是由邻近浸润性癌逆向扩散至正常导管-腺泡腔隙所形成的(类似于乳腺的原位病变)。另一项研究进一步支持这种逆向扩散理论:该研究发现,双侧淋巴结转移灶的分子特征更类似原发灶中的IDC、而不是浸润性癌,这说明导管克隆化(colonization)与转移能力的获得是同步发生的。
不过,后续的显微切割/全基因组测序研究发现,ICD的遗传学改变既不是浸润性癌的纯粹前驱病变、也不是从浸润性癌而来的纯粹进展现象。比如,ICD和浸润性癌同时存在的情况下,部分病例中MED12L获得仅见于浸润性成分,部分病例中MYC扩增在IDC或浸润性癌中也是互斥的存在。这说明IDC和相邻浸润性癌之间的空间相关性、分子相关性都是复杂的,且可能与所研究的具体病变有关。该研究还发现,BRCA2种系性突变的癌也与IDC存在相关性:Wnt信号通路中,MED12L/MED12的扩增更常见于BRCA2种系突变的癌中,且在IDC中也呈富集表现。最后,在TCGA分子分型中,IDC常见于SPOP突变的癌这一分组中,且IDC中TP53与RB1基因的突变几率高。
就前列腺粗针穿刺活检来说,孤立性IDC、或伴分级分组1组前列腺癌的IDC一般提示存在未能取到的高级别癌。这当然应该马上重新取材;也有人提出,存在IDC应视为不要主动检测(即应当进一步干预)的指征。
浸润性癌的分级中,是否该包括同时伴有的IDC成分,在本次会议中并未特异强调,因为这与IDC是否为癌前病变的观点无关。文献中反复强调国际泌尿病理学会(ISUP)与泌尿生殖病理学会(GUPS)关于是否将IDC纳入分级体系存在分歧,已经引发了混淆。从实际工作的角度来说,标本中IDC的量很少达到足以改变分级分组的程度。上述两个学会于2025年3月在波士顿举行的联席会议上,专门就IDC问题进行了陈述和讨论。截至本文撰写时,与会者的投票程序仍未完成。此举将促成一份独立的波士顿出版物,专门探讨IDC的分级这一重要议题。此前的佛罗伦萨会议并未解决IDC分级的关键问题,在这一问题上ISUP与GUPS的意见存在分歧。
本次会议中关于IDC的共识性意见投票结果详见表2。需要特别指出的是,参与投票的会议代表认为,相对于单纯的极度核增大来说,致密、膨胀表现的筛状至实性结构是诊断IDC的更强依据。这一观点与前述关于诊断可重复性研究的结果相吻合,同时也与细胞核增大的相关数据相印证。
表2.关于IDC的会议投票结果
1.IDC是细胞形态为恶性的上皮增生,一般呈致密筛状结构,充满前列腺的大腺泡及导管并使其扩张,至少局灶保留有基底细胞;(一致率98%)
2.无致密筛状至实性增生的情况下,仅细胞核显著增大及多形性(超出HGPIN的范畴)可能也足以诊断IDC;(一致率65%)
3.无细胞显著增大及多形性的情况下(即不超出HGPIN的范畴),致密筛状至实性增生也可以诊断为IDC(这不同于AIP);(一致率82%)
4.研究表明,IDC很可能是癌逆向影响腺体或导管的克隆化;(一致率94%)
——未完待续——
往期回顾:
前列腺癌前驱病变-来自国际泌尿病理学会的共识(一)














共0条评论