[导读] 宗雪1 王淑芳1 王云帆1
1北京大学首钢医院病理科,北京 100144
通信作者:王云帆,Email:wangtaozyy@126.com
1.临床资料
患者男,17岁。主因发现右下肢肿瘤于外院就诊行手术治疗,术后组织病理学诊断为软组织肉瘤。术后行持续性化疗,于2023年3月结束治疗。2024年3月左、右侧腹股沟及右髂血管旁淋巴结转移,后行持续性化疗。同年8月因胸闷、胸痛就诊我院,胸部CT示双侧胸腔积液。细胞学检查结果与会诊HE切片及免疫组织化学染色切片,进行对比。
2.材料与方法
送检胸腔积液500ml,取50ml进行离心3000r/min,5分钟,弃上清,沉淀倒入液基瓶,放入液基细胞制片染色机进行制片,同时将剩余胸腔积液制作细胞蜡块(胸腔积液放入离心机内,离心3000r/min,5 min;弃上清,加入5ml中性福尔马林固定液和15ml 95%酒精;再次进行离心2000r/min,10min;弃上清,将细胞沉淀物用滤纸包入包埋盒,进行脱水处理),行细胞蜡块检查及免疫组织化学染色。
3.病理学检查
细胞学检查:胸腔液基细胞学见肿瘤细胞单个散在或聚集成簇,肿瘤细胞较大,是淋巴细胞的5~10倍,呈圆形或多角形,细胞核偏位,可见多核细胞核,核空泡状,多形性,核膜不规则,核分裂象可见。细胞蜡块:肿瘤细胞多散在存在,异型性显著,见1-5个细胞核,胞质较少,部分胞质嗜酸性,核仁明显。免疫细胞化学结果:肿瘤细胞表达S-100、SOX10、HMB45、Melan A,CK、CD68及间皮标志物Calretinin 、CK5/6、WT1均阴性。
会诊组织学切片:肿瘤位于皮下软组织,细胞呈短梭形细,细胞成片及束状排列,部分胞浆淡染,略透明,个别细胞可见色素,细胞核类圆形,核内见核仁,免疫组化化学结果,S-100、SOX10、HMB45、Melan A均阳性表达,符合透明细胞软组织肉瘤。
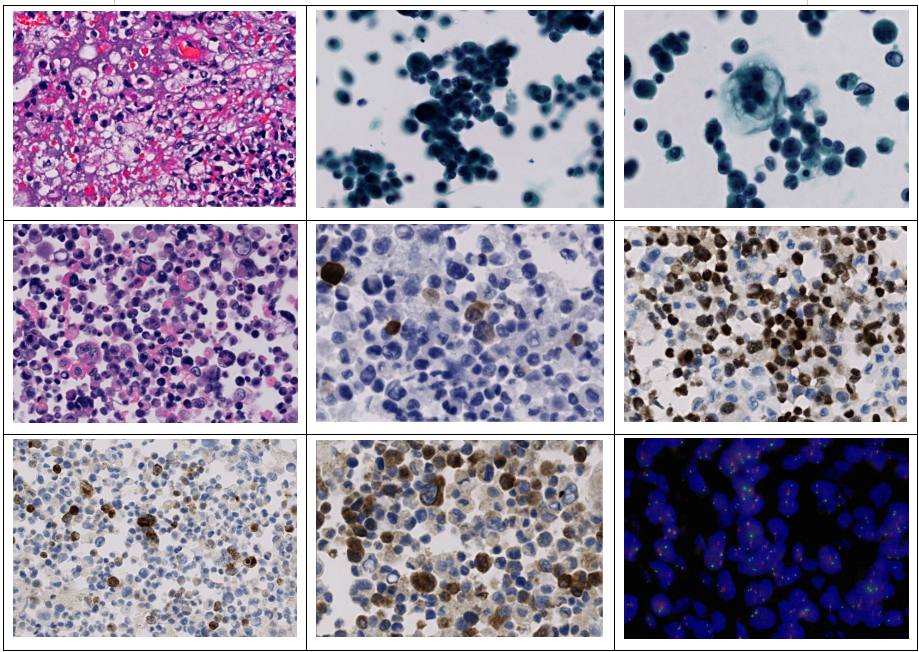 图1.软组织透明细胞肉瘤,瘤细胞呈短梭形或椭圆性,嗜酸性胞质为主,部分胞质透明,核圆形或类圆形,核染色质粗,核仁明显 HE高倍放大
图1.软组织透明细胞肉瘤,瘤细胞呈短梭形或椭圆性,嗜酸性胞质为主,部分胞质透明,核圆形或类圆形,核染色质粗,核仁明显 HE高倍放大
图2.胸腔积液液基片:肿瘤细胞簇状聚集,胞质少或中等量,核浆比高,异型性显著 液基低倍
图3.胸腔积液液基片:单个肿瘤细胞内见5个细胞核,核仁明显,胞浆泡状 液基高倍放大
图4.胸腔积液包埋块:肿瘤细胞异型性显著,见1-5个细胞核,胞质较少,部分胞质嗜酸性,,核仁明显,可见核分裂象 HE高倍放大
图5.肿瘤细胞表达 S-100蛋白 EnVision法中倍放大
图6.肿瘤细胞表达 SOX10蛋白 EnVision法中倍放大
图7.肿瘤细胞表达 HMB45 EnVision法中倍放大
图8.肿瘤细胞表达 Melan A EnVision法中倍放大
图9.胸腔积液包埋块荧光原位杂交检测 EWSR1分离探针,超过 50%的肿瘤细胞出现红绿信号分离,提示 EWSR1基因断裂 FISH法 高倍放大

图10.PRAME HE高倍放大
图11.PRAME 液基低倍
4.病理学结果
(胸水)液基+细胞蜡块:可见异型细胞,结合临床病史、免疫组化及FISH检测结果符合透明细胞软组织肉瘤转移。
5.讨论
软组织透明细胞肉瘤(clear cell sarcoma of soft tissue,CCS)是一种起源于神经外胚层的罕见且高度侵袭性的肿瘤,其特征是透明细胞形态和具有黑色素细胞分化,因此Enzinger于1965年首次将CCS描述为软组织恶性黑色素瘤[1]。但是,与黑色素瘤主要起源于皮肤内的黑素细胞不同,CCS起源于结缔组织结构,如肌腱和腱膜,在《世界卫生组织(WHO)第五版软组织和骨肿瘤分类》中,CCS的国际肿瘤疾病分类(ICD-O)编码为9044/3,不建议将其命名为“软组织恶性黑色素瘤”[3]。CCS常好发于年轻人四肢远端的深层部位,由于其形态学和免疫组化特征与黑色素瘤显著重叠,因此它们在浆膜腔积液细胞学诊断具有较大挑战。目前,国内外很少有研究充分阐述其细胞形态学谱,导致不少病理医师对CCS细胞学形态认识不足而发生误诊[2-4]。本例患者因胸腔积液首次在我院就诊,由于免疫组化特征的不典型性,险些导致误诊。最终通过会诊对肿瘤组织学切片进行详细分析,才避免了误诊的发生。因此,提高对CCS浆膜腔积液细胞学形态的认识,并结合免疫组化及分子检测手段进行综合判断和鉴别诊断,显得尤为必要。
回顾本病例,年轻男性,血性胸腔积液。与朱艳丽[2]报道CCS肿瘤细胞多以小体积细胞形态不同的是本例肿瘤细胞体积较大,液基细胞学见肿瘤细胞多簇状聚集,单个散在存在少见,肿瘤细胞异型性显著,多成多边/多角形,细胞质少至中等量、淡染细腻或空泡状,细胞核突出,多核肿瘤细胞可见1-5个细胞核,核仁明显。此肿瘤细胞形态需要与巨核细胞、间皮细胞及瘤巨细胞性肿瘤鉴别。免疫组化显示S-100、SOX10、HMB45、Melan A呈不同程度阳性,Ki-67肿瘤细胞阳性80%。鉴于CCS与恶性黑色素瘤在形态学和免疫组织化学上的相似之处,进一步应用荧光原位杂交(Fluorescence in situ hybridization,FISH)检测EWSR1探针断裂,结果显示存在EWSR1基因断裂,证实为CCS胸腔积液转移。相关研究[5]详细评估CCS5年生存率为62.9%,10年生存率为51.3%。局限性CCS(57.71%),区域性CCS(33.71%),远处/转移性CCS仅8.57%。本例随访及预后:患者术后半年发现腹股沟淋巴结转移,术后2年去世。
最近研究表明[6-7],PRAME高表达与恶性黑素瘤密切相关,并可用于区分黑素瘤与其他透明细胞肿瘤(包括CCS),PRAME阴性更支持CCS的诊断。本例经免疫组化证实肿瘤细胞未表达PRAME(如图?)。当结合组织学、免疫组织化学以及分子层面的研究,PRAME有望提升诊断的准确性,从而有效避免漏诊情况的发生[8]。
WHO皮肤肿瘤分类第五版纳入了类似CCS的新实体。在黑素细胞和软组织章节中描述并增加了3种新的实体,为MITF通路激活的皮肤黑素细胞肿瘤,包括CRTC1::TRIM11皮肤肿瘤(分化不确定的恶性软组织肿瘤)、ACTIN::MITF皮肤肿瘤(黑素细胞型)和MITF::CREM皮肤肿瘤(黑素细胞型)[9,10]。尽管这三种疾病在侵袭性和临床病程方面与CCS有很大的不同,但在组织学和免疫组化方面却非常相似。CCS分子遗传学标志是出现t(12;22)(q13;q12)易位使22号染色体上的EWSR1与ATF1(12号染色体上的CREB转录因子家族成员)融合,而ATF1是黑色素瘤和其他软组织肉瘤[5]中缺乏的染色体重排。考虑到分子诊断是鉴别CCS和黑色素瘤的必要条件,这一基因特征已成为鉴别CCS和黑色素瘤的关键[8]。
软组织透明细胞肉瘤(CCS)作为一种罕见的高度侵袭性肿瘤,其诊断面临三重挑战:形态学与黑色素瘤高度重叠、免疫组化表达相似,以及浆膜腔积液细胞学诊断经验匮乏。本例胸腔积液病例的误诊风险即源于此。综合分析表明,仅凭形态学和免疫组化无法可靠区分CCS与黑色素瘤或新近WHO分类中MITF通路激活的皮肤肿瘤(如CRTC1::TRIM11肿瘤)。分子病理学检测(t(12;22)易位形成EWSR1::ATF1融合)是确诊的核心依据,辅助标志物PRAME阴性可强化CCS诊断支持。在CCS胸水细胞学诊断中,结合形态学、免疫组化和分子检测结果,可以更准确地区分这两种肿瘤,建议由经验丰富的病理科医生进行综合评估。
[1] Enzinger FM. Clear-cell sarcoma of tendons and aponeuroses. An analysis of 21 cases. Cancer. 1965;18:1163-74.
[2] 朱艳丽,任文浩,王倩,等.细胞学容易误诊的转移性软组织透明细胞肉瘤1例[J].中华病理学杂志, 2022, 51(2): 149-151.
[3] World Health Organization (WHO). Classiffcation of Soft Tissue and Bone Tumours, 5th ed.; IARC: Lyon, France, 2020; pp. 300–302.
[4] Hisaoka M., Ishida T., Kuo T.T., et al. Clear cell sarcoma of soft tissue: a clinicopathologic, immunohistochemical, and molecular analysis of 33 cases. Am J Surg Pathol. 2008;32(3):452–460.
[5] Li, A.B.; Jiang, B.J.; Wang, H.H.; Yang, Y.S.; Zhang, X.B.; Lan, G.H.; Shu, W.B. Prognostic Factors for Survival in Patients with Clear Cell Sarcoma: An Analysis of the Surveillance, Epidemiology, and End Results (SEER) Database. Med. Sci. Monit. 2019.
[6] Lezcano, C.; Jungbluth, A.A.; et al.; Busam, K.J. PRAME Expression in Melanocytic Tumors. Am. J. Surg.Pathol. 2018, 42, 1456–1465.Cassalia, F.; Danese, A.; Tudurachi, I.; Federico, S.; Zambello, A.; Guidotti, A.; Franceschin, L.; Bolzon, A.; Naldi, L.; Belloni Fortina, A. PRAME Updated: Diagnostic, Prognostic, and Therapeutic Role in Skin Cancer. Int. J. Mol. Sci. 2024, 25, 1582.
[7] Cazzato Gerardo,Piscazzi Francesco,Filosa Alessandra et al. Clear Cell Sarcoma (CCS) of the Soft Tissue: An Update Narrative Review with Emphasis on the Utility of PRAME in Differential Diagnosis.[J] .J Clin Med, 2025, 14: undefined.
[8] Kalmykova, A.V.; Baranovska-Andrigo, V.; Michal, M. Update on cutaneous mesenchymal tumors in the 5th edition of WHO classiffcation of skin tumors with an emphasis on new fusion-associated neoplasms. Virchows Arch. 2024, 485, 777–792.
[9] de la Fouchardiere, A.; Pissaloux, D.; Tirode, F.; Hanna, J. Clear cell tumor with melanocytic differentiation and MITF-CREM translocation: A novel entity similar to clear cell sarcoma. Virchows Arch. 2021, 479, 841–846.
[10] Mocellin, S. Clear Cell Sarcoma. In Soft Tissue Tumors; Springer: Cham, Switzerland, 2021.















共0条评论