[导读] 编译整理:强子
实例展示之二:乙状结肠内镜黏膜下剥离标本
患者为80岁男性,因大便潜血阳性、进一步检查发现乙状结肠85mm息肉就诊。多学科讨论后,认为恶性风险高,因此行内镜黏膜下剥离术(ESD)整块切除病变。不过,术后出现了肠穿孔、需紧急行哈特曼手术(Hartmann's procedure)及结肠造口术。这一并发症的发生率约5.2%,具体与病变范围较大、部位位于近端、有纤维化相关。
组织学上,该息肉为管状腺瘤、伴低级别及高级别异型增生,且中央区域有高分化、黏膜下浸润的腺癌,后者最大宽度为7mm。未见脉管侵犯或神经周围侵犯;切缘未见肿瘤(R0)。肿瘤出芽不明显,但因为肿瘤深部散在急性炎症,因此未进行正式的肿瘤出芽评估。
需要注意的是,本例的组织学评估中可能会遇到几个方面的陷阱:无法观察到黏膜下的全层,黏膜肌有破坏,表面有溃疡。具体详述如下。
除了全层切除的标本外,结肠活检或内镜下切除标本中几乎都不会看到黏膜下的全貌。而要想实现足够的切除深度以达到切缘阴性、且获取诸如Kikuchi分级等组织学数据时,需要权衡肠穿孔、大出血、狭窄所致肠梗阻等手术并发症的风险。对于pT1期结直肠癌来说,只有可见固有肌层时才能做出Kikuchi分级的评估:因为只有这样才能像Kikuchi分级最初在手术切除标本中提出的那样、将黏膜下层分为三部分。如果标本中无黏膜下层全貌,病理医师不要尝试去评估Kikuchi分级;即使临床医师要求这样做(比如在多学科讨论的时候)也不要去迎合这一点。
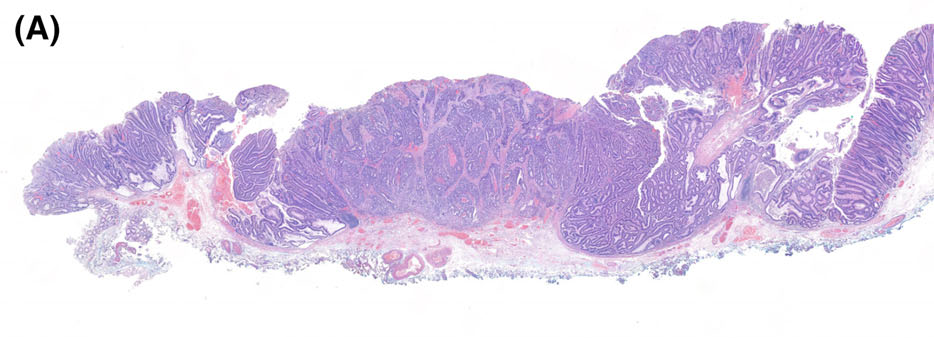 图3.本例标本中,黏膜下层仅部分可见,因此无法对Kikuchi分级做出精准评估。
图3.本例标本中,黏膜下层仅部分可见,因此无法对Kikuchi分级做出精准评估。
黏膜肌层的破坏或缺失有助于鉴别诊断:此时倾向于pT1期结直肠癌、而不是类似病变(如上皮易位)。这与黏膜肌层纤维的散乱(splaying)是不同的,后者是息肉扭转后的特征性表现。还要注意内镜和/或此前手术干预过程中所用黏膜抬举剂,也可导致息肉的解剖结构紊乱。对于已经证实的pT1期结直肠癌来说,相比黏膜肌保持完整者而言,黏膜肌破坏者的淋巴结转移几率更高。这种情况下,黏膜肌结构显著紊乱,会影响准确评估黏膜下肿瘤的深度。本例评估为切片中最深处肿瘤距离黏膜肌层3mm。
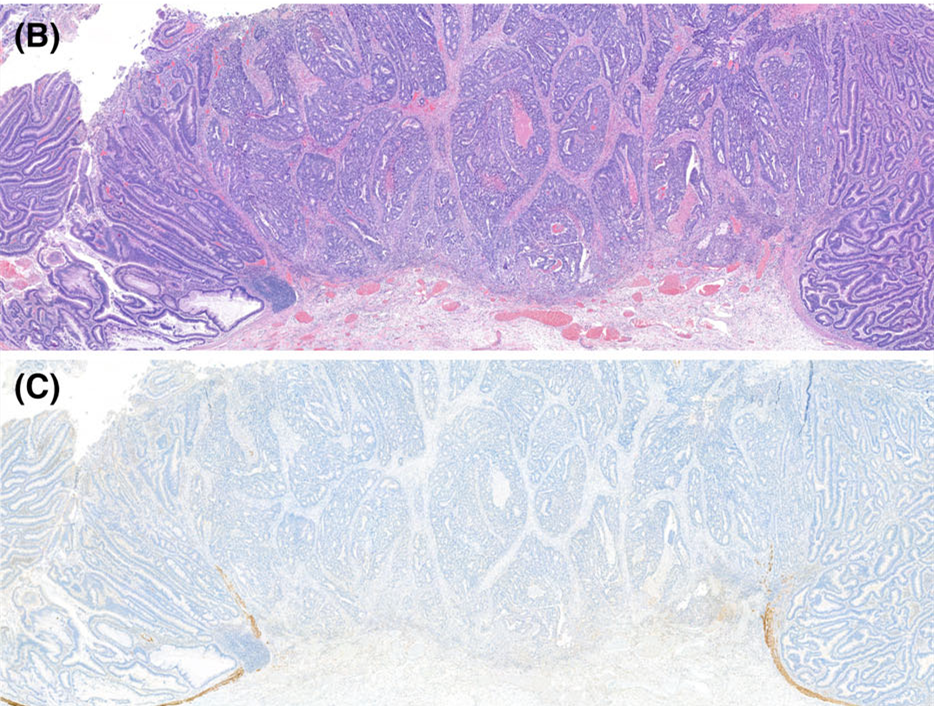 图4.本例为腺癌,但黏膜肌层缺失;因此无法精准评估肿瘤侵入黏膜下的深度。下图免疫组化为desmin。
图4.本例为腺癌,但黏膜肌层缺失;因此无法精准评估肿瘤侵入黏膜下的深度。下图免疫组化为desmin。
有研究发现,pT1期结直肠癌宽度>4mm、深度>2mm则脉管转移风险显著升高。该研究中黏膜下深度的测量中,上限参照的是黏膜肌层(如果有的话);如果没有黏膜肌层则上限参照息肉的表面。
Kiwachi等人采用日本结直肠癌学会(JSCCR)提出的方法进行测量,发现深度
无明确黏膜肌层的时候,浸润性成分和相关腺瘤的鉴别也可能很困难。如果黏膜肌层完全缺失,则深度的测量一般会从表面至浸润灶的最深处。不过这样做的话,测量出的深度几乎都是≥1mm,因此被广泛视为淋巴结转移的显著危险因素,且常用于结肠切除的标准。按照黏膜下浸润宽度作为肿瘤大小的衡量标准,可以规避深度评估中的某些缺陷;且文献研究表明,pT1期结直肠癌浸润宽度的测量具有高度一致性。
乙状结肠较大的息肉中,常见表面溃疡和炎症,且这些情况可能会导致难以区分高级别腺瘤型异型增生和腺癌。不过,溃疡和炎症主要影响的是细胞学特征的观察、而不会影响肿瘤性腺上皮的结构特征,而结构特征对于高级别异型增生和腺癌的区分更为重要。对于腺癌累及息肉表层并覆盖腺瘤成分时,溃疡形成可能会导致对腺癌浸润深度的低估。如果伴有扭转及相关的上皮易位(本例中无这些表现),则从组织学鉴别腺瘤和早期的腺癌可能难度更大。
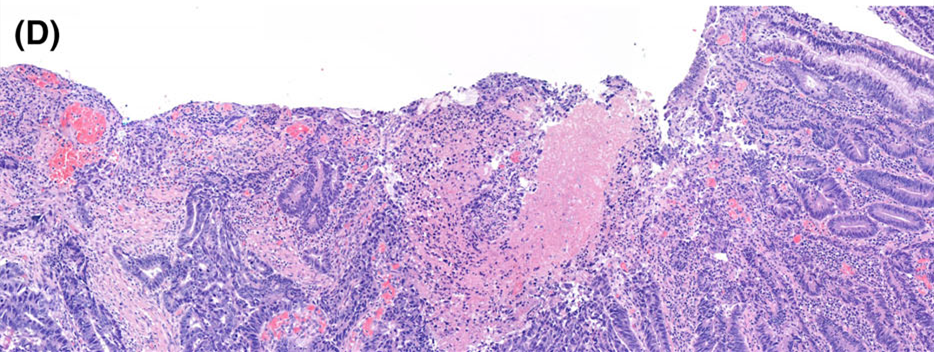 图5.本例息肉表面有溃疡,这可能会导致低估腺癌深度的判断。
图5.本例息肉表面有溃疡,这可能会导致低估腺癌深度的判断。
——未完待续——
往期回顾:
pT1期切除结直肠癌标本组织学评估中的陷阱(一)
pT1期切除结直肠癌标本组织学评估中的陷阱(二)
















共0条评论