[导读] 编译整理:强子
实例展示之一:乙状结肠息肉切除标本
患者为42岁男性,有直肠癌转移病史,曾因肝脏多发转移做过放化疗及手术治疗;定期内镜随诊中发现乙状结肠有4枚息肉,息肉切除标本中,1枚为早期息肉状癌(pT1)。多学科评估认为局部复发及进一步发生结直肠癌的风险高,建议密切内镜随诊并生化(CEA)和影像学随诊。
组织学上,该息肉为带蒂的管状腺瘤、伴低级别及高级别异型增生,且其中局灶为中-高分化的腺癌。未见脉管侵犯或神经周围侵犯;手术切缘有肿瘤累及(R1);肿瘤出芽分级为Bd1。虽然本例已有明确的转移性结直肠癌病史,但息肉切除的pT1期肿瘤组织学评估中仍可能存在某些陷阱,具体如:斜切,电刀假象,肿瘤出芽评估方面的问题;具体分析如下。
组织包埋时定位欠佳导致的斜切,可能会影响pT1期结直肠癌的精确镜下评估。直线测量淋巴结转移的某些组织学危险因素时可能会产生误导性数值,具体如肿瘤大小、与手术切缘的距离。对非肿瘤区域黏膜中隐窝形态仔细观察,可为是否斜切提供判断依据-非肿瘤性隐窝未垂直于黏膜表面,则提示可能是斜切。标本大体检查与取材过程中的规范操作,以及石蜡包埋阶段的组织精准定位,是最大限度降低斜切风险的最可靠方法。
就本例而言,虽然可能存在上述局限性,其黏膜下浸润深度评估结果为距离黏膜肌2mm,最大宽度3mm。对于带蒂息肉来说,组织定向不理想时,应谨慎评估Haggitt分级。本例Haggitt分级评估为3级:虽然难以准确定位,但腺癌似乎至少局灶侵入了息肉颈部。斜切严重阳性组织学评估结果的时候,要把这一信息转达给多学科诊疗团队。
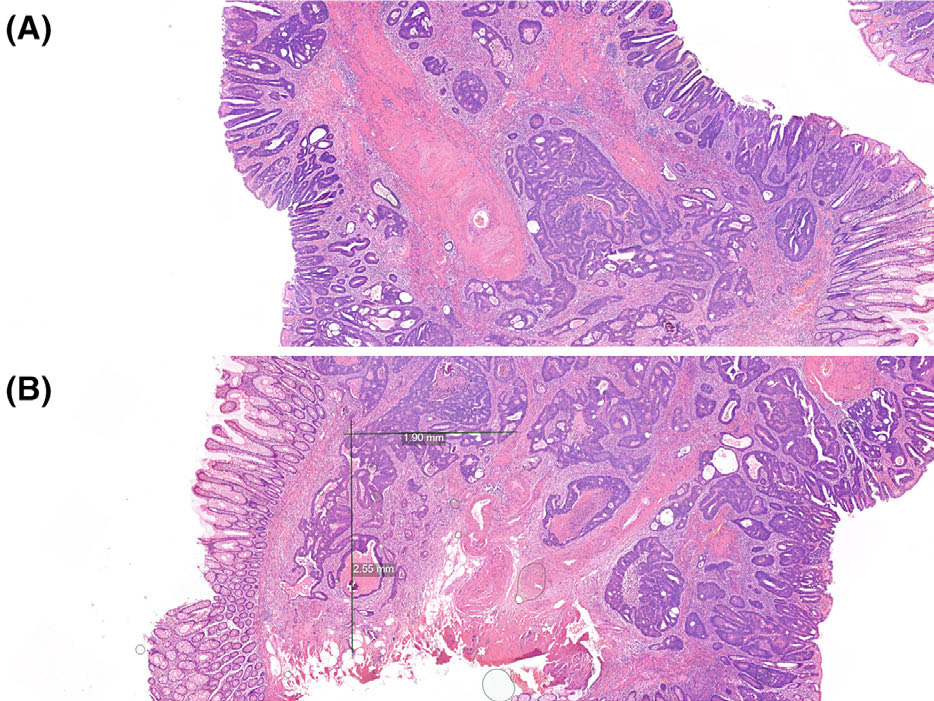 图1.(A)本例存在斜切,具体体现在:(主要与黏膜固有层相关的)肿瘤性腺上皮细胞团紧邻黏膜肌层纤维及厚壁血管;(B)本例中难以区分斜切与腺癌组织;但原作者仍对最有把握诊断为腺癌的区域进行了宽度与深度的测量标注。
图1.(A)本例存在斜切,具体体现在:(主要与黏膜固有层相关的)肿瘤性腺上皮细胞团紧邻黏膜肌层纤维及厚壁血管;(B)本例中难以区分斜切与腺癌组织;但原作者仍对最有把握诊断为腺癌的区域进行了宽度与深度的测量标注。
电刀假象及相关的组织收缩,也会导致难以准确评估腺癌与组织切缘的距离。英国皇家病理医师学会建议报告手术切缘的距离要精确到0.1mm。就本例而言,肿瘤距离切缘不足1mm(具体为0.3mm),按照应该皇家病理医师学会、国际癌症报告协作组织、英格兰肠癌筛查计划的相关指南,均为切缘阳性(R1)。如果烧灼区域有肿瘤性腺体,切缘也被视为受累及,如本例就是如此。烧灼区存在肿瘤相比肿瘤与手术切缘距离>0mm来说,前者淋巴结转移风险更高(P=0.04)。
2016年国际肿瘤出芽共识会议后,发布了结直肠癌肿瘤出芽评估建议,且英国皇家病理学家学会自2023年4月起将其纳入了pT1期结直肠癌局部切除标本指南。这一举措本身也存在相应局限性。比如有些情况下无法进行有效的肿瘤出芽评估,具体如:炎症区域,腺体破裂,黏液分化,同步进行新辅助治疗后。腺瘤或腺癌深部的急性炎症和/或脓肿形成导致上皮易位的情况并不少见,此时可类似肿瘤出芽。虽然可以尝试通过CK免疫组化来对肿瘤出芽进行分级,但这种做法仅用于显示出芽评级高的区域;还是要在HE切片中对这些区域的肿瘤出芽进行分级评估。肿瘤出芽评估中所需切面数量也没有规定。按照本文原作者日常工作来说,是检查至少3个切面,这样也有助于区分肿瘤出芽和低分化细胞簇(肿瘤浸润性前缘有≥5个肿瘤细胞)。也正是因为上述原因,所以人工智能用于肿瘤出芽评估可能很有必要:这样不仅可以节省病理医师的时间,也可以借此进一步对评估流程标准化、并巩固肿瘤出芽的预后指标的地位。具体到本例而言,肿瘤出芽评估为Bd1。
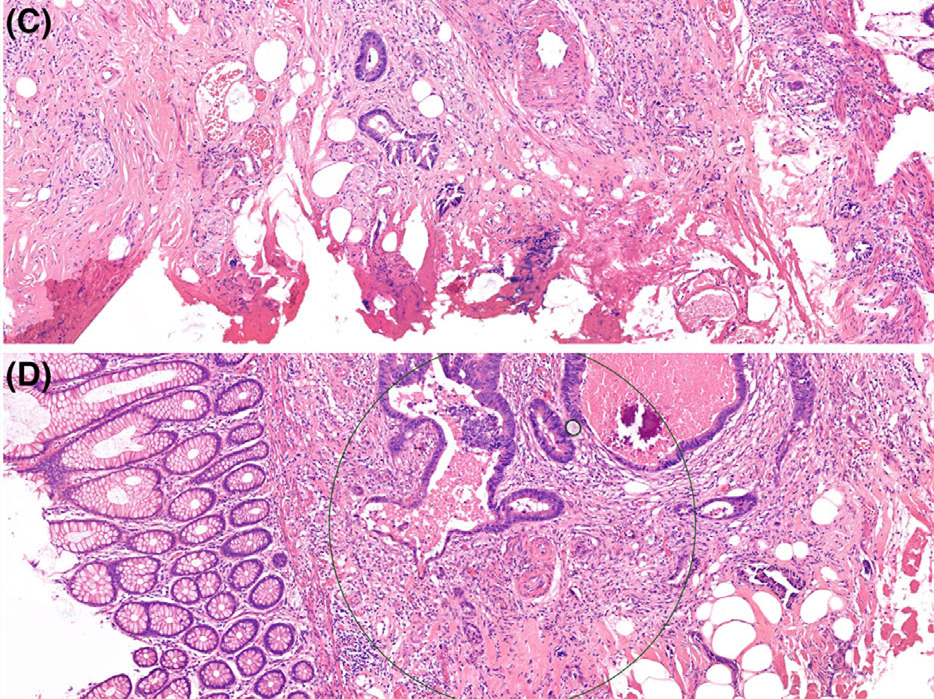 图2.(上)息肉电灼切缘存在电刀假象,且电灼区域深部位置的肿瘤腺体呈现不同程度的电灼假象。(下)肿瘤出芽评估。圆圈标示出0.785mm²的评估区域。该区域内仅见少量肿瘤出芽,因此出芽分级评为Bd1(低级别)。
图2.(上)息肉电灼切缘存在电刀假象,且电灼区域深部位置的肿瘤腺体呈现不同程度的电灼假象。(下)肿瘤出芽评估。圆圈标示出0.785mm²的评估区域。该区域内仅见少量肿瘤出芽,因此出芽分级评为Bd1(低级别)。
备注:肿瘤出芽评估的具体操作,为10倍物镜下扫描整个肿瘤浸润前沿(肿瘤-间质交界处),选择出芽最密集的区域、使用20倍物镜(视野直径约0.55mm,视野面积0.785mm2)计数分离的单个肿瘤细胞或≤4个细胞组成的细胞簇,重复计数3个相邻视野取平均值。最终结果的呈现为:出芽数量0-4个为低级别(Bd1),5-9个为中级别(Bd2),≥10个为高级别(Bd3)。
——未完待续——
往期回顾:
pT1期切除结直肠癌标本组织学评估中的陷阱(一)















共0条评论