[导读] 译者:慧海拾穗
【梭形细胞横纹肌肉瘤】
1992年首次提到“梭形细胞横纹肌肉瘤”[39],这是基于其梭形细胞形态、好发于睾丸旁区域、且预后比较好,在形态上是与胚胎性横纹肌肉瘤不同的亚型。随后的研究表明,虽然儿童期和睾丸旁区域发生的梭形细胞横纹肌肉瘤预后良好,但其他部位和成人的梭形细胞横纹肌肉瘤具有侵袭性的生物学行为[10,40-43]。几年后,硬化性横纹肌肉瘤被认为是梭形细胞横纹肌肉瘤形态谱的连续[42,44]。基于这些数据,2013年软组织与骨肿瘤WHO分类将梭形细胞/硬化性横纹肌肉瘤(spindle cell/sclerosing RMS, ssRMS)归为一类。从那时起,我们对SSRMS的理解和生物学分类迅速发生了转变。我们现在认识到梭形细胞横纹肌肉瘤至少有3种不同的临床病理和分子亚型,未来几年可能会有更多的亚型。包括目前作者在内的许多病理学家现在认为,至少有一部分最初被称为睾丸旁“梭形细胞横纹肌肉瘤”代表了胚胎型横纹肌肉瘤的梭形细胞变体(见上文)。
(1)MyoD1突变梭形细胞/硬化性横纹肌肉瘤(MyoD1 mutated spindle cell/sclerosing RMS)
MyoD1突变的ssRMS好发于青少年和年轻成人(但也可见于2岁以下的儿童),最常见的是发病部位头颈部、躯干和四肢[46,47]。形态学上,该亚组倾向于显示梭形和/或硬化模式(图3A-B),具有不同程度的横纹肌母细胞分化。通常会出现高级别的形态学特征,如核分裂象计数增加和肿瘤坏死。在以梭形细胞为主的病例可能类似于平滑肌肉瘤。相比之下,以硬化为主至纯硬化形态的病例可能表现出微腺泡特征(图3C),其中一些具有不同分化的横纹肌母细胞[48]。免疫组织化学显示,ssRMS这一亚型倾向于显示弱至缺失的myogenin染色和desmin表达不一。然而,MyoD1通常呈弥漫强阳性表达。这些肿瘤在MyoD1中均显示出L122R突变,该突变已被证明具有MYC样特性[49]。因此,这些肿瘤的预后较差。
(2)婴儿梭形细胞横纹肌肉瘤(Infantile spindle cell RMS)
婴儿梭形细胞横纹肌肉瘤[7],顾名思义,发生年龄为2岁以下,好发于颈部和躯干,其次是四肢[47,50]。在组织学上,其中一些肿瘤往往类似于婴儿纤维肉瘤(其中一些肿瘤可能在早期的研究中被报道为所谓的婴儿横纹肌纤维肉瘤[51])。肿瘤由相对单形的梭形细胞组成,呈短束状交织排列,瘤细胞具有少量嗜酸性细胞质和罕见的小核仁。部分病例高密度梭形细胞区域与低密度细胞区交替出现,低密度细胞区为胶原纤维内见散在少量肿瘤细胞。其他肿瘤更像平滑肌肉瘤,具有细长的细胞核和纤丝状嗜酸性细胞质[50]。坏死通常不存在,很少看到核分裂象,但具有高级别特征的罕见病例除外[52]。骨骼肌分化,表现为分化良好的横纹肌母细胞的存在,是通过形态学将这些病例与婴儿型纤维肉瘤区分开来的有用线索。肿瘤表达desmin, myogenin和MyoD1。婴儿/先天性梭形细胞横纹肌肉瘤已被证明含有涉及VGLL2、TEAD1和NCOA2的重现性基因融合,并与良好的预后和低转移潜力有关[46,47,50,51],很少有报道显示其具有更具攻击性的行为[52]。
Karanian及其同事[53]还报道了一组婴儿梭形细胞肿瘤,其形态和免疫表型具有广泛的横纹肌母细胞分化,但甲基化特征与其他横纹肌肉瘤亚型不同。在婴儿的椎旁区域出现的所有3例病例都存在涉及SRF与FOXO1或NCOA2的融合,预后良好。早期的一项研究[50]也提出了类似的病例,其形态学特征类似于平滑肌分化。
3.3.骨内梭形细胞横纹肌肉瘤(Intraosseous spindle cell RMS)
骨内梭形细胞横纹肌肉瘤的特征是TFCP2和EWSR1/FUS基因之间的融合,或更不常见的MEIS1::NCOA2基因融合[7]。这些肿瘤的就诊年龄范围较广(11-74岁)的成年人中更为常见,并好发于轴向骨骼和颅面骨,所有6例报告的MEIS1::NCOA2重排梭形细胞横纹肌肉瘤均发生于骨盆/骶骨[21,54,55]。组织学上,TFCP2重排肿瘤显示混合的梭形细胞和上皮样细胞特征,或不太常见的温和梭形细胞伴有明显的基质玻璃样变(图3D-F)。MEIS1::NCOA2基因重排的肿瘤可能显示更原始的梭形细胞组织学和/或可能显示上皮样细胞特征。虽然这些病例仍然相当罕见,需要进一步研究,但可能存在一些基因型-表型相关性[21,55]。TFCP2和NCOA2的骨横纹肌肉瘤的一个特征是ALK和/或斑片状细胞角蛋白的共表达,此外还有经典的骨骼肌标志物,如desmin、myogenin和MyoD1。在融合性肿瘤中,包括因疾病或持续性疾病死亡在内的侵袭性行为很常见[54,56-60],建议进行分子检测以区分这些肿瘤与肉瘤样癌。
3.4.其他融合基因驱动的梭形细胞横纹肌肉瘤(Other fusion driven spindle cell RMS)
最近,人们认识到越来越多的软组织梭形细胞横纹肌肉瘤涉及各种不同基因融合。迄今为止,已经描述了大约30例融合驱动的骨外梭形细胞横纹肌肉瘤,包括EWSR1/FUS::TFCP2、ZPF64::NCOA2/3、TCF12::VGLL3、DCTN1::ALK、MEIS1::NCOA2和MEIS1::FOXO1[54]。在免疫表型上,这些肿瘤已被证明以不同强度表达desmin、myogenin和MyoD1,有些病例显示角蛋白和ALK的共表达。从预后角度来看,它们的总体预后可能略好于MyoD1突变或骨内横纹肌肉瘤,但需要对每种融合类型的肿瘤进行更大规模的研究,以更好地确定其生物学潜力。
根据作者的经验,尽管形态学变化不一,但大多数类型的梭形细胞RMS显示出相当可靠的免疫表型,具有更多的局灶性desmin表达,myogenin表达罕见或缺失,但MyoD1通常非常弥漫强阳性表达。此外,如果肿瘤发生在骨内,免疫组织化学应考虑检测ALK和角蛋白。研究梭形细胞横纹肌肉瘤的形态可能有助于提出亚型,但在大多数病例中,鉴于需要突变分析(基于DNA)和/或融合(基于RNA)测试,最终的分类需要更全面的检测。
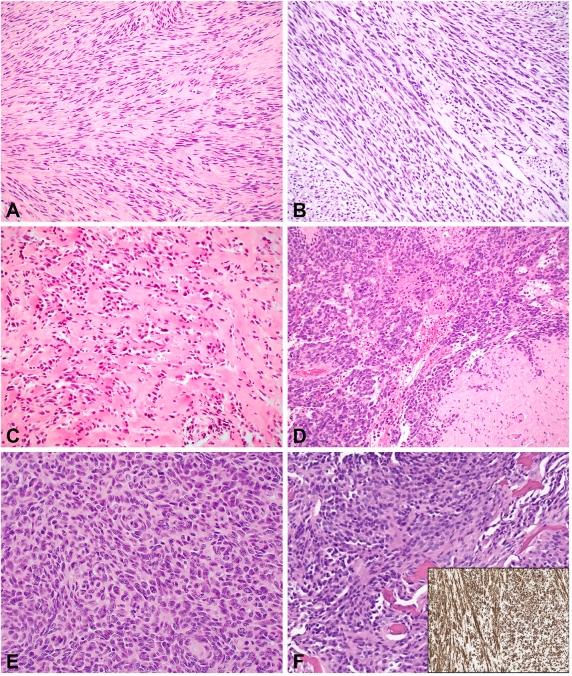
图3.梭形细胞横纹肌肉瘤:经典的梭形细胞横纹肌肉瘤显示梭形细胞束状排列(3A),图中可见明显的透明化区域(3B)。偶尔会出现假腺泡结构(3C)。这是一个携带MEIS1::NCOA2基因融合的骨肿瘤病例(3D);MEIS1::NCOA2基因融合肿瘤显示梭形细胞至上皮样细胞呈旋涡状排列(3E)。这是一个FUS:TFCP2基因重排的骨肿瘤病例,具有混合的梭形细胞和上皮样细胞特征(3F),免疫组织化学染色显示ALK呈弥漫性阳性(插图)。
参考文献
[1] Dehner CA, Rudzinski ER, Davis JL. Rhabdomyosarcoma: Updates on classification and the necessity of molecular testing beyond immunohistochemistry. Hum Pathol. 2024 May;147:72-81. doi: 10.1016/j.humpath.2023.12.004. Epub 2023 Dec 21. PMID: 38135061.
往期回顾:
横纹肌肉瘤分类最新进展和免疫组织化学以外分子检测的必要性(一)
横纹肌肉瘤分类最新进展和免疫组织化学以外分子检测的必要性(二)














共0条评论