[导读] 译者:慧海拾穗
【腺泡状横纹肌肉瘤】
腺泡状横纹肌肉瘤(Alveolar Rhabdomyosarcoma,ARMS)约占RMS的20%。ARMS在青少年和年轻人中更常见,尽管它可以在任何年龄出现,包括婴幼儿和老年人。ARMS发部位为四肢、头颈部以及会阴和椎旁区域。
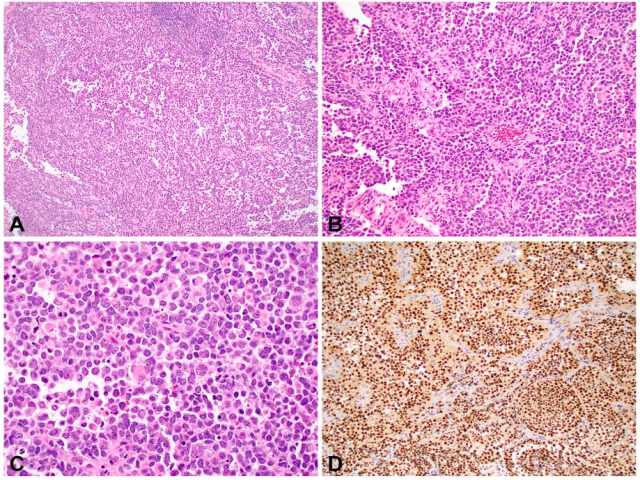
图2.腺泡状横纹肌肉瘤:低倍镜下显示细胞片状呈腺泡状排列(A)。中倍镜下可见许多不同分化的横纹肌母细胞呈腺泡状排列(B)。高倍镜下显示肿瘤细胞主要是圆形细胞,偶尔有多形性和多核细胞(C)。在ARMS中myogenin通常呈弥漫性强阳性(D)。
组织学上,ARMS呈现单一圆形细胞形态。这些细胞可以呈实性片状排列(实体型),也可以附着在薄的纤维血管间隔上(腺泡型)或者为胚胎性-腺泡状混合型。网状纤维染色能清晰的显示腺泡状结构。高倍镜下,肿瘤由未分化的原始间叶性细胞及少量早期分化的幼稚横纹肌母细胞组成。原始间叶性细胞呈圆形、卵圆形或小多边形,核深染,核分裂象易见,胞质稀少,与非霍奇金淋巴瘤或尤文肉瘤非常相似,在穿刺标本或活检小标本时特别要注意。虽然胚胎性横纹肌肉瘤有时肿瘤细胞呈比较原始一致时难以和ARMS区分,与胚胎性横纹肌肉瘤不同的是,ARMS多可以看见散在的核位于胞质周边排列、胞质淡染或弱嗜伊红的花环样(wreath-like)多核巨细胞,且ARMS免疫组化显示myogenin弥漫一致强表达。最近有文献报道,OLIG2和MUC4阳性是诊断ARMS的参考指标【见参考文献2、参考文献3】,且提示存在PAX3/7-FOXO1基因融合。除此之外,AP2beta和P-cadherin在ARMS是强表达,而HMGA2 and EGFR是弱表达,这与胚胎性横纹肌肉瘤相反。
遗传学上,大多数ARMS(80-90%的病例)涉及FOXO1(13q14.11)与PAX3(2q36.1)或PAX7(1p36.13)的易位[18,19]。PAX3::FOXO1融合存在于60-70%的ARMS中,PAX7::FOXO1结合存在于10-20%病例;10-20%的病例通过传统测试方法显示无法检测出FOXO1基因融合的证据[31]。此外,少数ARMS具有变异基因融合,包括PAX3与FOXO4、NCOA1、INO80D或FOXO1与FGFR1的融合[3,19,33-35]。关于这些融合变异肿瘤的组织学特征,或者它们的生物学行为更像融合阳性或融合阴性RMS,我们知之甚少。在一些报道中,个别病例的结果较差[34],而另一些报道则表明这些肿瘤的行为也可能更像胚胎性横纹肌肉瘤[36]。大约10-15%的ARMS具有2p24(包括MYCN)[38]和12q13-q14(包括CDK4)的扩增,最常见于PAX3::FOXO1融合病例[20]。这些扩增可能与更差的预后有关,但需要更大的分析来证实这一发现。有趣的是,TP53突变在ARMS中很少发现(<4%),但当存在时,它们的预后可能更差[20]。
根据作者的经验,ARMS的诊断可以通过形态学和免疫组织化学来实现(>50%的细胞显示细胞核myogenin一致强阳性表达)。然而,ARMS的关键预后标志仍然是FOXO1基因融合的存在与否。因此,在所有情况下,FOXO1基因融合的分子分析对于预后都是必要的,未来,了解特定的融合伴侣和其他标记物(包括MYCN或TP53)的掺入也可能成为风险分层的一部分。
参考文献
[1] Dehner CA, Rudzinski ER, Davis JL. Rhabdomyosarcoma: Updates on classification and the necessity of molecular testing beyond immunohistochemistry. Hum Pathol. 2024 May;147:72-81. doi: 10.1016/j.humpath.2023.12.004. Epub 2023 Dec 21. PMID: 38135061.
[2] Raghavan SS, Mooney KL, Folpe AL, Charville GW. OLIG2 is a marker of the fusion protein-driven neurodevelopmental transcriptional signature in alveolar rhabdomyosarcoma. Hum Pathol. 2019 Sep;91:77-85.
[3] Forgó E, Hornick JL, Charville GW. MUC4 is expressed in alveolar rhabdomyosarcoma. Histopathology. 2021 May;78(6):905-908.
往期回顾
横纹肌肉瘤分类最新进展和免疫组织化学以外分子检测的必要性(一)














共0条评论