WHO女生5ed第8章子宫颈肿瘤(三)
往期回顾:
2、腺体肿瘤和前驱病变
13、子宫颈的原位腺癌,HPV相关
定义
HPV相关原位腺癌(AIS),是一种HPV相关的腺上皮内肿瘤。
ICD-O编码
8240/2 原位腺癌NOS
8483/2 原位腺癌,HPV相关
ICD-11编码
2E66.Y&XH2L30 宫颈的其他特指性原位癌&原位腺癌NOS&人乳头瘤病毒
相关命名
可接受:高级别宫颈腺上皮内肿瘤
亚型
无
部位
鳞柱交界区和宫颈外口近端(较少见)。
临床特征
最常见表现为异常宫颈细胞学,显示非典型子宫颈管腺体,常伴有高度鳞状上皮内病变(HSIL)。
流行病学
就诊时平均年龄40多岁,比浸润性子宫颈管腺癌更年轻10-15岁。因为位于子宫颈管,细胞学取样和阴道镜评估都有困难,因此宫颈细胞学筛查时,比鳞状细胞病变更可能漏诊。最终导致其诊断相对罕见。
病因学
这些肿瘤伴有高危型HPV(HR-HPV)感染,最明显的是HPV16和HPV18,或HPV45。在所有的细胞学诊断的和/或阴道镜医生活检的AIS病例中,99%是HPV相关。其中,>90为HPV16和/或HPV18阳性,该比例类似于浸润性宫颈腺癌。已经明确,HPV18对浸润性腺癌的重要性大于鳞状细胞癌,这种情况也适用于原位腺癌(约50%)与鳞状上皮癌前病变(CIN2/3,约20%)的对比。也存在罕见的HPV不相关AIS。
发病机制
见“宫颈的鳞状上皮内病变”(原书第342页)。
大体检查
阴道镜下,AIS可能表现细微。在子宫颈管内位置高的病例,可能难以评估。也可能存在HSIL。
组织病理学
AIS取代上皮并位于原先存在腺体的结构。最重要的特征是柱状细胞,通常黏液缺失,核假复层排列,核深染,并有容易识别的顶端核分裂象(漂浮核分裂象)和基底部核碎裂。也能发现明显的胞质内黏液,伴或不伴杯状细胞;粉红色顶端胞质;纤毛(非常罕见);不同程度增大的深染核,或细长或圆形,有时呈不规则核轮廓,和粗糙染色质;多核细胞;和所谓的早期或表浅AIS,该病变加油站,优先沿着腺腔表面呈单层排列。最后一种模式可能呈现较均匀的核大小,核分裂象或凋亡小体不太明显。只有罕见病例有核仁。允许AIS有多大范围的腺腔内筛状结构和乳头状,有是争议的。在取样良好的标本中,当这些发现局灶性出现时,诊断为AIS是可接受的,但当这些发现广泛,应考虑诊断为腺癌伴非破坏性浸润,包括腺癌伴绒毛腺样结构。
黏液缺失的AIS可能产生诊断不确定,因为类似子宫内膜样腺癌;AIS是HPV相关,且缺乏明确的子宫内膜样特征,如非典型增生、鳞化和柱状细胞伴温和的卵圆形核且缺乏明显的核分裂象活性。如果出现杯状细胞,应怀疑AIS,但不能仅根据杯状细胞本身来诊断AIS,尽管HPV状态。纤毛AIS和缺乏明显核异型性的AIS可能与非肿瘤性/反应性/增生性子宫颈管腺体或输卵管子宫内膜样腺体相混淆。如有核分裂象活跃(AIS特征),可以解决这种诊断问题,辅助检查也有帮助。
尽管AIS呈p16弥漫强阳性,但肠型分化的表达可能降低,同时Ki-67增殖指数增加。ER表达通常缺失,PR表达缺失更特异。AIS的良性类似物往往呈ER和PR阳性。
一种重要的AIS亚型是复层产黏液性上皮内病变(SMILE),该病变由复层上皮组成,黏液遍布所有细胞层,外周常有一圈基底细胞/储备细胞围绕。低倍镜下,病变类似于HSIL累及宫颈腺体,但高倍镜下胞质内黏液通常很明显。核异型性、深染、核分裂象和凋亡小体通常存在。SMILE可能与HSIL、普通AIS或浸润性癌(包括产生复层产黏液性癌)共存。
辅助检查
由于与HPV原癌蛋白E7与RB1(视网膜母细胞瘤蛋白)的干扰,相关的代偿性上调,导致肿瘤抑制蛋白p16在几乎所有HPV相关的AIS病例中都过表达。阳性定义大片状强染色。p16染色不是必要的,因为形态学通常足以进行准确诊断。诊断不确定,需要鉴别增生性、反应性和化生病变时,应当使用p16染色。由于这些非肿瘤性增殖可能显示斑片状p16染色,因此区分大片状(或每个细胞)染色和斑片状染色至关重要,在适当的形态下,大片状染色模式可以证实诊断。还要注意其他具有大片状p16染色的腺体肿瘤,它们需要与AIS鉴别,特别是活检或刮宫标本。例如,子宫内膜或附件的浆液性癌(95-100%病例呈p16阳性)、子宫内膜高级别子宫内膜样癌(约1/3病例)和子宫内膜或宫颈的透明细胞癌(约1/3病例)。在有选择的病例中,直接HPV检测也可能有价值,例如p16染色模式不明确的病例,或缺乏AIS特征性形态的病变但呈大片状染色的病例。HR-HPV RNA原位杂交检测可以帮助判断这些疑难病例的HPV状态,并能提示正确诊断。
细胞学
AIS的特征是腺细胞形成条带和细胞簇,具有拥挤的栅栏状核,核增大、拉长和不规则。也可以看到极性丧失和羽毛征。染色质通常粗糙深染,但在液基制片上可能会呈现细颗粒状和更空亮。鉴于AIS与良性类似疾病在细胞形态学上有显著重叠,这些腺体异常通常被归类为非典型腺细胞(NOS或倾向肿瘤),而不能明确诊断为AIS。
宫颈细胞学检测宫颈腺癌的假阴性率很高。在一项大规模的基于人群的研究中,60%的AIS女性和85%的浸润性腺癌女性的细胞学呈阴性。联合检测HPV有帮助:44%的AIS女性和63%的浸润性腺癌女性同时检测到HPV阳性。
诊断性分子病理学
HR-HPV原位杂交将鉴定核信号(基于DNA)或核和胞质信号(基于mRNA)。基于mRNA的原位杂交比基于DNA的方法更具特异性。PCR可用于确认HPV感染,但缺乏敏感性和特异性,因为该分析在福尔马林固定的档案组织中可能表现不佳,并且不能确定HPV是否存在,特别是在肿瘤细胞内。
诊断标准
必要标准:假复层、核深染,易见顶端核分裂象和核碎裂。
理想标准:检测HPV,间接(大片状p16染色)或直接(使用高敏感性HR-HPV原位杂交)。
分期
该实体被分期为T0N0M0。
预后和预测
在大多数情况下,AIS可以通过环形切除和密切的细胞学随访成功治疗。如果没有生育意愿,子宫切除术可能是首选。对于保守治疗,阴道镜、细胞学和HPV检测的密切随访至关重要,HPV状态是成功切除(HPV阴性)与持续/进展性疾病(PHV阳性)的有力指标。
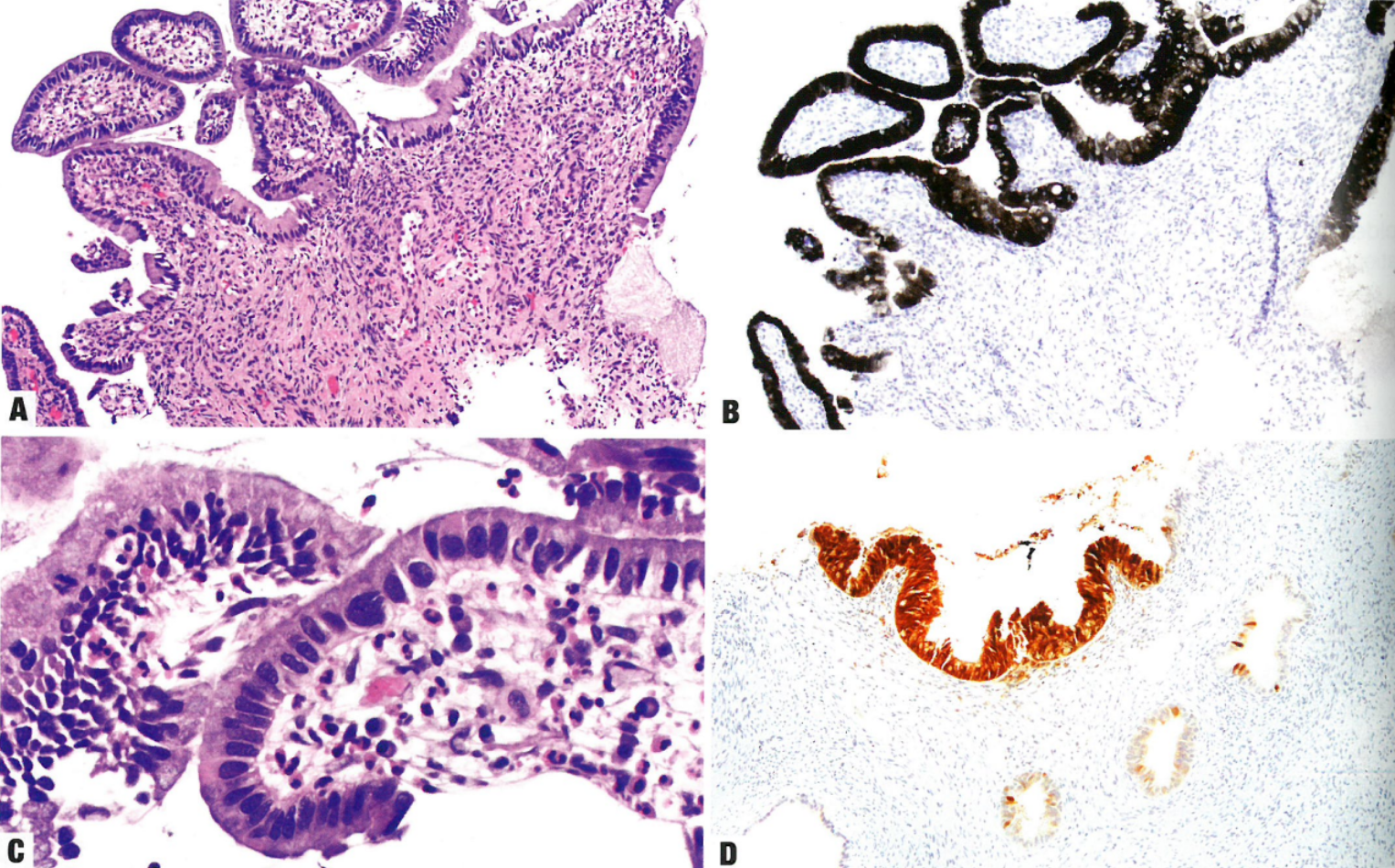
图8.26原位腺癌(AIS)。A 浅表(早期)AIS。注意子宫颈管乳头的形态学温和。明显的诊断性核特征在右侧。B 相同视野,弥漫强阳性p16染色。C 相同视野的高倍放大,显示一些孤立的核异型性,但没有核分裂象活性凋亡。D pl6在AIS呈大片状染色,在输卵管子宫内膜样化生中呈斑片状染色(病变底部),在正常宫颈腺上皮阴性(病变右侧))。
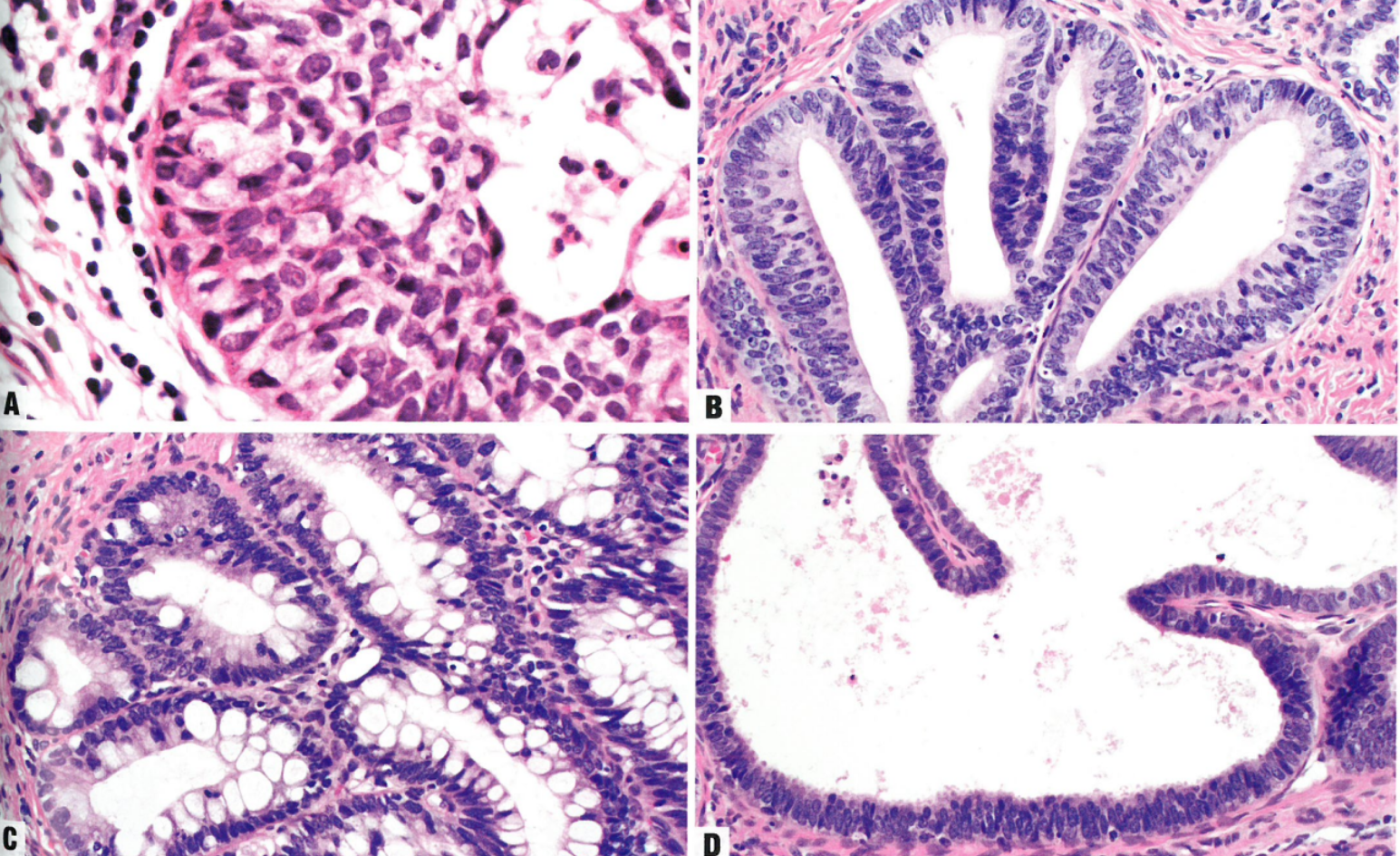
图8.27原位腺癌(AIS)。A 上皮内复层粘液性肿瘤细胞形成SMILE。B 一例典型AIS显示黏液缺失、上皮厚度不均匀、核分布不均匀、核深染、凋亡和核分裂象。C AIS伴肠型分化。D AIS伴较均匀的核特征和假复层上皮(下方),貌似子宫内膜样分化。
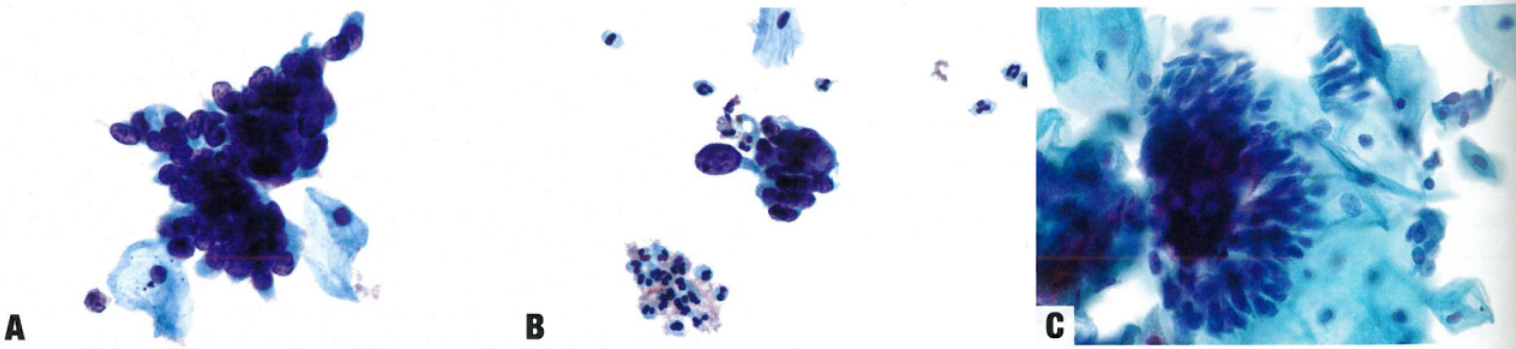
图8.28原位腺癌。宫颈液基细胞学显示一簇拥挤的腺体,核重叠深染。核突出于细胞簇的边缘(羽毛征)是显著特征。B 成簇的拥挤细胞,失去典型的腺细胞蜂窝状模式,核重叠。腺细胞显示高核质比和明显的羽毛征。C 一条拥挤的子宫颈管腺细胞,有羽毛征、栅栏状和细长的不规则的核。
14. 子宫颈腺癌,HPV相关
定义
HPV相关腺癌是一种良性乳头状苗勒管上皮肿瘤。
ICD-O编码
8140/3 腺癌NOS
8483/3 腺癌,HPV相关
ICD-11编码
2C77.1&XN8JY 子宫颈的腺癌&人乳头瘤病毒
相关命名
无
亚型
无
部位
宫颈(主要在移行区)。
临床特征
有症状的患者表现为异常子宫出血和/或肿块。有些病例是通过细胞学筛查发现的,如腺体异常或鳞状细胞异常。
流行病学
在未经筛查的人群中,腺癌约占所有宫颈癌的5%。然而,在发达国家,腺癌的相对患病率已增加到所有宫颈癌的10-25%,主要是由于基于细胞学的筛查对检测和治疗鳞状细胞癌前病变的影响。与细胞学检查相比,基于HPV的初级筛查可以更好地预防腺癌,可能是通过更好地检测和治疗HPV相关的腺癌前驱病变。患者的平均发病年龄为40-42岁,明显低于HPV不相关腺癌。
病因
肿瘤是HR-HPV感染所致。HPV 18、16和45型最常见,约占病例的95%。约10%的病例发生多种HPV类型的合并感染,正如HPV相关鳞状细胞癌中所见
发病机制
大多数腺癌的病因与HPV分支A9(通常称为HPV16)和A7(通常称为HPV18)有关。HPV病毒原癌蛋白E6和E7分别使p53和RB1失活;这种失活与HPV的整合、进入宿主基因组、基因组不稳定以及体细胞突变的积累有关。APOBEC高和APOBEC低分子标签都可能存在。HPV相关腺癌往往拷贝数改变水平低且上皮间质转化评分低,认为与microRNA miR-205-5p的低表达有关;相反,miR-375呈高水平表达。CpG岛超甲基化(CpG岛甲基化表型)在所有病例中或高或低,而中间评分少见。常见KRAS突变。
大体检查
大体病变表现为远端宫颈的外生性肿块或溃疡。内生性弥漫性受累大体表现为宫颈壁的扩张和硬化(桶状宫颈)。
组织病理学
所有形式的浸润性HPV相关腺癌都可以具有破坏性或非破坏性(AIS样)生长模式。基于模式的分类(Silva系统)显示肿瘤浸润模式与淋巴结转移、复发和生存风险之间的关联。Silva系统将浸润性肿瘤分为三组,包括间质浸润的范围。该系统具有可接受的可重复性,特别是能区分惰性肿瘤(模式A,非破坏性浸润)和潜在浸润性肿瘤(模式B和C,破坏性侵犯)。破坏性浸润病例表现为不完好的、成角的腺体和细胞簇,杂乱的浸润宫颈间质,伴有促结缔组织增生性性间质反应。这些病例通常很容易与AIS区分。非破坏性浸润形式包括高分化的腺体,通常形成模糊的小叶轮廓,有时很难与AIS区分。事实上,AIS和模式A很难区分,可重复性差。一种可接受的实用方法是报告浸润性腺癌的可能性,并测量可疑浸润灶的深度,特别是>3mm。根据定义,淋巴管血管浸润意味着破坏性浸润(模式B或C)。简表.01总结了HPV相关宫颈腺癌的基于模式的分类。
HPV相关宫颈腺癌的特征包括顶端核分裂象和核碎裂,在低倍镜下明显可见。核增大、拉长、深染。高分化至中分化的区域以腺体为特征,腺体具有光滑的管腔边缘,内衬假复层柱状上皮。简表.02总结了宫颈HPV相关腺癌的组织学亚型。
辅助检查
HPV相关的发病机制和形态学之间密切相关,表明HPV检测和相关分析通常不是诊断所必需的。p16免疫组化是一种有效的(但有瑕疵)间接检测HR-HPV感染的方法。大约95%的HPV相关癌显示弥漫性大片染色或每个细胞都染色(过表达)。罕见的p16阴性病例可能源于甲基化诱导的失活。重要的是,使用旧的或保存不良的组织蜡块,p16结果可能无法重复。重要的是,要牢记HPV不相关腺癌也可能有p16过表达,如来自浆液性癌的脱落转移、一部分子宫内膜的高级别子宫内膜样癌,以及子宫体或子宫颈的透明细胞癌。HR-HPV mRNA显色原位杂交能识别18种HR-HPV,其敏感性大致与p16相当,但特异性更强;很可惜这种检测技术尚未广泛使用。罕见的阴性病例可能与检测中未包括的HPV类型有关。其他阳性标志物包括CK7和PAX8(约75%)。大多数病例的p53染色正常,ER、PR、vimentin、CK20和SATB2均为阴性。CDX2可以阳性,特别是肠型肿瘤。
鉴别诊断
鉴别诊断包括低级别子宫内膜的子宫内膜样癌和HPV不相关腺癌(胃、透明细胞、中肾)。这些实体通常缺乏明显的核分裂象和凋亡,p16阴性,HPV阴性。小腺体增生缺乏核异型性和核分裂象。胃型癌和透明细胞癌通常ER/PR阴性。与腺鳞癌、神经内分泌癌(NEC)、浆液性癌以及低分化鳞状细胞癌和子宫内膜子宫内膜样癌的区分,需要适当的取样、仔细的检查和(必要时)辅助检测。
细胞学
浸润性宫颈腺癌的特征是合体细胞样聚集和三维恶性细胞簇,具有增大的多形性核、粗糙染色质、大核仁和细小空泡化的胞质。肿瘤素质的存在,有助于支持浸润。在液基制片上不太明显,表现为附着在肿瘤细胞簇边缘的颗粒状碎屑和凋亡碎片。发现宫颈AIS和/或HSIL的背景有助于将腺癌归类为子宫颈管起源。如果未见原位成分,最好将病例诊断为腺癌NOS,并将最终分类推迟到组织学标本。
诊断分子病理学
HR-HPV原位杂交(DNA或mRNA)检测核信号;基于mRNA的原位杂交比基于DNA的方法更具特异性。PCR可用于确认HPV感染,但敏感性和特异性值得怀疑,因为该分析在福尔马林固定的存档组织中可能表现不佳,并且不能确定HPV是否存在于肿瘤细胞内。一种涉及石蜡包埋福尔马林固定物的激光捕获显微切割的特定PCR方法似乎是敏感和特异的,但这种测试不能用于诊断环境。
诊断标准
基本标准:间质浸润,无论破坏性或非破坏性;顶端核分裂象和凋亡小体在低倍镜下易于识别;增大深染假复
层核;明显的胞质内黏液(黏液模式);外生性乳头状生长(绒毛腺模式);复层黏液细胞的实性浸润巢(复层产黏液模式);没有明确的子宫内膜样特征,如鳞化和子宫内膜异位症
理想标准:p16过表达;HPV检测;阴性ER、PR和(通常)vimentin;野生型p53。
分期
按照FIGO和国际癌症控制联盟(UICC)系统进行分期。显微镜下腺癌分期取决于病理特征,主要是浸润深度(FIGO)。当原位和浸润性成分无法可靠地区分时,应提供整个病变的厚度来代替深度。
预后和预测
5年总生存率为77%。分期是最重要的预后变量。早期浸润性(IA1期)腺癌的存活率接近100%,IA2、II和IV期的存活率分别为93%、34%和3%。其他预后变量包括浸润模式、淋巴管血管浸润和患者年龄。模式B和C分别具有大约4%和25%的淋巴结扩散风险。在C型病变中,微乳头状生长的病变具有更高的淋巴结扩散风险,而具有弥漫性破坏和融合结构的病变具有较高的复发风险和较差的生存率。KRAS和PIK3CA突变很常见,与破坏性浸润模式和预后有关。与HPV不相关腺癌相比,HPV相关腺癌的无病生存率和疾病特异性生存率显著提高。单纯的外生性绒毛状腺管状腺癌预后良好;间质浸润的预后与其他HPV相关腺癌相似。黏液型,包括复层产黏液性癌,可能比其他HPV相关类型的预后更差。早期浸润性病变(IA1和IA2期,无淋巴管血管浸润)和模式A病变可以保守治疗(锥切,不清扫淋巴结)。模式A病变不伴淋巴结转移或复发;然而,有报道称,早期、非破坏性浸润性腺癌伴AIS样形态,发生了卵巢转移,因此,保守治疗者需要仔细监测。IA2期肿瘤伴淋巴管血管浸润、IB期或以上肿瘤以及破坏性浸润的肿瘤最好采用根治性子宫切除术加淋巴结清扫和/或放化疗。对于伴有淋巴管血管浸润的IA期肿瘤和有选择的IB1期肿瘤,保留生育能力的选择包括具有重复锥切获得阴性切缘或根治性宫颈切除术,两者均进行前哨淋巴结评估。
简表8.01 HPV相关宫颈腺癌,基于模式的分类
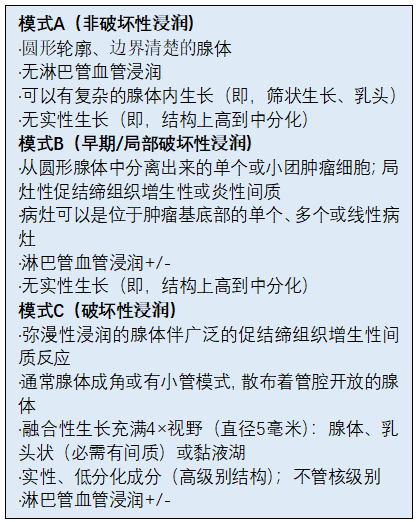
简表8.02 宫颈HPV相关腺癌的组织学类型

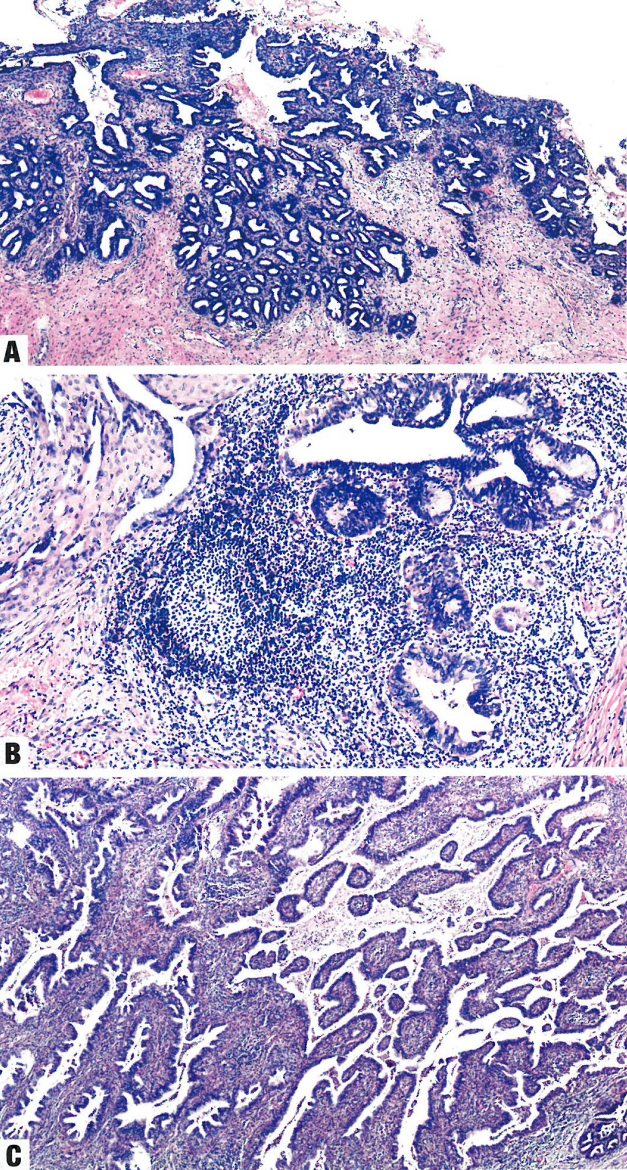
图8.29 HPV相关宫颈腺癌。A模式A。显著的腺体密集提示明确的浸润,但保留了成簇和模糊的小叶状结构,缺乏破坏性浸润。B模式B。在致密炎症背景下,完好的腺体形成不规则巢状。模式C。腺体融合使病变中心呈现绒毛状和微绒毛状,而周围显示细长和成角的腺体位于反应性间质中。
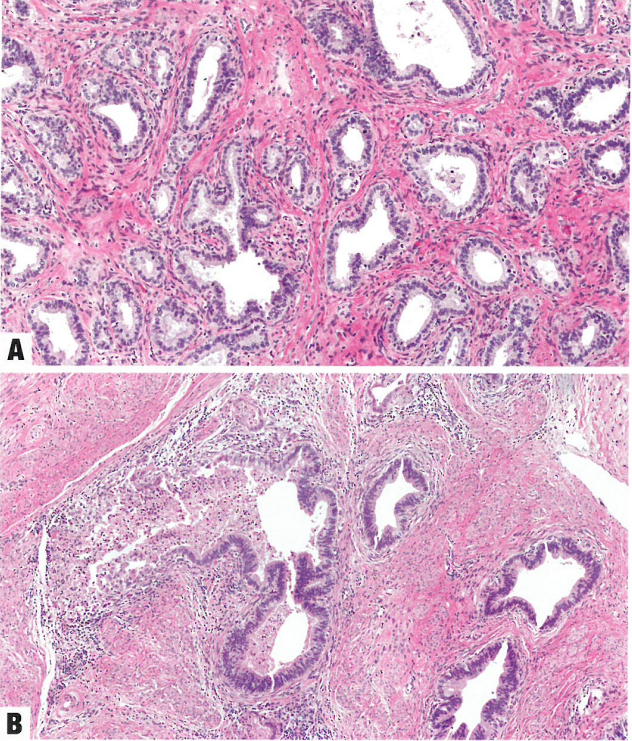
图8.30 HPV相关宫颈腺癌。A模式A。由完好的腺体组成的高分化增殖,部分呈模糊的小叶状。注意,浸润性腺体、融合、非腺体形成的肿瘤、促结缔组织增生性间质和淋巴管血管浸润都没有。B模式B。浸润性(成角的、不完整的)腺体,引起炎症和促结缔组织增生性间质反应,起源于边界清楚的(模式A)腺体。
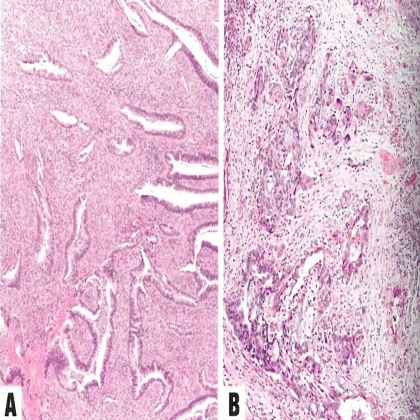
图8.31 模式C。A 不规则、成角、拉长的(而不是圆滑轮廓)腺体组成的浸润性肿瘤。B 不规则腺体是肿瘤细胞簇引发显著的促结缔组织增生性间质反应。
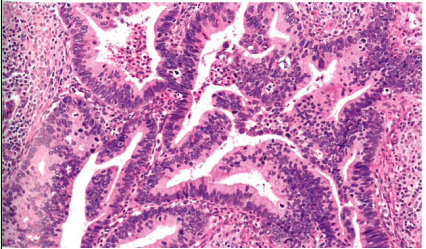
图8.32 HPV相关宫颈腺癌,普通型。由黏液缺失的细胞组成不规则的融合腺体,胞质模糊,核细长、假复层、深染。明显的顶端核分裂象和凋亡。
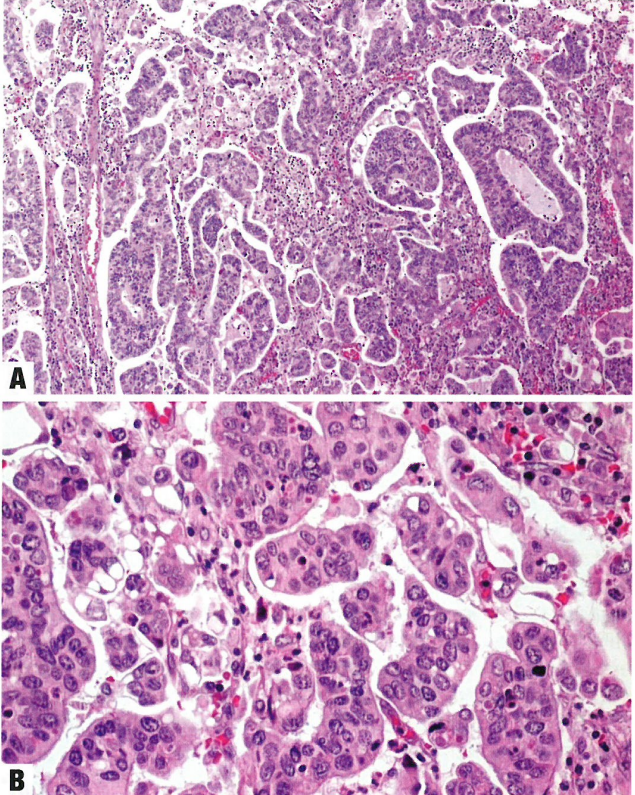
图8.33 模式C。A 实体结构属于破坏性模式。本例实性生长伴微乳头状细胞簇。B 微乳头状生长,细胞簇周围有间质空隙,与不利特征和预后有关。
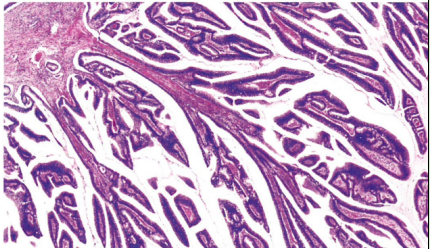
图8.34 HPV相关宫颈腺癌,绒毛腺型。以外生性乳头状生长为主。乳头被覆黏液缺失(常见类型)的上皮,核深染。
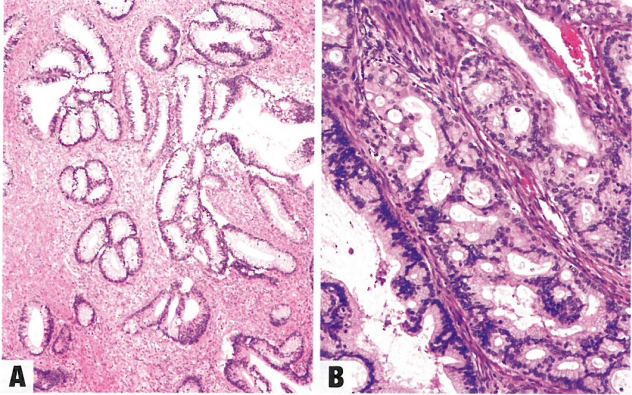
图8.35 HPV相关宫颈腺癌,黏液NOS(子宫颈管)型。A 不规则腺体,内衬柱状黏液上皮,显示明显的核深染、核分裂象和凋亡。B 柱状黏液上皮组成的筛状增殖,明显的核深染。
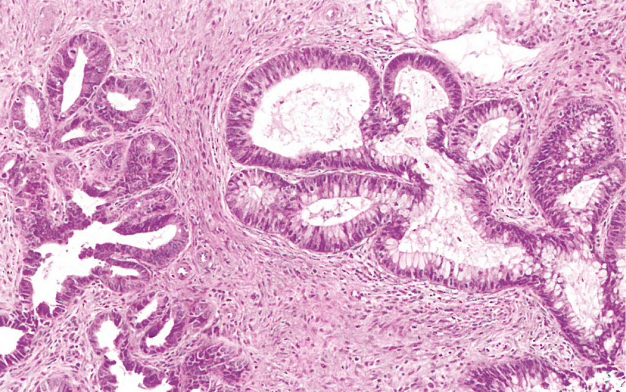
图8.36 HPV相关腺癌,黏液性肠型。在其他方面普通的腺癌中,观察到杯状细胞肠型黏液分化。
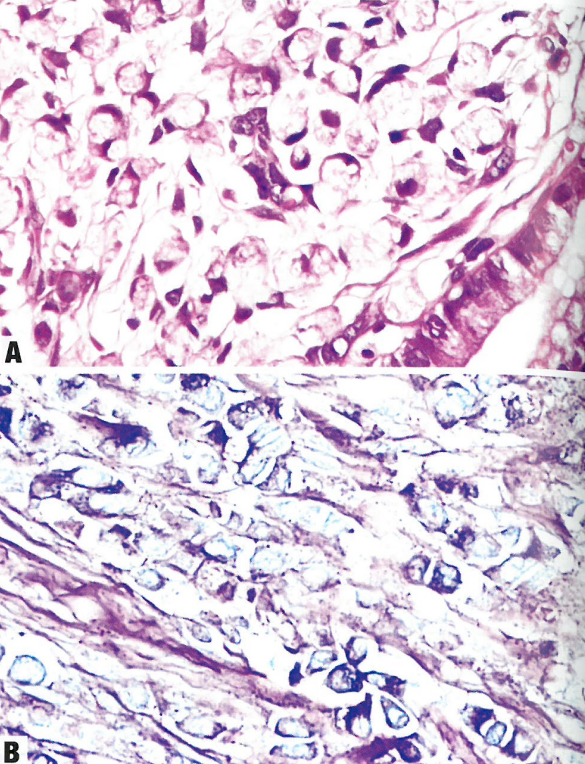
图8.37 HPV相关腺癌,印戒细胞型。A 不粘附的肿瘤细胞,有丰富的胞质内黏液,核位于一侧,很像印戒。B 低分化癌,特征为单个浸润性肿瘤细胞,有些细胞呈中央空泡,印戒样。AB染色显示中央空泡为黏液性质。
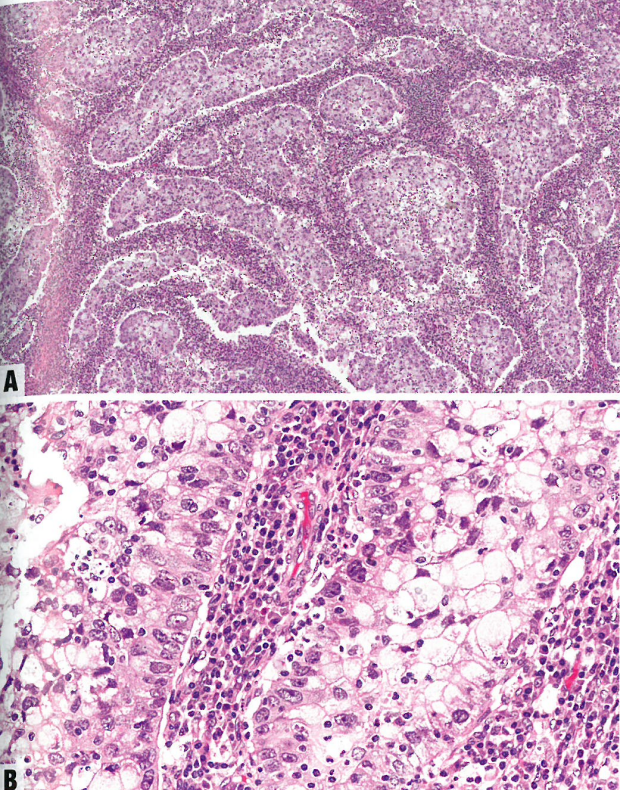
图8.38 HPV相关宫颈腺癌,浸润性复层产黏液型。A 浸润性增殖,在炎症间质中呈实性细胞巢。肿瘤巢由聚集的黏液上皮组成。B 肿瘤细胞排列成巢和聚集灶。注意整个病变都有胞质黏液。
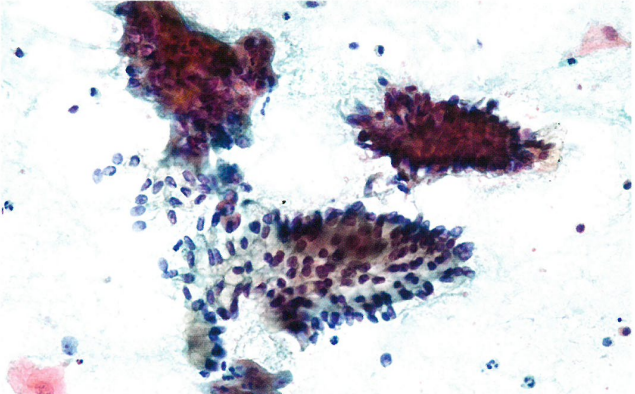
图8.39 子宫颈管腺癌。恶性腺细胞形成一个三维细胞簇,并有一条原位腺癌细胞簇。
15. 子宫颈的原位腺癌,HPV不相关
定义
HPV不相关原位腺癌(AIS)是一种与HPV无关的非浸润性腺体肿瘤。胃型分化具有特征性。
ICD-0编码
8140/2 原位腺癌NOS
8484/2 原位腺癌,HPV不相关
ICD-11编码
2C77.1&XH2L30 子宫颈的腺癌&原位腺癌NOS
相关命名
可接受:胃型原位腺癌;非典型小叶性子宫颈管腺体增生
亚型
无
部位
胃型AIS(gAIS)通常位于移行区或紧邻移行区近侧,可能延伸到子宫下段和子宫内膜。
临床特征
这些肿瘤可能表现为宫颈细胞学异常或稀水样分泌物。在子宫切除术或因其他指征而进行的宫颈切除术中偶然发现无症状病变。
流行病学
患者的年龄范围广(25-74岁;平均:51岁)。尽管AIS几乎总是与HPV有关,但HPV不相关的病例也有罕见报道。然而,由于大多数AIS病例无症状,通过基于细胞学和/或基于HPV的宫颈筛查诊断,因此文献报道可能低估了HPV不相关浸润性腺癌的前驱病变。
病因
未知
发病机制
未知
大体检查
gAIS不形成肉眼可见的肿块。
组织病理学
gAIS的特征是立方形至柱状细胞,有明显的细胞边界,嗜酸性至淡染和/或泡沫状胞质,核异型性从轻度到重度不等。有核分裂象和凋亡但不明显,通常在高倍镜下发现。经常观察到肠型(杯状细胞)分化(不同程度)。gAIS累及先前存在的正常子宫颈管腺体,因此没有杂乱的腺体拥挤或融合。然而,可能出现腺内复杂性结构(筛状、乳头状)。有时,病变向近端生长,累及子宫内膜腺体。有一种相关病变,称为“非典型小叶性子宫颈管腺体增生”,定义为小叶性子宫颈管腺体增生所界定的范围内存在细胞学异型性(见“小叶性子宫颈管腺体增生”,原书第357页)。这可能是gAIS的形态学谱系之一。免疫组化,gAIS和小叶性子宫颈管腺体增生呈CK7和幽门腺标志物HIK1083阳性(MUC6缺乏特异性),PAX8和CDX2通常阳性。ER和PR均为阴性或仅弱阳性。p16阴性或斑片状显色。异常p53免疫染色可支持该诊断。透明细胞癌对应的原位病变尚未识别。
细胞学
HPV不相关AIS在形态上可能类似HPV相关AIS,表现为核增大深染和羽毛状。然而,可能通过黄色胃型黏液的存在来区分,在常规涂片上最明显。由于黏液在液基制片中比浅淡染,因此很难区分黄色胃型黏液和粉红色正常宫颈黏液。
诊断分子病理学
无临床相关性
诊断标准
基本标准:增殖持续到正常的宫颈腺;腺上皮具有明显的细胞边界和嗜酸性到淡黏液质的胞质;核异型性和增殖;允许陆内复杂性;阴性/斑片状p16或阴性HPV检测;阴性ER和PR
理想标准:HIK1083、CK7和MUC6呈阳性(MUC6是非特异性的)。
分期
无临床相关性
预后和预测
gAIS的生物学行为和恶性潜能尚不清楚。建议进行锥形活检并完全切除。
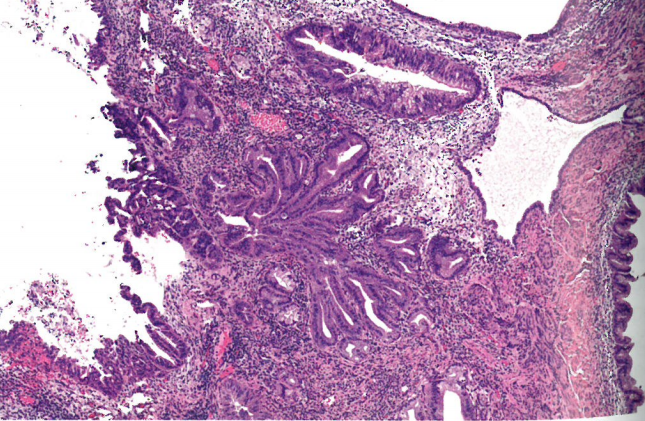
图8.40 胃型原位腺癌。注意柱状细胞有核异型性。
16. 腺癌,HPV不相关,胃型
定义
胃型HPV不相关腺癌是一种浸润性腺癌,表现为胃型(幽门腺)分化,与HPV感染无关。
ICD-O编码
8482/3 腺癌,HPV不相关,胃型
ICD-11编码
2C77.1 子宫颈的腺癌
相关命名
不推荐:微偏腺癌;恶性腺瘤;子宫颈管的黏液性腺癌(HPV阴性)
亚型
无
部位
这种肿瘤发生在子宫颈管上部,经常累及子宫体。
临床特征
临床特征包括出血和稀水样阴道排液。
流行病学
在全球范围内,胃型腺癌占宫颈腺癌的10-15%,在日本占20-25%。患者的平均年龄50-55岁(范围:37-84岁),明显高于HPV相关腺癌。
病因学
这些肿瘤不是由HPV引起的。它们可见于Peutz-Jeghers综合征(种系STK11突变)。
发病机制
其发病机制可能与小叶性子宫颈管腺体增生有关。非典型小叶性子宫颈管腺体增生和胃型原位腺癌似乎是前驱病变
大体检查
肿瘤巨大,平均大小38mm(范围:21-55m),可以表现为息肉样或溃疡。肿瘤取代宫颈壁导致整个宫颈硬化,形成桶状宫颈。
组织病理学
标志性特征是腺细胞,具有丰富的透明淡嗜酸性胞质和清晰的细胞边界。存在顶端核分裂象和凋亡,但不明显。胞质含有中性黏液,在AB/PAS特殊染色中呈粉红色(与正常宫颈管酸性黏液的深紫色形成对比)。形态学变化范围大,从分化程度极高的腺癌(以前称为“微偏腺癌”),伴深部不规则鸟爪状腺体和有限的促结缔组织增生反应,到低分化的腺体、细胞簇和单个细胞。低分化腺体中,核改变程度不一,包括大泡状核伴明显核仁。其他特征包括普通型或子宫内膜样腺体、泡沫状胞质、胞质缺失的立方形细胞和杯状细胞。常见淋巴管血管浸润(见于48%的病例)。
免疫组化,胃型(幽门腺)标志物HIK1083和MUC6经常阳性(但MUC6特异性较差)。这些幽门腺标志物在胃型腺癌中可能局部表达,而小叶性子宫颈管腺体增生呈弥漫表达。PAX8、CAIX、CEA和CK7通常都是阳性的。CK20和CDX2可能局部阳性。据报道,HNF1β呈弱阳性。PAX2表达通常缺失。ER和PR通常阴性。p16在大多数病例中呈阴性或斑片状显色;然而,也可能看到过表达。大约50%的病例出现p53异常表达(过表达或全不表达)。
细胞学
有人提出,识别常规涂片上双色黏液(黄色胃型黏液和粉红色正常宫颈黏液)作为胃型分化病变的诊断线索。胃型腺癌的其他特征包括单层片状腺细胞,具有泡沫状胞质、明显的细胞边界、胞质内中性粒细胞和空泡状核伴明显核仁。鉴于细胞学难以诊断胃型腺癌,诊断往往不能明确诊断为恶性,而是归类为非典型腺细胞
诊断分子病理学
这些肿瘤HPV检测呈阴性。常见STK11突变。有些病例与PeutzJeghers综合征有关。TP53常有改变。在一些肿瘤中检测到ERBB2(HER2)和MDM2基因扩增。
诊断标准
基本特征:丰富的淡嗜酸性至透明胞质和明显的细胞边界(胃型),或完好的腺体,分布不规则,异型性轻微(微偏);破坏性浸润和中重度核异型性(胃型);ER/PR阴性。
理想标准:p16阴性或斑片状和/或HPV检测阴性;中性黏液(AB/PAS染色呈粉红色);约50%病例p53异常染色。
分期
按照FIGO和TNM系统进行分期。
预后和预测
胃型腺癌具有侵袭性。与HPV相关肿瘤相比,它们具有更高频率的破坏性浸润、子宫外扩散和就诊时晚期。无病生存率和总体生存率明显更差。预后差与分化程度无关。
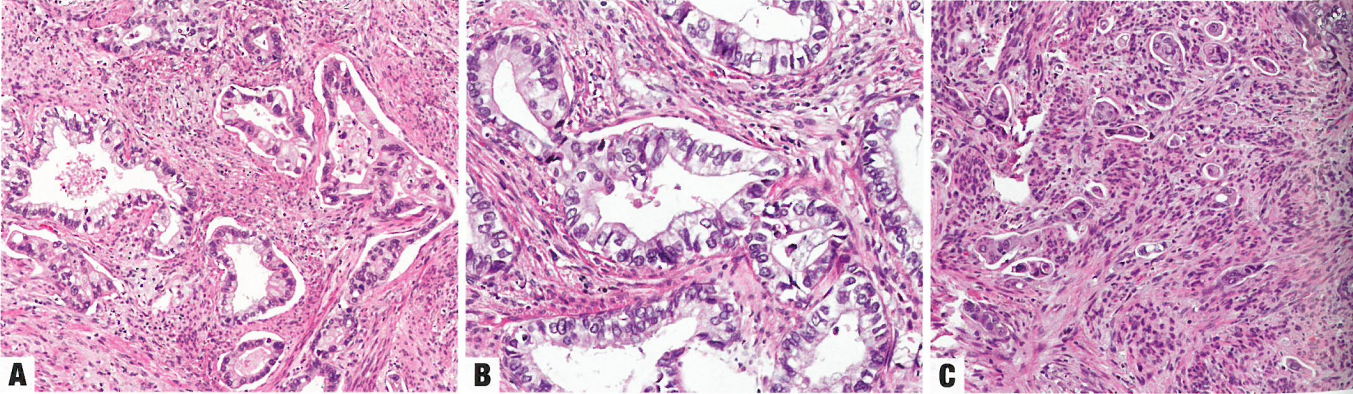
图8.41胃型子宫颈管腺癌。A 形状不规则的、浸润性黏液性腺体伴明显的核异型性。B 肿瘤腺体由黏液性细胞组成,具有丰富的颗粒状至泡沫状胞质和明显的细胞边界。C 低分化区呈现显著浸润和重度异型性。注意相对丰富的嗜酸性到空泡状胞质。
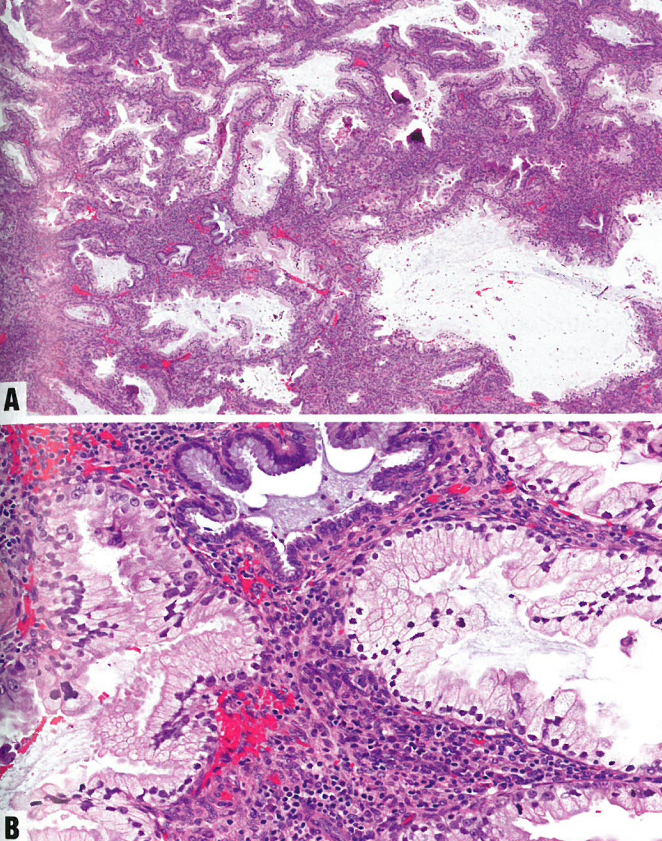
图8.42胃型子宫颈管腺癌,微偏型。A 分化极好腺体增生、轮廓光滑、随机分布。B 腺体由高柱状上皮组成,具有丰富的淡染泡沫状胞质和明显的细胞边界(与正常子宫颈管腺体相比,顶部中间)。核异型性(左侧)可以遇到,但通常是局灶发现。
17. 腺癌,HPV不相关,透明细胞型
定义
透明细胞癌是一种恶性腺体肿瘤,由均匀、透明或嗜酸性、扁平或立方形细胞组成,排列成一种或多种模式:管囊状、乳头状、实性。
ICD-O编码
8310/3 腺癌,HPV不相关,透明细胞型
ICD-11编码
2C77.1&XH6L02 子宫颈的腺癌&透明细胞腺癌NOS
相关命名
无
亚型
无
部位
散发性肿瘤发生在子宫颈管。子宫内接触己烯雌酚(DES)相关的肿瘤发生在外子宫颈会。
临床特征
临床特征与其他宫颈腺癌相似。
流行病学
这些肿瘤罕见,占宫颈腺癌的3-4%。它们出现在两种不同的情况下:作为散发性肿瘤(患者中位年龄:51岁),与宫内DES暴露相关(患者平均年龄:19岁)。
病因
该实体与高危型HPV无关。病例报告中,作者认为透明细胞癌起源于子宫颈管,描述了罕见的POLE突变伴DES暴露和Lynch综合征。
发病机制
未知
大体检查
大体检查,肿瘤可能表现为内生性,伴有宫颈弥漫性增大,或为外生性,伴有脱出的肿块,或没有临床明显的肿块。
组织病理学
肿瘤细胞排列成管囊状、乳头状和/或实性结构(通常不同程度地混合),含有透明(胞质内糖原)、嗜酸性颗粒状胞质,有时呈鞋钉状,轻微复层化。胞质边界明显。核深染,偶见核仁增大,或(少见)核假包含体。小管或囊肿内衬单层扁平上皮细胞,可能貌似温良。核分裂象计数通常低,常见间质透明变性。伴有Arias-Stella反应或滋养细胞疾病的子宫颈管腺体可能类似于透明细胞癌。
免疫组化,尽管没有高危型HPV感染,p16可能弥漫阳性。HNF1β和napsin A敏感但不特异,因为它们可能在胃型和HPV相关腺癌中表达。据报道,AMACR在大多数透明细胞癌中呈阳性,但在中肾管癌中呈阴性,而中肾秋癌常被误诊为透明细胞癌。ER和GATA3通常阴性。
细胞学
透明细胞癌的特征包括透明至空泡状富含糖原的胞质、清晰的细胞边界和透明小球。核增大深染,有大核仁。
诊断分子病理学
无临床相关性
诊断标准
基本标准:管囊状、乳头状和/或实性结构的混合;透明、嗜酸性、扁平或立方形细胞,核大多均匀但有细胞异型性,排列成一种或多种模式:管囊状、乳头状、实性
理想标准:低核分裂象计数;轻微细胞复层化;ER和HPV阴性。
分期
该实体的分期方式与其他宫颈癌相同。
预后和预测
有限的数据表明,I期疾病患者的总体生存率更高,复发率更低。复发通常在术后1年内发现,但可能发生在术后3年以上。淋巴结状态是总体生存和复发的有力预测因素。
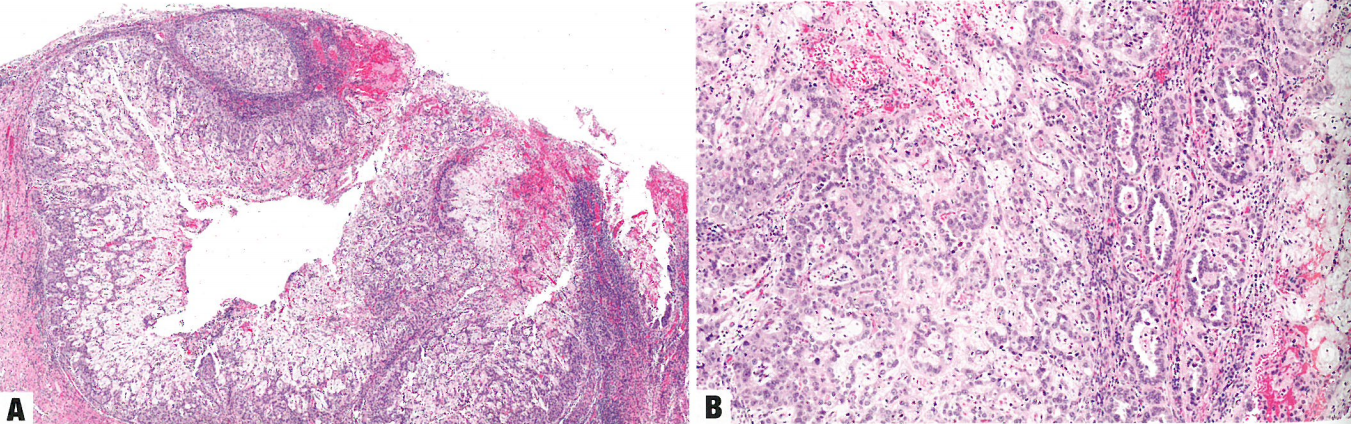
图8.43宫颈透明细胞癌,HPV不相关。A 肿瘤浸润宫颈壁内口。B 小管和腺体内衬单层立方细胞,均均匀,位于黏液样透明间质中。
18. 腺癌,HPV不相关,中肾管型
定义
中肾管型HPV不相关腺癌是一种具有中肾管(午菲管)分化的恶性肿瘤。
ICD-O编码
9110/3 腺癌,HPV不相关,中肾管型
ICD-11编码
2C77.1&XH5WG5 子宫颈的腺癌&和中肾管腺癌
相关命名
无
亚型
无
部位
中肾管癌通常与位于宫颈壁两侧深处的胚胎性中肾管沿线的中肾管残余物有关。
临床特征
就诊时患者的平均年龄为53岁。症状包括阴道异常出血,腹痛、子宫脱垂和性交痛。患者可能会出现宫颈细胞学异常或与转移有关的症状。
流行病学
这些肿瘤罕见,占宫颈腺癌的<1%。
病因
与高危型HPV无关。
发病机制
现认为肿瘤起源于胚胎期男性生殖系统的遗迹(午菲管/中肾管)。大多数患者携带KRAS突变和1q染色体的获得(其中部分患者显示1p同时缺失)。2/3患者在染色质重塑基因(ARID1A/B或SMARCA4)中发生突变,1/3患者在BCOR/BCORL1中发生突变。少数患者在TP53或CTNNB1中发生突变。他们的突变负荷低,没有微卫星不稳定性。
大体检查
肿瘤主体通常位于宫颈壁内,即中肾管残余物所在的位置,并延伸至上方的宫颈粘膜。全层浸润、环周浸润、溃疡和延伸到子宫下段并不少见。部分肿瘤可以形成外生性或息肉样肿块。切面质硬,白色或灰色,可能弥漫出血。
组织病理学
典型模式是管状,表现为背靠背的小管,内衬立方形细胞,管腔内充满致密的嗜酸性分泌物(PAS阳性,黏液卡红阳性)。导管(假子宫内膜样)模式由衬覆柱状细胞的成角腺体组成。其他类型包括乳头状、网状、性索状、鞋钉状、球状、筛状、梭形和实性。核均匀,染色质粗糙或空泡状,或有核沟,核仁不明显。核分裂象活性不一致。重要的是,没有鳞状分化和胞质黏液。肉瘤性分化,包括软骨肉瘤、横纹肌肉瘤和骨肉瘤,支持中肾管癌肉瘤的诊断。中肾管癌没有适用的分级系统。与良性中肾管残余和增生的区别,包括:结构拥挤、杂乱浸润性生长、核分裂象活性升高、管腔内坏死碎屑和核异型性。
肿瘤呈GATA3、PAX8和CD10阳性(管腔染色模式);ER完全阴性;Napsin A和AMACR通常阴性,它们呈TTF1(很少)和calretin阳性。p53是野生型。p16不弥漫,也没有检测到HPV。
细胞学
宫颈细胞学表现为疏松粘附的立方形细胞,核深染但核轮廓光滑,可能提示中肾管分化,但中肾管增生与中肾管癌的区分需要组织学检查。此外,根据核异型性,高级别中肾管腺癌可导致宫颈细胞学诊断为恶性肿瘤,但分类为中肾管癌必需取决于组织学和免疫组化结果。
诊断分子病理学
无临床相关性
诊断标准
必要标准:结构模式的混合;有核沟的透明核;p16不弥漫。
理想标准:伴有邻近的中肾管残余和/或中肾管增生;GATA3和/或TTF1阳性;ER和Napsin A阴性;HPV阴性。
分期
该实体的分期方式与其他宫颈癌相同。
预后和预测
在有限的病例系列中,大约1/3病例复发。可能经历很长时期才复发(平均:4年;范围:1-11年),可能局部复发(骨盆和腹部)和远处复发(肺、纵隔)。
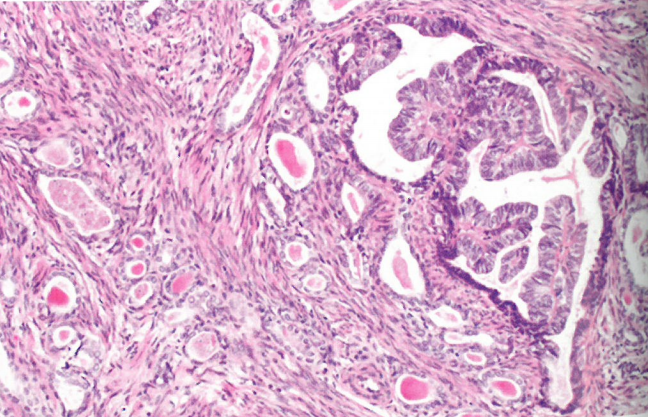
图8.44中肾管癌。典型的管状和导管模式。小管内衬立方形细胞,含有致密的嗜酸性分泌物,以及局灶管腔内坏死碎屑。导管模式包括成角的腺体,内衬柱状细胞。
19. 宫颈的其他腺癌
定义
累及宫颈的恶性腺体肿瘤。
ICD-O编码
8484/3 腺癌,HPV不相关,NOS
ICD-11编码
2C77.1 子宫颈的腺癌
2C77Y 子宫颈的其他特指性恶性肿瘤
相关命名
可接受:子宫颈管的子宫内膜样腺癌;子宫内膜样腺癌继发性累及子宫颈;浆液性癌继发性累及宫颈;腺癌NOS
亚型
子宫内膜样腺癌NOS
部位
子宫颈管和外子宫颈
临床特征
目前尚无关于原发性子宫内膜腺癌或腺癌NOS.的信息。继发性累及宫颈的癌可能伴有阴道出血、非特异性盆腔症状、血清CA125水平升高和/或宫颈细胞学阳性有关。原发部位常有主要肿块。
流行病学
宫颈的子宫内膜样腺癌罕见,占所有原发性宫颈腺癌的1%以下,而大约10%的子宫内膜的子宫内膜样性腺癌病例浸润宫颈间质。由于与普通型腺癌在形态上相似,且缺乏适当的定义,因此在旧文献中报道的患病率较高。尽管在旧文献中对原发性宫颈浆液性癌进行了研究,但现在普遍认为,在宫颈中检测到的大多数或所有浆液性癌都代表附件或子宫内膜浆液性癌的转移或直接扩散,尽管尚未发表支持这一点的结论性研究。根据国际宫颈腺癌标准和分类(IECC)的建议,几乎所有宫颈腺癌(98%)都可以使用HE染色切片分为HPV相关和HPV不相关,这意味着NOS类别只应很少使用。这是一种排除性诊断。
病因
宫颈的子宫内膜样腺癌被认为起源于子宫内膜异位症。继发累及宫颈的子宫内膜样腺癌通过直接(累及粘膜和/或间质)或间接(通过淋巴管血管浸润累及粘膜)从子宫体和子宫下段延伸。这些肿瘤通常是中/高级别,严重浸润子宫肌层,伴有明显的淋巴管血管浸润。继发于宫颈的浆液性癌直接(累及粘膜和/或间质)从子宫体和子宫下段延伸,或间接(通过植入或淋巴管血管浸润涉及粘膜)延伸。腺癌NOS是一组异质性肿瘤。
发病机制
未知
大体检查
子宫内膜样亚型肿瘤通常表现为肉眼可见的息肉样或溃疡性宫颈肿块。
组织病理学
子宫内膜样亚型必须出现明确的子宫内膜样特征:至少局灶性低级别子宫内膜样腺体,衬覆柱状细胞,具有淡染嗜酸性胞质,核假复层、形态学温,伴或不伴鳞状分化和/或宫颈子宫内膜异位症。因此,宫颈的子宫内膜样癌的形态学必须与子宫内膜的子宫内膜样癌症的形态学相同。一个可能的例外是,高分化子宫内膜样腺体有间质浸润,但没有间质反应。2003年有一篇文献讨论了这个主题,描述了继发性累及宫颈的子宫内膜样子宫内膜癌的相同模式,这种模式并不罕见。与HPV相关腺癌不同,子宫内膜样癌在扫描倍数下不显示顶端核分裂象和凋亡小体,p16在高级别病变中可能呈大片状阳性;然而,大多数子宫内膜样腺癌显示p16呈斑片状阳性,所有病例均为HPV阴性。在黏液缺失的宫颈腺癌存在的情况下,即使存在筛状结构,也不应反射性诊断真正的宫颈的子宫内膜样癌。只有在排除原发性子宫内膜癌和HPV感染后,才能确定这一诊断。
继发性累及宫颈的浆液性癌,其形态学等同于其他部位出现的浆液性癌和高级别浆液性癌。宫颈细胞学、宫颈刮除术或活检报告的浆液性癌不足以诊断为原发性浆液性癌。任何假定的原发性宫颈浆液性癌都必须存在异常p53染色模式且没有HPV感染,并且必须排除子宫内膜和附件的原发性浆液性癌。
宫颈腺癌NOS的形态尚不清楚,但强烈建议病理学家根据是否存在HPV对这些肿瘤进行分类。如其他章节所述,HPV相关腺癌表现出明显的漂浮核分裂象和核碎裂。HPV存在的辅助检查可能需要特定检测(基于mRNA的高危型HPV原位杂交)或间接检测(p16免疫组化)。这些方法的陷阱在HPV相关宫颈腺癌一节中进行了讨论(见子宫颈腺癌,HPV相关,原书第367页)。HPV不相关腺癌通常具有特征性的组织学表现,但在活检小样本中可能很难进行进一步分类。有限的免疫组化染色(p16、ER和GATA3)可用于缩小鉴别诊断范围。当无法进一步细分时,可接受“HPV相关(或HPV不相关)腺癌NOS”这一术语。
细胞学
肿瘤素质,单个肿瘤细胞或以小的、紧密的三维簇或乳头状结构。常见胞质稀少的肿瘤细胞和胞质内的中性粒细胞。子宫浆液性癌常表现为乳头状细胞簇,由大的多形性肿瘤细胞组成,核仁显著,有坏死背景。还可以看到单个细胞和裸核。
诊断分子病理学
无临床相关性
诊断标准
基本:明确的子宫内膜样特征(原发性或继发性子宫内膜样癌);HPV阴性(原发性或继发性子宫内膜样癌、浆液性癌、HPV不相关腺癌NOS);伴有宫颈的子宫内膜异位症(原发性或继发性子宫内膜样癌);肿瘤不应累及子宫体或下段子宫(原发性子宫内膜样癌或浆液性癌);肿瘤不应累及子宫附件(继发性高级别浆液性癌)。
理想标准:基于p16和/或mRNA的高危型HPV原位杂交(以确定HPV相关);p53免疫组化(用于浆液性癌鉴别诊断)。
分期
子宫颈的腺癌NOS如果是原发性的,则按宫颈癌分期。
预后和预测
由于之前缺乏统一的标准,宫颈原发性子宫内膜样腺癌的预后尚不清楚。
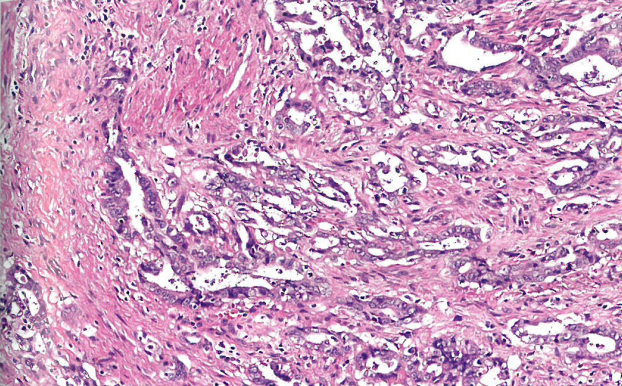
图8.45宫颈的子宫内膜样腺癌。高倍,由完好的腺体、肿瘤浸润性淋巴细胞、圆形空泡状核和很少核分裂象或凋亡小体组成。HPV mRNA原位杂交和p16均为阴性(未提供图片)。
20. 癌肉瘤NOS
定义
癌肉瘤是一种由上皮和间叶性成分组成的双相性恶性肿瘤。
ICD-O编码
8980/3 癌肉瘤 NOS
ICD-11编码
2C77.Y&XH2W45 子宫颈的其他特指性恶性肿瘤&癌肉瘤NOS
相关命名
不推荐:恶性中胚层混合瘤;恶性苗勒混合瘤;化生性癌
亚型
无
部位
子宫颈
临床特征
宫颈癌肉瘤主要发生在绝经后妇女,表现为从宫颈口脱出的巨大息肉样肿块。
流行病学
原发性宫颈癌肉瘤的发病率远低于子宫体或卵巢发生的对应肿瘤。
病因
一些肿瘤与高危HPV感染(16型和18型)有关。
发病机制
发病机制与子宫肿瘤相似。这些肿瘤可能代表去分化(化生性)癌。
大体检查
子宫颈癌肉瘤表现为巨大的鱼肉样息肉样肿块,常伴有坏死和出血。
组织病理学
癌成分可以是原发性宫颈恶性上皮性肿瘤的亚型之一(鳞状细胞癌、腺癌、腺样基底细胞癌、中肾管癌、神经内分泌癌)。间叶性成分通常是同源性(纤维肉瘤、子宫内膜样间质肉瘤),但偶尔出现异源性分化(横纹肌肉瘤、骨肉瘤)。中肾管型肿瘤的上皮成分呈CD10和GATA3阳性。骨肉瘤成分可以用SATB2证实。
细胞学
癌肉瘤可以通过存在恶性上皮成分和肉瘤成分来识别。然而,在38-75%的病例中,宫颈细胞学可能没有肉瘤成分。
诊断分子病理学
无临床相关性
诊断标准
基本标准:边界清楚的癌和肉瘤成分形成双相性混合物。
分期
该实体按宫颈癌分期。
预后和预测
预后不良,2年总生存率为60%。肿瘤分期是唯一最重要的预后指标。然而,宫颈癌肉瘤通常比子宫体肿瘤的分期更早(约50%的宫颈癌肉瘤为FIGO IB期)。因此,其预后可能更好。
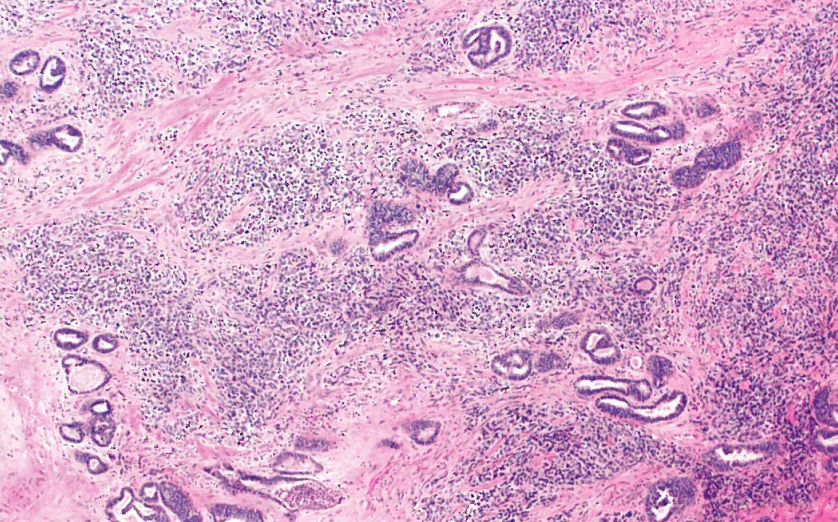 图8.46癌肉瘤,中肾管型。由相对低级别的上皮成分和高级别肉瘤成分混合而成的肿瘤。存在典型的中肾管癌区域(未提供图片)。性淋巴细胞、圆形空泡状核和很少核分裂象或凋亡小体组成。HPV mRNA原位杂交和p16均为阴性(未提供图片)。
图8.46癌肉瘤,中肾管型。由相对低级别的上皮成分和高级别肉瘤成分混合而成的肿瘤。存在典型的中肾管癌区域(未提供图片)。性淋巴细胞、圆形空泡状核和很少核分裂象或凋亡小体组成。HPV mRNA原位杂交和p16均为阴性(未提供图片)。
01. 宫颈的腺鳞癌和黏液表皮样癌
定义
腺鳞癌和黏液表皮样癌是同时表现出鳞状分化和腺体分化的恶性上皮性肿瘤。
ICD-O编码
8560/3 腺鳞癌
8430/3 黏液表皮样癌
ICD-11编码
2C77.2 宫颈腺鳞癌
2C77.Y&XH1J36 子宫颈的其他特指性恶性肿瘤&黏液表皮样癌
相关命名
不推荐:毛玻璃细胞癌
亚型
无
部位
大多数位于鳞柱交界区。
临床特征
患者就诊时的平均年龄约为46岁。大多数患者出现异常阴道出血。
流行病学
这些肿瘤少见,但并不罕见,约占所有宫颈癌的5-6%。
病因
这些肿瘤与高危型HPV有关,最常见的是PHV 16和18型。
发病机制
原位杂交或PCR可用于检测HPV。与鳞状细胞癌相比,腺鳞癌的ARID1A表达较低,而在没有激活突变的情况下,EGFR(HER1)和PDGFR的表达很常见。
大体检查
肿瘤表现为溃疡、结节或息肉样质硬肿块。
组织病理学
组织学上,腺鳞癌应呈现明确的腺体分化和鳞状分化区域。腺体成分通常是普通的HPV相关类型。鳞状细胞可有丰富的透明、富含糖原的胞质。这两种肿瘤成分通常密切混合,形态学可以识别,无需特殊的染色方法。鳞状细胞癌中散在的产黏液细胞不应诊断为腺鳞癌。坏死、炎性浸润和淋巴管血管浸润的区域经常出现。“毛玻璃细胞癌”曾用于描述低分化腺鳞癌,不建议使用。腺鳞癌应与浸润性复层产黏液癌和宫颈黏液表皮样癌区分开来,后者是一种非常罕见的实体,表现出三种细胞类型(表皮样细胞、产黏液细胞和中间型细胞),并显示MAML2基因重排。
腺鳞癌中的两种肿瘤成分通常对p16表现出不同的免疫反应性。腺成分通常对CK7、CEA和PAX8呈阳性,鳞状成分通常对p63和p40呈阳性。
细胞学
同时出现恶性腺细胞和恶性鳞状细胞令人怀疑腺鳞癌的可能性。然而,最好等到组织学标本才分类。
诊断分子病理学
无临床相关性
诊断标准
基本标准:恶性腺体成分和鳞状成分。
分期
分期与其他宫颈肿瘤相同。
预后和预测
较早的文献表明,腺鳞癌呈侵袭性临床进程,分期预后比鳞状细胞癌和腺癌差。然而,最近的研究表明,其临床结果与宫颈腺癌相似。
22. 宫颈的腺样基底细胞癌
定义
腺样基底细胞癌是一种上皮性肿瘤,由形态温和的基底样细胞形成小的圆形细胞巢。
ICD-0编码
8098/3 腺样基底细胞癌
ICD-11编码
2C77.1&XH70J2 子宫颈的腺癌&腺样基底细胞癌
相关命名
可接受:腺样基底上皮瘤;低级别腺样基底细胞肿瘤
亚型
无
部位
宫颈(通常位于移行区)
临床特征
患者通常无症状。除非并存另一种肿瘤类型,否则肿瘤通常是在因宫颈细胞学结果异常而接受治疗的患者中偶然发现。
流行病学
在报道的病例中,患者年龄从21岁到91岁(平均64.6岁)。
病因
在大多数病例中检测到高危型HPV。
发病机制
未知
大体检查
除非同时存在另一种类型癌,否则通常不出现严重异常。
组织病理学
腺样基底细胞癌是一种上皮性肿瘤,由小的、形态温和的、分化良好的、圆形细胞巢组成,或有时由相对单形的、胞质稀少的基底样细胞形条索状。肿瘤细胞巢可能表现为外周栅栏状排列、囊性变、透明细胞改变和局灶性腺体或鳞状分化。通常没有间质反应。腺样基底细胞癌通常并存高度鳞状上皮内病变(>90%)或另一种类型的浸润性癌,最常见的是鳞状细胞癌。因此,要诊断单纯的腺样基底细胞癌,就需要对整个肿瘤进行评估。腺样基底细胞癌并存另一种浸润性癌类型,应报告为混合癌,并描述其各个组织类型及其比例。腺样基底细胞癌应与腺样基底增生区分开来,后者是一种储备细胞来源的非肿瘤性病变,p16和HPV均为阴性。免疫组化显示,肿瘤细胞呈广谱CK、p63和p16(大片状模式)呈阳性。
细胞学
腺样基底细胞癌在宫颈细胞学中很少发现,被描述为拥挤的小而均匀的成片细胞,具有深染的卵圆形核。在诊断腺样基底细胞癌诊断之前,最常见的宫颈细胞学结果是高度鳞状上皮内病变。
诊断分子病理学
无临床相关性
诊断标准
必要标准:非肿块形成性病变;形态温和的基底样细胞形成浸润性小巢或条索;没有间质反应。
理想标准:p16和/或HPV检测。
分期
分期与其他宫颈肿瘤相同。
预后和预测
对于腺样基底细胞癌在纯型,没有已知的转移潜能,因此有人提出了“腺样基底瘤”一词。含有腺样基底肿瘤成分的混合癌,其预后取决于其他成分的预后特征。
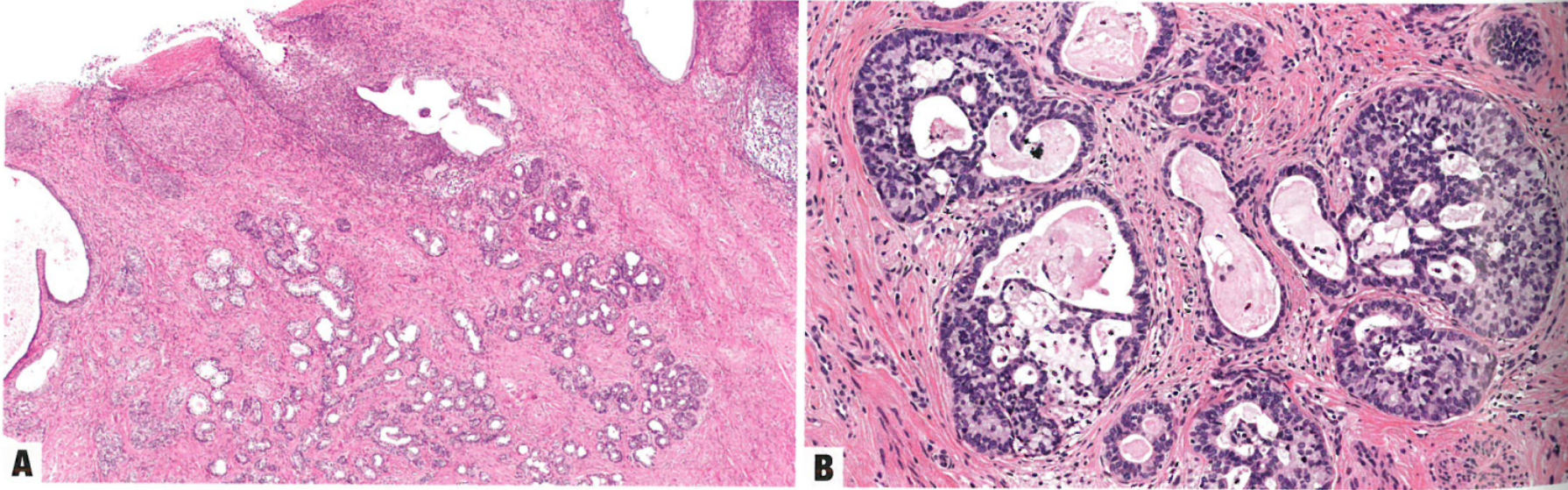
图8.47腺样基底细胞癌。A 基底样细胞形成小的圆形巢,伴一些腺体分化。本例也有上方的高度鳞状上皮内病变。B 由形态温和的基底样细胞形成巢,伴有中心囊性改变。对肿瘤巢没有明显的间质反应。
23. 未分类宫颈癌
定义
未分类宫颈癌是一种无法进一步分类的宫颈恶性上皮性肿瘤;诊断需要排除潜在的组织学相似病变,包括原发性和转移性肿瘤。
ICD-O编码
8020/3 未分化癌,NOS
ICD-11编码
2C77.Z 宫颈的恶性肿瘤,非特指
相关命名
可接受:未分化癌;低分化癌
亚型
无
部位
子宫颈
临床特征
其临床特征与普通的宫颈癌相似。在SEER分析中,患者的平均年龄为42岁(范围:32-58岁),70%的病例按AJCC分期为I期。
流行病学
这些只占宫颈癌的很小比例。
病因
数据有限,但大多数病例为HPV相关和/或大片状p16阳性。
发病机制
发病机制通常与HPV有关。
大体检查
大体外观与宫颈癌相似。
组织病理学
肿瘤表现出上皮表型,但缺乏其他特殊亚型宫颈癌的组织学或免疫组化特征(如鳞状细胞癌、腺癌和神经内分泌癌)。在病例中,可能是取样不足或取样缺乏代表性的结果。弥漫性p63表达应考虑低分化鳞状细胞癌。
细胞学
无临床相关性
诊断分子病理学
无临床相关性
诊断标准
基本标准:原发性恶性上皮性肿瘤缺乏特异性分化特征;分子分析和p16免疫组化可能有助于确定HPV相关病因。
分期
分期与其他宫颈肿瘤相同。
预后和预测
在SEER分析中,10年病因特异性生存率为84.9%,与宫颈鳞状细胞癌没有统计学差异。
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论