[导读] 编译整理:强子
小标本、大风险-部分乳腺病变粗针穿刺活检诊断要点(一)
小标本、大风险-部分乳腺病变粗针穿刺活检诊断要点(二)
小标本、大风险-部分乳腺病变粗针穿刺活检诊断要点(三)
小标本、大风险-部分乳腺病变粗针穿刺活检诊断要点(四)
小标本、大风险-部分乳腺病变粗针穿刺活检诊断要点(六)
腺病
腺病是乳腺内有上皮细胞、肌上皮细胞的腺体成分良性增生。该病也是发生于终末导管小叶单位的小叶中心性病变。组织学具有多种类型,且有些会形似浸润性癌。腺病可形成临床可触及、或影像学可检出的肿物。
硬化性腺病
硬化性腺病是腺病中最为常见的组织学亚型,一般发生于绝经前女性。乳腺粗针穿刺活检标本中检出率约为12%。影像学最常见表现为钼靶检查中的微钙化、超声中伴或不伴钙化的肿物。
组织学上,硬化性腺病为仍有上皮层、肌上皮层的腺体增生;上皮细胞层偶可萎缩表现、甚至几乎完全消失;基底膜可增厚、显著嗜酸性;周围间质呈硬化性表现或纤维化。部分硬化性腺病病例可呈不规则表现并累及周围脂肪组织、乳腺纤维性间质、甚至神经,此时极易误诊为浸润性癌的神经周围侵犯。硬化性腺病周围可有其他良性病变,如纤维囊性改变、复杂性硬化性病变、纤维上皮性病变、乳头状病变。非典型小叶增生、小叶原位癌周围出现硬化性腺病的几率增加三倍。导管非典型增生、导管原位癌、浸润性癌也可累及硬化性腺病、或出现在其周围。
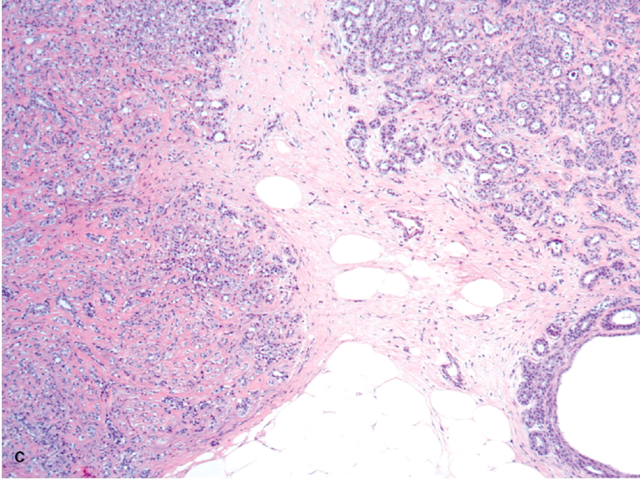
图1. 硬化性腺病,左侧为实性、小叶中心性区域,而右侧为相对疏松、貌似浸润性生长的区域。
大汗腺腺病
乳腺良性活检标本中约40%会存在大汗腺化生,且大汗腺化生常伴纤维囊性改变、腺病、乳头状病变等。大汗腺腺病是指大汗腺改变累及硬化性腺病,而非典型大汗腺腺病则指硬化性腺病中出现大汗腺型非典型。
影像学上并无可靠特征足以区分大汗腺腺病和其他类型腺病。非典型大汗腺腺病罕见,据报道发生率约为0.4%。组织学上,大汗腺改变特点是细胞增大、胞质丰富、颗粒状、嗜酸性,细胞之间界限清晰;细胞核大而圆形,染色质空泡状,一般有显著核仁。
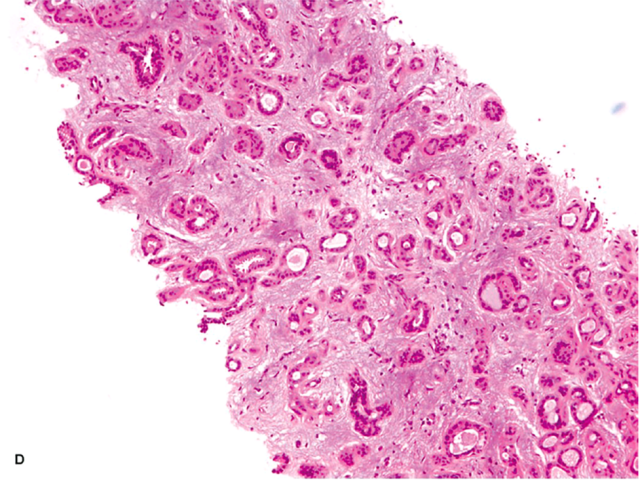
图2. 呈浸润性表现、且有间质纤维化的大汗腺型腺病。本例应注意鉴别小管癌,但并无促纤维结缔组织增生、无细胞学异型性。免疫组化肌上皮标记有助于确定诊断。
诊断非典型的相关标准不一,但主要依据是结构改变、细胞核特征、病变范围。目前一致的观点是:大汗腺病变中的细胞学异型性是指大汗腺型细胞的细胞核增大至正常大汗腺细胞的三倍以上,具有显著的单个或多个核仁,核浆比增加,细胞核深染,局灶有核分裂。不过,大汗腺型非典型与大汗腺型导管原位癌之间的区分,在专家之间也是个有争议的话题。硬化性腺病中非典型大汗腺成分显著增生,很难与大汗腺型导管原位癌、大汗腺型浸润性癌鉴别。有报道指出大汗腺型病变中肌上皮细胞不连续或缺失,因此粗针穿刺活检中的硬化性大汗腺型病变与浸润性癌鉴别时,应注意仔细、慎重判读。
微腺性腺病
乳腺粗针穿刺活检标本中最具争议的可能就是微腺性腺病了。微腺性腺病中增生的腺体类似浸润性导管癌。该病可发生于任何年龄,28-82岁均有报道。临床上可表现为触及肿物,或因其他原因粗针穿刺活检偶见。钼靶或超声检查无特异性表现,MRI可表现为中等程度的早期或延迟增强肿物。
与其他类型腺病相反,微腺性腺病中的腺体呈非小叶中心型分布,且并无肌上皮层。微腺性腺病的腺体小、圆形,衬覆单层的扁平至立方状上皮细胞,细胞核圆形,核仁不明显。腺腔内可见PAS阳性、黏液卡红阳性的分泌物,且可能有微钙化。非典型微腺性腺病中,腺体结构仍保存,但细胞及结构方面均具有异型性。有时非典型微腺性腺病中可见软骨化生,发生于微腺性腺病的癌中也可以与出现软骨化生。
临床及影像学已证实微腺性腺病和浸润性癌有关。最常见容易与微腺性腺病、非典型微腺性腺病混淆的癌是非特异性浸润性癌、腺样囊性癌、浸润性癌。微腺性腺病中发生的浸润性癌突破基底膜,一般有坏死,常见核分裂,且周围有淋巴细胞聚集。
腺病鉴别诊断及免疫组化
粗针穿刺活检标本中,应区分开各种不同类型的腺病,因为其治疗可能不同。对硬化性腺病来说,主要应鉴别浸润性癌。如前所述,硬化性腺病为小叶中心型增生,而浸润性癌中的腺体为杂乱分布;此外,硬化性腺病中一般HE切片中即可见基底膜和肌上皮细胞。不过,偶有间质显著硬化时会造成鉴别困难。此外,即使低级别癌中,其细胞学异型性也会超出硬化性腺病中的异型性程度。不过,细针穿刺标本中由于组织有限,因此可能无法充分评估前述所有特点,此时免疫组化或特殊染色有助于鉴别:网状蛋白、层黏连蛋白、PAS、IV型胶原等均可用于显示硬化性腺病周围的基底膜;肌上皮标记结果更为可靠。
伴或不伴非典型的大汗腺型腺病鉴别诊断应注意大汗腺型导管原位癌累及硬化性腺病、小叶原位癌(多形性亚型)、浸润性大汗腺癌。有导管原位癌的结构特征、具有显著多形性、有坏死、核分裂多见,则倾向于导管原位癌。与硬化性腺病一样,间质硬化、挤压非典型大汗腺细胞的时候,可误判为浸润性癌。要想不出现类似误诊,了解这一现象是才是关键!可疑的时候,免疫组化加做肌上皮标记。此外,伴或不伴非典型的大汗腺腺病PAS阳性,免疫组化EMA、CK8、CK18、AR、GCDFP-15均阳性,而ER、PR阴性。多形性小叶原位癌中细胞失黏附是有助于确诊的重要线索;但非典型、胞质嗜酸性在大汗腺型病变中也会存在。多形性小叶原位癌一般免疫组化GCDFP-15阳性而E-cadherin阴性。
微腺性腺病应鉴别高分化浸润性导管癌、小管癌、其他类型腺病。与高分化浸润性癌类似,微腺性腺病也呈浸润性、无序生长,且无肌上皮细胞。小管癌一般腺体成角,大小不一,而微腺性腺病则为小而均一、管腔开放的圆形腺体,间质为致密、细胞稀疏的纤维性或脂肪性间质。无促纤维结缔组织增生反应、有增厚的基底膜,有助于微腺性腺病和浸润性癌的鉴别。
微腺性腺病与其他类型腺病的鉴别也很关键,因为尽管微腺性腺病是良性,但如果切除不完整则可以复发。粗针穿刺活检诊断为微腺性腺病者,应建议病灶全部切除进一步评估,并排除非典型或浸润性癌的存在;而粗针穿刺活检诊断为硬化性腺病则无需手术切除。
微腺性腺病、非典型微腺性腺病、微腺性腺病相关的癌中,其上皮细胞免疫组化表达S100、CK8/18、EGFR,而不表达ER、PR、HER2、GCDFP-15、CK5/6、EMA;低级别浸润性癌中则一般ER、PR、EMA强阳性。微腺性腺病和浸润性癌的鉴别中,免疫组化Ki-67、p53也有帮助。
腺病鉴别预后及治疗
与其他无非典型的增生性病变一样,硬化性腺病后续发生乳腺癌的风险低,其相对风险为1.7-2.1。粗针穿刺活检中诊断为硬化性腺病时常规无需建议手术切除,除非伴其他增生性病变,如复杂性硬化性病变、非典型,或影像学与病理学诊断不符。
文献中对大汗腺型化生与浸润性癌的关系还有争议。部分良性增生性大汗腺病变中存在分子遗传学改变,表明某些病变可能是克隆性的;但目前尚无充分证据得出确定性结论。不过,目前认为:大汗腺型化生并非癌前病变。
由于非典型大汗腺型腺病罕见,因此尚需大规模、长期研究。有作者发现如伴增生性病变时,则发生癌的风险增加;但也有作者并未发现这一相关性。目前认为,非典型大汗腺型腺病可能并非浸润性癌的前驱病变,因此如果仅单独这一病变则与乳腺癌发生风险增加无关。
有几项研究称,微腺性腺病和非典型微腺性腺病可进展为浸润性癌;且30%的微腺性腺病患者可检出癌。分子遗传学研究表明这类病变是克隆性、肿瘤性,毫无疑问是部分高级别、三阴型乳腺癌的前驱病变。由于相关病变例数少,因此目前对微腺性腺病、非典型微腺性腺病及相关浸润性癌的预后和生物学行为还难以评估。
参考文献
Rosa M, Agosto-Arroyo E.Core needle biopsy of benign, borderline and in-situ problematic lesions of the breast: Diagnosis, differential diagnosis and immunohistochemistry[J].Annals of diagnostic pathology,2019,43:151407.
DOI:10.1016/j.anndiagpath.2019.151407















共0条评论