[导读] 编译整理:强子
骨原发肿瘤诊断策略概述(一)
骨原发肿瘤诊断策略概述(二)
骨原发肿瘤诊断策略概述(三)
骨原发肿瘤诊断策略概述(四)
骨原发肿瘤诊断策略概述(五)
骨原发肿瘤诊断策略概述(六)
六. 纤维骨性肿瘤
1. 纤维结构不良
纤维结构不良是一种中央型、良性纤维骨性肿瘤,可单骨发生(约占75%)、也可多骨发生(约占25%)。任何部位骨均可受累,影像学特征在X线表现为典型的“毛玻璃样”。该病变不应“冲破”皮质骨,但在较薄的骨骼处(如颅骨、肋骨、手部小骨)可以出现这一现象。临床症状可出现疼痛、畸形、骨折、颅神经症状等,具体取决于受累骨骼位置。10%的纤维结构不良病例会伴有低磷血症,因此这类患者均应常规检测血钙、血磷。本文作者也会在病理报告中写出这一建议。低血磷是由于肿瘤细胞分泌的FGF23所致,且对肾脏具有系统性影响。临床可导致腿部弯曲、未成熟或正在成熟中的骨骼弯曲,需要咨询骨骼代谢专家进行治疗。
组织学上,纤维结构不良的特点为形态单一、表现温和的梭形细胞,其中可见数量不等的不成熟编织骨,且这些骨组织呈不规则成角、弯曲小梁状,因此称之为字母样或中国字样。这些骨小梁周边并无骨母细胞环绕(这一点与后续骨纤维结构不良相反)。核分裂并不常见,但儿童时可较多见,且应注意恶性可能。
纤维结构不良应主要和低级别中央型骨肉瘤鉴别;如病变自髓腔发生,还应注意与骨旁骨肉瘤鉴别。GNAS突变和MDM2扩增相互排除,可用于病变鉴别。病变位于胫骨及腓骨时,还应考虑到骨纤维性结构不良的可能,应进行广谱CK免疫组化。CK阳性与GNAS突变之间也是相互排除的。纤维结构不良也可伴肌内黏液瘤、Mazabraud 综合征,且这类病变也可出现GNAS突变。
2. 骨纤维结构不良
骨纤维结构不良是一种以皮质骨为主的良性肿瘤,基本仅发生于胫骨、腓骨。如临床为年轻患者、双侧发病,也可能与cMET种系突变有关;这一突变在散发病例并无发现。组织学上与前述纤维结构不良极为相似,但该病变中骨小梁周围有明显骨母细胞瘤围绕,且有CK阳性细胞,这一特征是与GANS突变互斥的。骨纤维结构不良被认为是釉质上皮瘤(adamantinoma)的前驱病变,但这一转化可能极为罕见。
七. 脊索肿瘤
1. 脊索瘤
脊索瘤是一种具有脊索分化的恶性肿瘤,其起源认为是中线储持续存在的胚胎脊索成分(persistent midline embryonic notochord elements)。大部分脊索瘤均为散发性病变,但也可表现为常染色体显性遗传,是由于brachyury基因串联重复所致。目前认为脊索瘤可以发生于中轴骨的任何部位,自蝶骨、枕部、颅底直至骶尾部均可出现;极为罕见的情况下可出现于中轴骨之外及软组织。
脊索瘤患者年龄分布宽泛,自刚出生、直至最常见的五六十岁均可发生。儿童组患者主要见于蝶骨、枕部及脊柱颈段。存活时间中位数为7年。转移一般出现于确诊数年后,可播散至其他部位骨组织,不常见情况下可转移至皮下组织。治疗方面主要为手术并联合放疗。EGFR抑制剂已确定是一个很有潜力的治疗方案。
大部分脊索瘤组织学表现都很典型,但由于其细胞具有透明细胞表现,因此鉴别诊断应考虑到转移癌、软骨肉瘤等。由于脊索瘤可表达CK,因此有时候诊断非常有难度。不过,脊索瘤的标志性免疫组化标记brachyury极少表达于癌;去分化的脊索瘤也不表达该标记。脊索瘤可以出现软骨分化,但这些细胞还是会表达brachyury,且这种形态的出现不会影响临床预后及治疗方案。
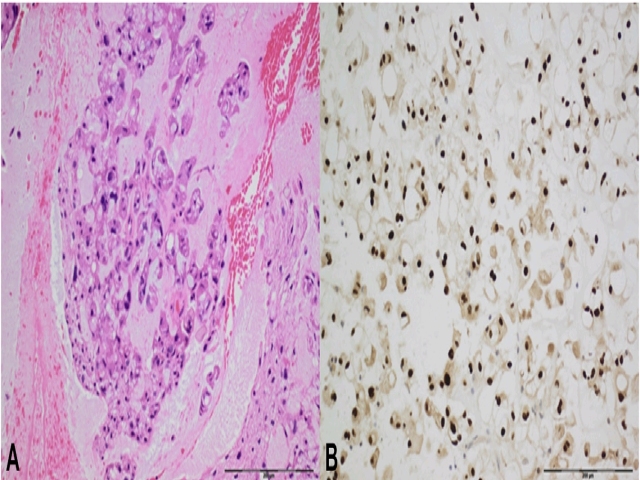
图18. 脊索瘤。镜下肿瘤细胞胞质界限清晰、泡沫样或空泡样,呈条索样分布,可见显著核仁。可见纤维性间隔,间质有黏液样变。免疫组化brachyury细胞核强阳性,有助于脊索瘤和转移性透明细胞癌、软骨肉瘤的鉴别。
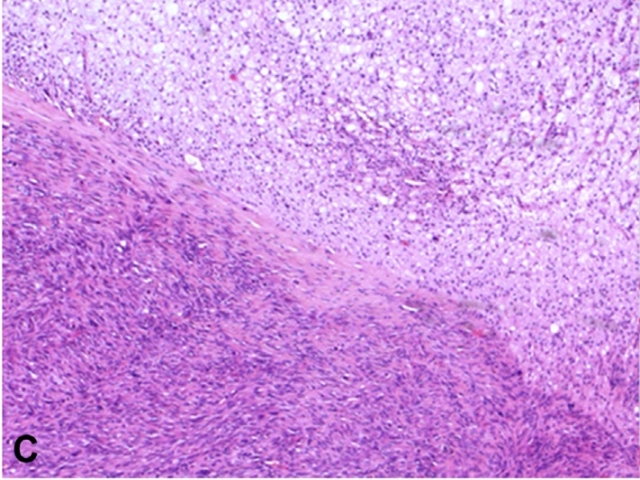
图19. 去分化脊索瘤。本例脊索瘤周边可见未分化的梭形细胞肿瘤;结合影像学特征、部位位于中轴处,加之有分化型脊索瘤成分,因此综合考虑诊断为去分化脊索瘤。
2. 良性脊索细胞瘤
良性脊索细胞瘤的发生部位与脊索瘤相同。有经验的影像科根据影像学表现即可做出诊断,因此很少进行活检。目前对于这类患者该如何进行随访还无共识。组织学容易误诊为脂肪组织,但免疫组化表达CK及brachyury。良性脊索细胞瘤周边偶见软骨瘤,这说明该肿瘤可能是一种前驱性病变。
良性脊索细胞瘤虽然有脊索瘤的相关表现,但不会出现宿主骨或软组织受累。发生于颅底的良性脊索细胞瘤也称之为颅内蝶枕脊索瘤(ecchordosis physaliphora)。
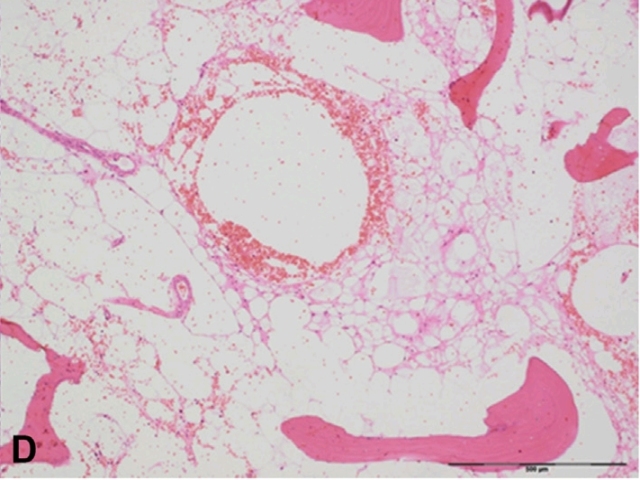
图20. 良性脊索细胞瘤。该肿瘤为透明细胞组成,细胞核特征温和,免疫组化为脊索表型。肿瘤无细胞学异型性、无黏液样改变或坏死。偶见于骶骨骨肉瘤切除后。
八. 圆细胞肿瘤
首先需要指出的是,目前随着肿瘤形态学认识的深入、以及免疫组化和/或遗传学检测应用的增多,“圆细胞肿瘤”的诊断越来越少。本文重点介绍Ewing肉瘤及Ewing肉瘤家族肿瘤。
大部分Ewing肉瘤家族肿瘤均具有EWSR1基因重排,但该基因异常也可见于其他肿瘤类型,如透明细胞肉瘤、血管瘤样纤维组织细胞瘤、肌上皮瘤、骨外黏液样软骨肉瘤、促纤维结缔组织增生性小圆细胞肿瘤。因此形态学评估才是最为关键的。
Ewing肉瘤是具有神经内分泌分化的恶性“小圆细胞”肿瘤。此前的外周神经外胚层肿瘤、Askin肿瘤等目前统称为Ewing肉瘤家族肿瘤。这类肿瘤可以发生于任何部位的骨及软组织,发生于骨组织者80%为儿童,发生于软组织者则主要为成人。临床部位一般为四肢长管状骨的干骺端及骨干。临床表现可类似骨髓炎,出现疼痛、发热、体重减轻及白细胞升高。
自从20世纪80年代现代化疗方案引入之后,Ewing肉瘤的预后出现了显著改善。对于局灶肿瘤来说,5年生存率已达70-80%,但有转移的情况下则仅为15-30%。
组织学上,Ewing肉瘤表现为形态单一的“小圆形细胞”表现,免疫组化CD99膜阳性;偶有更加多形性的表现(非典型Ewing肉瘤),且免疫组化CD99表达降低。需要说明的是,CD99对于Ewing肉瘤的诊断敏感性和特异性均较差,因此应结合遗传学检测才可确诊。90%的Ewing肉瘤具有EWS-FLI1融合基因,但也有其他伴侣基因报道,如ERG、ETV1。
Ewing肉瘤家族肿瘤中还有部分称之为Ewing样肉瘤,即并无特征性分子遗传学改变者。这类肿瘤表现为圆形细胞为主,但具体形态学表现略有差异;遗传学上可有特征性的CIC-DUX4、BCOR-CCNB3等。尽管这类肿瘤是否属于Ewing肉瘤家族肿瘤还有争议,但目前其新辅助治疗方案与Ewing肉瘤有相似之处。
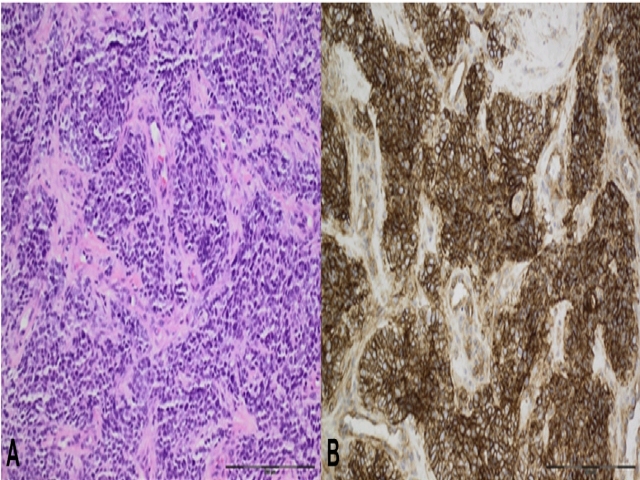
图21. Ewing肉瘤,组织学表现为形态单一的“小圆形细胞”,胞质稀少。可见Homer-Wright菊型团,提示为神经外胚层分化。免疫组化CD99为细胞膜强阳性,不过这一指标对于Ewing肉瘤的诊断来说敏感性较低。
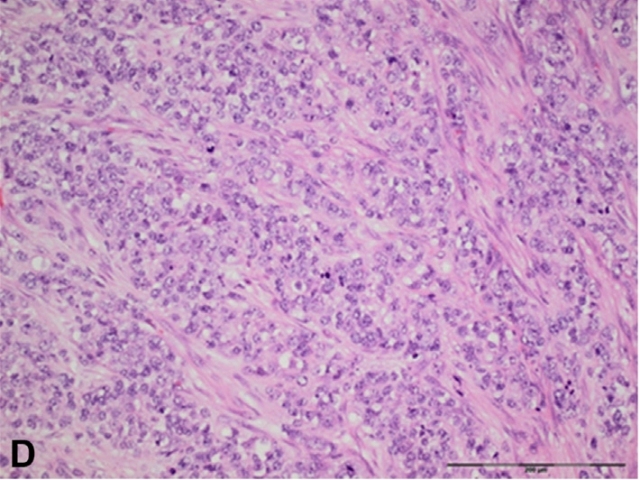
图22. CIC-DUX4重排肉瘤,瘤细胞虽然仍为小圆形细胞形态,但其多形性比经典Ewing肉瘤的多形性要更加显著。
目前对于Ewing肉瘤的诊断也有一些新的免疫组化标记物,如EWSR1-FLI1下游靶点NKX2.2。该标记物对于Ewing肉瘤诊断敏感性好,但并无特异性,其他肿瘤如间叶性软骨肉瘤、CIC-DUX4重排、BCOR-CCNB3重排圆细胞肉瘤中也有表达,因此限制了其诊断在诊断中的应用。
全文完
点击下载英文文献
参考文献
Flanagan AM.A diagnostic approach to bone tumours[J].Pathology,2017,49(7):675-687.
DOI:10.1016/j.pathol.2017.08.003


















共0条评论