[导读] 译者:薛德彬
2.2.8 伯基特淋巴瘤:EBV有重要意义
在WHO-HAEM5中,伯基特淋巴瘤(BL)的定义基本上没有改变,为一种侵袭性成熟B细胞肿瘤,由中等大小的细胞组成,呈生发中心B细胞表型(CD10+、BCL6+、BCL2-/弱)、高Ki67指数(>95%)和IG::MYC并置(图4)。鉴于历史上已确认三种BL亚型(“地方性”、“非地方性或散发性”和“免疫缺陷相关”)[145],最近的数据表明,无论流行病学背景和地理位置如何,EBV阳性BL和EBV阴性BL的分子特征形成不同的生物学群体groups ,因此取代了流行病学亚型[146-151]。EBV感染在导致B细胞逃避凋亡的早期发病机制中起着至关重要的作用[152,153]。新证据表明BL有双重发病机制:病毒驱动与突变,取决于EBV状态[147]。EBV阳性和EBV阴性BL有共同的编码突变的证据,这些编码突变影响BCR和PI3K信号传导途径、凋亡、SWI/SNF复合物和GPCR信号传导途径[149,154,155]。与EBV阴性BL相比,EBV阳性BL显示出显著增高的体细胞超突变水平(尤其是在靠近转录起始点的非编码序列中[149])、含有更少的驱动突变(尤其是在凋亡途径中[149]),并且在编码转录因子TCF3或其阻遏物ID3的基因中显示出更低的突变频率[149]。为了承认最近对BL生物学的这些见解,WHO-HAEM5建议区分两种亚型,即EBV阳性BL和EBV阴性BL。
2.2.9 KSHV/HHV8相关B细胞淋巴增殖性疾病和淋巴瘤
WHO-HAEM5认可与卡波西肉瘤疱疹病毒/人类疱疹病毒8(KSHV/HHV8)感染相关的全谱淋巴增殖性疾病,为了与其他疱疹病毒的术语平行,现称为KSHV/HHV8,以适应血液病理学家和病毒学家的常见做法。这些淋巴增殖性疾病包括KSHV/HHV8相关多中心Castleman病(KSHV/HHV8-MCD)[包括在“B细胞占优势的瘤样病变”类别下]、KSHV/HHV8阳性嗜生发中心淋巴增殖性疾病(KSHV/HHV8-GLPD)、原发性渗液性淋巴瘤(PEL)、体腔外PEL(EC-PEL)和KSHV/HHV8阳性弥漫大B细胞淋巴瘤(KSHV/HHV8-DLBCL)[156,157]。PEL/EC-PEL和KSHV/HHV8-DLBCL是HIV患者特征性发现,但也可见于其他免疫缺陷环境。相比之下,KSHV/HHV8-GLPD在没有明显免疫缺陷的老年患者中更为普遍,但在HIV阳性个体中也有报道。此外,KSHV/HHV8-MCD在HIV阳性和HIV阴性患者中均可见,但后者总体年龄较大[158-160]。根据WHO-HAEM5中的定义,对各种KSHV/HHV8相关实体的原型病例进行诊断通常很简单。然而,很明显,KSHV/HHV8相关实体的形态学和临床谱系比之前所认识的更广泛[161]。此外,个别患者的临床、组织学和病毒特征(KSHV/HHV8伴或不伴EBV)在实体之间存在重叠。对不同KSHV/HHV8相关病变的同时和异时表现的观察,以及具有多个实体的形态学和/或临床特征的病例支持这样一种观点,即这些模棱两可的病例可能是由KSHV/HHV8的特殊生物学引起的,而目前的疾病定义标准并未充分捕捉到这一点[158-161-162]。例如,区分基于淋巴结的体腔外PEL和KSHV/HHV8阳性DLBCL是困难的,可能是主观的。WHO-HAEM5承认其定义的局限性。虽然还需要更多的数据来支持实体之间生物学定义的界限,但建议在具有挑战性的病例中,在多学科背景下解决分类问题,作出最佳的治疗决策。
2.2.10 与免疫缺陷和失调相关的淋巴增殖性疾病和淋巴瘤:顺序模式order patterns的新方法
WHO-HAEM5对免疫缺陷相关淋巴增殖性疾病的分类作出了重大改变(图5)。在以前的分类中,这些疾病根据其发生的背景疾病进行分组,并在单独的章节中进行讨论。这些背景疾病包括:原发性免疫缺陷、HIV感染、移植后和其他医源性免疫缺陷。多年来,这种方法在支持临床决策以及作为转化和基础研究的基础上一直很有价值。从这种方法获得的知识支持这样一种观点,即,许多实体的形态特征和生物学存在一定程度的重叠,免疫缺陷的范围比以前所认识的更广。因此,根据2015年血液病理学学会和欧洲血液病理学协会组织的免疫缺陷和失调研讨会上提出的统一命名法,认为需要及时引入一个总体框架和标准化命名法以涵盖免疫功能障碍的不同情况[163]。该框架旨在关注共同的组织学和致病特征,并适应特定病变和特定临床和/或治疗后果的不同因果关系[163,164]。

图5 WHO-HAEM4R和WHO-HAEM5中命名和定义的免疫缺陷相关淋巴增殖性疾病与淋巴瘤之间的关系总结。
WHO-HAEM5中应用的总体概念认可在各种免疫缺陷环境中出现的增殖之间的病理学和生物学相似性,同时认可它们的具体特征。在共享实体之外,对于各种先天性免疫错误(IEI)独特的增殖尤为典型。EBVMCU:EBV阳性的粘膜皮肤溃疡。
新的标准化命名法建立在综合诊断方法的基础上,该方法将所有相关数据合并到一个报告系统中,如下所示(表5):
1) 根据公认的标准和术语进行组织学诊断;
2) 是否存在一种或多种致癌病毒;
3)临床环境/免疫缺陷背景。
表5 免疫缺陷/失调环境下产生的淋巴增殖性疾病和淋巴瘤的三部分命名法。
该命名法解决了不同免疫缺陷环境中类似病变的术语和诊断标准存在的不一致性,可以改善多学科团队之间的沟通,指导适当的临床管理和研究,并促进该领域新知识的融合。由于同一病理实体,例如多形态淋巴增殖性疾病,在不同的免疫缺陷/失调环境中不一定具有相同的发病机制或临床行为,这强调了需要将免疫缺陷/失调环境作为三部分命名法的必要部分。
新类型的免疫缺陷环境继续得到认可[165-167]。用于治疗实体瘤和血液肿瘤的多药化疗已被广泛接受为免疫缺陷的根本原因。然而,目前尚不清楚哪些综合化疗方案会带来这种风险,以及这种风险会持续多久[168]。此外,随着新型免疫调节剂的使用越来越多,出现了意想不到的免疫功能障碍类型,例如,在CAR-T细胞和/或检查点抑制疗法之后。免疫衰老是另一种尚不清楚的情况,目前尚不可能定义或排除;因此,主观地使用年龄界限没有科学依据[169]。所有这些新出现的概念都对“免疫缺陷”一词的充分性提出了质疑,因为它没有反映免疫抑制的程度、深度或表型变化以及解除管制的免疫细胞亚群的环境。因此,WHO-HAEM5采用了“免疫缺陷/失调”(IDD)作为首选术语,以涵盖这种不断扩大的疾病谱。
与种系突变相关的原发性免疫缺陷已被国际免疫学会联合会更名为“先天性免疫错误”(IEI),这是WHO-HAEM5采用的术语[170]。IEI患者可能会出现特定IEI特有的独特类型的淋巴增殖性疾病,以及后天性IDD环境中描述的淋巴增殖性疾病。这些增殖的类型和频率在很大程度上取决于各IEI下的种系畸变所导致的免疫失调。鉴于与其他IDD环境的重叠,IEI相关的淋巴增殖性疾病和淋巴瘤已被纳入“与免疫缺陷和失调相关的淋巴增殖性疾病和淋巴瘤”的总体框架和命名法。
IDD相关淋巴增殖性疾病和淋巴瘤分类的新方法影响了WHO单独章节中描述的其他淋巴实体。这尤其适用于EBV起决定性或重要作用的诊断,包括EBV阳性DLBCL、淋巴瘤样肉芽肿和CHL。在WHO-HAEM5中,这些类别之间的诊断标准已经尽可能地协调一致,同时承认一些术语是主观的。例如,一名患有DLBCL并携带EBV的老年患者,是否应根据假定的免疫衰老在IDD环境而诊断为EBV+DLBCL?这些疾病边界的澄清有待进一步了解临床病理学数据和疾病发病机制,从而进一步优化基于证据的分类。
2.2.11 霍奇金淋巴瘤:假冒CHL被明确定义,NLPHL正在努力明确定义,但NLPBCL尚未明确定义
经典型霍奇金淋巴瘤(CHL)包括一组B细胞肿瘤,起源于生发中心B细胞,特征是少量肿瘤细胞埋陷在免疫细胞丰富的反应性微环境中。诊断性Hodgkin和Reed-Sternberg(HRS)大细胞的特征是显示有缺陷的B细胞程序。与WHO-HAEM4R相比,HRS细胞的定义免疫表型保持不变,结节硬化型CHL(NSCHL)、混合细胞型CHL(MCCHL)、淋巴细胞丰富型CHL(LRCHL)和淋巴细胞消减型CHL(LDCHL)亚型的标准也保持不变。在现代治疗方案中,这些亚型失去了大部分预后相关性。然而,描述这些亚型以支持流行病学和转化研究仍然有价值,因为特定亚型与不同的临床特征和潜在生物学相关[171]。虽然自上个世纪以来,基本描述没有实质性改变,但WHO-HAEM5包括了一个关于CHL病因和发病机制的综合章节,特别是纳入了关于微环境在调节疾病中的关键作用的新数据[172-173]。最近的生物学见解使人们认识到越来越多的陷阱、灰色区域和假冒CHL的病变,其中包括淋巴结T滤泡辅助细胞淋巴瘤和可能含有EBV阳性HRS样细胞的免疫缺陷/失调环境中出现的淋巴增殖性疾病[163,174,175]。因此,在IDD环境下考虑CHL的诊断时应谨慎;这同样适用于纯粹的结外CHL样淋巴增殖性疾病。
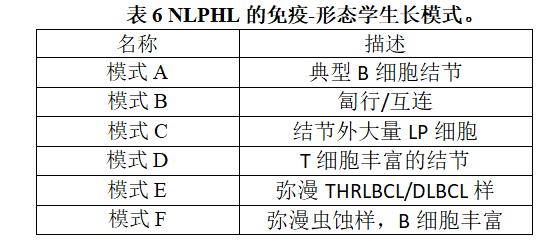
WHO-HAEM5继续将结节性淋巴细胞为主型霍奇金淋巴瘤(NLPHL)列入霍奇金淋巴瘤家族;保留NLPHL(霍奇金淋巴瘤)的现有术语,以免干扰正在进行的临床试验。然而,NLPHL可以更准确地称为“结节性淋巴细胞为主型B细胞淋巴瘤”,因为肿瘤细胞有功能性B细胞程序,因此现在认为该术语是可以接受的,以准备将来被最终采用的新命名法所采纳。NLPHL中的一个重要问题是认识到不同的生长模式[176],在一种极端情况下,这些生长模式与T细胞/组织细胞丰富的大B细胞淋巴瘤(THRLBCL)相重叠(表6)[177]。这些模式出现在所有年龄组。在回顾性分析中,一些变异型模式(模式C、D和E)与更具侵袭性的临床行为相关[177–179],因此可能反映了肿瘤的自然发展和进展[180-181]。在某些情况下,NLPHL模式E和THRLBCL可能无法明确区分,因为这两种疾病都处于晚期临床阶段。在小活检标本中,区分尤其困难,因为可能不具有代表性。
2.2.12 浆细胞肿瘤及其他含有副蛋白的疾病:从AESOP 到TEMPI的新病种
WHO-HAEM5中浆细胞肿瘤的章节认可了新的实体,并改进了分类结构,作为WHO-HAEM4R的一个进步。新的病种包括具有肾脏意义的单克隆丙种球蛋白病(MGRS)、冷凝集素病(CAD),以及TEMPI综合征(WHO-HAEM4R中的一个临时实体,以毛细血管扩张、促红细胞生成素和红细胞增多、单克隆丙种球蛋白病、肾周积液和肺内分流为特征)和AESOP综合征(浆细胞瘤上方的腺病和广泛皮肤斑块)。基于副蛋白类型和疾病负担,重新编排了章节。CAD、IgM MGUS和非IgM MGUS和MGRS被归为单克隆丙种球蛋白病,而具有异常单克隆免疫球蛋白沉积的疾病被归为一类。重链疾病(HCD)现已列入浆细胞肿瘤部分。
冷凝集素病(CAD)是一种由单克隆冷凝集素介导的自身免疫性溶血性贫血,由不符合B细胞淋巴瘤标准的潜在克隆性B细胞淋巴增殖所驱动。这种罕见疾病的年发病率估计为1-1.8/百万;在较冷的国家,其患病率高出四倍[182–184]。具有肾脏意义的单克隆丙种球蛋白病(MGRS)是一种浆细胞或B细胞增殖,不符合公认的恶性肿瘤标准,但分泌单克隆免疫球蛋白或免疫球蛋白片段,导致肾损伤[185-186]。归入MGUS的患者,约1.5%有MGRS[187]。
IgM MGUS和非IgM MGUS的风险分层模型已经更新。所有3个风险因素包括:(1)异常的血清游离轻链比率,(2)IgA型或IgM型MGUS,以及(3)血清M蛋白值>1.5 g/dL,被认为是高风险,20年后约有50-60%的进展风险,而当没有任何风险因素存在时,风险仅为5%[188]。主要通过临床和影像学检查来诊断TEMPI综合征。大多数病例骨髓不明显;少数病例表现为红系增生和少量轻链限制性浆细胞[189-190]。AESOP综合征患者的皮肤活检显示与周围皮肤粘液相关的真皮血管弥漫增生,淋巴结可显示类似Castleman病的特征[191-192]。
关于从前体状态到浆细胞(多发性)骨髓瘤(PCM)的进展,出现了新的数据,涉及分支演化模式、新突变、肿瘤抑制基因的等位基因双打击和片段拷贝数变化[193]。虽然1q21获得通常是早期事件,但1q21的易位和额外扩增在发病过程中出现较晚[194]。根据国际骨髓瘤工作组提出的经修订的多发性骨髓瘤国际分期系统对PCM进行分期[195]。在评估PCM患者预后和风险分层中,使用下一代流式细胞术或免疫球蛋白基因重排的下一代测序以及PET/CT检测微小/可测量残留疾病(MRD)的重要作用已有详细描述[196,197]。
(未完待续)
往期回顾:
淋巴造血肿瘤WHO分类第5版:淋巴肿瘤(1)简介
淋巴造血肿瘤WHO分类第5版:淋巴肿瘤(2)B
淋巴造血肿瘤WHO分类第5版:淋巴肿瘤(2)B续1
















共0条评论