[导读] 译者:薛德彬
2.2.5 滤泡性淋巴瘤(FL):从经典分级到生物学分组
滤泡性淋巴瘤家族包括滤泡性淋巴瘤、原位滤泡性B细胞肿瘤(ISFN)、儿科型FL型和十二指肠型FL。WHO-HAEM5对后三种实体没有重大更新。相比之下,滤泡性淋巴瘤实体经历了重大修改。绝大多数FL(85%)至少部分具有滤泡生长模式,由中心细胞和中心母细胞组成,携带与IGH::BCL2融合相关的t(14;18)(q32;q21)易位;这些称为经典型FL(cFL),以区分两个相关亚型/群:滤泡性大B细胞淋巴瘤(FLBL)和FL伴罕见特征(uFL)。
WHO-HAEM5认为,FL分级仅与cFL有关,因此不再强制要求FL分级。这个决定基于文献的广泛讨论和评估,文献围绕着分级的可重复性及其在现代治疗时代对个别患者的可疑临床意义进行讨论和评估。可重复性差可能由多种原因造成,包括取样(完全淋巴结切除与粗针活检)、中心母细胞的定义和识别以及计数方法。由于FL的分级是基于每个高倍视野(HPF)的中心母细胞计数,因此挑战之一是使用40倍显微镜物镜(放大400倍)对HPF缺乏一致的定义,即使在相同的放大率下,显微视野的大小多年来也发生了变化[94]。对于中心母细胞的形态谱缺乏共识,使用传统的计数方法会对重复性产生进一步的负面影响[95]。1级、2级和3A级FL患者的临床结果似乎没有显著差异。目前,在世界许多地区,患者在临床试验内外都采用类似的方案进行治疗[96–99]。虽然已经尝试通过数字切片用或使用免疫组织化学支持数据来提高重复性,但这些方法尚未与患者结果进行比较。因此,将其纳入WHO-HAEM5[100–102]被认为为时过早。综上所述,由于组织病理学和临床原因,及时将FL分级改为cFL亚型的可选项。
罕见的cFL 3A级病例可能表现为局灶的或广泛的弥漫生长模式。在WHO-HAEM4R中,对此类病例的建议诊断是“DLBCL伴滤泡性淋巴瘤”,尽管通常不存在大片大细胞。目前,尚不确定此类病例最好归入cFL还是DLBCL[103],因此,个别患者的治疗决定不应当只是根据病理信息,而是应当多学科会诊,并等待研究确定更客观的标准来预测临床病程。FLBL亚型在很大程度上等于WHO-HAEM4R FL 3B级,为了在整个分类过程中保持一致,对其进行了重命名。
新引入的uFL亚型又包括两个子类,并与cFL显著不同:一个具有“母细胞样”或“大中心细胞”变异型细胞学特征,另一个主要为弥漫生长模式[104,105]。前一个FL更频繁地表现出变异型免疫表型和基因型特征,生存情况可能较差[106]。这种FL需要区分大B细胞淋巴瘤伴IRF4重排[107]。后一个FL常表现为腹股沟区的一个大肿瘤,常伴有CD23表达、IGH::BCL2融合缺失[108]和频繁的STAT6突变以及1p36缺失或TNFRSF14突变[104,109]。将此类病例与cFL分开,将有助于阐明疾病生物学的研究,从而在未来的分类中有更好的定义。
2.2.6 套细胞淋巴瘤:改进风险分层
WHO-HAEM5将套细胞肿瘤分为三章。原位套细胞肿瘤(ISMCN)罕见,通常是偶然发现。它代表了携带IG::CCND1融合并导致cyclin D1过度表达的B细胞在淋巴滤泡套区的定殖(克隆化)[110]。
与t(11;14)(q13;q32)相关的IGH::CCND1融合是套细胞淋巴瘤(MCL)的遗传标志,存在于≥95%的病例(即,cyclin D1阳性MCL亚型)[111,112]。偶尔,IGK或IGL作为CCND1易位伙伴[113]。在偶尔出现的强表达cyclin D1蛋白但FISH未显示CCND1重排的MCL病例中,基因组研究揭示了IGK或IGL增强子与CCND1的隐性重排[114–116]。在少数cyclin D1阴性和CCND1重排阴性的MCL病例中(即,cyclin D1阴性MCL亚型),确定了CCND2、CCND3或CCNE作为细胞周期失调的替代机制[117]。近年来,由于治疗方法的改进,MCL患者的中位总生存期显著提高。因此,预后亚组的确定变得高度相关。广泛可用且最成熟的高危MCL生物标志物包括细胞形态学(多形性或母细胞样外观)、高Ki67增殖指数、p53表达和TP53突变[118119]。
非淋巴结MCL(nnMCL)的特点是累及血液、骨髓和脾,很少或没有淋巴结病变,主要表现为无症状,与MCL相比,临床结局更好。在生物学上,nnMCL与MCL的不同之处在于:(i)缺乏SOX11表达[120121],低Ki67指数,CD5失表达频繁[122];(ii)IGHV基因片段的使用差异与IGHV1-8基因的偏差使用[122]加上较高的体细胞超突变负荷[121,123,124];(iii)基因改变更少,基因组复杂性更少见[120125]。
2.2.7 高级别转化的重大进展
WHO-HAEM5首次包括一个章节,描述惰性B细胞淋巴瘤的高级别转化,并总结了已知基因和驱动基因的发生率。
2.2.8 大B细胞淋巴瘤:新名称和新伞
大B细胞淋巴瘤家族包括多种肿瘤。虽然这些细胞通常由中等大小到大细胞组成,具有圆形到卵圆形核和空泡状染色质,但中等大小和母细胞样细胞的病例也可能符合该家族的标准。这些需要从形态学相似的实体中进行描述,如:套细胞淋巴瘤和淋巴母细胞白血病/淋巴瘤的母细胞样变异型。
弥漫大B细胞淋巴瘤,非特指(DLBCL-NOS)是最常见的实体,定义为上述大细胞形态、成熟B细胞表型和缺乏定义特定大B细胞淋巴瘤实体的标准。包含在DLBCL-NOS内的淋巴瘤在形态学和分子特征方面都具有异质性。由于大多数DLBCL-NOS在很大程度上涵盖了在生发中心(GC)中活跃的分化和成熟机制,WHO-HAEM4R先前定义的两个主要亚型继续得到认可。生发中心B细胞样(GCB)亚型具有与GC细胞起源(COO)相关的基因表达谱(GEP),并且由于t(14;18)(q32;q21)和有助于GC发育、GC暗区和亮区转换以及微环境相互作用的基因突变,如EZH2、GNA13、MEF2B、KMT2D、TNFRSF14、B2M和CREBBP,导致丰富的IGH::BCL2融合。活化B细胞样(ABC)亚型来自离开GC或GC后起源的细胞,具有GC后或早期浆母细胞表型。其特征是依赖BCR信号和NFκB活性,大多数GC标记物为阴性,并表达IRF4/MUM1[127]。它富含BCR途径突变,如MYD88(主要是p.L265P)、CD79B和PIM1,以及阻止B细胞分化程序的遗传变化,如BCL6重排和PRDM1/BLIMP1突变/缺失[126]。建议继续进行GCB/ABC(GCB/非GCB)区分,尽管在临床试验之外,COO分层的临床影响相对有限。虽然IHC流程显然不识别“未分类”GEP类别,并且与GEP存在一致性问题,但它们在日常实践中被广泛使用。下一代测序研究的最新数据表明了DLBCL的异质性分子特征,NOS具有约150个遗传驱动因素,这些驱动因素在DLBCL中重现突变,平均每个患者约有8%的这些基因发生突变[128]。有趣的是,尽管使用了各种测序方法和聚类算法,但用于DLBCL-NOS亚分类的遗传图谱具有广泛的一致性,这表明可以通过突变分析捕获潜在的疾病生物学。一些基因组的突变谱与FL或MZL的突变谱部分重叠,这表明要么是这些低级别淋巴瘤的转化,要么是其早期发病的共同途径。然而,到目前为止,所提议的基因突变簇集和遗传驱动因素的意义尚未建立统一的概念,因此目前无法定义DLBCL-NOS的统一遗传框架。此外,这些基因簇集对结果的影响以及作为靶向治疗方法基础的影响目前尚不清楚,正在等待临床试验的证据。因此,在WHO-HAEM5中引入此类分子分类被认为为时过早。
除DLBCL-NOS外,WHO-HAEM5认可17种特定实体为“大B细胞淋巴瘤”(表1和图3)。与WHO-HAEM4R相比,大多数这些实体的生物学概念和诊断策略基本保持不变。然而,出于一致性的原因,一些实体的名称已经修改,从“弥漫大B细胞淋巴瘤”改为“大B细胞淋巴瘤”,承认在一些实体中弥漫生长模式或者不明显/不存在,或者无法评估(如:纤维素相关大B细胞淋巴瘤,或液体超载相关大B细胞淋巴瘤)。
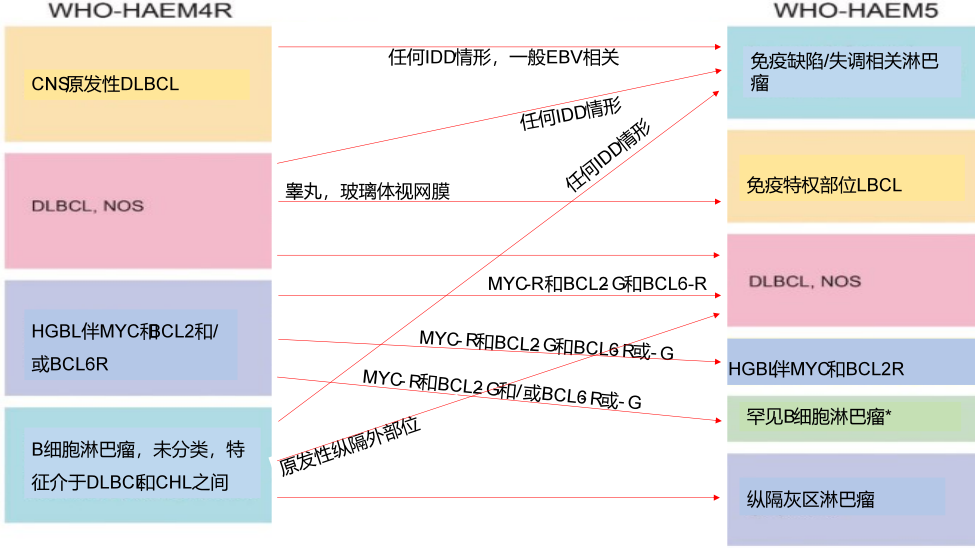
图3 WHO-HAEM4R和WHO-HAEM5中命名和定义的大B细胞淋巴瘤(LBCL)实体之间的关系总结。
*“罕见B细胞淋巴瘤”是指那些符合特定临床病理实体定义的淋巴瘤,同时伴有MYC和BCL2重排。如:液体超载相关大B细胞淋巴瘤和罕见滤泡性淋巴瘤。(R重排,G种系构型)
WHO-HAEM4R中,“高级别B细胞淋巴瘤伴MYC和BCL2和/或BCL6双重排”这个实体已在概念上重新定义和分配。认识到其形态多样,但均具有暗区生物学特征和基因表达特征,WHO-HAEM5将“弥漫大B细胞淋巴瘤/高级别B细胞淋巴瘤伴MYC和BCL2重排(DLBCL/HGBL-MYC/BCL2)”这个实体重新命名,以包含由大细胞或中间细胞或母细胞样细胞组成的、由MYC和BCL2双重排定义的肿瘤(图4)。因此,在确定遗传构成后,可以维持肿瘤的初始形态分类。这群病例形成了一个均质性实体,具有唯一的GC基因表达谱,与FL和分子GC样DLBCL亚群有密切的致病关系[129–132]。此外,与DLBCL/HGBL-MYC/BCL2相关的基因表达特征(MHG,DHITsig)[130133]与Burkitt淋巴瘤(BL)显著重叠。相反,具有MYC和BCL6双重排的淋巴肿瘤表现出更为多样的谱系[129],具有可变的基因表达谱和突变谱,与DLBCL/HGBL-MYC/BCL2明显不同。因此,这些病例被排除在DLBCL/HGBL-MYC/BCL2实体之外,现在根据其细胞形态学特征被分类为DLBCL-NOS或HGBL-NOS亚型(图4)。
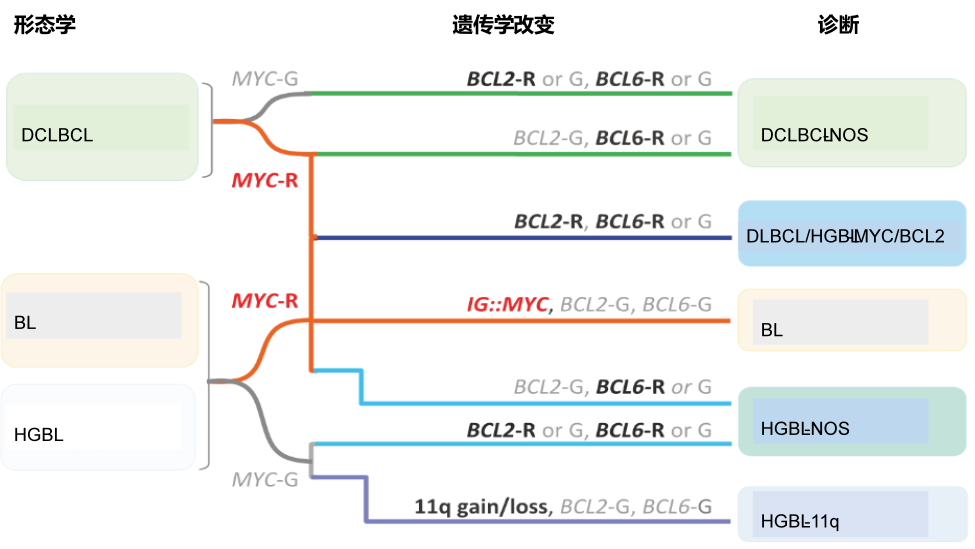
图4根据MYC、BCL2和BCL6重排以及复杂的11q获得/缺失模式对WHO-HAEM5中侵袭性B细胞淋巴瘤进行分类的流程。(R重排,G种系构型)
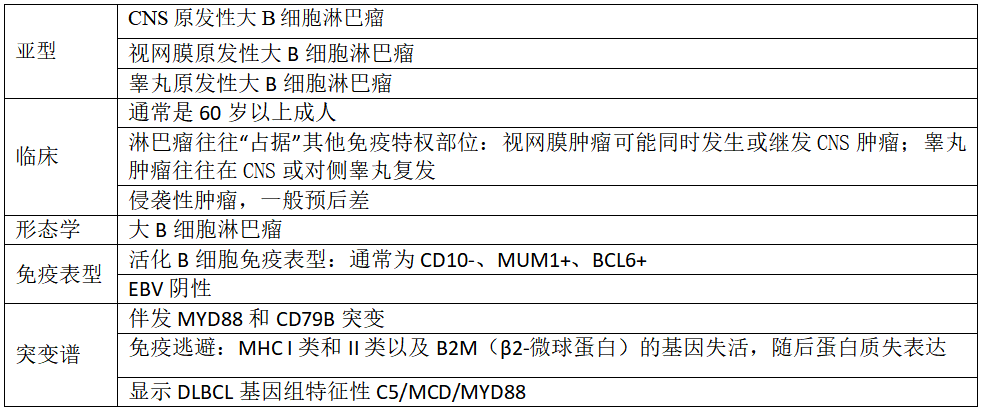
表4 免疫特权部位原发性大B细胞淋巴瘤的特征。
高级别B细胞淋巴瘤伴11q畸变(HGBL-11q),以前在WHO-HAEM4R中称为伯基特样淋巴瘤(BL)伴11q畸变,是一种侵袭性MYC重排阴性成熟B细胞淋巴瘤,其形态类似于BL或具有中间/母细胞样外观、免疫表型(CD10+、BCL6+、BCL2-),和/或基因表达谱(GEP)类似于BL,以及特征染色体11q获得/缺失模式。与着丝粒获得相比,11q24qter中的缺失对该实体更具特异性,但很少可能被拷贝数中性杂合性缺失所替代。最近的研究也证实,除了基因组失衡模式外,突变谱不同于BL,更类似于GCB型DLBCL。值得注意的是,影响ID3-TCF3复合物(BL的分子标志之一)的基因组改变即使在HGBL-11q中也很少见[134,135]。因此,具有BL样外观且缺乏MYC重排的B细胞淋巴瘤病例应测试11q获得/缺失模式[136](图4)。应该注意的是,由特定的11q获得/缺失模式定义的HGBL-11q的形态谱比DLBCL/HGBL-MYC/BCL2的形态谱更受限制。
免疫特权部位(或免疫豁免部位)的大B细胞淋巴瘤(LBCL)是WHO-HAEM5新引入的一个总括术语,用于确认一组侵袭性B细胞淋巴瘤的共同生物学特征,这些淋巴瘤是作为中枢神经系统(CNS)、视网膜和免疫功能正常患者睾丸的原发肿瘤而出现的。这个新的实体现在将以前的CNS原发性DLBCL实体与以前包含在DLBCL、NOS中的视网膜和睾丸的DLBCL结合起来。它们出现在由各自的解剖结构(例如血脑屏障、血视网膜屏障和血睾丸屏障)以及各自原发部位内的免疫调节系统创建的“免疫避难所”中,并共享免疫表型和分子特征[137-139](表4)。关于这组肿瘤的信息正在迅速积累:似乎一些发生在其他不同部位(如乳腺和皮肤)的淋巴瘤具有一些相同的特征,因此,这组“免疫特权淋巴瘤”可能会在未来的分类中扩大。
液体超载相关大B细胞淋巴瘤是WHO-HAEM5对大B细胞淋巴瘤列表的新增,与原发性渗液性淋巴瘤(PEL)不同。第5版胸部肿瘤WHO分类中已简要提及该实体,称为“PEL样淋巴瘤”或“HHV8无关PEL样淋巴瘤”[140]。患者通常是成年人,主要是老年人,没有潜在免疫缺陷,仅累及体腔,最常见的是胸膜腔[141-143]。他们常有导致液体超载的潜在疾病,如慢性心力衰竭、肾功能衰竭、蛋白缺失性肠病或肝功能衰竭/肝硬化。肿瘤性大细胞表现为成熟的B细胞而非浆细胞免疫表型。KSHV/HHV8呈阴性,而EBV在13-30%的病例中呈阳性,并且基因组状况与PEL明显不同[141,142]。预后似乎相当良好,这是区别于PEL的另一个原因。
纵隔灰区淋巴瘤(MGZL)是一种以原发性纵隔B细胞淋巴瘤(PMBL)和典型霍奇金淋巴瘤(CHL),尤其是结节硬化性CHL(NSCHL)为特征的重叠性B细胞淋巴瘤。该实体取代了WHO-HAEM4R中的术语“B细胞淋巴瘤,未分类,特征介于DLBCL和CHL之间”,考虑到具有这些特征的淋巴瘤为纵隔所特有,并且是单个生物组的一部分,具有从CHL到PMBL的形态学和免疫表型谱,MGZL跨越两者。目前的证据表明,具有类似MGZL的形态学和免疫表型特征,但发生在纵隔之外且不涉及纵隔的病例,具有不同的基因表达谱和DNA改变[143]。因此,这些病例最好归类为DLBCL-NOS。
高级别B细胞淋巴瘤NOS(HGBL-NOS)代表由中等大小或母细胞样细胞组成的侵袭性成熟B细胞淋巴瘤,不符合其他定义明确的实体。基于NGS的突变谱和基因表达特征分析表明,HGBL-NOS是一个异质性类别,也包括具有MYD88、CD79B或TBL1XR1突变的活化B细胞淋巴瘤。最常见的突变见于KMT2D(43%)和TP53(30%)。根据GEP,大多数HGBL-NOS病例被归为“未分类”亚群,其余病例则被可变地归为其他亚群[144]。有趣的是,基因表达谱显示,54%的HGBL-NOS具有LBCL/HGBL和MYC/BCL2的“双打击”特征(DHITsig),尽管这些基因缺乏重排[144]。
(未完待续)
往期回顾:
淋巴造血肿瘤WHO分类第5版:淋巴肿瘤(1)简介
淋巴造血肿瘤WHO分类第5版:淋巴肿瘤(2)B
















共0条评论