[导读] 译者:薛德彬
2、B细胞淋巴组织增殖性疾病与淋巴瘤
WHO-HAEM5新增:以B细胞为主的瘤样病变
WHO关于血淋巴肿瘤的“蓝皮书”首次引入瘤样病变,列为独立的一组,即“以B细胞为主的瘤样病变”,包括五个实体。Castleman病不是单一病种,而是三种临床病理上不同的疾病:单中心Castleman病、特发性多中心Castleman病和KSHV/HHV8相关多中心Castleman病。Castleman病分类的诊断流程需要综合多学科数据,包括组织学、血液学、免疫学和临床参数[5-9]。本节还包括IgG4相关疾病;IgG4相关淋巴结病具有与Castleman病重叠的特征。第五章介绍了其他非肿瘤性B细胞为主的淋巴组织增殖性疾病,它们累及淋巴结和/或结外部位,并可能假冒淋巴瘤,包括生殖中心进行性转化、传染性单核细胞增多症、女性生殖道的旺炽性反应性淋巴组织增生/淋巴瘤样病变和系统性红斑狼疮。
2.1 B淋巴母细胞白血病/淋巴瘤(B-ALL):遗传学定义的新实体和亚型
根据上述“基本”和“理想”诊断标准的原则,B淋巴母细胞白血病/淋巴瘤(B-ALL)可以仅根据形态学和免疫表型在家族/组级别上诊断为B-ALL,不用进一步分类(not further classified,NFC)。大多数实体可以根据广泛可用的细胞遗传学检测进行分类,但根据目前的技术水平,一些实体需要进行分子遗传学分型。B-ALL NOS应保留用于即使在综合测试后也无法分类的情况。根据倍性变化,如超二倍体和亚二倍体,以及染色体重排或其他遗传因素的存在,大多数前体B细胞肿瘤在WHO-HAEM5都有分类。在大多数病例中,众所周知的驱动因素是B-ALL发病机制的基础,如:iAMP21、BCR::ABL1融合、KMT2A重排、ETV6::RUNX1融合、TCF3::PBX1融合或IGH::IL3融合。与WHO-HAEM4R相比,基于这些遗传学信息的分类基本上保持不变;然而,命名法侧重于分子事件而非细胞遗传学改变,以便使用不同的技术检测它们(表1)。其他细微更新反映了在基于共享基因表达特征的实体定义中纳入了额外的遗传学发现和改进。WHO-HAEM5中加入了罕见的B-ALL伴TCF3::HLF融合;它不同于B-ALL伴TCF3::PBX1融合,其特征是具有特别的侵袭性行为[11,12]。B-ALL伴BCR::ABL1样特征现在是一个实体(以前是临时实体),根据定义,它与B-ALL伴BCR::ABL1融合具有共同的基因表达和表型特征;它在所有年龄组中普遍存在[13,14],并且显示出靶向治疗的明显获益[15–17]。类似地,诊断方法学的进步识别了一个新实体,即B-ALL伴ETV6::RUNX1样特征,其描述放在B-ALL伴ETV6::RUNX1融合的章节之后[18]。
最近的基因表达和测序研究已经确定了一些新的基因驱动因素,这些因素似乎赋予了不同的临床、表型和/或预后特征。考虑到未来将它们作为潜在的新实体进行分离的新证据,这些新亚型被归入“B-ALL伴其他明确的遗传异常”。这些新亚型包括B-ALL伴DUX4[18,19]、MEF2D[20]、ZNF384[21]或NUTM1[22]重排,伴IG::MYC融合[23,24],和伴PAX5alt[25]或PAX5 p.P80R(NP_057953.1)][26]异常。有趣的是,B-ALL伴ZNF384重排、DUX4重排或PAX5 p.P80R可能在治疗后甚至在诊断时显示单核细胞分化[27,28],拓宽了白血病谱系可塑性的概念。这种可塑性对疾病管理具有重要意义,包括最小残留疾病(MRD)的评估[27]。
2.2 成熟B细胞肿瘤
成熟B细胞肿瘤的类别包括12个家族。表1概述了层次结构。
2.2.1 肿瘤前和肿瘤性小淋巴细胞增殖性疾病:保留MBL和CLL/SLL;B-PLL不再视为一个实体
该家族包括两个实体:单克隆B细胞淋巴细胞增多症(MBL)和慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)。WHO-HAEM5认可三种MBL亚型:
a. 低计数MBL或单克隆B细胞扩增:单克隆CLL/SLL表型B细胞计数<0.5×109/L,无其他诊断B淋巴细胞增殖性疾病的特征。这个主观的阈值基于与临床队列相比的人群研究中克隆性B细胞计数的分布[29]。
b. CLL/SLL型MBL:单克隆CLL/SLL表型B细胞计数≥0.5×109/L,总B细胞计数<5×109/L,无其他诊断CLL/SLL的特征[30]。<5×109/L的阈值是主观的,但与B细胞计数在5–10×109/L之间的个体相比,这个阈值能识别需要治疗的可能性非常低的群体[31]。
c. 非CLL/SLL型MBL:任何单克隆非CLL/SLL表型B细胞扩增,无其他成熟B细胞肿瘤的症状或诊断特征。大多数病例的特征符合边缘区(marginal zone,MZ)[32]。
所有MBL亚型的临床特征都是免疫功能受损,对疫苗的反应不佳,感染风险增加[33–37]。在CLL的诊断中,CD5、CD19、CD20、CD23以及表面或细胞质κ和λ轻链信为基本标记物,CD10、CD43、CD79b、CD81、CD200和ROR1作为有助于与其他小B细胞淋巴瘤/白血病进行鉴别诊断的附加标记物[38]。除了del(11q)、del(13q)、del(17p)和12三体评估外,TP53突变分析、免疫球蛋白基因重链可变(IGHV)区体细胞超突变(SHM)分析和B细胞受体定型亚群分析(亚群#2构型)都是全面评估CLL/SLL预后的关键[39–41]。在靶向治疗的背景下,核型复杂性和BTK、PLCG2和BCL2突变状态的检测仍然是理想的额外研究。IGHV突变和TP53畸变状态均包括在CLL国际预后指数(CLL-IPI)中[42],以及年龄、临床分期和β2微球蛋白水平。早期CLL/SLL(IPS-E)的国际预后评分包括IGHV突变状态、绝对淋巴细胞计数>15×109/L以及可触及淋巴结的存在[43]。在转化的情况下,建议使用“Richter转化”一词,而不是“Richter综合征”。
鉴于其异质性,WHO-HAEM4R中的B-幼淋巴细胞白血病(B-PLL)在WHO-HAEM5中不再被认可。以前被诊断为B-PLL的病例包括:(1)套细胞淋巴瘤的一种变异型,特征是存在IGH::CCND1;(2) CLL/SLL的幼淋巴细胞进展,定义为CD5阳性的非套区B细胞肿瘤,外周血和/或骨髓中有>15%的幼淋巴细胞[44–47],(3)其他病例,现在归入“脾B细胞淋巴瘤/白血病伴显著核仁”。
以前一些归入B-PLL的病例确实代表了(母细胞样)套细胞淋巴瘤(正如WHO-HAEM4R中已经指出)或CLL的幼淋巴细胞进展。WHO-HAEM4R中分类为CLL/SLL的病例伴≥15%的幼淋巴细胞,在WHO-HAEM5中归入CLL的幼淋巴细胞进展,伴<15%的幼淋巴细胞仍为CLL/SLL。SBLPN吸收了以前被归类为毛细胞白血病变异型(HCLv)的病例和具有类似形态学特征的非常罕见的脾边缘区淋巴瘤病例。应该注意的是,在没有脾切除术标本的情况下,不能总是区分各种实体。
表2 WHO血淋巴肿瘤分类,第5版:T细胞和NK细胞淋巴增殖和淋巴瘤。
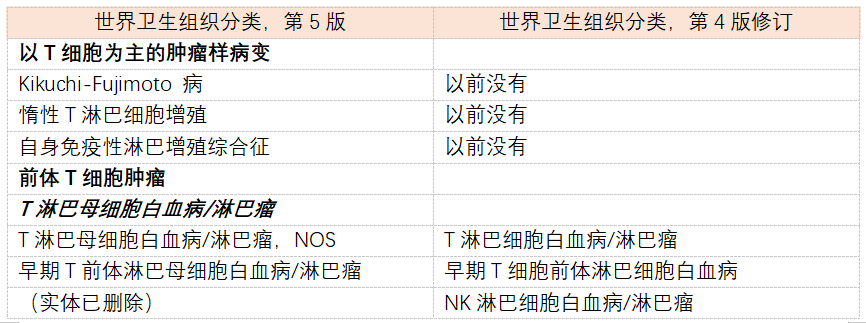
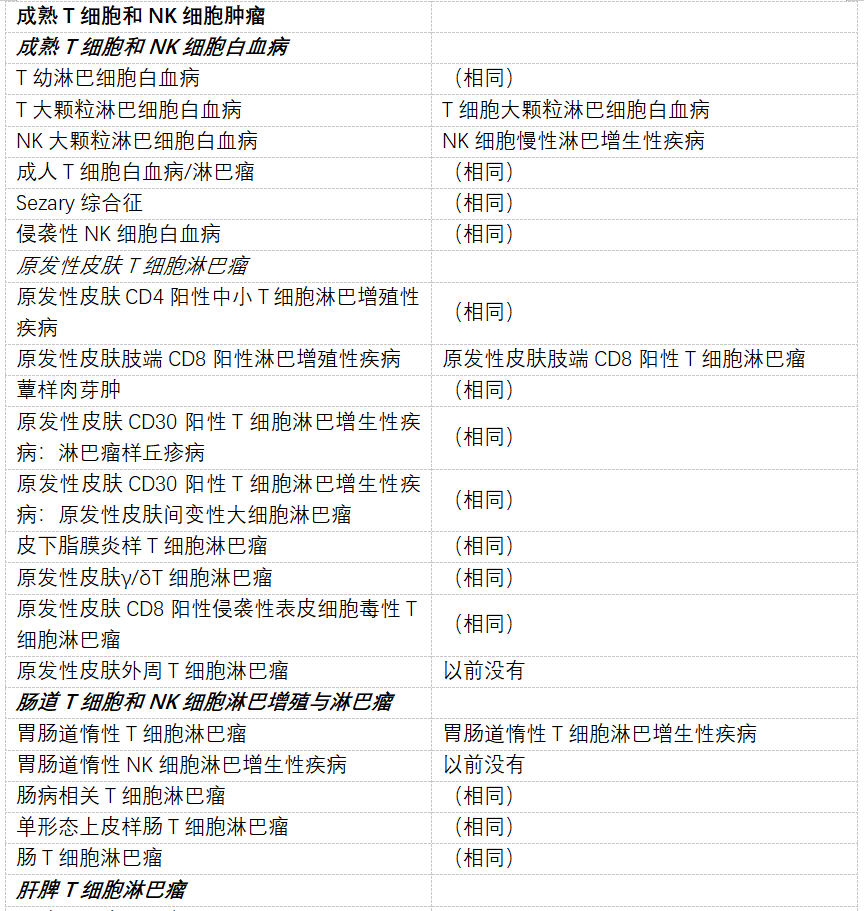
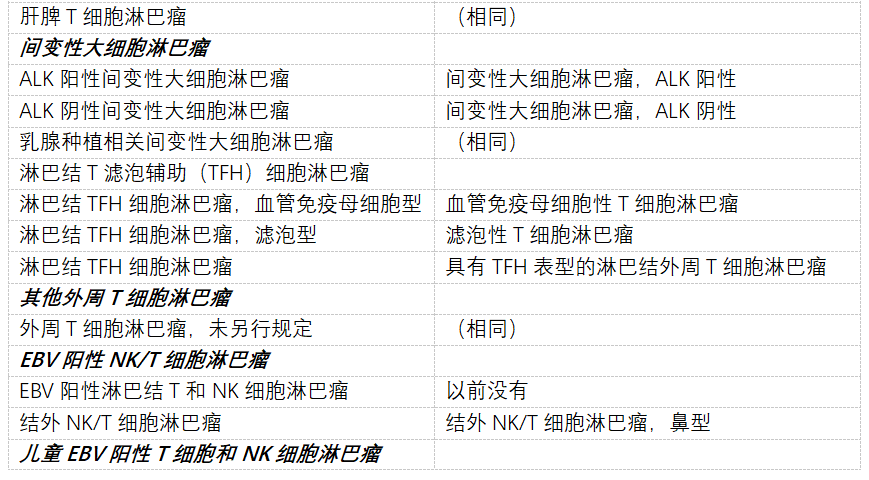
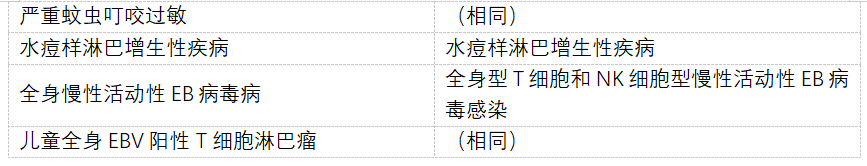
表3 WHO淋巴造血肿瘤分类,第5版:淋巴组织间质源性肿瘤。
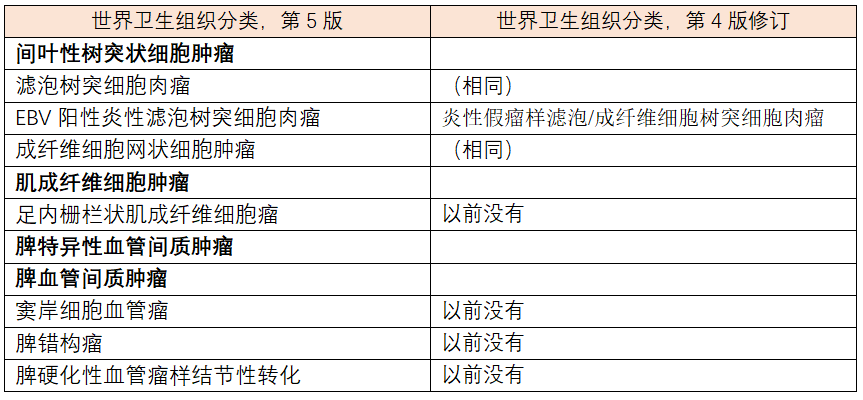
2.2.2 脾B细胞淋巴瘤和白血病:“脾B细胞淋巴瘤/白血病伴显著核仁”一词取代了“毛细胞白血病变异型”和“CD5阴性B细胞幼淋巴细胞白血病”
WHO-HAEM5中的脾B细胞淋巴瘤和白血病家族包括毛细胞白血病(HCL)、脾B细胞淋巴瘤/白血病伴显著核仁(SBLPN)、脾弥漫红髓小B细胞淋巴瘤(SDRPL)和脾边缘区淋巴瘤(SMZL)(图1)。与WHO-HAEM4R不同,SBLPN和SDRPL现在被单独分类,前者的命名发生了变化。毛细胞白血病是一种成熟B细胞肿瘤,具有独特的临床病理特征,≥95%的病例有BRAF p.V600E(NP_004324.2)体细胞突变[48]。其他脾小B细胞淋巴瘤通常缺乏BRAF突变。
新实体脾B细胞淋巴瘤/白血病伴显著核仁(SBLPN)取代了之前的术语“毛细胞白血病变异型”,因为认识到这种增殖性疾病在生物学上不同于HCL,尽管白血病细胞可能部分类似于HCL的“毛细胞”。此外,根据WHO-HAEM4R,该实体还吸收所有以前称为CD5阴性B-幼淋巴细胞白血病(B-PLL)的病例。虽然文献中的数据不能直接推断出新的分类,但可以说SBLPN很罕见,约占慢性淋巴恶性肿瘤的0.4%[49–53],主要影响老年患者。肿瘤细胞核仁突出,HCL标记物CD25、annexin A1、TRAP和CD123阴性。SBLPN在临床上比HCL更具侵袭性,并且对cladribine单药治疗具有耐药性。最近研究表明,cladribine与rituximab或bendamustine联合使用可提高对cladribine的敏感性[49,54-56]。
脾弥漫红髓小B细胞淋巴瘤(SDRPL)有一些与HCL和SBLPN重叠的特征,但可以通过仔细评估形态学和免疫表型特征来区分。流式细胞术检查,CD200平均荧光强度(MFI)/CD180 MFI比值<0.5倾向于诊断SDRPL,而非HCL、SMZL和SBLPN[57]。通过脾的病理检查可以最好地鉴别这些实体;在没有脾切除术标本的情况下,骨髓检查显示SDRPL具有特征性,主要为窦内模式,而SMZL和SBLPN在骨髓中的生长模式更为多样,HCL显示典型的弥漫模式,伴有网状蛋白纤维化[58,59]。然而,在没有脾切除术标本的情况下,通常无法进行区分。
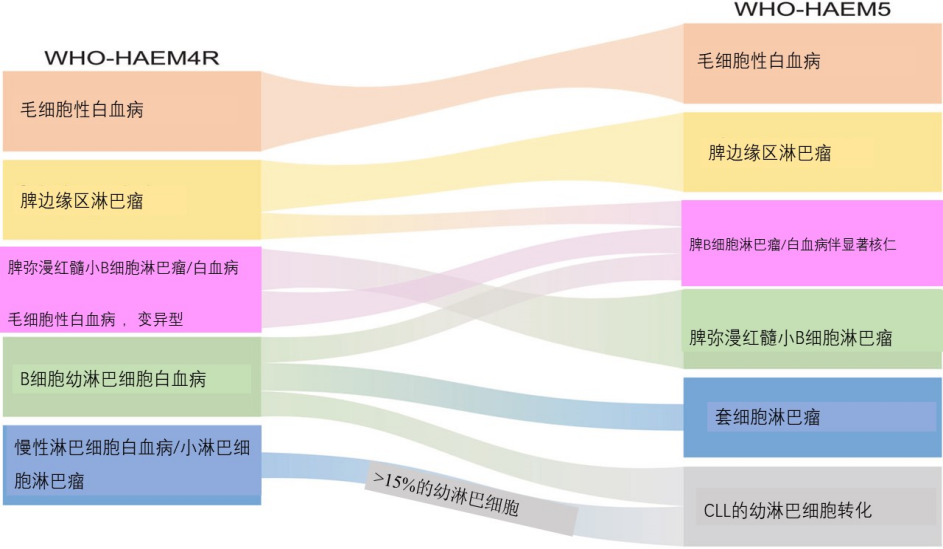
图1 WHO-HAEM4R和WHO-HAEM5中命名和定义的脾B细胞淋巴瘤实体之间的关系总结
2.2.3淋巴浆细胞性淋巴瘤:IgM有重要意义
WHO-HAEM5认可两种淋巴浆细胞淋巴瘤(LPL)亚型,最常见的是IgM LPL/Waldenström巨球蛋白血症(WM)型。非WM型LPL约占LPL的5%,包括:(1)具有IgG或IgA单克隆蛋白的病例,(2)非分泌性LPL,以及(3)未累及骨髓的IgM LPL[60–65]。
根据有无MYD88 p.L265P(NP_002459.2)突变,IgM-LPL/WM型有两个分子亚群。该突变是绝大多数LPL(>90%)的标志性驱动突变[66–69]。检测该突变可能有助于区分淋巴结和结外边缘区淋巴瘤(MZL)伴浆细胞样分化和浆细胞(多发性)骨髓瘤的疑难病例。
除罕见的MZL病例外,后两种实体通常缺乏该突变。在高达40%的LPL发生CXCR4突变,通常与MYD88突变同时发生。对考虑使用BTK抑制剂治疗的患者进行CXCR4突变分析是可行的,因为这种遗传背景不仅与较短的治疗时间有关,而且尤其与ibrutinib治疗的耐药性有关[70]。
2.2.4 边缘区淋巴瘤:细胞遗传学和突变特征因解剖部位不同而异,皮肤MZL成为独立实体
粘膜相关淋巴组织结外边缘区淋巴瘤(EMZL)和淋巴结边缘区淋巴瘤(NMZL)作为WHO-HAEM4R中的不同实体,在WHO-HAEM5中予以保留。儿科淋巴结边缘区淋巴瘤(pNMZL)从淋巴结边缘区淋巴瘤的一个亚型升级为一个独立的实体。虽然它与儿科型滤泡性淋巴瘤表现出重叠的特征,但目前发表的证据认为不足以将这两种惰性儿科疾病合并一个家族。由于具有独特的临床病理特征,原发性皮肤边缘区淋巴瘤(PCMZL)在WHO-HAEM5中也被命名为单独实体。
EMZL、NMZL和PCMZL具有重叠的组织学和免疫表型特征:肿瘤细胞是成熟的小B细胞,通常CD5和CD10阴性。常见浆细胞分化,并且通常伴随反应性淋巴滤泡。然而,尽管有一些共同的特征,但它们有不同的病因和发病机制,不同解剖部位的EMZL之间存在进一步的差异。这三种实体都是常见3号和18号染色体的三体性。NMZL常见染色体2p和6p的获得以及1p和6q的缺失[71–77];然而,6p获得和6q缺失仅在眼附属器EMZL中重现[78]。涉及MALT1的易位,如t(11;18)(q21;q21),导致BIRC3::MALT1融合,在胃和肺EMZL中复现,但在其他部位罕见[79–83]。相反,在PCMZL或NMZL中未描述重现性基因融合或重排。
EMZL和NMZL的突变模式不同[76,84–86]。此外,不同解剖部位的EMZL之间存在显著的遗传学差异(图2):例如,眼附属器EMZL通常显示TNFAIP3突变/缺失[87,88];涎腺EMZL显示重现性GPR34突变[89,90];大多数甲状腺EMZL携带CD274、TNFRSF14和/或TET2的有害突变[91];PCMZL经常显示FAS突变[92]。KMT2D、PTPRD、NOTCH2、KLF2及其他基因的体细胞变异在NMZL中很常见[76,84,85,93],但在EMZL中不常见。更好地定义这些淋巴瘤潜在的分子遗传变化可能为改进治疗方案打开大门。
结外边缘区淋巴瘤
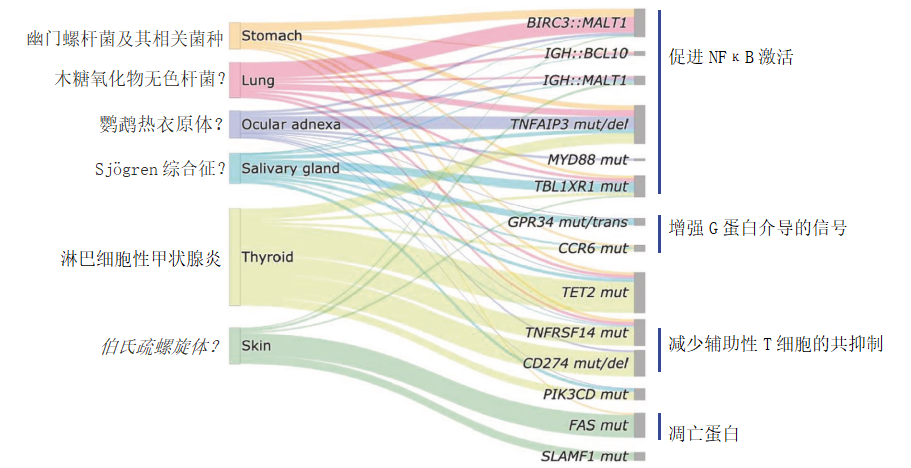
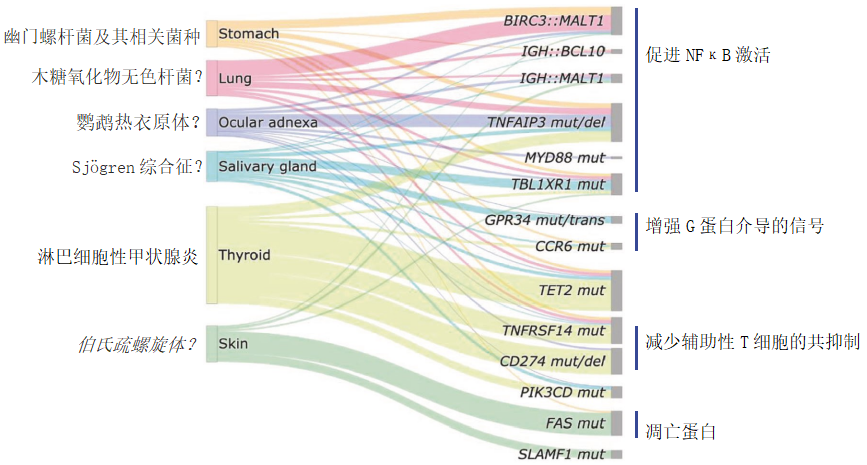

图2不同部位结外边缘区淋巴瘤(EMZL)的病因和重现性遗传异常。
一个重要的临床应用是BIRC3::MALT1能识别对根除幽门螺杆菌无反应的胃EMZL病例。由于许多涉及EMZL的基因尚未在不同部位进行统一研究,因此仅介绍了对理解EMZL发病机制至关重要的重现性遗传变化。这些部位下方盒子的高度不代表这些淋巴瘤的发生率。(trans 反式易位, mut 突变, del 缺失)
(未完待续)
往期回顾:
淋巴造血肿瘤WHO分类第5版:淋巴肿瘤(1)简介




















共0条评论