[导读] 作者:慧海拾穗
伴浆母细胞分化的淋巴瘤的临床病理学特征(1)
伴浆母细胞分化的淋巴瘤的临床病理学特征(2)
伴浆母细胞分化的淋巴瘤的临床病理学特征(3)
(四)渗出性淋巴瘤,HHV8阴性/II型PEL【Effusion-Based Lymphoma, Human Herpesvirus 8-Negative (Or Type II PEL)】
【定义】
文献报道,有一组HHV8阴性的大B细胞淋巴瘤(LBCL)病例表现为渗出性淋巴瘤(EBL),没有可检测到的肿瘤性包块。这些HHV8阴性EBL病例表现出与典型PEL(PEL,原发性渗出性淋巴瘤)重叠的临床特征和形态学特征,但有独特的免疫表型(通常CD20呈阳性),并且通常与HIV或EBV无关。此类病例在2017年世界卫生组织淋巴造血系统肿瘤分类中尚未定义。我们提出“II型PEL”一词是为了强调有与经典型(I型)PEL相似的临床病理特征,但没有与HIV、HHV8或EBV合并感染。
【临床特征】
HHV8阴性EBL的临床表现为胸膜、心包和/或腹腔积液,无肿瘤性包块,与经典型PEL相似。与经典型PEL相比,HHV8阴性EBL(或II型PEL)患者年龄较大,HIV阴性,无免疫功能低下。一部分病例可能与体液超载状态(肝硬化、心力衰竭和肾病)和/或丙型肝炎病毒感染有关。
【组织病理学(细胞形态学)】
HHV8阴性EBL的肿瘤细胞体积较大,具有免疫母细胞、浆母细胞和/或间变性形态,与经典型PEL重叠。
【免疫表型】
与具有浆母细胞分化表型的经典型PEL相比,HHV8阴性EBL的肿瘤细胞经常表达pan-B细胞标记物(CD19、CD20和/或CD79a),但CD138或CD30的阳性率较低。根据定义,HHV8为阴性。在我们之前的研究中,BCL2在大多数HHV8阴性EBL病例中为阳性表达,但在经典型PEL中为阴性表达。几乎所有HHV8阴性EBL病例均为非GCB表型,与经典型PEL相同。
【与EB病毒的关系】
根据我们最近的研究和文献回顾,EBER在经典型PEL中的阳性率高于II型PEL(65%对28%,P<0.001)。在II型PEL中EBV潜伏期模式和LMP1蛋白表达的数据很少(Data of EBV latency pattern and LMP1 protein expression in type II PEL are few.)。
【分子遗传学】
在我们之前的研究中,HHV8阴性EBL(或II型PEL)的IGH、MYC、BCL2和BCL6基因重排率分别为64%、20%、17%和18%。我们最近报告了一个独特的病例,表现为EBV阳性,HHV8阴性,双重打击EBL(MYC和BCL2基因重排)。相比之下,在经典型PEL中很少出现MYC、BCL2和BCL6基因重排,这可以解释为有或无HHV8感染的不同发病机制。最近一项利用全基因组测序和靶向测序的研究表明,HHV8阴性EBL的基因组结构复杂、突变频繁、拷贝数异常、基因易位,与ABC型或GCB型DLBCL和经典型PEL相似。除了与GCB后细胞起源相关的高频率体细胞过度突变外,本研究中发现的最常见的突变是HIST1H1E和MYD88。MYD88 L265P突变是一种众所周知的重现性突变,发生于大多数淋巴浆细胞淋巴瘤(lymphoplasmacytic lymphoma)病例及部分ABC型、结外(睾丸、中枢神经系统、乳腺、原发性皮肤腿型)和CD5表达的DLBCL病例中。另外,在6/8和2/8的病例中,PRDM1缺失和突变,导致3/8的病例中PRDM1双等位基因失活,这可以解释HHV8阴性PEL中频繁的浆母细胞生形态和/或免疫表型,类似于PBL(plasmablastic lymphoma,浆母细胞性淋巴瘤)。除了最常见的MYC、BCL2和BCL6基因易位外,在共8例病例中,TP63、EXOC2和KMT2D的基因易位各1例。
【预后、预测因素和治疗】
在我们最近的PEL研究中,经典型(I型)和II型PEL的预后都很差,中位生存时间分别为4个月和3个月。单因素分析显示,总存活率与MYC蛋白表达和BCL2基因重排有关。然而,总生存期为0~104个月,其中2例未经化疗,经穿刺积液后仍能自行完全缓解,这可能是由于肿瘤细胞局限于体腔内,无血管淋巴通道扩散所致。有趣的是,我们遇到了一个EBL病例,通过流式细胞仪免疫表型分析和抽吸后B细胞受体基因重排分析,其形态退化(morphologic regression),但具有克隆遗传特征(clonal genetic features)。这样的病例强调了辅助检查在确认形态退化EBL的克隆性质方面的重要性。除了冲洗积液外,目前还没有针对这些患者的标准化疗方案。大多数报告病例采用CHOP或CHOP样方案联合利妥昔单抗。
(五)间变性淋巴瘤激酶(ALK)阳性大B细胞淋巴瘤
【定义】
ALK阳性LBCL是一种罕见的侵袭性LBCL,其特征是单一免疫母细胞样细胞形态增生,表现为浆母细胞分化表型,ALK基因重排和ALK蛋白表达。
【临床特征】
ALK阳性LBCL通常发生在HIV阴性、免疫功能正常、全身淋巴结肿大的年轻男性中,60%临床分期为III/IV期。可有淋巴结外受累,如鼻咽、舌、胃、骨、骨髓、软组织、肝、脾和皮肤。
【组织病理学(细胞形态学)】
图4为发生于老年人小肠的ALK阳性LBCL病例,肿瘤细胞通常体积较大,具有免疫母细胞、浆母细胞或间变性特征,在淋巴结内呈弥漫片状或典型的窦内生长。有些病例表现出从浆细胞到浆母细胞的连续形态谱,可能与髓外浆细胞瘤相似。
【免疫表型】
免疫表型上,肿瘤细胞通常表达浆细胞相关标记物、轻链限制性细胞质Ig(80%病例中为IgA)、CD45、BOB1和OCT2,但不表达pan-B细胞标记物(CD20、CD79a和PAX5)。CD3阴性,但半数病例中发现CD4异常表达。极少数病例表达细胞角蛋白AE1/AE3,这是一个诊断陷阱,可导致对转移性癌的错误诊断,尤其是在表现为窦内生长模式、EMA表达以及CD20和CD3表达缺失时。CD30通常为阴性,但很少有CD30弱或强表达的病例。然而,CD30的表达模式不同于间变性大细胞淋巴瘤(ALCL)或经典型霍奇金淋巴瘤(CHL)中的弥漫性强阳性表达。MYC蛋白阳性但没有MYC基因重排,活化的ALK-STAT3途径可能是MYC蛋白表达的替代机制。ALK免疫组化染色是ALK阳性LBCL的一个诊断和定义性标记,因为它在浆母细胞性淋巴瘤(PBL)、浆母细胞性浆细胞瘤/多发性骨髓瘤(PBM)和原发性渗出性淋巴瘤(PEL)、中是阴性表达的。ALK免疫组化最常见的表现细胞质颗粒状染色(GCS)模式,对应于CTLC-ALK或其他少见的伴侣融合基因。少数病例显示ALK的细胞质和细胞核染色模式,对应于ALK阳性ALCL中最常见的融合基因NPM1-ALK融合。也有少数病例仅见少数肿瘤细胞显示局灶GCS模式,这与ALK基因的隐匿性插入有关。Sakamoto等人根据ALK不同的染色模式将ALK阳性LBCL患者分为2组,发现与GCS模式相比,即使在调整了年龄和临床分期之后,非GCS模式与GCS模式的总生存率较低相关。
【与EB病毒的关系】
EBV在所有病例中均为阴性。
【分子遗传学】
ALK蛋白是一种酪氨酸激酶受体,调节神经细胞增殖和脑发育。ALK阳性LBCL中的ALK基因重排导致一个融合蛋白激活了几个后续的信号通路,包括STAT3磷酸化和活化,这与磷酸化STAT3的蛋白表达有关。激活的STAT3通过上调PRDM1/BLIMP1激活浆细胞分化程序,导致ALK阳性LBCL的浆母细胞分化形态和免疫表型。在最近的一篇综述中,94%(67/71)的ALK阳性LBCL病例通过FISH或细胞遗传学检测到ALK基因重排。ALK(2p23号染色体)基因最常见的易位伙伴是CTLC(17q23),其次是NPM1(5q35.3)、SEC31A(4q21)、SQSTM1(4q21)、RANBP2、EML4和IGL。遗传学研究已经确认了ALK和染色体区域4q22、12q24或Xq21之间的其他易位,但相应的伴侣基因尚未确定。Valera等人发现,MYC蛋白在所有12例ALK阳性LBCL中均有表达,但与PBL相比,ALK阳性LBCL没有MYC基因重排,而是携带MYC获得(6例)或扩增(1例)。他们的研究表明,在ALK阳性LBCL病例中,STAT3持续被激活,并提示激活的STAT3可能是促进这些肿瘤中MYC表达的另一种机制。传统的细胞遗传学研究揭示了复杂的核型结构和数量的变化,约50%的病例检测到四倍体。
【预后、预测因素和治疗】
ALK阳性LBCL预后差,5年总生存率为34%。约60%的病例临床分期为晚期(III/IV),其中30%的病例有骨髓受累。有利的预后因素包括早期(I/II)、年轻(35岁以下)和ALK为GCS染色模式。文献中大多数患者接受CHOP或CHOP样方案化疗,但疗效较差。需要更多的强化化疗或新的靶向治疗,如ALK抑制剂和STAT3通路抑制剂,并且需要更多的临床试验。Crizotinib是一种ALK受体酪氨酸激酶抑制剂,已被美国食品和药物管理局(FDA)批准用于治疗伴有ALK重排的非小细胞肺癌患者。据报道,Crizotinib对难治性ALK阳性LBCL患者有短期疗效,但需要大规模的临床试验来验证。
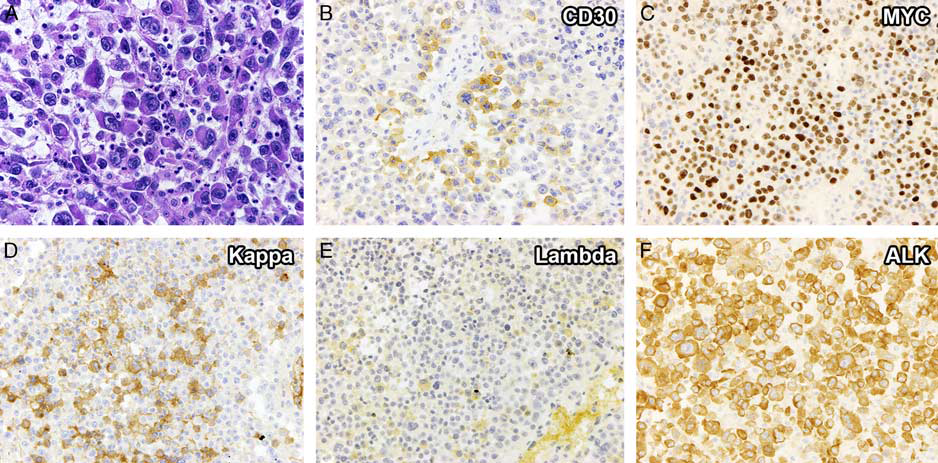
图4:一位老年女性小肠间变性淋巴瘤激酶(ALK)阳性大B细胞淋巴瘤:HE染色显示大的间变性肿瘤细胞,细胞核空泡状,核仁明显,胞质丰富嗜酸性(A)。肿瘤细胞广泛表达IgA、vimentin、MYC(C)、和ALK(F)蛋白,部分表达CD30(B)。单型kappa轻链表达(D),而CD3、CD4、CD5、CD19、CD20、CD45、CD138、EMA、PAX5、IRF4/MUM1、TIA-1、lambda轻链(E)和EBER阴性。荧光原位杂交技术检测ALK基因重排阳性(未显示)。
【参考文献】
[1] Lymphoid Neoplasms With Plasmablastic Differentiation: A Comprehensive Review and Diagnostic Approaches. Adv Anat Pathol, 2019.














共0条评论