[导读] 编译整理:强子
Cadherin-catenin复合体的免疫组化应用
免疫组化中E-cadherin表达缺失,早已被视为小叶癌的标志性特点,浸润性及原位病变中均是如此。结合前述介绍的E-cadherin在细胞连接(特别是黏附连接)中的功能,因此只要染色结果不是基底外侧细胞膜明确的强阳性、边界清晰的线状着色,就提示E-cadherin很可能存在异常。正常的基底侧着色模式某些情况下也被描述为“杯状”。后述其他着色模式都应被视为E-cadherin“着色异常”,且结合相应形态学表现一般符合小叶表型。相邻正常乳腺(导管)上皮的E-cadherin着色分布及强度,可作为一个很好的参照:做E-cadherin和catenin免疫组化检测时,建议将此作为基本准则。如果内对照不是基底侧细胞膜的强阳性,则可能是组织处理问题(如固定)或免疫组化检测本身的问题。
E-cadherin免疫组化细胞膜染色强度弱于典型情况、和/或弱于内对照,则是倾向于小叶分化的着色异常;这一点也适用于细胞膜部分着色、碎片状或颗粒状着色。实际工作中,弱到什么程度才明确将其归为“异常”着色呢?本文原作者采用的原则是:阴性为0、强阳性为3+的情况下,1+(弱阳性)即可视为异常;2+(中等强度阳性)或仅轻度不同于内对照者可通过catenin的检测进一步证实。此外,E-cadherin错误定位于胞质或高尔基体(核旁、逗点状)也应视为异常着色。有些E-cadherin抗体也会有细胞核着色,尤其克隆号36者;这并非生理性表达模式,不必进行判读。本文原作者表示,他们还曾遇到过使用针对E-cadherin不同抗原表位的抗体时,极少数病例会呈现不同着色模式。
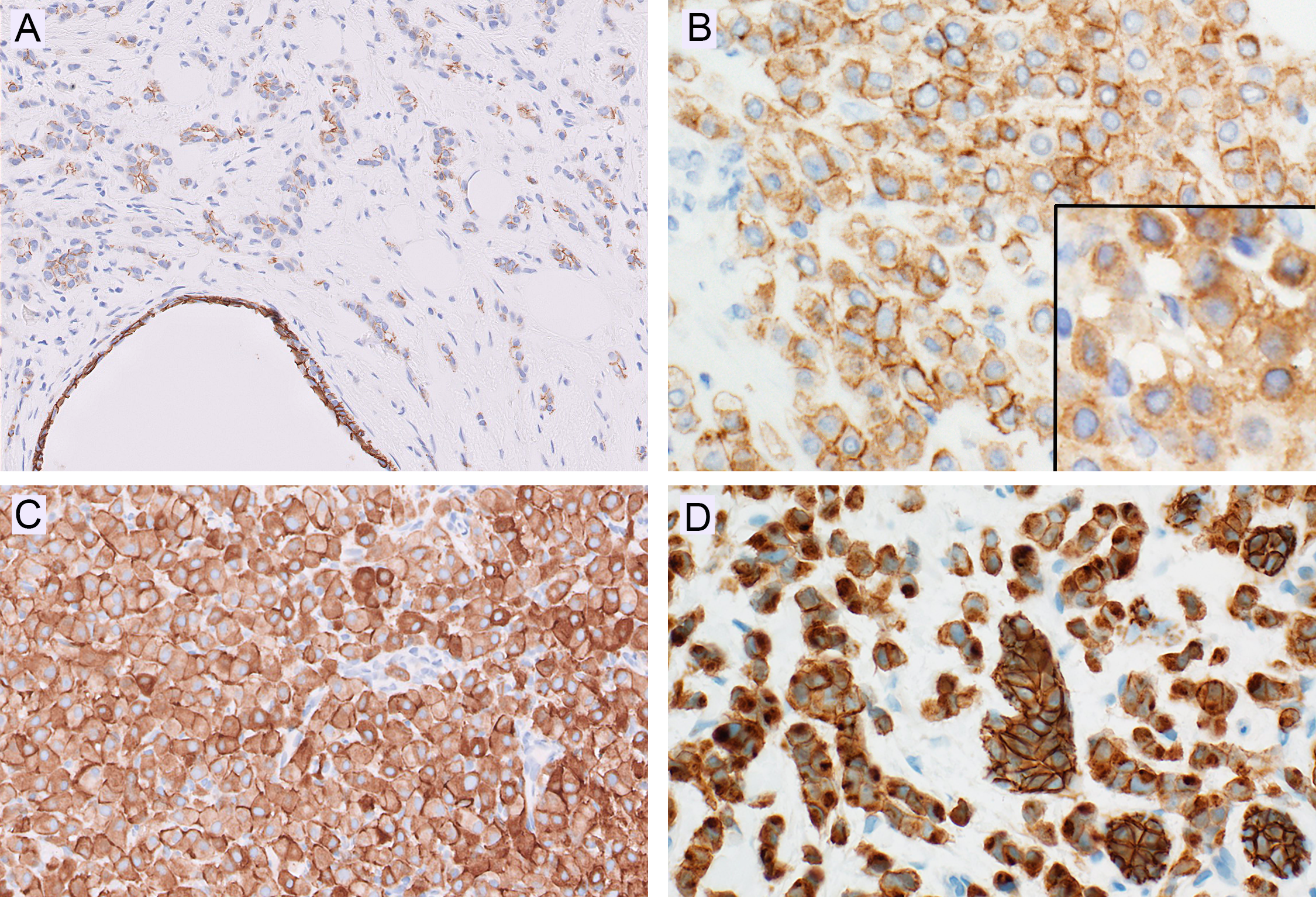 图1.E-cadherin免疫组化的异常着色模式:(A)可确定有细胞膜着色,但显著弱于下方扩张的导管;(B)另一例的高倍镜,E-cadherin呈散在、弱阳性细胞膜着色;插图示p120为胞质着色;(C)E-cadherin明确为胞质着色,偶见细胞膜着色;(D)图中右侧有几个正常导管,其他区域的浸润性肿瘤成分为胞质着色至核旁逗点状着色。
图1.E-cadherin免疫组化的异常着色模式:(A)可确定有细胞膜着色,但显著弱于下方扩张的导管;(B)另一例的高倍镜,E-cadherin呈散在、弱阳性细胞膜着色;插图示p120为胞质着色;(C)E-cadherin明确为胞质着色,偶见细胞膜着色;(D)图中右侧有几个正常导管,其他区域的浸润性肿瘤成分为胞质着色至核旁逗点状着色。
E-cadherin和catenin免疫组化的解读一定要注意结合形态学。如果E-cadherin着色符合预期结果,则可以做出相应解读,具体如考虑为小叶表型者阴性或异常着色、考虑为导管表型者为细胞膜完整强阳性。不过,如果E-cadherin着色结果不确定(如中等程度细胞膜着色),则可加做catenin免疫组化以提供更多信息。
针对cadherin-catenin复合体其他组分的抗体也已有应用,可用于探究该复合体的完整性。E-cadherin存在表达、但功能异常的时候,catenin会出现表达缺失或定位异常。不过,按照本文原作者所述,他们也的确遇到过典型浸润性小叶结构、典型小叶的细胞形态但E-cadherin免疫组化细胞膜强阳性、p120和β-catenin也为细胞膜着色的病例。
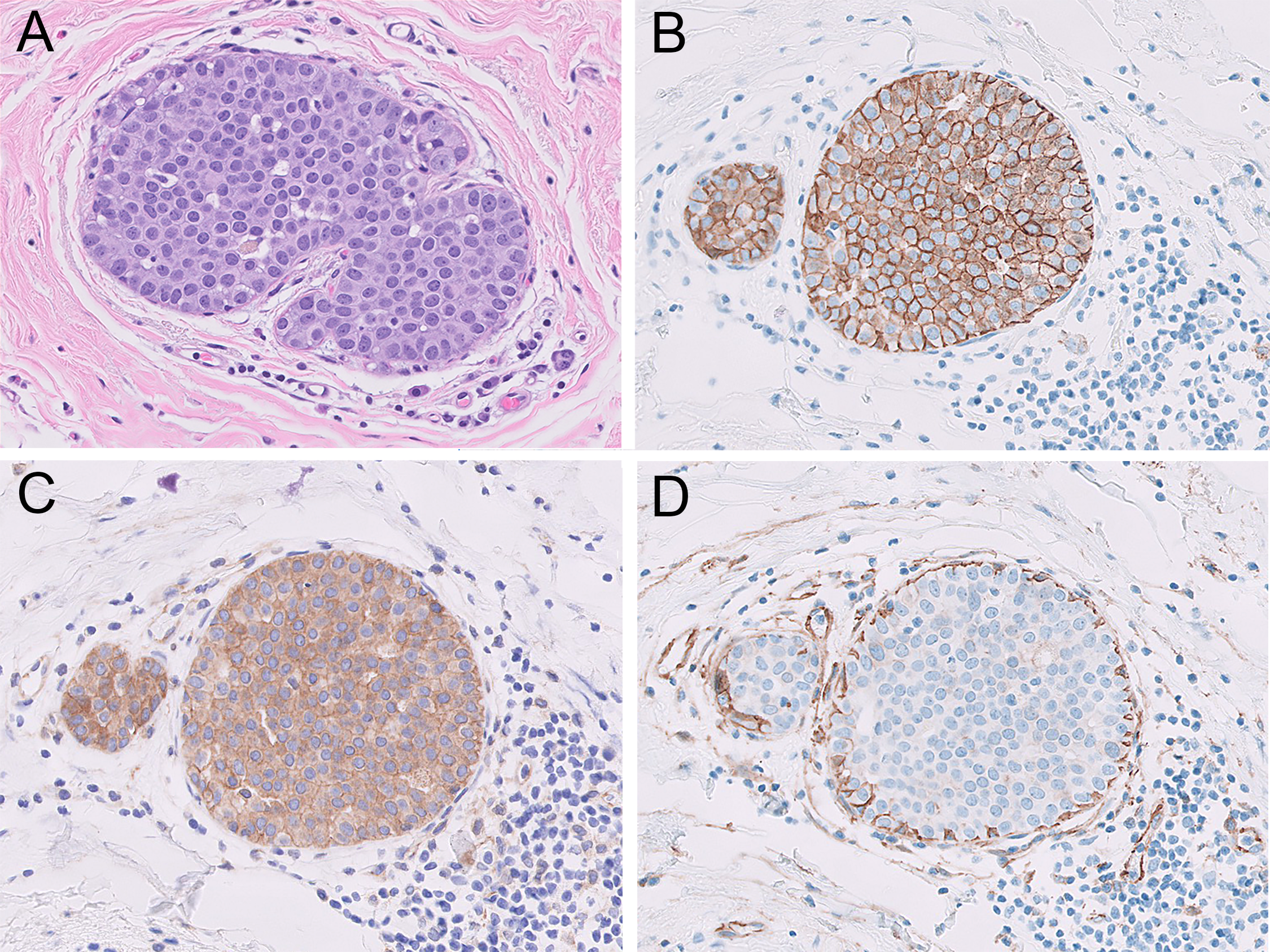 图2.(A)本例HE切片中,可见形态为小叶分化的细胞呈原位增生表现;(B)E-cadherin免疫组化为细胞膜中等程度着色;(C)p120免疫组化明确有细胞膜着色,但胞质也有着色,因此本例结果不确定。(D)β-catenin免疫组化明确阴性,支持小叶原位癌的形态学判断。
图2.(A)本例HE切片中,可见形态为小叶分化的细胞呈原位增生表现;(B)E-cadherin免疫组化为细胞膜中等程度着色;(C)p120免疫组化明确有细胞膜着色,但胞质也有着色,因此本例结果不确定。(D)β-catenin免疫组化明确阴性,支持小叶原位癌的形态学判断。
就catenin的免疫组化着色解读来说,β-catenin的着色模式和E-cadherin相同:相比内对照来说,正常导管β-catenin为细胞膜着色;小叶着色缺失。β-catenin的异常着色也和E-cadherin相似,但已知其他组织中β-catenin可易位至细胞核。p120则是结合于E-cadherin中胞质内结构域的不同部分,因此其表达模式也不同。正常导管中p120的表达是细胞膜,但在小叶癌、或E-cadherin功能缺失的情况下,则表达于细胞质。不过,p120的免疫组化解读可能不是那么直接。本文原作者认为,p120染色完全缺失不具备诊断价值,而细胞膜与细胞质都有着色的情况则属于不明确/模棱两可的范畴。对于p120这种着色的罕见病例尚需进一步研究,并注意密切结合E-cadherin、β-catenin的染色结果;文献中对这种情况是需要做分子检测的。
最近有作者关注了E-cadherin和catenin免疫组化的质量及标准化中相关重要问题。近期世界范围内的调查发现,临床应用中E-cadherin有11种不同的克隆、β-catenin和p120各有4种不同的克隆,且均对应种类繁多的染色流程。NordiQC项目最近一次评估E-cadherin是在2018年,根据对两种正常组织、两种导管癌和一种小叶癌的质评测试,结果显示:除EP700Y克隆抗体外,其他多种抗体在定性评估中均表现出色。还有相关研究发现,NCH-38和ECH-6克隆的特异性最高。更多文献信息可移步原文,但需要指出的是:与其他诊断性标志物的免疫组化检测一样,乳腺小叶性病变诊断中的相关免疫组化标记也必须经过严格验证,所用组织样本应覆盖其预期检测用途,并需对其性能进行持续监测。E-cadherin和catenin的免疫组化几乎总是有内对照,结果可疑的情况下还可将相关标记物的染色进行交叉对比。
 图3.(A)本例HE切片中,可见癌细胞呈小梁状、条索状、单细胞生长,侵入纤维性间质。免疫组化E-cadherin检测,克隆号4A2C7(B)和NCH-68者均呈细胞膜阳性,强度轻度减弱,但环周着色;而36B5克隆(D)则为完全阴性。免疫组化p120(E)显示细胞膜着色轻度降低,但并无胞质着色;免疫组化β-catenin(F)同样显示细胞膜阳性。后续测序证实CDH1 I250N改变,可能为致病性。
图3.(A)本例HE切片中,可见癌细胞呈小梁状、条索状、单细胞生长,侵入纤维性间质。免疫组化E-cadherin检测,克隆号4A2C7(B)和NCH-68者均呈细胞膜阳性,强度轻度减弱,但环周着色;而36B5克隆(D)则为完全阴性。免疫组化p120(E)显示细胞膜着色轻度降低,但并无胞质着色;免疫组化β-catenin(F)同样显示细胞膜阳性。后续测序证实CDH1 I250N改变,可能为致病性。
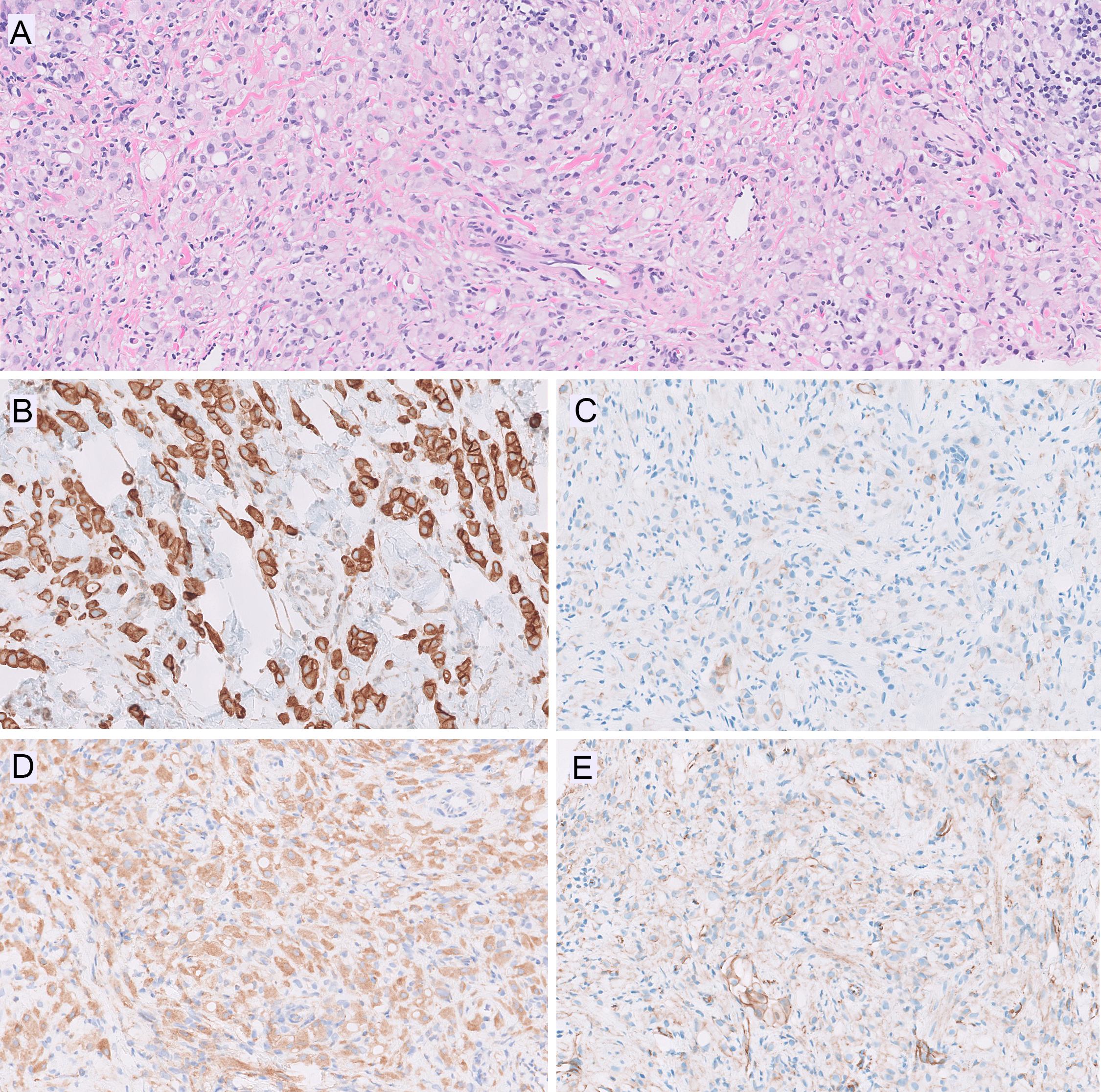 图4.浸润性小叶癌,(A)HE切片中可见胞质丰富、淡染的失黏附细胞,细胞核小而形态温和,结构呈片状;(B)免疫组化E-cadherin主要为细胞膜着色(36克隆),但NCH-38克隆则为阴性(C);p120呈胞质着色(D),β-catenin阴性(E);符合小叶癌。
图4.浸润性小叶癌,(A)HE切片中可见胞质丰富、淡染的失黏附细胞,细胞核小而形态温和,结构呈片状;(B)免疫组化E-cadherin主要为细胞膜着色(36克隆),但NCH-38克隆则为阴性(C);p120呈胞质着色(D),β-catenin阴性(E);符合小叶癌。
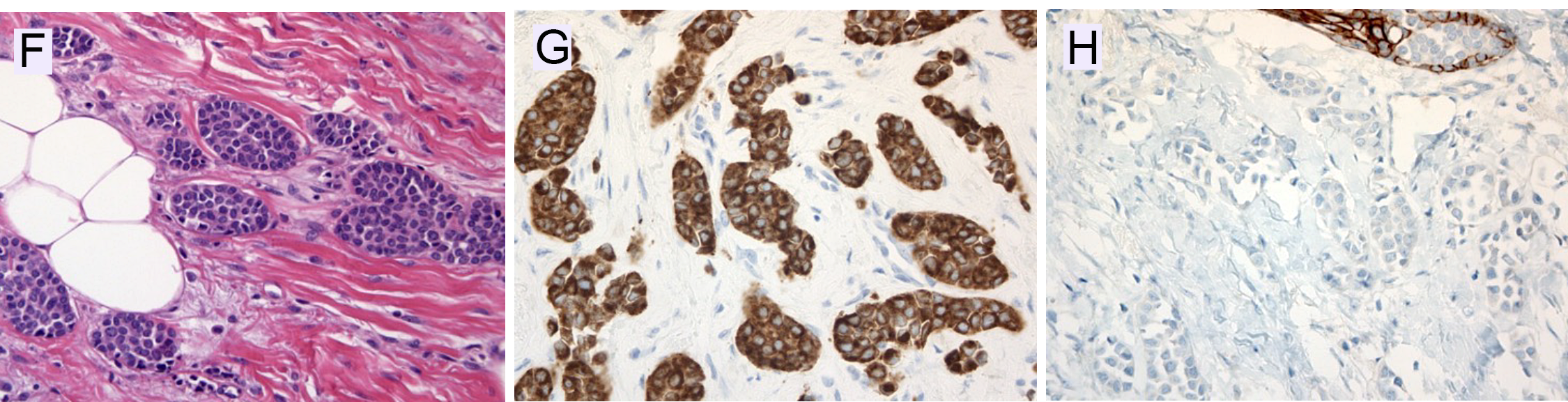 图5.浸润性小叶癌,(左)HE切片中可见具有小叶形态的癌细胞,结构呈小巢状、梁状。(中)免疫组化E-cadherin似乎为强阳性(克隆号未知);但其着色为细胞质、而非细胞膜;这对于胞质稀疏的细胞来说可能难以确定。(右)同一病例的另一区域、另一种克隆号的E-cadherin(ECH6克隆)免疫组化,结果明确为阴性;上方的原位成分也是相同的着色模式。
图5.浸润性小叶癌,(左)HE切片中可见具有小叶形态的癌细胞,结构呈小巢状、梁状。(中)免疫组化E-cadherin似乎为强阳性(克隆号未知);但其着色为细胞质、而非细胞膜;这对于胞质稀疏的细胞来说可能难以确定。(右)同一病例的另一区域、另一种克隆号的E-cadherin(ECH6克隆)免疫组化,结果明确为阴性;上方的原位成分也是相同的着色模式。
未完待续
往期回顾:
分子时代的乳腺小叶性病变再学习(一)
分子时代的乳腺小叶性病变再学习(二)


















共0条评论