[导读] 编译整理:强子
ALK重排肾细胞癌
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排肾细胞癌最初报道于2011年,是一种分子定义的病种:具有ALK基因(2p23)和不配体基因的融合,导致ALK异常激活。该肿瘤的诊断得益于已在其他类型肿瘤得以验证并广泛应用的ALK免疫组化和FISH检测。确定有ALK重排具有重要临床意义,因为有证据表明这类肿瘤对于ALK靶向治疗有效,否则进展期肾癌患者一般不会选择这一治疗。
多种血液系统恶性肿瘤和实体瘤中已明确证实了不同嵌合型ALK融合转录本的致癌作用。对于肾脏肿瘤来说,也已确认了几种ALK的融合配体,如VCL、HOOK1、STRN、TPM3、EML4、PLEKHA7、CLIP1、KIF5B、KIAA1217。
ALK重排肾细胞癌患者的发病年龄宽泛,从儿童到成人均有涉及。一般表现为孤立性、界清肿瘤,切面囊实性、灰褐色、或多种颜色。其组织学形态也表现不一、多种多样,并无特征性或特异性。伴VCL-ALK融合的肿瘤可见于有镰状细胞特质的人群(sickle cell trait,指一个人从父母一方遗传了镰状血红蛋白基因,另一方遗传了正常基因。携带者通常没有症状,但在极端情况下如严重脱水、缺氧等则可能出现并发症),形态学为实性片状的多边形或梭形细胞,胞质嗜酸性,细胞核大、空泡状,有显著核仁,常见胞质内空泡,伴淋巴细胞浸润。这类肿瘤SMARCB1(INI1)阳性表达,且侵袭性似乎比肾髓质癌要弱一些。其他融合配体的肿瘤因为目前报道的相关病例数很少,因此还不确定是否存在与特殊融合配体相关的组织形态学特征。总体而言,ALK重排肾细胞癌常为嗜酸性细胞、伴胞质内空泡,且有黏液或黏液样成分(细胞内或肠型)。有趣的是,虽然绝大部分ALK重排的肾细胞癌都有少见组织形态学表现,但也发现有一小部分病例类似黏液管状及梭形细胞肾细胞癌、乳头状肾细胞癌、肾源性腺瘤。
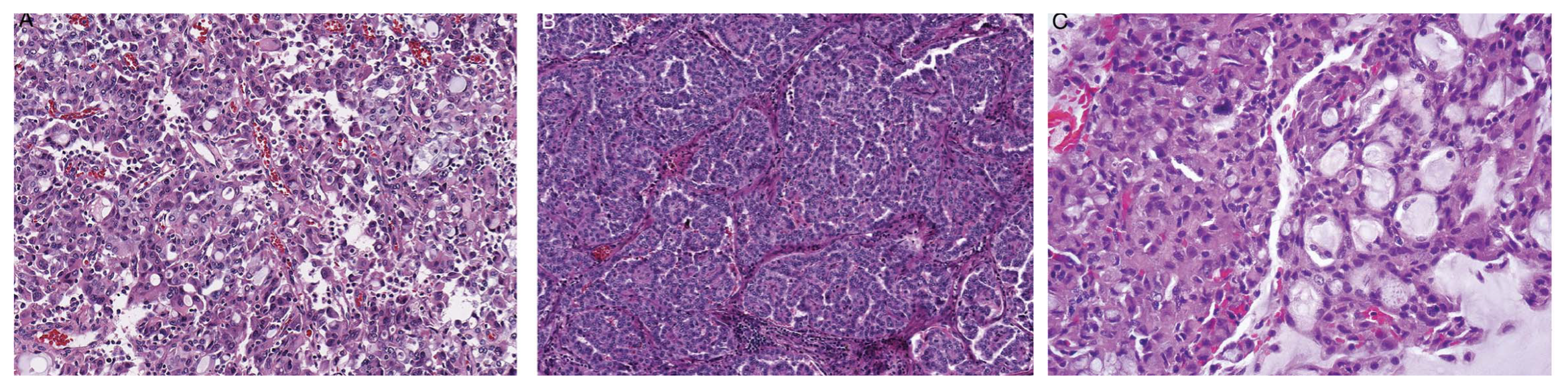 图5.ALK重排肾细胞癌形态学表现不一:图中为不同融合配体的情况,A为VCL-ALK融合,B为EML-ALK融合,C为TPM3-ALK融合。
图5.ALK重排肾细胞癌形态学表现不一:图中为不同融合配体的情况,A为VCL-ALK融合,B为EML-ALK融合,C为TPM3-ALK融合。
已在非小细胞肺癌中明确的ALK免疫组化(克隆号为D5F3或5A4)在ALK重排肾细胞癌中一般为胞质和细胞膜弥漫着色,且的确是一种非常有助于诊断的检查手段。不过,建议FISH检测进一步证实。RNA测序基础上的融合检测会提供更多关于融合配体的信息。除ALK外,该肿瘤一般阳性表达PAX8、CK7、vimentin、SMARCB1、34βE12、AMACR。
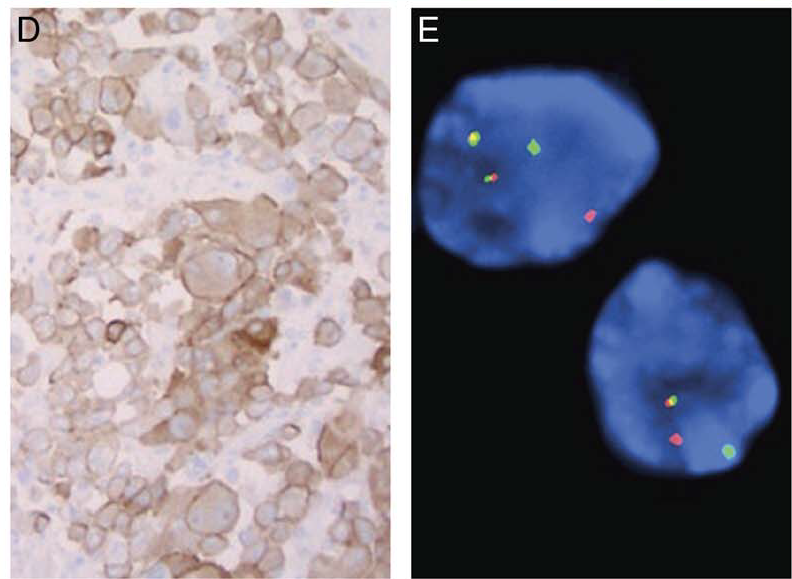 图6.(左)ALK免疫组化为细胞膜和胞质着色;ALK断裂探针FISH检测为红绿信号分离(右)。
图6.(左)ALK免疫组化为细胞膜和胞质着色;ALK断裂探针FISH检测为红绿信号分离(右)。
ALK重排肾细胞癌极为罕见,大部分为单一机构1-2例的报道,甚至有一项研究在1019例肾脏肿瘤中都未检出一例该肿瘤。鉴于其非常罕见,因此临床行为还并不明确。文献中报道的病例大部分为惰性,但也有少数侵袭性临床行为者,如转移和导致患者死亡。
少见类型高级别肾细胞癌鉴别诊断难点
转移性少见类型肾细胞癌通常对已获批的全身性治疗方案(包括靶向药物和免疫疗法)的效果差,因为这些疗法主要是基于透明细胞肾细胞癌的。不过,这些疗法中有些还是会显示出抗肿瘤效果、且预后得以改善。因此,对于进展期的非透明细胞肾细胞癌来说,让患者积极参与临床试验当下已成为一条至关重要的治疗途径。基于肿瘤中独特分子驱动的分类方案有助于更准确地对这些罕见肾肿瘤进行分层,从而为临床试验和其他研究项目提供支持,最终可能催生新的治疗方案。
不过,对于分子定义的高级别肾细胞癌来说,一种常见情况就是其形态学表现宽泛,不仅相互之间组织学特征存在重叠、且与其他类型高级别肾细胞癌之间也存在重叠。面对这种错综复杂的挑战,必须借助高灵敏度与高特异性的辅助检测才能做出明确诊断。正如本文前述三种肿瘤所见,需要强调的是对于不同类型的高级别肾细胞癌形态学谱系来说,促纤维增生性间质中的乳头状结构、或浸润性管状/管状乳头状生长是相对并无特异性的特征。因此,对于伴显著乳头状结构的高级别肿瘤来说,其鉴别诊断包括:伴乳头状结构的透明细胞癌,TFE3重排肾细胞癌,FH缺陷型肾细胞癌,ALK重排的肾细胞癌,TFEB改变的肾细胞癌等。上述病种都要考虑到,且在诊断高级别乳头状肾细胞癌之前要通过免疫组化或分子检测来排除相应病种。
与此类似,对于累及肾髓质、且有浸润性管状/管状乳头状生长的肿瘤来说,在诊断为集合管癌之前则要排除转移癌、尿路上皮癌伴腺样分化、FH缺陷型肾细胞癌、SMARCB1缺陷型肾髓质癌、黏液管状及梭形细胞癌伴高级别转化、管状囊性癌等。此外,非特殊类型或未分类的肾细胞癌则可用于形态特征特殊而不符合所有明确类型肿瘤形态和分子表现者。
对于肾切除标本、尤其较大肿瘤来说,仔细的大体检查并广泛取材,可能可以查见某一组织学类型的典型形态,这对于进一步免疫组化检查也非常关键。对于小活检标本来说,则需根据组织学特征选择具体所考虑瘤种相对特异性的免疫组化标记,如CA9、TFE3、FH、2SC、SMARCB1、SDHB等;且注意保留组织做更有帮助的分子检测。
对于分类困难的高级别肾细胞癌来说,病理医师可用的辅助检查手段越来越多,不过有些因为性价比的问题、以及肿瘤罕见的问题而并未进入临床日常工作中,二代测序基础上的临床分子检测虽然很有帮助,但耗时较长;从病理医师的角度来说,这一过程往往难以控制且无法介入。精准医学时代,如何将这些突破性的分子发现融入肿瘤分类体系,并在提升分类先进性与保持临床实用性之间取得平衡,将是一项持续的挑战。
我们对具有特定分子驱动的罕见类型高级别肾细胞癌的深入认知,也同时揭示出我们对此形态学谱系中其余尚未发现明确分子改变或致癌通路肿瘤的知识空白。比如,排除本文所说的分子定义的三个病种后,伴混杂的浸润性乳头状及管状结构、累及肾皮质和肾髓质的肿瘤还有很大一部分可能被归为了高级别乳头状肾细胞癌、集合管癌、非特殊类型或未分类的肾细胞癌,因为这三个病种基本是排除其他已明确的肿瘤类型后才可做出诊断的。不过,目前对于这三个病种的全身治疗方案也是差别非常大的:集合管癌患者首选细胞毒性化疗,乳头状肾细胞癌患者一般选择MET通路相关的靶向治疗,非特殊类型肾细胞癌的治疗则是根据经验来,且可能无法被纳入需有特异诊断的临床试验中。
对于高级别的未分类肾细胞癌进行分子检测,可以区分出具有诊断和治疗意义的独特分子亚组,其中有相当一部分病例伴NF2突变、且并无其他已明确病种的独特分子特征。这类NF2缺失的肿瘤有些会有独特形态学特征,且被描述为双相型玻璃样变砂粒体样肾细胞癌(biphasic hyalinizing psammomatous RCC,BHP-RCC);其他病例则符合高级别乳头状肾细胞癌。鉴于这类患者预后差,还要对这些界定不清的肿瘤分类“灰区病变”加强研究,希望可以开发出全新的诊断与治疗方法。
全文完
往期回顾:
肾脏肿瘤系列学习-高级别肾细胞肿瘤(一)
肾脏肿瘤系列学习-高级别肾细胞肿瘤(二)















共0条评论